NaOH-NaAl(OH)4-H2O三元溶液体系的比定压热容
2012-12-14刘士军肖刘萍陈启元
宋 婷,刘士军,肖刘萍,陈启元
(中南大学 化学化工学院,长沙 410083)
三元溶液体系NaOH-NaAl(OH)4-H2O的物理化学性质是铝化学中非常重要的内容,许多地质变化过程及地球生态都涉及到铝酸钠溶液的物理化学性质,例如矿物形成、地热变化、岩浆沉积以及核废水在地下的变化等。同时,铝酸钠溶液是铝工业生产过程中非常重要的溶液体系,其物理化学性质对铝工业具有重要意义[1]。但由于铝酸钠溶液离子组分和结构的复杂性,强碱性和不稳定性等特点,关于铝酸钠溶液的热容实验研究非常有限。HOVEY等[2]运用了流动热量仪测定温度为10~50 ℃常压条件下铝酸钠溶液的热容,但是他们仅测定两组不同的苛性比的溶液。MASHOVETS等[3]采用静态量热法测定了温度在150~300 ℃之间铝酸钠溶液的热容,但不在恒定压强条件下,同时溶液中Al2O3的质量分数在1%~1.5%内,远低于实际工业生产的需要。MAGALHAES等[4]运用采集流动热量仪测定了铝酸钠溶液在离子强度小于 6 mol/kg及不同苛性比条件下铝酸钠溶液的比定压热容,仅测定了25 ℃温度下的数据。CHEN等[5]运用量热法结合 CANIANI等[6]的数据计算 0~160 ℃Al(OH)的比定压热容,但未计算铝酸钠溶液体系的热容。SCHRODLE 等[7]等运用微量热仪C80研究了压强为10 MPa离子强度小于6 mol/kg不同苛性比条件下铝酸钠溶液的比定压热容。本文作者测定了298.15~363.15 K 温度范围常压下铝酸钠溶液的比定压热容,并建立了铝酸钠溶液体系比定压热容与总碱度、苛性比及温度的关系式,以期更好地完善铝酸钠溶液在常压下的热力学数据。
1 实验
1.1 试剂和溶液
NaOH原液由优级纯 NaOH (国药集团化学试剂有限公司)加高纯水(尽量除尽CO2)制备,具体方法参见文献[8],浓度的确定采用盐酸滴定。超纯 Al丝(>99.999%)(国药集团化学试剂有限公司),用体积比为 1:1的盐酸煮沸约10min,再用超纯水和无水乙醇洗涤,干燥、密封储存。铝酸钠溶液的制备参照文献[9]的方法采用Al丝加NaOH原液在聚四氟乙烯容量瓶中反应制备而成,反应温度控制在343~363.15 K,反应6~12 h,该方法避免了化学分析铝酸钠溶液的成分。实验中配制溶液及热容测定所用的水均为一次蒸馏水再用MILLIPORE公司的超纯水系统Synergy UV纯化的高纯水,电导率小于1.0×10-4S·m。
1.2 实验方法及基本原理
1.2.1 实验方法
实验采用C80微量热仪(法国Setaram公司)测定,仪器能直接测量过程的吸热、放热情况。其主要技术指标如下[10]:可测温度范围室温至300 ℃;恒温控制精度±0.001 ℃;升温速度 0.01~2.00 ℃/min;热量测量感度2~5 μW;热量测量精度0.1 μW。
实验的参比池和样品池都使用常压标准池。由于铝酸钠溶液具有强碱性,所以在常压池内加聚乙烯塑料管作为内衬。采用台阶升温法测定溶液的比定压热容:在样品池中加入6 g左右铝酸钠溶液,参比池不加溶液,量热仪在初始温度T0达到稳定后,以 0.25 K/min的升温速率升温到T1,并恒温1 h,得到样品有个吸热量Q1,再以同样升温速率升温到T2,并恒温同样时间,得到样品的吸热量Q2,依次类推,至最终温度(363.15 K)。当样品池和参比池都为空时采用以上同样操作,则理论上热效应应为零,但由于仪器本身的原因,空白测空的热效应不为零,因此,需将此空白热效应从样品测量结果中扣除。
1.2.2 实验基本原理
当样品的温度自T0(单位为K)升到T1,样品吸收热量为Q1(单位为J),当温度从T1继续升高到T2时,样品吸收热量为Q2(单位为J),则这时有依次类推当温度升高至任意温度T时有

所以根据实验数据可以得出温度在T0~T区间样品的焓变(单位为J)与T的关系式,将关系式除以样品的质量,得到单位质量焓变(单位为J/g)与T的关系式。由于

2 结果与讨论
2.1 仪器和实验方法准确性的校准
为了检验量热仪测量的准确性及实验方法的可靠性用上述方法测量了纯水的比定压热容,所得结果列于表1。
由表1可知,所得的水的比定压热容值与文献值比较相对偏差(RE)小于0.9%,说明设备和实验方法是可靠的。
2.2 铝酸钠溶液体系的比定压热容
用文中所述方法在温度为298.15~363.15 K常压条件下测定一系列不同浓度不同αk(αk=mT/mNaAl(OH)4,mT为总碱质量摩尔浓度,mNaAl(OH)4为NaAl(OH)4的质量摩尔浓度)的 NaOH-NaAl(OH)4-H2O三元溶液体系的焓变见表2~3。
表1 水的比定压热容cp与文献[11]的比较Table 1 Comparison values of isobaric heat capacity of water cp with in Ref.[11]

表1 水的比定压热容cp与文献[11]的比较Table 1 Comparison values of isobaric heat capacity of water cp with in Ref.[11]
T/K cp/(J·g-1·K-1) 0pc/(J·g-1·K-1) RE/% T/K cp/(J·g-1·K-1) 0pc/(J·g-1·K-1) RE/%300 4.199 1 4.180 6 0.44 330 4.210 6 4.183 7 0.64 305 4.178 3 4.179 5 0.03 340 4.218 9 4.185 8 0.79 310 4.170 0 4.179 2 0.22 345 4.226 1 4.188 3 0.90 315 4.171 7 4.179 6 0.19 355 4.233 6 4.198 2 0.84 320 4.180 7 4.180 5 0.01 360 4.208 7 4.202 3 0.15 325 4.194 5 4.181 9 0.30
表2 不同浓度铝酸钠溶液的Table 2 of sodium aluminate solution with different concentrations

表2 不同浓度铝酸钠溶液的Table 2 of sodium aluminate solution with different concentrations
1)M(aq)is solution mass.
Experiment No. T/K 0 TTH Δ /J Condition Experiment No. T/K 0 TTH Δ /J Condition 302.73 109.957 302.68 98.957 307.69 220.170 307.64 198.097 312.64 331.082 312.6 298.168 317.59 441.599 317.55 398.461 322.57 557.139 322.52 499.302 327.52 669.198 327.49 600.425 332.49 781.572 332.44 701.520 337.43 894.174 337.40 802.746 342.41 1 006.840 342.35 904.524 347.37 1 119.707 347.31 1 006.489 352.32 1 232.598 352.26 1 108.484 357.28 1 345.509 357.18 1 210.405 1 362.24 1 458.890 T0=297.77 K mT=0.881 3 mol/kg αk=3.196 2 M(aq)=5.641 5 g 4 362.16 1 312.338 T0=297.73 K mT=2.888 0 mol/kg αk=3.361 7 M(aq)=5.340 4 g 302.63 102.923 302.62 111.418 307.58 205.968 307.58 223.113 312.53 309.667 312.54 335.138 317.49 413.923 317.49 447.476 322.44 518.366 322.45 560.392 327.39 623.107 327.40 673.560 332.35 727.849 332.36 786.753 337.31 832.789 337.35 900.560 342.26 937.916 342.28 1 014.528 347.22 1 043.237 347.23 1 128.743 352.17 1 149.014 352.18 1 243.255 357.12 1 254.957 357.13 1 357.507 2 362.07 1 360.802 T0=297.67 K mT=1.456 1 mol/kg αk=2.685 6 M(aq)=5.337 4 g 5 362.08 1 472.011 T0=297.67 K mT=3.231 6 mol/kg αk=4.316 9 M(aq)=6.043 8 g 302.72 118.277 302.67 106.049 307.67 236.864 307.62 212.076 312.64 356.102 312.59 318.714 317.59 475.380 317.56 425.812 322.55 594.785 322.53 533.348 327.52 714.648 327.49 641.066 332.47 835.063 332.46 748.922 337.43 955.695 337.38 857.165 342.39 1 076.939 342.32 965.496 347.34 1 198.360 347.27 1 073.910 352.3 1 319.753 352.22 1 182.714 357.25 1 441.595 357.24 1 291.380 3 362.2 1 563.635 T0=297.76 K mT=1.982 9 mol/kg αk=2.696 0 M(aq)=6.267 5 g 6 362.07 1 360.802 T0=297.72 K mT=3.710 8 mol/kg αk=4.736 M(aq)=5.764 5 g
表3 不同浓度铝酸钠溶液的Table 3 of sodium aluminate solution with different concentrations

表3 不同浓度铝酸钠溶液的Table 3 of sodium aluminate solution with different concentrations
Experiment No. T/K 0 TTH Δ /J Condition Experiment No. T/K 0 TTH Δ /J Condition 302.62 108.970 302.74 94.864 307.57 218.138 307.70 189.581 312.53 327.815 312.66 285.004 317.48 437.915 317.60 381.127 322.44 548.029 322.58 477.244 327.40 658.446 327.53 573.761 332.36 769.174 332.49 670.483 337.31 880.287 337.42 767.546 342.27 991.469 342.41 864.832 347.22 1 102.869 347.37 962.069 352.18 1 214.504 352.31 1 059.434 357.13 1 326.139 357.26 1 156.802 7 362.08 1 437.946 T0=297.72 K mT=4.219 mol/kg αk=3.347 4 M(aq)=5.989 0 g 10 362.23 1 254.413 T0=297.79 K mT=4.928 1 mol/kg αk=1.979 1 M(aq)=5.375 4 g 302.64 112.185 302.75 102.754 307.60 225.616 307.71 205.986 312.55 339.539 312.67 309.955 317.50 453.878 317.63 414.497 322.45 568.438 322.58 519.438 327.41 683.307 327.54 624.729 332.36 798.540 332.49 730.145 337.31 914.018 337.45 835.696 342.27 1 029.901 342.41 941.293 347.22 1 145.768 347.34 1 047.113 352.18 1 261.716 352.3 1 153.048 357.13 1 377.877 357.28 1 258.889 8 362.08 1 494.448 T0=297.73 K mT=2.888 0 mol/kg αk=3.361 7 M(aq)=5.340 4 g 11 362.23 1 364.906 T0=297.79 K mT=5.520 0 mol/kg αk= 2.410 8 M(aq)=5.980 8 g 302.62 103.038 302.75 111.120 307.58 206.293 307.71 224.773 312.54 309.880 312.66 339.426 317.50 413.766 317.62 454.496 322.46 517.773 322.57 570.202 327.41 622.093 327.53 686.294 332.36 726.667 332.49 802.437 337.32 831.508 337.46 918.738 342.28 936.738 342.41 1 035.099 347.23 1 042.050 347.37 1 151.475 352.18 1 147.509 352.32 1 268.049 357.14 1 253.179 357.27 1 384.731 9 362.19 1 359.076 T0=297.67 K mT=4.691 0 mol/kg αk=4.437 4 M(aq)=5.697 8 g 12 362.23 1 501.417 T0=297.81 K mT=6.162 6 mol/kg αk=2.037 4 M(aq)=6.603 6 g
实验 1~10号所采用的空白在温度为 298.15~363.15 K常压条件下与T的关系式为

实验 11、12号所采用的空白在温度为 298.15~363.15 K常压条件下与T的关系式为
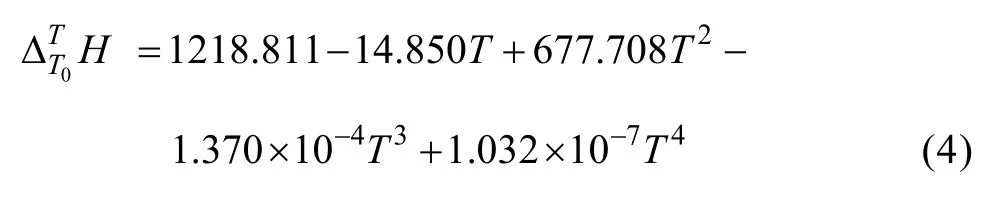
根据上述实验方法,在温度为298.15~363.15 K常压条件下溶液体系所测得的(表2~3)与温度T的关系式,减去空白时所产生的与T的关系式(方程(3)和(4)),再除以待测溶液的质量。所求得与T的关系式为
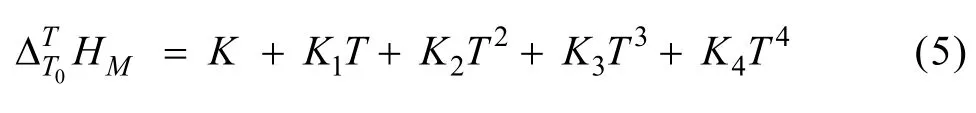
由实验结果所得方程(5)的参数列于表4。cp与T的关系式可以通过对方程(5)求导得到,从而可求表2和3中各实验条件下铝酸钠溶液三元体系温度为T时的比定压热容
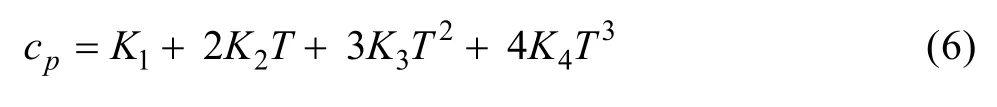
2.3 体系比定压热容与浓度及组成的关系
由于上述方法只建立了cp与T的关系式,不能求出任意浓度及组分的比定压热容,参考文献[12-13]二元水溶液体系建立模型的方式,并加以改进,试以方程(7)拟合所求得的比定压热容数据,建立能在温度298.15~363.15 K总碱度小于6 mol/kg内都能适用的铝酸钠溶液三元体系比定压热容模型。
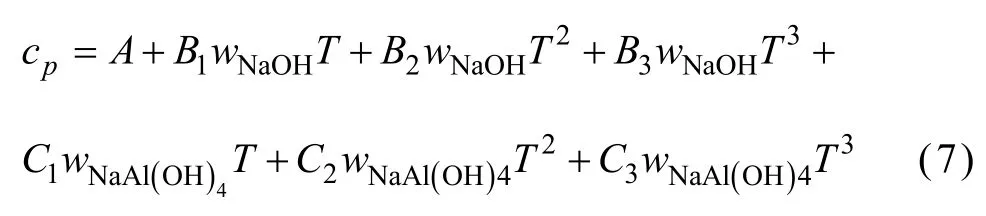
式中:T表示温度,wNaOH和wNaAl(OH)4分别是NaOH和NaAl(OH)4在铝酸钠溶液体系中的质量分数,可通过总碱度mT(mT=mNaOH+mNaAl(OH)4)及苛性比αk(αk=mT/mNaAl(OH)4)分别由方程(8)和(9)来表示:

方程(7)中A、B1、B2、B3、C1、C2、C3是回归系数系数列于表5。
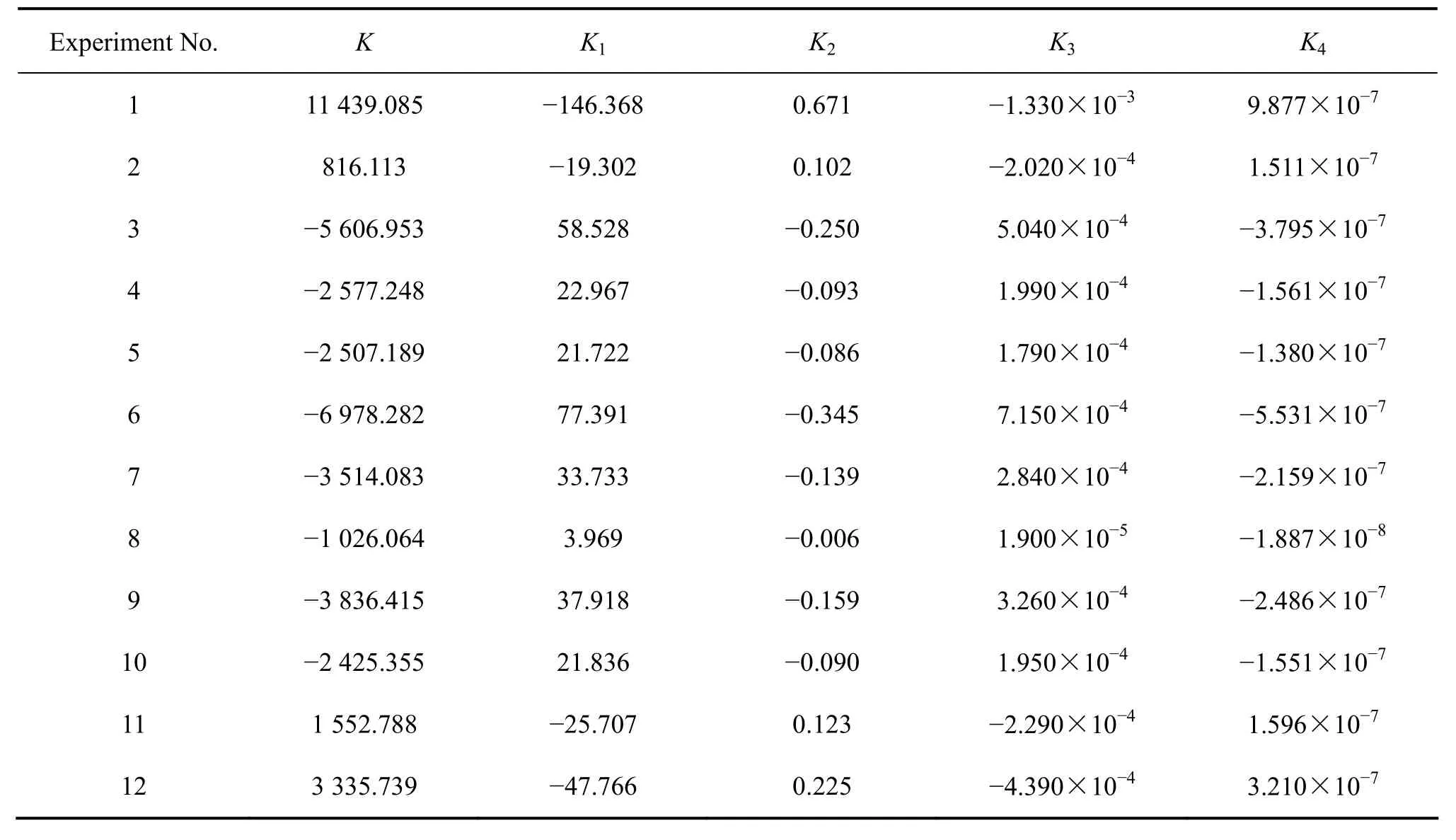
表4 方程(5)的回归参数Table 4 Regression parameters for Eq.(5)

表5 方程(7)的回归系数Table 5 Regression parameters for Eq.(7)
拟合方程平均偏差小于0.53%,最大不超过3%。并用拟合的方程(7)计算文献[4]在温度298.15 K条件下离子强度(Ⅰ=mT=mNaOH+mNaAl(OH)4)为1~6 mol/kg及不同 NaAl(OH)4(aq)含量(不包括mNaAl(OH)4=0 mol/kg)的比定压热容数据,用方程计算的比定压热容值cp,cal与文献的实验值cp,exp比较,相对平均偏差为 1.4%,其中最大相对偏差为4.1%,且在浓度低于4 mol/kg,相对平均偏差为0.2%,说明所回归方程可以准确计算铝酸钠溶液离子强度1~6 mol/kg的比定压热容。
根据方程(7)所计算的铝酸钠溶液比定压热容与浓度、温度、苛性比关系如图1所示。
从图1可以看出,铝酸钠溶液的比定压热容随温度的升高而增大,同时随着总碱度的增大而减小。当总碱度mT一定时,随着溶液的αk的增大即溶液中NaAl(OH)4的浓度的减小溶液体系的比定压热容增大,这与文献[7]所研究的铝酸钠溶液体系在 10 MPa的大气压强下比定压热容随温度及各组分浓度变化的规律基本一致。
2.4 铝酸钠溶液的表观摩尔比定压热容
将比定压热容数据代入下面方程[4]可求出三元体系铝酸钠溶液的表观摩尔热容
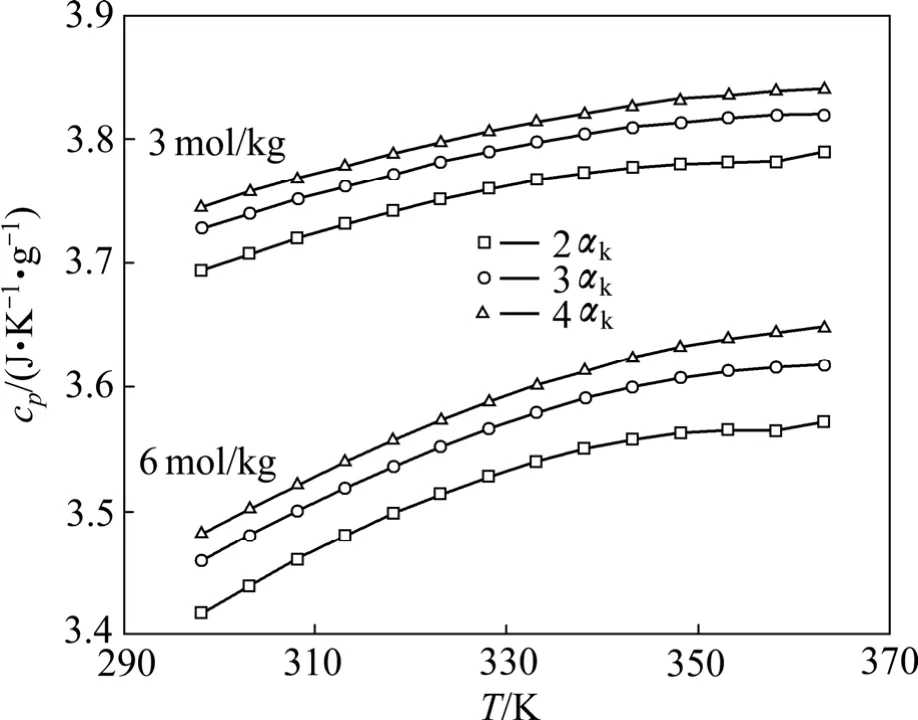
图1 不同浓度铝酸钠溶液比定压热容—温度曲线Fig.1 cp—T curves of sodium aluminate solution with different concentrations

式中:cpΦ(单位为J/(K·mol))为铝酸钠溶液体系的表观摩尔热容,cp为比定压热容,m2和m3分别指该溶液体系中NaOH与NaAl(OH)4的质量摩尔浓度,M2和M3分别指NaOH与NaAl(OH)4的摩尔质量,0pc是指纯水的比定压热容,具体值见文献[11]。
在铝酸钠溶液中离子强度可用总碱度mT来表示,mNaAl(OH)4浓度的变化可以用 1/αk即mNaAl(OH)4/mT来表示。当温度一定时不同浓度铝酸钠溶液表观摩尔热容与1/αk关系如图2所示。
当组成一定时,铝酸钠溶液表观摩尔热容随温度下变化规律见图3。
从图1和2中可以知道,铝酸钠溶液在298.15~363.15 K温度条件下的表观摩尔热容有以下规律:当温度和αk一定时随离子强度的增大而增大;当温度一定时,随着 1/αk的增大表观摩尔热容呈线性增长规律,即表观摩尔热容与mNaAl(OH)4/mT呈线性规律, 这基本符合WU[14]所引用的Young规律,这一规律使得计算该体系中纯 NaAl(OH)4(aq)的表观摩尔热容成为可能;当组成一定时,温度在298.15~363.15 K下铝酸钠溶液表观摩尔热容先呈明显的增大趋势但当接近 363.15 K表观摩尔热容随温度升高逐渐出现了减小趋势,根据文献[15]表明,NaOH溶液在这个温度范围内表观摩尔热容也呈先增大后在接近 363.15 K时也开始逐渐减小,同时综合文献[2, 4-5, 7]可知,纯NaAl(OH)4(aq)表观摩尔热容在298.15~363.15 K也在近363.15 K时呈现出下降趋势,这与本研究所得结果基本一致。
3 结论
1)测定了铝酸钠溶液三元体系温度在 298.15~363.15 K,离子强度1~6 mol/kg的比定压热容,并提出了体系比定压热容与温度和浓度及苛性比的关系式,用本研究所建立的关系式计算 25 ℃时离子强度1~6 mol/kg及苛性比1.9~10的比定压热容值与文献值比较结果表明:拟合的方程能较准确地计算铝酸钠溶液的比定压热容,可供工程实验和设计时使用。

图2 不同温度下铝酸钠溶液表观摩尔热容随1/αk及离子强度Ⅰ变化图Fig.2 Isobaric apparent molar heat capacities of sodium aluminate solution as a function of level of substitution of aluminate for 1/αk at various temperatures: (a)298.15 K; (b)308.15 K; (c)333.15 K; (d)363.15 K (constant ionic strengths: 1—1.0 mol/kg; 2—2.0 mol/kg; 3—3.0 mol/kg; 4—4.0 mol/kg)

图3 铝酸钠溶液的cpΦ—T曲线Fig.3 cpΦ—T curves of sodium aluminate solution
2)计算出了溶液体系的表观摩尔比定压热容,并研究表观摩尔比定压热容与溶液组成及温度的关系,表观摩尔热容与mNaAl(OH)4/mT呈线性规律, 这基本符合 Young规律,这一规律使得计算该体系中纯NaAl(OH)4(aq)的表观摩尔热容成为可能。
[1]杨重愚.氧化铝生产工艺学[M].修订版.北京: 冶金工业出版社, 1993: 135.YANG Zhong-yu.Industrial technology of aluminum oxide[M].Revised ed.Beijing: Metallurgical Industry Press, 1993: 135.
[2]HOVEY J K, HEPLER L G, THEMAINE P R.Thermodynamics of aqueous aluminate ion: Standard partial molar heat capacities and volumes of Al(OH)4-1(aq)from 10 to 55 ℃[J].J Phys Chem,1988, 92(5): 1323-1332
[3]MASHOVETS V P, PUCHKOV L V, MATVEEVA R R,BARANOVA T A.Specific heats of solutions in the system Na2O-Al2O3-H2O at 150-300 ℃[J].Tsvetnye Metally, 1969,42(2): 60-63.
[4]MAGALHAES M C F, KONIGSBERGER E, MAY P M,HEFTER G.Heat capacities of concentrated aqueous alkaline aluminate solutions 25 ℃[J].Journal of Chemical &Engineering Data, 2002, 47(4): 960-963.
[5]CHEN Q Y, LI X U, HEPLER G.Calorimetric study of the digestion of gibbsite, Al(OH)3(cr), and thermodynamics of aqueous aluminate ion, Al(OH)4-(aq)[J].Canadin Journal of Chemistry, 1991, 69(11): 1685-1690.
[6]CAIANI P, CONTI G,GIANNI P, MATTEOLI E.Apparent molar heat capacity and relative enthalpy of aqueous NaOH between 323 and 523 K[J].Journal of Solution Chemistry, 1989,17(5): 481-497.
[7]SCHRŐDLE S, KŐNIGSBERGER E, MAY P M, HEFTER G.Heat capacities of aqueous sodium hydroxide/aluminate mixtures and prediction of the solubility constant of boehmite up to 300℃[J].Geochimica et Cosmochimica Acta, 2010, 74(8):2368-2379.
[8]SCHRŐDLE S, KŐNIGSBERGER E, MAY P M, HEFTER G.Heat capacities of aqueous solutions of sodium hydroxide and water ionization up to 300 ℃ at 10 MPa[J].Geochimica et Cosmochimica Acta, 2008, 72(13): 3124-3138.
[9]ZHOU Jun, CHEN Qi-yuan, LI Jie, YIN Zhou-lan, ZHOU Xia,ZHANG Ping-min.Isopiestic measurement of the osmotic and activity coefficients for the NaOH-NaAl(OH)4-H2O system at 313.2 K[J].Geochimica et Cosmochimica Acta, 2003, 67(18):3459-3472
[10]SETARAM Co.C80Ⅱ user manual[M].SETARAM Co:Bordeaux, 2001: 37.
[11]WANGER W, PRUSS A.The IAPWS formulation 1995 for the thermodynamic properties of ordinary water substance for general and scientific use[J].J Phys Chem, 2002, 31(2):387-535.
[12]田 涛, 郑丹星, 武向红, 蒋翼然.室温离子液体[Emim]BF4及其水溶液体系的恒压热容测定[J].北京化工大学学报: 自然科学版, 2008, 35(3): 27-31.TIAN Tao, ZHENG Dang-xing, WU Xiang-hong, JIANG Yi-ran.Determination the heat capacity of the ionic liquid [Emim]BF4and its aqueous solutions[J].Journal of Beijing University of Chemical Technology: Natural Science, 2008, 35(3): 27-31.
[13]魏 治, 武向红, 郑丹星, 王建召, 董 丽.离子液体[Emim]Br水溶液的比热容测量及其模型化[J].北京化工大学学报: 自然科学版, 2010, 37(1): 9-12.WEI Zhi, WU Xiang-hong, ZHENG Dan-xing, WANG Jian-zhao, DONG Li.Determination of the heat capacity of aqueous solutions of [Emim]Br[J].Journal of Beijing University of Chemical Technology: Natural Science, 2010, 37(1): 9-12.
[14]WU Y C.Young’s mixture rule and its significance[J].J Phys Chem, 1970, 74(21): 3781-3786.
[15]ROUX A H, PERRON G, DESNOYERS J E.Heat capacities,volumes, expandabilities and compressibilities for concentrated aqueous solutions of LiOH, NaOH and KOH[J].Can J Chem,1984, 62(5): 878-888.
