腹腔镜与开腹手术治疗直肠癌的临床疗效及对免疫功能的影响
2016-03-15郭宏斌
郭宏斌, 刘 超
(辽宁省辽阳市中心医院 普外科, 辽宁 辽阳, 111000)
腹腔镜与开腹手术治疗直肠癌的临床疗效及对免疫功能的影响
郭宏斌, 刘超
(辽宁省辽阳市中心医院 普外科, 辽宁 辽阳, 111000)
摘要:目的探讨腹腔镜与开腹手术治疗直肠癌的近期临床疗效及不同术式对患者免疫功能的影响。方法腹腔镜直肠癌根治术患者46例设为腹腔镜组,选取同期接受开腹手术进行治疗的患者43例为开腹组。观察2组手术情况和并发症情况,检测术前及术后1、3、7 d时患者T细胞亚群和免疫球蛋白的变化情况。结果腹腔镜组在术中出血量、排气时间、肛门功能、VAS评分及住院时间方面均优于开腹手术组(P<0.05); 2组术后1 d、3 d 和7 d CD3+、CD4+显著降低 (P<0.05), 且腹腔镜组明显高于开腹组(P<0.05); 术后1、7 d CD8+显著升高(P<0.05),且腹腔镜明显低于开腹组。术后2组1 d及3 d IgG、IgM及IgA水平均显著降低(P<0.05), 腹腔镜组降低的幅度小于开腹组(P<0.05)。结论腹腔镜直肠癌根治术具有微创、出血量少、恢复快等优势,且与开腹手术比较对患者机体产生的影响较小,有利于保护患者免疫功能。且与开腹手术比较对患者机体产生的影响较小,有利于保护患者免疫功能。
关键词:直肠癌; 腹腔镜结肠癌根治术; 开腹手术; 免疫功能
结直肠癌是消化系统中常见的恶性肿瘤之一,其发病率约占所有胃肠道肿瘤的26%、大肠癌的70%左右[1-2]。目前临床上主要采用开腹手术、经肛门切除术、放疗化疗、介入治疗等方案治疗结直肠癌。近年来,全直肠系膜切除(TME)理念得到普及,腹腔镜手术在患者术后恢复中体现了一定的优势,并得到了迅猛发展[3]。本研究对比腹腔镜手术和开腹手术对直肠癌患者的临床疗效差异和免疫功能的影响,现报告如下。
1资料与方法
1.1一般资料
选取2013年3月-2015年6月辽阳市中心医院普外科接受腹腔镜结肠癌根治术患者46例为腹腔镜组,其中男25例,女21例;年龄40~72 岁,平均(60.1±7.8)岁;肿瘤直径平均(3.6±0.8) cm; TNM分期: Ⅰ期12例,Ⅱ期25例,Ⅲ期9例;病理分化程度:高度分化6例,中度分化27例,低度分化13例。选取同期接受开腹手术进行治疗的患者43例为开腹组,其中男24例,女19例;年龄40~70岁,平均(59.2±8.1)岁;肿瘤直径平均(3.6±0.8) cm; TNM分期: Ⅰ期11例,Ⅱ期23例,Ⅲ期9例;病理分化程度:高度分化5例,中度分化24例,低度分化14例。2组患者在年龄、性别、临床分期和病理分化程度等方面比较差异无统计学意义(P>0.05), 具有可比性。所有患者均经肠镜检查确诊为直肠癌,且经病理检查排除其他恶性肿瘤,无胃穿孔、消化道出血、急性肠梗阻等疾病,均签署知情同意书。
1.2手术方法
2组患者术前经常规肠道准备,肠镜检查,病理学检查。均采用气管插管及静脉复合全身麻醉,手术遵循肿瘤根治原则、无瘤接触原则和全直肠系膜切除(TME)原则。
1.2.1腹腔镜技术:取患者头低右侧高的膀胱截石位,建立CO2气腹,气腹压力在12~14 mmHg(1 mmHg=0.133 kPa), 避免挤压肿瘤。脐下建立直径10 mm观察孔,并于脐水平线两侧腹直肌外缘2 cm处建立直径为5 mm的操作孔2个,探查腹腔观察病灶具体位置。术中采用超声刀切除肿瘤远近端肠管,结扎血管根部动静脉,清除区域淋巴结与脂肪,并于根部切断肠系膜下动静脉,切断直肠双侧处韧带,于骶前间隙进行锐性分离。下达尾骨尖及两侧提肛肌平面,将肿瘤远端肠段连同系膜、腹膜后淋巴结及脂肪组织全切除。直肠切除后,用大量消毒水或抗癌药物溶液经腹多次冲洗盆腔,于骶前剥离面置血浆引流管,由会阴切口引出。检查腹腔内无活动性出血后,解除气腹,腹部缝合盆底后腹膜,会阴部切口分层缝合,对已污染的伤口,会阴部切口不易完全缝合,应以油纱布或碘仿纱布填塞。操作时避免直接接触肿瘤,均在组织间隙内进行,以防止肿瘤细胞扩散。切除后的组织需进行病理检验,确认切除边缘是否为阴性。
1.2.2开腹手术:开腹手术采用静吸复合麻醉,根据患者情况行传统的开腹手术,按《手术学全集-普通外科卷》进行[4]。
1.2.3检测方法: T细胞亚群指标水平采用流式细胞仪检测,免疫球蛋白指标水平采用免疫比浊法经全自动生化分析仪测定。
1.3观察指标
1.3.1临床疗效: ① 手术情况:记录2组手术时间、术中出血量、淋巴结清除数量; ② 术后肛门功能评价; ③ 术后胃肠道功能恢复时间、疼痛视觉模拟评分(VAS)(0~10分)以及并发症发生情况。
1.3.2免疫功能:观察2组患者术前及术后1、3、7 d免疫指标: ① T细胞亚群CD3+、CD4+及CD8+的变化情况; ② 免疫球蛋白IgG、IgM及IgA的变化情况。
1.4评价标准
术后肛门功能评级,优:干稀便能自制,控制时间>2 min, 大便1~2 次/d;良:干便能自制,偶有稀便失禁,控制时间1~2 min, 大便3~4 次/d;差:干稀便失禁,不能区别排便、排气。VAS疼痛评分标准: 0分:无痛;3分以下:有轻微的疼痛,能忍受; 4~6分:患者疼痛并影响睡眠,尚能忍受;7~10分:患者有渐强烈的疼痛,疼痛难忍,影响食欲,影响睡眠。T细胞亚群指标水平采用流式细胞仪检测,免疫球蛋白指标水平采用免疫比浊法经全自动生化分析仪测定。
1.5统计学处理

2结果
2.12组手术临床疗效对比
2组在手术时间和淋巴结清除数量、并发症发生率上无显著差异(P>0.05); 腹腔镜组在术中出血量、排气时间、肛门功能、VAS评分及住院时间方面均优于开腹手术组(P<0.05)。见表1、2。
2.22组患者手术前后T细胞亚群变化情况
2组患者术前CD3+、CD4+、CD8+比较无显著性差异(P>0.05); 与术前比较, 2组术后1、3和7 d CD3+、CD4+显著降低,术后1、7 d CD8+显著升高(P<0.05), 且术后1、3及7 d腹腔镜组CD3+、CD4+明显高于开腹组,CD8+明显低于开腹组(P<0.05)。见表3。
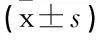
表1 2组患者术中情况比较
与开腹组比较, **P<0.01。
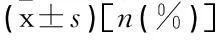
表2 2组患者术后情况比较
与开腹组比较,*P<0.05。

表3 2组患者术前及术后T细胞亚群变化情况比较±s)
与手术前比较,*P<0.05; 与开腹组比较,#P<0.05。
2.32组患者手术前后免疫球蛋白变化情况
2组患者术前IgG、IgM及IgA比较无显著性差异(P>0.05); 术后2组1 d及3 d IgG、IgM及IgA均显著降低(P<0.05), 腹腔镜组降低的幅度小于开腹组(P<0.05), 术后7 d基本恢复到术前。见表4。
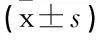
表4 2组患者术前及术后免疫球蛋白变化情况
与开腹组比较,*P<0.05;与手术前比较,#P<0.05。
3讨论
1982年Heald等[5]提出TME原则治疗直肠癌的概念, 1991年Jacobs等[6]首次将腹腔镜技术应用于直肠癌的治疗,因其复发率低,现已广泛在临床上应用。腹腔镜可以放大手术视野,对于部分患者瘤体较大、盆腔狭小的问题在腹腔镜下手术能做到血管裸化。从根部结扎切断血管时,更好地进行区域分离,且易分辨从而切除小淋巴结,便于完成根治手术[7]。但手术属于一种有创治疗方式,会导致机体产生一系列的应激反应,通过一系列的变态反应影响机体的免疫功能[8]。免疫系统属于机体保护自身的防御性结构,免疫抑制程度与创伤度、术中出血量、手术时间等因素相关,因此,治疗直肠癌手术的关键在于最大限度减轻手术创伤、减少出血量、缩短手术时间,以最小的创伤达到最佳的效果。多项临床研究证实,腹腔镜下直肠癌根治术是微创手术,在一定程度上维持了机体内环境的稳定,可以较大限度地保护细胞介导的免疫反应,减少手术创伤对患者免疫功能的影响,抑制并发症的发生及潜在肿瘤细胞的生长[9]。
本研究中, 2组患者术后均治愈,在手术时间和淋巴结清除数量、并发症发生率上无显著差异(P>0.05), 腹腔镜组术中出血量明显少于开腹组(P<0.05), 证明腹腔镜手术与开腹手术在根治性方面无显著差异。术后指标包括肛门功能、胃肠道功能恢复时间、VAS评分等,评价腹腔镜手术临床疗效较开腹术有优势。近年来各国大型研究的数据[10-12]显示腹腔镜手术对治疗直肠癌方面疗效与开腹组手术无显著差异,与本研究结果相近。
细胞免疫是机体抗肿瘤免疫中最主要的方式。CD3+细胞存在于成熟的T淋巴细胞外周,代表总T细胞的水平,其降低表示机体免疫功能也在下降[13];CD4+T细胞是辅助性和诱导性T细胞,通过活化释放大量细胞因子来增强抗肿瘤效应,其降低表示免疫诱导效应不足,影响抗肿瘤的特异性;CD8+T细胞抑制CD4+细胞和B细胞,具有病毒清除和黏附功能[14-15], 能抑制抗体形成且阻止细胞免疫反应。本研究中,与术前比较,2组术后1 d、7 d CD3+、CD4+显著降低,CD8+显著升高(P<0.05); 术后腹腔镜组1、3及7 d CD3+、CD4+水平显著高于开腹组,CD8+明显低于开腹组(P<0.05)。体液免疫是通过激活补体系统,溶解肿瘤细胞,同时调理抗体来发挥抗肿瘤的免疫效应。IgG与相应抗原结合后,在补体、巨噬细胞等参与下,引起细胞溶解或促进其他细胞对靶细胞的杀伤作用;IgM主要是激活补体和调理吞噬功能,通过补体介导以组织损伤为主,促进吞噬作用;IgA是机体黏膜防护的重要元素。本研究中,术后1 d及3 d IgG、IgM及IgA均显著降低(P<0.05), 且腹腔镜组明显高于开腹组(P<0.05), 说明腹腔镜组创伤比开腹组程度低,且恢复时间短,术后免疫功能下降[16-18], 但开腹组免疫功能受到的影响更大。
参考文献
[1]杨进山, 齐保聚. 腹腔镜手术和开腹手术治疗直肠癌对比研究[J]. 现代中西医结合杂志, 2013, 21(36): 4036.
[2]Li K, Li J P, Huang M J, et al. Quality of life of elderly Chinese rectal cancer patients after preventative anal surgery: a cohort study[J]. Hepatogastroenterology, 2013, 60(126): 1376.
[3]陈合钦, 王玲, 胡百奇, 等. 腹腔镜直肠癌根治术气腹对老年患者呼吸功能的影响[J]. 现代中西医结合杂志, 2010, 19(32): 4184.
[4]黎介寿, 吴孟超, 黄志强. 手术学全集-普通外科卷[M]. 2版. 北京:人民军医出版社, 2007: 367.
[5]池畔, 林惠铭, 陈大良. 经腹腔镜行全直肠系膜切除的可行性研究[J]. 中华普通外科杂志, 2002, 17(2): 78.
[6]Pugliese R, Di Lernia S, Sansonna F, et al. Outcomes of laparoscopic Miles' operation in very low rectal adenocarcinoma. Analysis of 32 cases[J]. Eur J Surg Oncol, 2007, 33(1): 49.
[7]任鹏涛, 张苑, 闫庆辉, 等. 不同手术方式对直肠癌术后感染患者病原菌与免疫功能影响分析[J]. 中华医院感染学杂志, 2014, 24(004): 965.
[8]王旻, 陈学博, 王欢, 等. 直肠癌扩大根治术对患者外周血中细胞免疫功能的影响[J]. 中国实验诊断学, 2011, 15(3): 521.
[9]任宏伟. 腹腔镜手术治疗对直肠癌患者免疫功能的影响分析[J]. 中国医药科学, 2015, 8: 005.
[10]Jayne D G, Guillou P J, Thorpe H, et al. Randomized trial of laparoscopic-assisted resection of colorectal carcinoma: 3-year results of the UK MRC CLASICC Trial Group[J]. J Clin Oncol, 2007, 25(21): 3061.
[11]Lacy A M, Delgado S, Castells A, et al. The long-term results of a randomized clinical trial of laparoscopy-assisted versus open surgery for colon cancer[J]. Ann Surg, 2008, 248(1): 1.
[12]Fleshman J, Sargent D J, Green E, et al. Laparoscopic colectomy for cancer is not inferior to open surgery based on 5-year data from the COST Study Group trial[J]. Ann Surg, 2007, 246(4): 655.
[13]曹其彬, 胡三元. 腹腔镜与开腹结直肠癌手术对机体免疫功能的比较[J]. 中国普通外科杂志, 2006, 15(8): 615.
[14]赵刚, 肖刚, 黄美雄, 等. 腹腔镜结直肠癌根治对机体免疫状态的影响[J]. 中华胃肠外科杂志, 2006, 8(5): 407.
[15]赖添武, 赵权, 徐奎, 等. 结直肠癌传统开腹手术与腹腔镜手术对免疫功能影响的对比研究[J]. 微创医学, 2014, 9(3): 293.
[16]李志民, 吴浩荣, 高泉根, 等. 1Adv-mIL-12转染KC治疗人结直肠癌裸鼠移植瘤的实验研究[J]. 中华全科医学, 2011, 9(4): 505.
[17]周志涛, 李俊, 吕培标, 等. 腹腔镜直肠癌根治术对患者血清C反应蛋白的影响[J]. 海南医学院学报, 2011, 17(7): 945.
[18]张亚军, 张雷, 李文海, 等. 早期低位直肠癌局部切除术后辅助放疗疗效分析[J]. 中华全科医学, 2013, 11(9): 1346.
Clinical efficacy of laparoscopic operation versus laparotomy operation in treatment of rectal cancer and their influence on immunological function
GUO Hongbin, LIU Chao
(GeneralSurgeryDepartment,LiaoyangCityCentralHospital,Liaoyang,Liaoning, 111000)
ABSTRACT:ObjectiveTo explore the short-term clinical effect of laparoscopic radical rectectomy versus laparotomy operation for rectal cancer and their influence on immunological function of patients. MethodsTotally 46 patients with rectal cancer performed with laparoscopic radical rectectomy were designed as laparoscope group and 43 patients with rectal cancer undergoing laparotomy operation at the same period were as open group. The surgical condition and complications of 2 groups were observed, and the changes of T-lymphocyte subset and immune globulin were detected and compared before surgery and 1, 3 and 7 days after surgery. ResultsIntraoperatve blood loss, evacuation time, anus functions, VAS score and hospital stays in laparoscope group was superior to open group (P<0.05). The levels of CD3+、CD4+of 2 groups decreased obviously (P<0.05), and were higher in laparoscope group than in open group 1, 3 and 7 days after surgery (P<0.05), but the level of CD8+significantly increased (P<0.05), and was lower in laparoscope group than in open group 1 and 7 days after surgery (P<0.05). The levels of IgG, IgM and IgA of 2 groups decreased obviously (P<0.05), and the decreased degree was lower in laparoscope group than in open group 1 and 3 days after surgery (P<0.05). ConclusionLaparoscopic radical rectectomy for rectal cancer, which is minimally invasive surgery, with less blood loss and rapid recovery, has a little influence on the body and helps protect the immune function of patients compared with laparotomy operation.
KEYWORDS:rectal cancer; laparoscopic radical rectectomy for rectal cancer; laparotomy operation
基金项目:中国高校医学期刊临床专项资金(11523456)
收稿日期:2015-10-20
中图分类号:R 735.3
文献标志码:A
文章编号:1672-2353(2016)01-065-04
DOI:10.7619/jcmp.201601020
