NKG2D-IL-21融合基因修饰的结肠癌细胞体外刺激NK细胞活化的研究
2016-03-15赵培蕾赵艺杰龚卫娟
赵培蕾, 赵艺杰, 冷 洁, 龚卫娟
(扬州大学医学院 免疫学教研室, 江苏 扬州, 225001)
NKG2D-IL-21融合基因修饰的结肠癌细胞体外刺激NK细胞活化的研究
赵培蕾, 赵艺杰, 冷洁, 龚卫娟
(扬州大学医学院 免疫学教研室, 江苏 扬州, 225001)
摘要:目的观察含NKG2D-IL-21融合基因的重组表达载体转染结肠癌细胞后对NK细胞活化的影响。方法首先利用DNA限制性内切酶鉴定插入真核表达载体(pcDNA3.1-NKG2D-IL-21)的NKG2D和IL-21基因序列,并通过脂质体介导质粒转染结肠癌细胞株CT-26。流式细胞术胞内染色法检测CT-26内NKG2D-IL-21融合蛋白的表达,酶联免疫吸附实验鉴定细胞培养上清NKG2D-IL-21蛋白的含量。最后将经基因转染的CT-26细胞与小鼠脾脏NK细胞共培养,流式细胞术检测NK细胞表面活化性受体CD69的表达。结果NKG2D-IL-21融合基因稳定插入pcDNA3.1载体。CT-26细胞经外源性NKG2D-IL-21融合基因转染后,表达含有NKG2D和IL-21的融合蛋白。分泌NKG2D-IL-21融合蛋白的CT-26细胞具有明显促进NK细胞表达CD69的活性。结论重组pcDNA3.1-NKG2D-IL-21真核表达载体可作为一种新型DNA疫苗。
关键词:NKG2D; IL-21; 融合基因; 结肠癌; NK细胞
NKG2D是表达于NK、CD8+T、γδT、NKT细胞表面的一种活化性受体。当NKG2D与其受体结合, 可激活与其偶联的信号转接蛋白DAP10, 从而启动细胞活化信号通路,促进这些淋巴细胞分泌IFN-γ等细胞因子,以及发挥细胞毒性功能[1-2]。NKG2D的配体为主要表达于人肿瘤细胞表面的主要组织相容性复合体 I类相关抗原A和B(MICA、MICB), 小鼠主要为视黄酸早期诱导转录子(RAE-1)[3-4]。由于免疫选择压力,晚期肿瘤患者体内淋巴细胞表面NKG2D的表达明显降低,从而不能介导NK细胞等的免疫监视作用[5-6]。IL-21主要由活化的T细胞和NK细胞分泌,IL-21与其受体结合后,激活胞内的JAK1、JAK3和STAT3激酶,从而促进淋巴细胞分泌颗粒酶、IFN-γ,显著增强淋巴细胞的杀伤功能[7-8]。本研究观察课题组前期制备的含NKG2D和IL-21融合基因的表达载体(pcDNA3.1-dsNKG2D-IL-21)转染结肠癌细胞后,是否具有激活NK细胞的功能,从而为制备含该重组表达载体的抗肿瘤基因疫苗提供重要实验依据。
扬州市-扬州大学合作基金(2012038-5); 国家级大学生创新创业训练计划(2013111117045Z)
1材料与方法
1.1实验材料
重组真核表达载体pcDNA3.1-dsNKG2D-IL-21为本课题组前期制备并常规保存,脂质体Lipofectamine 2000购自Invitrogen公司。DNA限制性内切酶购自Takara公司,质粒抽提试剂盒来自Qiagen公司。小鼠NKG2D抗体(CX5)、CD49b抗体(DX5)、CD69抗体(H1.2F3),流式胞内染色破膜试剂盒、IL-21检测ELISA试剂盒购自eBioscience公司。重组小鼠IL-21蛋白来自Peprotec公司,RPMI-1640培养基购自Invitrogen 公司,胎牛血清购自杭州四季青公司。CT-26细胞株来自美国ATCC公司,Balb/c小鼠来自扬州大学比较医学中心。
1.2方法
1.2.1双酶切鉴定重组载体pcDNA3.1-dsNKG2D-IL-21: 含重组质粒的细菌经过夜培养后,利用Qiagen公司小量质粒提取试剂盒,按说明书抽提质粒,紫外分光光度计法测定质粒的浓度。在20 μL总体系中,分别加入Xba I和Kpn I、Xba I和Xho I、Xho I和Kpn I DNA限制性内切酶,37 ℃孵育4 h, 进行琼脂糖凝胶电泳。
1.2.2脂质体包裹质粒后转染细胞:调整重组DNA质粒的浓度为 1 mg/mL, 与脂质体按质量/体积比为6︰1室温孵育20 min。同时对隔夜接种的CT-26细胞(小鼠结肠癌细胞株)用无血清培养基洗涤3次,加入脂质体质粒混合物,37 ℃孵育5 h后,更换为全血清培养基。72 h后同时收集细胞和培养上清。
1.2.3流式细胞术胞内染色法检测融合蛋白:收集经脂质体转染的CT-26细胞,经冷PBS洗涤后,加入固定/破膜剂,室温孵育30 min收集细胞,破膜缓冲液洗涤细胞,加入以破膜缓冲液稀释的NKG2D抗体(10 μg/mL),4 ℃孵育30 min, 破膜缓冲液洗涤3次后,利用流式细胞仪(FACS Calibur)检测阳性细胞的频率。
1.2.4ELISA检测细胞培养上清融合蛋白:取预先包被好抗体的酶标板,分别加入上述经脂质体转染的细胞培养上清,37 ℃孵育30 min, 洗涤后加入酶标抗体和底物,37℃避光孵育1 h,加入终止液。15 min后利用酶标仪读取450 nm处吸光度值。根据阳性蛋白对照绘制标准曲线,计算各样品内NKG2D-IL-21的浓度。
1.2.5基因修饰的CT-26细胞对NK细胞的刺激:按1.2.2方法转染CT-26细胞,48 h后分离正常小鼠脾脏单细胞悬液,按1︰1细胞数比例共培养过夜。次日收集细胞,经冷PBS洗涤后,同时加入CD49b抗体(DX5,标记小鼠NK细胞)和CD69抗体,流式细胞仪检测DX5+CD69+细胞的频率。
1.3统计学分析
不同处理组之间的差异采取ANOVA分析方法,两组之间的比较采取团体t检验分析,P<0.05为差异有统计学意义。
2结果
2.1重组pcDNA3.1-dsNKG2D-IL-21表达载体
的酶切鉴定
为明确课题组先前制备的2个NKG2D胞外区和IL-21基因序列均插入真核表达载体pcDNA3.1(-),分别利用Xba I和Kpn I、Xba I和Xho I、Xho I和Kpn I DNA限制性内切酶处理重组载体。结果证实,在Xba I和Xho I酶切位点之间插入了第1个NKG2D基因序列(544 bp),在Xho I和Kpn I酶切位点之间插入了第2个NKG2D和IL-21基因序列(858 bp),而在Xba I和Kpn I酶切位点之间则包含了2个NKG2D和IL-21的基因序列(1402 bp),其电泳结果见图1。
2.2重组质粒转染CT-26细胞后融合蛋白表达的鉴定
脂质体包裹重组质粒后,体外转染对数期培养的CT-26细胞,72 h后收集细胞,流式细胞仪胞内染色法检测NKG2D-IL-21融合蛋白的表达。结果证实,重组质粒转染细胞后,NKG2D-IL-21融合蛋白得到表达(图2),且随着转染质粒浓度的增加,NKG2D-IL-21融合蛋白阳性表达的细胞频率明显增高(图3)。

1.pcDNA3.1-dsNKG2D-IL-21载体经XbaI和KpnI酶切2.pcDNA3.1-dsNKG2D-IL-21载体经XhoI和KpnI酶切3.pcDNA3.1-dsNKG2D-IL-21载体经XbaI和XhoI酶切4.DNAladder图1 重组载体pcDNA3.1-dsNKG2D-IL-21双酶切后产物的凝胶电泳结果
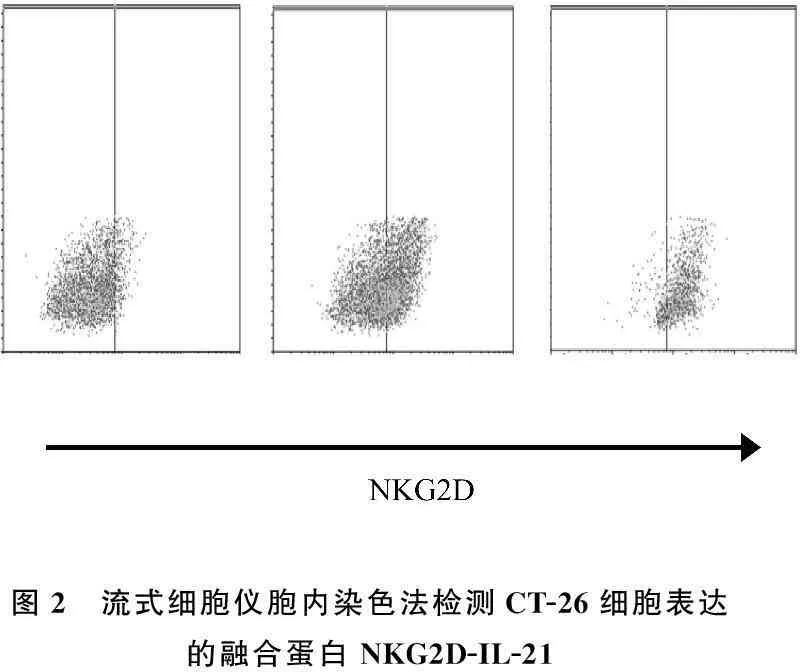
图2 流式细胞仪胞内染色法检测CT-26细胞表达的融合蛋白NKG2D-IL-21

与空质粒相比,**P<0.01;与空质粒相比,***P<0.001。图3 不同剂量重组质粒转染CT-26细胞后,NKG2D阳性细胞频率的比较
2.3重组质粒转染CT-26细胞,培养上清内融合蛋白浓度的测定
收集经重组质粒转染的细胞培养上清,ELISA检测上清内IL-21的浓度。结果显示,重组质粒转染细胞后,NKG2D-IL-21融合蛋白可分泌细胞外,且随着转染质粒浓度的增加,NKG2D-IL-21融合蛋白阳性表达的细胞频率明显增高(图4)。

与空质粒相比,*P<0.05;与空质粒相比,**P<0.01。图4 不同剂量重组质粒转染CT-26细胞后,培养上清NKG2D-IL-21融合蛋白的浓度
2.4重组质粒转染的CT-26细胞对NK细胞的刺激
CT-26细胞经重组质粒转染后,与脾脏单细胞悬液孵育后,检测NK细胞表面CD69的表达。结果发现,与商品化重组IL-21蛋白相似,经重组质粒转染的CT-26细胞可明显促进NK细胞表达CD69(图5、6)。

图5 重组质粒转染CT-26细胞后,刺激NK细胞表达CD69的检测

与空质粒相比,**P<0.01。图6 经重组质粒转染的CT-26细胞刺激NK细胞表达CD69的统计学分析
3讨论
本研究首先对课题组先前制备的重组pcDNA3.1-dsNKG2D-IL-21载体进行表达特性分析,在证实该重组载体转染结肠癌CT-26细胞后,可在胞浆和细胞培养上清检测到NKG2D-IL-21融合蛋白的表达和分泌;并进一步观察到经该融合基因修饰的CT-26细胞可刺激脾脏NK细胞活化,证明该重组基因表达的产物具有生物学活性。研究结果不仅从细胞层面证实该重组真核表达载体的有效性,还为进一步开发相应的基因疫苗、或基因修饰的肿瘤疫苗,用于临床治疗提供实验依据。
NKG2D识别其配体MICA分子时,是由2个NKG2D同源二聚体形成复合物来结合1个MICA分子[9],因此本研究制备的NKG2D-IL-21融合基因中含有2个NKG2D胞外结构域序列,将保证该基因的表达产物NKG2D-IL-21蛋白对其配体的结合功能。课题组前期利用重组DNA技术,在大肠杆菌表达NKG2D-IL-15融合蛋白,体内外实验[10]均证实该蛋白具有很强的识别MICA/RAE-1阳性肿瘤细胞的活性。本文中制备的NKG2D-IL-21重组载体与NKG2D-IL-15相比,并未改变上游NKG2D的基因序列,因此理论上同样具有较好的识别相应肿瘤细胞的活性。
尽管IL-21在体内主要由活化的CD4+T和NKT细胞分泌,其受体在体内广泛表达,如T、B、NK、巨噬细胞、树突状细胞、皮肤及肠道上皮细胞[11]。IL-21可促进CD4+T细胞向Th2、Th17细胞分化,抑制调节性Treg细胞的分化,并促进B细胞的类别转换,被认为是滤泡辅助性T细胞发挥活性的关键细胞因子[12]。IL-21信号通路活化后可明显刺激NK和CD8+T细胞发挥细胞毒功能,促进颗粒酶和FasL的表达[13]。胰腺癌[14]和乳腺癌[15]细胞过表达IL-21分子,均可明显抑制肿瘤的生长。外源性添加重组IL-21蛋白可明显抑制小鼠肿瘤的生长,且与IL-2和IL-15相比,具有明显的优越性[16]。结肠癌细胞经外源性NKG2D-IL-21融合基因修饰,刺激NK细胞活化后,是否发挥抗肿瘤活性,还期待进一步研究。
综上所述,本研究将重组pcDNA3.1-dsNKG2D-IL-21载体转染结肠癌细胞进行基因修饰后,证明该细胞直接具有刺激NK细胞活化的能力,为后续研发相应的肿瘤治疗性IL-21基因疫苗以及表达IL-21相关基因工程蛋白,建立重要的前期工作基础。
参考文献
[1]López-Soto A, Huergo-Zapico L, Acebes-Huerta A, et al. NKG2D signaling in cancer immunosurveillance [J]. Int J Cancer, 2015, 136(8): 1741.
[2]Ullrich E, Koch J, Cerwenka A, et al. New prospects on the NKG2D/NKG2DL system for oncology [J]. Oncoimmunology, 2013, 2(10): e26097.
[3]Le Bert N, Gasser S. Advances in NKG2D ligand recognition and responses by NK cells [J]. Immunol Cell Biol, 2014, 92(3): 230.
[4]Marcus A, Gowen BG, Thompson TW, et al. Recognition of tumors by the innate immune system and natural killer cells [J]. Adv Immunol, 2014, 122: 91.
[5]El-Gazzar A, Groh V, Spies T. Immunobiology and conflicting roles of the human NKG2D lymphocyte receptor and its ligands in cancer [J]. J Immunol, 2013, 191(4): 1509.
[6]Spear P, Wu M R, Sentman M L, et al. NKG2D ligands as therapeutic targets [J]. Cancer Immun, 2013, 13: 8.
[7]Tangye S G. Advances in IL-21 biology-enhancing our understanding of human disease [J]. Curr Opin Immunol, 2015, 34: 107.
[8]Davis M R, Zhu Z, Hansen D M, et al. The role of IL-21 in immunity and cancer [J]. Cancer Lett, 2015, 358(2): 107.
[9]Lengyel C S, Willis L J, Mann P, et al. Mutations designed to destabilize the receptor-bound conformation increase MICA-NKG2D association rate and affinity [J]. J Biol Chem, 2007, 282(42): 30658.
[10]Xia Y, Chen B, Shao X, et al. Treatment with a fusion protein of the extracellular domains of NKG2D to IL-15 retards colon cancer growth in mice [J]. J Immunother, 2014, 37(5): 257.
[11]Sndergaard H, Skak K. IL-21: roles in immunopathology and cancer therapy [J]. Tissue Antigens, 2009, 74(6): 467.
[12]Moens L, Tangye S G. Cytokine-Mediated Regulation of Plasma Cell Generation: IL-21 Takes Center Stage [J]. Front Immunol, 2014, 5: 65.
[13]Spolski R, Leonard W J. Interleukin-21: a double-edged sword with therapeutic potential [J]. Nat Rev Drug Discov, 2014, 13(5): 379.
[14]Ugai S, Shimozato O, Yu L, et al. Transduction of the IL-21 and IL-23 genes in human pancreatic carcinoma cells produces natural killer cell-dependent and -independent antitumor effects [J]. Cancer Gene Ther, 2003, 10(10): 771.
[15]Xu M, Liu M, Du X, et al. Intratumoral Delivery of IL-21 Overcomes Anti-Her2/Neu Resistance through Shifting Tumor-Associated Macrophages from M2 to M1 Phenotype [J]. J Immunol, 2015, 194(10): 4997.
[16]Rochman Y, Spolski R, Leonard W J. New insights into the regulation of T cells by gamma(c) family cytokines [J]. Nat Rev Immunol, 2009, 9(7): 480.
Study of NK cell activation by colon cancer cells genetically modified with NKG2D-IL-21 fusion gene ex vivo
ZHAO Peilei, ZHAO Yijie, LENG Jie, GONG Weijuan
(TeacjimgandResearchSectionofImmunology,MedicalCollegeofYangzhouUniversity,Yangzhou,Jiangsu, 225001)
ABSTRACT:ObjectiveTo observe effect of NK cell activation by colon cancer cell genetically modified with NKG2D-IL-21 fusion gene in a recombinant expression vector. MethodsFirstly, the recombinant vector, pcDNA3.1-NKG2D-IL-21, was identified with double restrictive enzymes for insertion of NKG2D and IL-21. After transfection by liposome and plasmid complex, expression of NKG2D-IL-21 fusion protein in CT-26 cells (a colon cancer cell line) was detected by an intracellular staining flow cytometry. Concentrations of NKG2D-IL-21 in cell-culture supernatants were measured by an ELISA assay. Finally, transfected CT-26 cells were co-cultured with mouse splenocytes overnight, and frequencies of DX5+CD69+cells were checked by flow cytometry. ResultsThe NKG2D-IL-21 fusion gene was stably inserted into pcDNA3.1. Ectopically transfection by NKG2D-IL-21 fusion gene in CT-26 cells leaded to express the corresponding protein. The secreted protein by CT-26 cells pre-transfected by the pcDNA3.1-NKG2D-IL-21 plasmid stimulated NK cells to express CD69. ConclusionThe pcDNA3.1-NKG2D-IL-21 plasmid can be considered as a new DNA vaccine to mediate anti-tumor activity.
KEYWORDS:NKG2D; IL-21; fusion gene; colon cancer; NK cell
通信作者:龚卫娟
基金项目:国家自然科学基金(81471547, 81172785); 江苏省自然科学基金(BK2011449, BK2008215);
收稿日期:2015-09-10
中图分类号:R 392.33
文献标志码:A
文章编号:1672-2353(2016)01-001-04
DOI:10.7619/jcmp.201601001
