人免疫重建荷子宫内膜癌SCID小鼠动物模型的建立
2016-03-15徐寒子陆谔梅孙志华
徐寒子, 贡 震, 陆谔梅, 孙志华,
吴 强1, 季明华1, 唐金海1,2
(1. 南京医科大学附属江苏省肿瘤医院, 江苏 南京, 210009;
2. 南京中医药大学, 江苏 南京, 210023;
3. 南京医科大学附属南京妇幼保健院, 江苏 南京, 210004)
人免疫重建荷子宫内膜癌SCID小鼠动物模型的建立
徐寒子1,2, 贡震3, 陆谔梅1, 孙志华1,
吴强1, 季明华1, 唐金海1,2
(1. 南京医科大学附属江苏省肿瘤医院, 江苏 南京, 210009;
2. 南京中医药大学, 江苏 南京, 210023;
3. 南京医科大学附属南京妇幼保健院, 江苏 南京, 210004)
摘要:目的构建人免疫重建皮下荷人子宫内膜癌移植瘤SCID小鼠模型。方法将SCID小鼠随机分成空白对照组、单纯免疫重建组、荷瘤组及模型组,分别经腹腔注射人淋巴细胞和(或)皮下接种HEC-1B细胞建立相应模型。观察荷瘤鼠成瘤、移植瘤生长及组织学特征;ELISA法检测小鼠血清中人IgG含量,流式细胞术、免疫组化法检测小鼠外周血及脾脏T细胞表型。结果小鼠成瘤率均为100%,但模型组小鼠成瘤潜伏期延长、移植瘤生长受限。单纯免疫重建组及模型组小鼠外周血、脾脏分别可检出人IgG及人T淋巴细胞表型。未发现移植物抗宿主情况,空白对照组、单纯免疫重建组、模型组小鼠体质量无显著差异。结论初步建立了人免疫重建荷人子宫内膜癌SCID小鼠复合模型。
关键词:子宫内膜恶性肿瘤; 疾病模型; 动物; SCID小鼠
SCID小鼠是1983 年Bosma[1-2]首次报道的一种以细胞和体液严重联合免疫缺陷为特征的近交系小鼠,目前国内外已有用SCID小鼠重建人免疫系统并移植人类肿瘤成功的报道,尚鲜见人免疫重建荷人子宫内膜癌的复合小鼠模型见诸报道。本研究选择预处理的SCID小鼠作为载体,通过腹腔注射人淋巴细胞,皮下种植人子宫内膜癌细胞,建立人免疫重建、皮下荷人子宫内膜癌移植瘤的SCID小鼠模型,以期为子宫内膜癌的生物学研究及治疗学评价提供体内实验研究平台。
1材料与方法
1.1主要试剂
小牛血清购自杭州四季青公司,培养基购自美国Gibco公司,人淋巴细胞分离液为挪威Axis-Shield PoC AS公司产品,人IgG ELISA检测试剂盒购自杭州联科生物,FITC标记的鼠抗人CD3单抗为美国BD公司产品
1.2细胞
人子宫内膜腺癌细胞株HEC-1B购自中科院上海细胞库。细胞置于含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的MEM培养液中,37 ℃、5%CO2培养箱中培养,每48 h换液1次,0.25%胰蛋白酶消化传代。细胞呈单层贴壁生长,收集对数生长期细胞以PBS重悬,调细胞浓度为2×107/mL进行实验。
1.3动物
CB-17 SCID小鼠,4~6周龄,购自北京维通利华实验动物技术有限公司,SPF无菌条件下饲养,无免疫渗漏(ELISA法测定鼠血清IgG水平≤10 μg/mL)的入组实验。
1.4方法
1.4.1分离人外周血淋巴细胞PBL: 抽取健康志愿者外周血,采用密度梯度离心法,以人淋巴细胞分离液分离得到人外周血单个核细胞(PBMC)作为PBL,PBS重悬细胞,调整细胞浓度为8×107/mL。
1.4.2小鼠复合模型的建立:24只SCID小鼠于建模前1 d接受3.5 Gy全身照射后随机分成4组,每组6只。A组为空白对照组,不进行免疫重建,皮下和腹腔仅注射PBS; B组为单纯荷瘤组,于每鼠后肢内侧皮下接种3×106个HEC-1B细胞,腹腔仅注射PBS而未行免疫重建;C组为单纯免疫重建组,经每鼠腹腔注射5×107个PBMC,每鼠后肢内侧皮下仅注射PBS而未行移植瘤的皮下种植;D组为复合模型组,于每鼠后肢内侧皮下接种3×106个HEC-1B细胞,腹腔注射5×107个PBMC。
1.5复合模型的鉴定
1.5.1小鼠生物学体征观察:观察小鼠的精神状态、活力、营养状态等,以及是否出现皮疹、腹泻步态改变等表现,异种移植物抗宿主病(GVHD)诊断标准参照文献判定[3]。
1.5.2移植瘤生长检测:用卡尺检查测量荷瘤鼠瘤体生长情况并判断潜伏期及成瘤率,经测量瘤体最长径D和最短径d后按公式Dd2/2计算肿瘤近似体积[4],绘制移植瘤生长曲线。
1.5.3组织观察:建模后6周处死小鼠称重,取小鼠脾脏、移植瘤组织,以福尔马林固定、石蜡包埋、切片染色后镜检。
1.6免疫重建的鉴定
ELISA检测小鼠外周血人IgG: 建模后每周断尾取血300 μL,离心得约120 μL待测血清样品。按人IgG-ELISA试剂盒使用说明操作:抗人IgG单抗4℃包被过夜于酶板上后,将标准品和待测样品100 μL加于上述包被板37 ℃孵育1 h, 使人IgG与单抗结合;再加入100 μL标记后的抗人IgG抗体37 ℃孵育1 h, 洗涤后加入显色液显色0.5 h, 最后上酶标仪测OD值,并通过标准曲线计算人IgG含量。
流式细胞术检测小鼠外周血T细胞(CD3+细胞)比例:处死小鼠后取小鼠外周血样品经溶血素破红5 min, 加CD3单抗或对照抗体4 ℃孵育30 min,PBS洗涤,最后上流式细胞仪检测。取前述石蜡包埋备用的小鼠脾脏组织,按免疫组化S-P法操作,检测人淋巴细胞(CD3+细胞)的存在。
1.7统计学分析
所有数据均采用统计软件SPSS 13.0进行统计学分析,均值以均数±标准差表示,计量资料两组间比较用t检验,多组间比较用方差分析。P<0.05为差异有统计学意义。
2结果
2.1小鼠生物学体征
所有小鼠在6周内均存活。荷瘤组小鼠出现了不同程度的精神萎靡、目光呆滞、行动迟缓、毛色黯淡杂乱等表现;而免疫重建组小鼠(包括了复合模型组小鼠)未出现明显的行为及生活习性的改变,也未观察到皮疹、腹泻等症状发生,处死小鼠后主要脏器检查亦无明显GVHD。荷瘤组小鼠体质量较其他各组显著减轻,余各组间无显著差异(见图1),提示本法安全可靠。

图1 建模后6周,荷瘤组小鼠体质量较其他各组显著减轻(P<0.05),余各组间无显著差异
2.2小鼠移植瘤生长情况
SCID小鼠皮下接种HEC-1B细胞后,单纯荷瘤组成瘤潜伏期约1周左右;而复合模型组小鼠潜伏期需要10~14 d, 较单纯荷瘤组明显延长。单纯荷瘤组和复合模型组小鼠成瘤率均为100%;但同期2组小鼠移植瘤体大小相比较,复合模型组小鼠显著小于单纯荷瘤组小鼠(P<0.05), 见图2。建模6周后处死小鼠,瘤体可见肿瘤细胞丰富,结构混乱(见图3A、C); 复合模型组存在一定程度的淋巴细胞浸润(见图3B), 而单纯荷瘤组则不甚明显(见图3D)。
2.3免疫重建的鉴定
2.3.1小鼠人B淋巴细胞重建检测:免疫重建小鼠外周血100%可检测到人IgG; 在建模后6周的时间内,人IgG含量随时间的延长而逐渐升高;同期下复合模型组显著高于单纯免疫组(P<0.05), 见图4。而单纯荷瘤组与空白对照组则无显著差异,均为本底检测量。

图2 小鼠皮下移植瘤生长对比
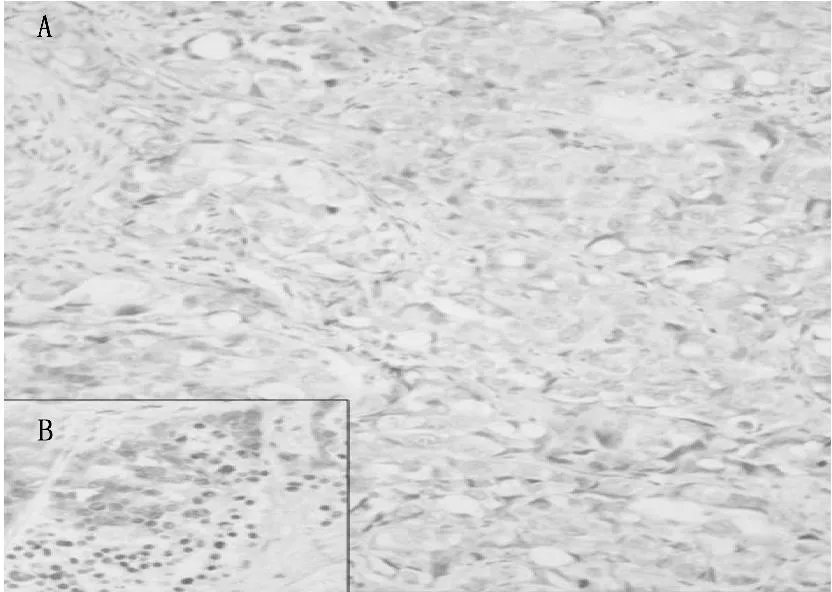

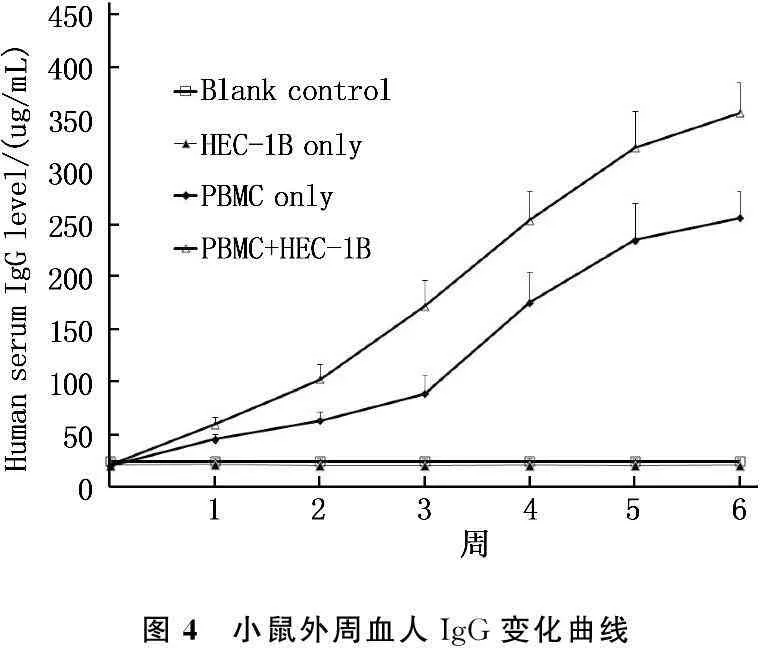
图3 小鼠皮下移植瘤镜下所见: A. 复合模型组; C. 单纯荷瘤组
2.3.2小鼠人T淋巴细胞重建检测:建模后6周处死小鼠提取脾,以免疫组化方法检测小鼠脾脏人T淋巴细胞,单纯免疫重建组、复合模型组小鼠脾脏可见人CD3+的T淋巴细胞(见图5 C、D, 棕色细胞),而空白对照组及单纯荷瘤组小鼠脾脏未见人CD3+的T淋巴细胞(见图5A、B)。以流式细胞术检测小鼠外周血人T淋巴细胞(CD3+细胞)比例,结果显示在免疫重建后6周复合模型组略高于单纯免疫组。而单纯荷瘤组与空白对照组未见明显人T淋巴细胞存在(见图5E)。

图5 小鼠脾脏及外周血免疫重建
3讨论
子宫内膜癌(EMC)是起源于子宫内膜腺体的恶性肿瘤,又称子宫体癌。子宫内膜癌是女性生殖器3大恶性肿瘤之一,约占女性癌症总数的7%,占生殖道恶性肿瘤20%~30%[5]。子宫内膜癌近年来发病率在世界范围内明显上升,仅次于宫颈癌,在欧美等发达国家已超过宫颈癌,成为女性生殖道最常见的恶性肿瘤[6]。
截止目前,子宫内膜癌的发病机制尚不完全清楚。子宫内膜癌早期患者经手术治疗预后较好,但治疗后复发率达15%~20%;而晚期及复发患者经激素治疗或放化疗后中位生存期<1年[7]。因此,对于子宫内膜癌生物学与治疗学的研究具有重要的现实意义。
子宫内膜癌动物模型是子宫内膜癌生物学研究及治疗学评价的重要工具。当前,实验性子宫内膜癌动物模型主要为移植模型[8],此外可见诱发模型的少量报道[9]。由于诱发模型的肿瘤与人类存在较大差异,且存在诱导时间长(>23周)、成瘤率低(48%)等缺陷[9],目前多数研究采用人-裸鼠移植模型。但裸鼠缺乏重要的抗肿瘤免疫系统,因此人-裸鼠移植模型仍无法完全模拟人体真实的体内环境,进而不便用于子宫内膜癌生物学特性(如肿瘤免疫耐受、免疫逃逸)的研究及治疗学(如生物、免疫治疗)的评价。因此,随着肿瘤生物学和治疗学研究的发展,对于子宫内膜癌缺乏一种可靠的与时俱进的体内研究模型。
严重联合免疫缺陷小鼠(SCID)的出现,为肿瘤体内模型的建立提供了更好的选择。SCID小鼠由CB17 近交小鼠16号常染色体scid隐性基因突变而来,该突变破坏了免疫球蛋白基因和T细胞受体基因的重组,导致缺乏成熟的功能性T、B 细胞[10]。SCID小鼠是一种先天性T 和B 细胞双重免疫缺陷动物,不仅可成功移植人肿瘤细胞,而且可利用人类有关免疫细胞进行免疫功能重建,适合于研究人类免疫细胞和人类肿瘤的关系。与单纯T淋巴细胞缺乏的裸小鼠相比,是更好的异种移植活体承载系统[11-12]。
就重建免疫的材料而言,当前主要包括人胎儿胸腺、脐血细胞、成人外周血造血干细胞、成人外周血淋巴细胞等;就免疫重建的途径而言,也可分为静脉与腹腔注射两类[13]。其中以经腹腔注射人外周血淋巴细胞最为简便、有效,最有实用价值。因此本实验选择SCID小鼠作为载体,通过皮下种植人子宫内膜癌细胞、腹腔注射人淋巴细胞来建立复合模型。
鉴于SCID鼠仍具有其固有免疫如自然杀伤细胞NK、淋巴因子活化的杀伤细胞LAK、巨噬细胞等排斥植入的异种组织,所以实验前SCID小鼠往往需要杀伤固有免疫细胞的预处理,如全身照射或抑制固有免疫细胞功能的药物等[14-15]。本实验于建模前1 d对SCID 鼠进行了3.5 Gy全身照射预处理,基本排除了固有免疫细胞作用的干扰。
当然,免疫系统的重建成功也与淋巴细胞的注射数量密切相关。数量不足,可能难以成功建立人免疫系统;数量过度,又容易诱发GVHD。本实验在腹腔注射5×107个人淋巴细胞后1~2周,单纯重建组及复合模型组小鼠外周血即可检测出人IgG, 人T淋巴细胞,且随时间的延长而逐渐增高,一定意义上代表了小鼠体内在建模后的6周内已初步建立了人细胞、体液免疫,同时也提示5×107个淋巴细胞是比较适宜的移植数量。由于脾脏参与了免疫效应细胞的归巢与再循环[16],因此建模后6周作者又对小鼠脾脏进行检测,结果对单纯重建组及复合模型组均可检出人CD3+T淋巴细胞,提示小鼠体内已成功建立了人免疫系统。
皮下移植瘤的监测结果显示成瘤率100%,经过对移植瘤组织学检查证实HEC-1B细胞在SCID 鼠皮下移植成功。鉴于单纯荷瘤组成瘤潜伏期明显短于复合模型组,瘤体大小亦显著大于复合模型组,提示重建的人免疫细胞可能已在局部发挥了抗肿瘤免疫效应。
综上所述,本实验成功建立了人免疫重建荷人子宫内膜癌SCID小鼠复合模型,该模型较好地模拟了子宫内膜癌的体内发生发展情况,是子宫内膜癌生物学研究和治疗学评价的理想平台。
参考文献
[1]Ye F, Chen H, Liang Z, et al. Establishment of a cervical cancer model via inoculating SiHa Cells into humanized severe combined immunodeficient mice[J]. Eur J Gynaecol Oncol, 2006, 27(6):566.
[2]Seitz G, Pfeiffer M, Fuchs J, et al. Establishment of a rhabdomyosarcoma xenograft model in human-adapted mice[J]. Oncol Rep, 2010, 24(4): 1067.
[3]Williamson LM, Warwick RM. Transfusion-associated graft-versus-host disease and its prevention[J]. Blood Rev, 1995, 9(4): 251.
[4]Rosato A, Zoso A, Dalla Santa S, et al. Predicting tumor outcome following cancer vaccination by monitoring quantitative and qualitative CD8+ T cell parameters[J]. J Immunol, 2006, 176(3): 1999.
[5]Marnitz S, K?hler C. Current therapy of patients with endometrial carcinoma. A critical review[J]. Strahlenther Onkol, 2012, 188(1): 12.
[6]Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1): 5.
[7]Gurumurthy M, Somoye G, Cairns M, et al. An update on the management of uterine carcinosarcoma[J]. Obstet Gynecol Surv, 2011, 66(11): 710.
[8]Kamat AA, Merritt WM, Coffey D, et al. Clinical and biological significance of vascular endothelial growth factor in endometrial cancer[J]. Clin Cancer Res, 2007, 13(24): 7487.
[9]Niwa K, Tanaka T, Mori H, et al. Rapid induction of endometrial carcinoma in ICR mice treated with N-methyl-N-nitrosourea and 17 beta-estradiol[J]. Jpn J Cancer Res, 1991, 82(12): 1391.
[10]Nonoyama S, Ochs HD. Immune deficiency in SCID mice[J]. Int Rev Immunol, 1996, 13(4): 289.
[11]Pearson T, Greiner DL, Shultz LD. Humanized SCID mouse models for biomedical research[J]. Curr Top Microbiol Immunol, 2008, 324: 25.
[12]Thomsen M, Galvani S, Canivet C, et al. Reconstitution of immunodeficient SCID/beige mice with human cells: applications in preclinical studies[J]. Toxicology, 2008, 246(1): 18.
[13]Van Duyne R, Pedati C, Guendel I, et al. The utilization of humanized mouse models for the study of human retroviral infections[J]. Retrovirology, 2009, 6: 76.
[14]Boynton E, Aubin J, Gross A, et al. Human osteoblasts survive and deposit new bone when human bone is implanted in SCID mouse[J]. Bone, 1996, 18(4): 321.
[15]Matsuura Y, Yagi H, Matsuda S, et al. Human liver-specific nanocarrier in a novel mouse xenograft model bearing noncancerous human liver tissue[J]. Eur Surg Res, 2011, 46(2): 65.
[16]Serody JS, Burkett SE, Panoskaltsis-Mortari A, et al. T-lymphocyte production of macrophage inflammatory protein-1alpha is critical to the recruitment of CD8(+) T cells to the liver, lung, and spleen during graft-versus-host disease[J]. Blood, 2000, 96(9): 2973.
Establishment of a hu-PBL-SCID mouse xenograft model of human endometrial cancer
XU Hanzi1,2, GONG Zhen3, LU Emei1, SUN Zhihua1,WU Qiang1, JI Minghua1, TANG Jinhai1, 2
(1.JiangsuTumorHospitalAffiliatedtoNanjingMedicalUniversity,Nanjing,Jiangsu, 210009;2.NanjingUniversityofTraditionalChineseMedicine,Nanjing,Jiangsu, 210023;3.NanjingMaternalandChildHealthCareHospitalAffiliatedtoNanjingMedicalUniversity,Nanjing,Jiangsu, 210004)
ABSTRACT:ObjectiveTo establish a chimeric mouse model of endometrial cancer. MethodsPre-treated SCID mice were divided into 4 groups, including blank control, humanized control, xenograft control and chimeric model, which would be transplanted with human peripheral blood lymphocyte (PBL) intraperitoneally and/or injected with human endometrial cancer cells HEC-1B subcutaneously. The tumor growth was observed. Human immunoglobulin (IgG) and human T cells were assayed by ELISA, flowcytometry and immunochemistry (IHC) respectively. ResultsThe tumorigenecity rate of the model mice was 100%. Compared with xenograft control mice, the tumor size of chimeric model mice significantly depressed (P<0.05). Human IgG and T lymphocytes were observed in mice peripheral blood and spleen of humanized control and chimeric model groups. No GVHD was observed and the mouse weights among blank control, humanized control and chimeric model groups had no significant differences. ConclusionA hu-PBL-SCID mouse xenograft model of human endometrial cancer has been established successfully.
KEYWORDS:endometrial neoplasm; disease models; animal; SCID mouse
基金项目:国家自然科学基金项目(81202007); 江苏省肿瘤医院院基金项目(ZQ20120117)
收稿日期:2015-09-20
中图分类号:R 737.33
文献标志码:A
文章编号:1672-2353(2016)01-008-05
DOI:10.7619/jcmp.201601003
