粘质沙雷氏菌低温脂肪酶的基因克隆与酶学性质分析
2016-03-15李婧玒李仁宽叶秀云
李婧玒, 李仁宽, 2, 林 娟, 2, 叶秀云, 2
(1.福州大学生物科学与工程学院, 福建 福州 350116;2. 酶高效表达国家工程实验室, 福建 福州 350002)
粘质沙雷氏菌低温脂肪酶的基因克隆与酶学性质分析
李婧玒1, 李仁宽1, 2, 林 娟1, 2, 叶秀云1, 2
(1.福州大学生物科学与工程学院, 福建 福州 350116;2. 酶高效表达国家工程实验室, 福建 福州 350002)
克隆一个源于北极冻土沙雷氏菌的脂肪酶基因lip18, 实现其在大肠杆菌中的表达, 并进行酶学性质研究. 克隆脂肪酶基因lip18, 并构建pET-28a(+)-lip18重组表达载体, 导入大肠杆菌BL21(DE3)中, 诱导优化重组蛋白表达, 并研究其酶学性质. 克隆得到脂肪酶基因lip18, 全长为1 842 bp, 编码614个氨基酸. 重组菌的诱导温度对蛋白表达影响很大, 在最适诱导温度为20 ℃时脂肪酶大量表达, 重组脂肪酶的相对分子质量约为65 ku. 酶学性质研究表明: 重组酶高效水解C10~C16的中、 长链脂肪酸, 最适作用温度30 ℃, 最适作用pH值 7.0, 并且在0 ℃条件下有一定的催化活性, 热稳定性差, 是低温中性脂肪酶; 同时, 对有机溶剂有较好的耐受性.
沙雷氏菌; 脂肪酶; 克隆; 表达; 性质分析
0 引言
脂肪酶(lipase, E.C3.1.1.3)是在异相系统(油-水界面)催化天然油脂的酯键水解产生丙三醇和水不溶性十二碳以上长链脂肪酸的一类酶的总称[1]. 不同于大多数水解酶, 脂肪酶的催化反应体系为非均相系统. 鉴于脂肪酶的特性, 其在传统工业领域如食品、 医药、 洗涤剂、 皮革和造纸等具有重要用途[2-3], 同时在新型工业领域如生物柴油、 手性化合物和功能性低聚糖制备等也具有宽阔的应用前景[4-5].
目前研究最多的产脂肪酶的细菌是芽孢杆菌Bacillus, 芽孢杆菌属的脂肪酶具有较好的耐热性和耐碱性. 粘质沙雷氏菌Serratiamarcescens, 亦称灵杆菌Bacillusprodigiosus, 有对底物的催化反应存在底物异构性和有机溶剂耐受性, 在手性药物的动力学拆分和生物柴油等领域的作用不可估量, 但其有条件致病性以及产鲜红色素, 故通过对其进行异源表达的研究不断增多, 以期提高S.marcescens脂肪酶的性质. Lee等[6]报道了S.marcescensES-2的脂肪酶基因在大肠杆菌表达体系中表达, 可用于外消旋体氟比洛芬酯的动力学拆分, 其对光学纯的(S)-氟比洛芬(98.5% ee)的选择性较高(E=332). 朱绮霞等[7]将粘质沙雷氏菌脂肪酶基因lipA插入重组表达载体pET-22b(+), 导入大肠杆菌Bl21(DE3)中实现脂肪酶的高表达, 酶活力为104 U·mL-1, 而且具有较好的热稳定性和甲醇耐受性.
Naeem等[8]将最适反应温度约为30 ℃, 并且在0 ℃时依然可以催化底物反应的脂肪酶称为低温脂肪酶. 产低温脂肪酶的低温微生物大多分布在南、 北两极以及大洋底部等极冷环境, 目前发现的种属大都属于假单胞菌属Pseudmonas、 青霉菌Penicillum[9]以及嗜冷杆菌Psychrobacter[10]等. 已报道有部分低温脂肪酶基因在大肠杆菌中得到表达, 但易形成没有生物学活性的包涵体, 需要复杂的复性过程.
用于工业领域的脂肪酶多为中温酶, 在低温条件下酶的催化效率极低, 然而低温脂肪酶凭借卓越的低温高催化活性性质使其在食品、 奶制品以及环境修复等诸多领域具有良好的应用潜力, 如低温脂肪酶用于处理含脂废弃物, 附加热能低, 不会造成二次污染, 起到较好的环境保护作用[11]. 本文所研究的产脂肪酶菌株BOB筛选于北极冻土样品, 对其进行基因克隆, 并实现其在大肠杆菌中的表达, 研究诱导温度对大肠杆菌表达体系分泌脂肪酶的影响, 并研究重组蛋白性质.
1 材料
1.1 菌株和质粒
实验所用到的菌株与质粒如表1所示.
1.2 酶和试剂
限制性内切酶(NcoⅠ,XhoⅠ), T4 DNA连接酶, DNA聚合酶, 2×PCR mix等均购自TaKaRa公司; 基因组DNA抽提试剂盒, 胶回收试剂盒, 质粒DNA抽提试剂盒等均购自Sangon Biotech公司; 对硝基苯酚酯(C4~C16)为Sigma公司产品, 其他药品均为进口或国产分析纯.
1.3 培养基
LB培养基: 酵母膏5 g·L-1, 蛋白胨10 g·L-1, NaCl 10 g·L-1, 固体培养基再添加琼脂20 g·L-1;
LLB培养基: 酵母膏5 g·L-1, 蛋白胨10 g·L-1, NaCl 5 g·L-1, 固体培养基再添加琼脂20 g·L-1;
牛肉膏蛋白胨培养基: 牛肉膏3 g·L-1, 蛋白胨10 g·L-1, NaCl 5 g·L-1, 固体培养基再添加琼脂20 g·L-1;
初筛培养基: 下层为橄榄油乳化液20 mL, 0.1 g·L-1维多利亚蓝 100 mL, 琼脂20 g·L-1, pH 7.5; 上层为牛肉膏蛋白胨固体培养基.
2 方法
2.1 菌株的筛选及鉴定
将北极冻土样品稀释适当倍数后涂布于初筛培养基上, 27 ℃恒温培养2~3 d, 观察菌落周围是否出现透明圈, 有透明圈的菌株即为产脂肪酶菌株. 从中筛选到一株能降解橄榄油且透明圈较大的菌株BOB, 并用细菌鉴定16S rRNA基因通用引物27F和1492R进行分析. 获得序列委托英潍捷基公司进行测序.
2.2 BOB菌株脂肪酶基因克隆
BOB菌株的总基因由基因组DNA抽提试剂盒提取. 根据BOB菌株16S rRNA鉴定结果, 在NCBI上检索该菌属脂肪酶基因序列, 设计基因全长特异引物:
上游引物BOY-F: 5’-ccatggGCATCTTTAGCTATAAGGATCTG-3’, 含NcoⅠ酶切位点(下划线标注);
下游引物BOY-R: ctcgagGGCCAACACCACCTGATCGGTG-3’, 含XhoⅠ酶切位点(下划线标注). 引物合成由生工生物工程上海有限公司合成.
以菌株BOB基因组为模板, BOY-F和BOY-R为引物, 进行常规PCR技术克隆. PCR程序: 94 ℃, 5 min; 95 ℃, 30 s; 55 ℃, 30 s; 72 ℃, 90 s, 共30次循环; 72 ℃, 7 min.
扩增成功后进行琼脂糖凝胶电泳, 回收与预测条带大小相同的基因片段. 将纯化的目的基因进行TA克隆和阳性克隆子筛选.
利用生物信息学软件对送测成功的脂肪酶基因lip18进行分析, 蛋白质相对分子质量及等电点预测采用Compute pI/Mw, 信号肽序列预测采用SignalP 4.1, NetNGly预测可能的N-糖基化位点, TMHMM分析蛋白跨膜区域, 利用NCBI网站的结构域数据库进行结构域分析, DNA-BLAST以及Protein-BLAST分析其同源性.
2.3 表达载体的构建
提取阳性克隆子质粒用限制性内切酶NcoⅠ和XhoⅠ进行酶切, 并同时用相同的酶处理质粒pET-28a(+), 通过琼脂糖凝胶电泳后回收目的片段. 将双酶切后的目的片段与载体用T4 DNA连接酶4℃连接过夜, 并通过热激法转化到E.coliDH5α感受态细胞中, 复苏后涂布于含Kana抗性25 mg·L-1的LB筛选平板, 37 ℃过夜, 挑选阳性克隆子接入5 mL LB液体中, 37 ℃过夜. 提取阳性克隆子质粒, 用限制性内切酶NcoⅠ和XhoⅠ进行酶切, 条带正确后委托英潍捷基公司进行测序.
2.4 大肠杆菌表达菌株的构建
将阳性克隆子的质粒pET-28a(+)-lip18热激导入E.coliBL21(DE3)感受态细胞中, 将转化克隆子涂布于含Kana抗性25 mg·L-1的LB筛选平板, 37 ℃过夜, 挑选阳性克隆, 提取质粒进行序列测定.
2.5 重组菌E.coliBL21/pET-28a(+)-lip18表达及SDS-PAGE分析
重组菌E.coliBL21/pET-28a(+)-lip18于10 mL LB(Kana终质量浓度为25 μg·mL-1培养液, 37 ℃培养过夜, 以6%的接种量加入50 mL LB培养液, 37 ℃培养到菌液D600达到0.5时, 加入终浓度为0.75 mmol·L-1的IPTG诱导15 h, 10 000 r·min-14 ℃离心15 min, 收集沉淀细胞, 溶解于等体积的pH 7.0、 50 mmol·L-1磷酸盐缓冲液中, 冰浴条件下进行超声波破碎15 min(以破碎时间3 s, 间隔时间2 s为一次循环), 收集破碎上清液获得可溶性重组蛋白LIPA, 同时收集破碎沉淀, 用等体积的2 mol·L-1尿素在1 mmol·L-1EDTA, pH 7.0 、 50 mmol·L-1磷酸盐缓冲液中洗涤包涵体以除去膜碎片和膜蛋白, 用等体积的6 mol·L-1盐酸胍溶解蛋白, pH 7.0、 50 mmol·L-1磷酸盐缓冲液中透析复性, 获得包涵体蛋白LIPB.
选取不同诱导温度15~35 ℃(间隔5 ℃), 用SDS-PAGE分析LIPA和LIPB蛋白, 分别测定蛋白LIPA酶活力, 确定最佳的诱导温度, 每个诱导温度进行3个平行实验, 研究不同温度对包涵体形成的影响.
相对分子质量的测定: SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)分析, 利用SDS-PAGE分析lip18在大肠杆菌BL21(DE3)中的表达情况. 实验采用12.5% SDS-PAGE蛋白电泳, 考马斯亮蓝染色, 脱色液脱色后检测目的蛋白条带.
蛋白浓度的测定: BCA法测定, 利用BCA蛋白质定量检测试剂盒测定蛋白浓度.
酶活力的测定:p-NP比色法[12]测定lip18脂肪酶酶活. 反应总体积1 mL, 反应液包括90 μL 10 mmol·L-1p-NPP、 810 μL 50 mmol·L-1pH 7.0的磷酸盐缓冲液, 反应液经35 ℃预热5 min, 加入适当稀释的酶液100 μL, 35 ℃反应15 min. 检测硝基苯酚(p-NP)生产, 检测波长为404 nm. 以灭活的酶液为空白, 将在一定条件下, 单位时间内脂肪酶催化对硝基苯酚酯水解生成1 μmol对硝基苯酚所需的酶量定义为一个脂肪酶活力单位(U).
2.6 重组蛋白LIPA分离纯化与SDS-PAGE
将IPTG诱导后的发酵液于10 000 r·min-14 ℃离心15 min, 沉淀溶于清洗液(10 mmol·L-1咪唑、 20 mmol·L-1磷酸、 0.1 mol·L-1NaCl、 pH 7.5), 冰浴条件下进行超声波破碎15 min, 从而获得含His-tag-LIPA融合蛋白上清, 过HisTrapTMFF亲和层析柱纯化, 再由洗脱液(250 mmol·L-1咪唑、 20 mmol·L-1磷酸、 0.1 mol·L-1NaCl、 pH 7.5)梯度洗脱. 纯化过程参照GE Healthcare说明书. 收集出峰的液体, 在pH 7.0磷酸盐缓冲液中4 ℃透析过夜. 纯化蛋白通过SDS-PAGE电泳检验纯化效果.
2.7 酶学性质研究2.7.1 底物特异性
配置10 mmol·L-1的不同碳链长度的对硝基苯酚酯(C4~C16), 在35 ℃、 pH 7.0条件下, 测量其酶活力, 将最高酶活定义为100%.
2.7.2 最适反应pH值及pH稳定性
选取pH值为5.7、 6.0、 7.0的0.05 mol·L-1磷酸盐缓冲液和pH值为7.0、 7.5、 8.0、 9.0、 10.0的0.05 mol·L-1Tris-HCl缓冲液, 在30 ℃下测定其相对酶活力, 将最高酶活定义为100%, 计算其相对酶活, 以确定最适反应pH值.
将酶液溶于pH值为5.7、 6.0、 7.0的0.05 mol·L-1磷酸盐缓冲液和pH值为7.0、 8.0、 9.0、 10.0的0.05 mol·L-1Tris-HCl缓冲液中, 4 ℃下保温120 min, 在最适反应温度及最适反应pH值条件下测定其酶活力, 以未经保温的酶液为100%, 确定pH稳定性.
2.7.3 最适温度及温度稳定性
选取温度为0~60 ℃(每隔10 ℃, 0 ℃条件为冰水混合条件), 在最适pH值下测定其相对酶活力, 将最高酶活定义为100%, 计算其相对酶活, 以确定最适反应温度.
将酶液在10~60 ℃(每隔10 ℃)下保温120 min, 在最适反应温度及最适反应pH值条件下测定其酶活力, 以未经保温的酶液为100%, 确定温度稳定性.
2.7.4 有机溶剂耐受性
将酶液以50%(体积分数)溶于有机溶剂甲醇、 乙醇、 丙醇、 正丁醇、 异丙醇、 异丁醇、 丙三醇中, 于30 ℃水浴摇床震荡3 h. 在最适反应温度及最适反应pH值条件下测定其酶活力, 将未经处理的酶液定义为100%.
3 结果与分析
3.1 菌株BOB的16S rRNA鉴定结果
测序得到BOB菌株的16S rRNA基因序列为1 561 bp, NCBI BLAST进行序列比对后利用MEGA软件构建BOB菌株的系统发育树, 如图1所示. 结果表明BOB菌株与肠道杆菌科Enterobacteriaceae沙雷氏菌Serratiasp.属的种Serratiamarcescensstrain MH6的16S rRNA 序列同源性达96%, 初步判定为沙雷氏菌Serratiasp..
3.2 脂肪酶基因的克隆
以Serratiasp. BOB基因组为模板, 由引物BOY-F和BOY-R, PCR扩增得到lip18基因, 可见在1 500~2 250 bp之间有一条较亮的条带, 大小与预测片段长度一致.lip18基因编码区全长为1 842 bp, 编码614aa, G+C含量为62%. 通过生物信息学软件预测: 总相对分子质量为64.7 ku, 理论pI为4.43, 不存在信号肽序列和跨膜区域. NCBI网站的结构域数据库分析结果表明: LIPA脂肪酶属于α/β型水解酶第6家族, 脂肪酶超家族保守区域在140~260 aa区间, 360~580 aa区间编码有关次生代谢产物的生物合成、 运输和分解代谢的COG2931片段, 编码RTX毒素和相关Ca2+结合位点.
将该基因序列提交NCBI进BLASTN同源比对, 分析表明该脂肪酶与Serratiasp. FS14(GenBank: CP005927.1)分泌型脂肪酶(extracellular lipase)的编码基因相似性最高, 一致性为99%; BLASTP同源比对表明该脂肪酶与Serratiamarcescens(GenBank: WP015377732.1)的分泌型脂肪酶的相似性最高, 一致性为99%. 由DNAMAN软件对lip18编码蛋白与相关脂肪酶蛋白氨基酸序列进行比对, 结果表明, 7条序列的相似性较高, 并且都存在保守五肽结构-GHSLG-.
目前,Serratiamarcescensstrain ECU1010的分泌型脂肪酶lipA基因(GenBank: DQ884880.1)和lipB基因(GenBank: HM440338.1)与lip18基因的一致性均为97%, Long等[13]实现了lipA在大肠杆菌中的大量表达, 得到可以高效催化外消旋酮洛芬的lipA蛋白; Li等[14]将Serratiamarcescensstrain ECU1010通过定点突变方法获得有机溶剂高度耐受的脂肪酶.
3.3 重组菌E.coliBL21/pET-28a(+)-lip18表达及表达优化
成功构建重组菌E.coliBL21/pET-28a(+)-lip18, 重组菌表达脂肪酶位于细胞内, 需要经过超声细胞破碎, 诱导表达经SDS-PAGE验证(见图2), 得到相对分子质量约为65 ku的重组酶, 与理论值接近; 利用p-NPP法测表达后菌体破碎液的上清液脂肪酶, 酶活力为5.29 U·mL-1. 以上结果表明基因lip18编码产生的蛋白为脂肪酶.
实验对重组菌进行诱导优化时, 采用不同的诱导温度15~35 ℃时, 发现当诱导温度高于20 ℃, 可溶性蛋白LIPA(见图2 注1、 3、 5)逐渐减少, 重组蛋白大量形成不溶性的包涵体蛋白LIPB(见图2 注2、 4、 6). 包涵体虽然复性后同样具有脂肪酶活性, 但其复性条件繁琐, 故应尽量避免目标蛋白形成包涵体. 图3是重组蛋白LIPA诱导温度优化的相对酶活力图, 结合图2、 3, 重组蛋白在15和20 ℃的诱导温度培养下主要以可溶性蛋白形式存在(见图2 注7、 9), 并且在诱导温度为20 ℃时的LIPC的酶活力最高. 而过高的诱导温度(高于20 ℃)导致重组蛋白LIPA多形成包涵体, 原因可能为在较高诱导温度下重组菌表达的蛋白结构发生改变, 导致重组蛋白以不溶性的包涵体形式存在. 因此选择20 ℃为重组菌的最优诱导温度.
3.4 重组蛋白LIPA分离纯化
为了更好地对重组脂肪酶LIPA进行理化性质研究, 对该重组菌的发酵液进行分离纯化. 对其亲和层析结果的研究表明, His-tag-LIPA融合蛋白上清过HisTrapTMFF亲和层析柱纯化后比酶活达66.79 U·mg-1(见表2). SDS-PAGE检测到65 ku处存在单一条带(见图4).
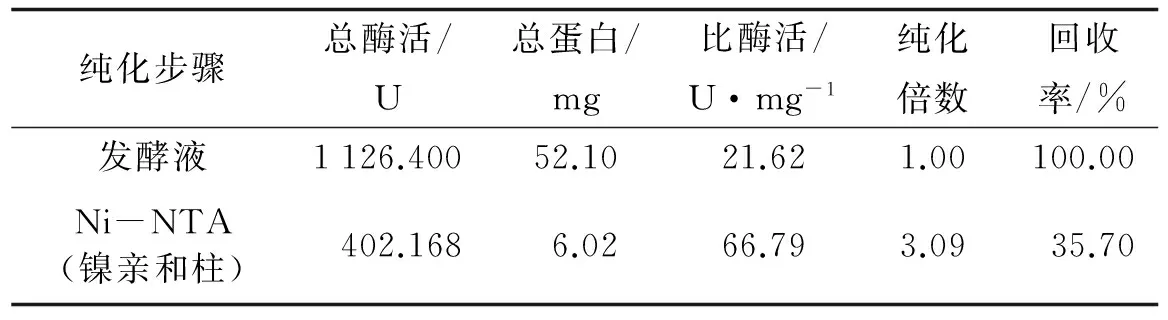
表2 重组脂肪酶分离纯化表Tab.2 Purification of the recombinant lipase
3.5 酶学性质研究
在pH 值7.0、 35 ℃条件下测定LIPA蛋白降解底物对硝基苯酚酯(C4~C16)的相对酶活力, 结果如图5所示, 表明LIPA最适底物为对硝基苯肉豆蔻酸酯C14. 由此, 该LIPA酶是典型的长链脂肪酸水解酶, 虽然其对短链脂肪酸C4~C8也有一定的水解作用, 但其对C10~C16的中长链底物有较好的水解效果及较高的选择性.
在pH值 5.7~10.0范围的缓冲体系中将重组蛋白LIPA与最优底物反应, 并进行酶活力测定, 结果表明, 重组蛋白LIPA的最适pH值为7.0(见图6(a)). 已报道的重组菌E.coliBL21(DE3)/pET-22b(+)-lipA[7]的最适pH值为7.0~7.5, 与本研究相近; 重组酶pH稳定性研究表明, 该酶在pH 值7.0~8.0下保温2 h比较稳定, 相对酶活力高于70%, 过碱的条件导致脂肪酶活力急剧下降(见图6(b)). 在温度10~60 ℃范围内对重组蛋白LIPA进行酶活力测定, 结果如图6(c)所示, 重组蛋白LIPA的最适温度为30 ℃, 且在0 ℃条件下仍然具有催化活性, 为低温脂肪酶, 该LIPA蛋白在低温下可维持较高的酶活性的主要原因为其生长于北极而做出对周围极冷环境的适应; 如图6(d)所示, 重组酶温度稳定性研究表明, 低温酶的热稳定性差, 在40 ℃保温2 h酶活力约为60%, 温度达到60 ℃后稳定性极大下降, 已报道的SerratiamarcescensECU1010[15]的lipB脂肪酶30~50 ℃保温2 h酶活维持在45%以上, 60 ℃时则基本失活, 与本研究的脂肪酶温度稳定性相似.
如图7所示, 实验条件是有机溶剂的体积分数为50%, 30 ℃水浴摇床保温3 h, 重组酶对甲醇、 乙醇、 丙醇、 丙三醇有着很好的耐受性. 其中LIPA蛋白对丙三醇的耐受性比较突出, 相关酶活高于130%, 而在异丙醇和异戊醇溶液中的酶活力基本丧失. LIPA蛋白在丙三醇溶液中酶活力升高的原因可能为丙三醇是蛋白质的常见稳定剂, LIPA蛋白在丙三醇溶液中的蛋白质结构比在其他环境下更加稳定, 同时, 酶活力的提高与产物浓度的酶促反应相关. LIPA蛋白具有较好的有机溶剂耐受性, 可使其应用于生物柴油领域, 由于脂肪酶催化植物油酯化合成或转酯化产生的脂肪酸甲酯是生物柴油的主要成分[16], 故而脂肪酶与其他酶制剂制成的混合酶制剂可用于脂类加工厂和餐饮业排放的含脂类的废水和废物等转换为生物柴油[17].
4 结语
微生物脂肪酶、 蛋白酶以及糖化酶是最主要的三大工业用酶, 同时, 粘质沙雷氏菌脂肪酶在手性药物拆分及生物柴油领域等多个领域有着广泛的应用, 由于其独特的理化性质及较高的商业应用价值, 国内外对沙雷氏菌脂肪酶的研究在不断深入.
本文克隆了沙雷氏菌的脂肪酶基因lip18, 实现其在大肠杆菌中异源表达, 从而克服了沙雷氏菌条件致病性的限制, 并且对重组脂肪酶进行了表达优化以及酶学性质研究.lip18基因编码区全长为1 842 bp, 氨基酸长度为614 aa. 由BLASTN进行同源比对, 有12条沙雷氏菌的基因与lip18基因同源性高于95%, 其中Serratiasp. FS14(GenBank: CP005927.1)的分泌型脂肪酶(extracellular lipase)的一致性最高为99%.
构建基因工程菌经IPTG诱导, 20 ℃培养时, 可获得大量的可溶重组蛋白. 对重组蛋白进行表达, 在SDS-PAGE下测得酶的相对分子质量约为65 ku, 对纯化后的LIPA进行酶学性质研究表明, 重组脂肪酶具有低温高催化活性, 对有机溶剂(甲醇、 乙醇、 丙醇、 丙三醇等)有较好的耐受性, 对C10~C16的中、 长链脂肪酸有较高的选择性, 以上特性使其在食品、 冷洗、 制药领域有更大的应用潜力.
[1] JAEGER K, EGGERT T. Lipases for biotechnology[J]. Current Opinion in Biotechnology, 2002, 13(4): 390-397.
[2] DICKEY D, ATLANTA G. Improving the catalytic aetivity ofCandidaantareticalipase B by circular permutation[J]. American Chemical Society, 2005, 127(39): 13 466-13 467.
[3] SHIMADA Y, WATANBE Y, SUGIHARA A. Enzymatic alcoholysis for biodiesel fuel production and application of the reaction to oil processing[J]. Journal of Molecular Catalysis B: Enzymatic, 2002, 17(3): 133-142.
[4] HASAN F, SHAH A A, HAMEED A. Industrial applications of microbial lipases[J]. Enzyme and Microbial Technology, 2006, 39(2): 390-397.
[5] KELLY W J, ASMUNDSON R V, HUANG C M. Characterization of plantaricin KW30, a bacteriocin produced byLactobacillusplantarum[J]. Journal of Applied Bacteriology, 1996, 81(6): 657-662.
[6] LEE K W, BAE H A, LEE Y H. Molecular cloning and functional expression of esf gene encoding enantioselective lipase fromSerratiamarcescensES-2 for kinetic resolution of optically active (S)-flurbiprofen[J]. Journal of Microbiology and Biotechnology, 2007, 17(1): 74-80.
[7] 朱绮霞, 陈英, 张搏, 等. 粘质沙雷氏菌脂肪酶基因的克隆表达和酶学性质的研究[J]. 生物技术, 2010, 20(5): 12-16.
[8] NAEEM R, YUJI S, SATOSHI E,etal. Low-temperature lipase fromPsychrotrophicpseudomonassp. strain KB700A[J]. Applied and Environmental Microbiology, 2001, 67(9): 4 064-4 069.
[9] 林学政, 侯旭光, 李光友. 南极微生物低温酶的研究进展[J]. 海洋科学, 2002, 26(10): 38-42.
[10] YUMOTO I, HITOTA K, SOGABE Y,etal.Psychrobacterokhotskensissp. nov., a lipase-producing facultative psychrophile isolated from the coast of the Okhotsk Sea[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53(Pt6): 1 985-1 989.
[11] 陈贵元, 魏云林. 低温脂肪酶的研究现状与应用前景[J]. 生物技术通报, 2006(2): 29-43.
[12] TANG L H, XIA L M. Purification and partial characterization of a lipase fromBacilluscoagulanszju318[J]. Applied Biochemistry and Biotechnology, 2005, 125(2): 139-146.
[13] LONG Z D, XU J H, ZHAO L L,etal. Overexpression ofSerratiamarcescenslipase inEscherichiacolifor efficient bioresolution of racemic ketoprofen[J]. Journal of Molecular Catalysis B: Enzymatic, 2007, 47(3/4): 105-110.
[14] LI S X, MA Q, LIN K,etal. Essential role of gly33 in a novel organic solvent-tolerant lipase from Serratia marcescens ECU1010 as determined by site-directed mutagenesis[J]. Applied Biochemistry and Biotechnology, 2014, 172 (6): 2 945-2 954.
[15] WANG Y, ZHAO J, XU J H,etal. Significantly improved expression and biochemical properties of recombinantSerratiamarcescenslipase as robust biocatalyst for kinetic resolution of chiral ester[J]. Applied Biochemistry and Biotechnology, 2010, 162(8): 2 387-2 399.
[16] 寇秀颖, 于国萍. 脂肪和脂肪酸甲酯化方法的研究[J]. 食品研究与开发, 2005, 26(2): 46-47.
[17] 张开平, 惠明, 田青, 等. 微生物脂肪酶的应用领域及研究进展[J]. 河南工业大学学报(自然科学版), 2012, 33(1): 90-94.
(责任编辑: 洪江星)
Gene cloning and characterization of low-temperature lipase fromSerratiasp.
LI Jinghong1, LI Renkuan1, 2, LIN Juan1, 2, YE Xiuyun1, 2
(1.College of Biological Science and Technology, Fuzhou University, Fuzhou, Fujian 350116, China;2. National Engineering Laboratory for Highly Efficient Enzyme Expression, Fuzhou, Fujian 350002, China)
The genelip18 encoding lipase fromSerratiasp. screened from Arctic tundra was cloned and expressed inEscherichiacoli, the enzymatic properties were characterized. Thelip18 gene was amplified and integrated into the genome ofE.coliBL21(DE3) via the pET-28a(+) vector. The induction of the recombinant protein was optimized, then the enzymatic properties of the recombinant enzyme was studied. A new genelip18 consists of 1 842 bp, encoding 614 amino acids, was cloned. After induced by 20 ℃, recombinant lipase were magnanimous expressed with weight of 65 ku. Recombinant protein has high selectivity in C10~C16medium and long chain fatty acid. The optimum pH and temperature for the recombinant protein was at 7.0 and 30 ℃, still remained activity at 0 ℃, was thermal instability and low-temperature lipase. Moreover, the recombinant enzyme have better tolerance of the organic solvent.
Serratiasp.; lipase; cloning; expression; property analysis
10.7631/issn.1000-2243.2016.05.0738
1000-2243(2016)05-0738-08
2015-05-28
叶秀云(1962- ), 教授, 主要从事蛋白质工程方面的研究, xiuyunye@fzu.edu.cn
国家海洋局海洋公益性行业科研专项资助项目(201305015)
Q784
A
