Toll样受体基因多态性与幽门螺杆菌感染及其相关疾病关系的研究进展
2016-03-13杨晓燕综述张平安审校
杨晓燕 综述 张平安 审校
(武汉大学人民医院检验科,湖北 武汉 430060)
Toll样受体基因多态性与幽门螺杆菌感染及其相关疾病关系的研究进展
杨晓燕 综述 张平安 审校
(武汉大学人民医院检验科,湖北 武汉 430060)
Toll样受体(TLRs)是近年来发现的跨膜信号转导受体,它作为模式识别受体(PRRs),能通过识别病原体相对保守的病原相关分子模式(PAMPs)激活相关炎症级联反应,诱导细胞因子和化学因子的表达,在幽门螺杆菌(Hp)感染及其所致的相关疾病中起重要作用。TLRs的基因多态性能够影响机体对疾病的遗传易感性,本文拟从TLRs家族的生物学特征、信号传导途径及其基因多态性与Hp感染及相关疾病的关系作一综述。
Toll样受体;基因多态性;幽门螺杆菌
天然免疫系统是机体抵御微生物入侵的第一道防线,而模式识别受体(pattern recognition receptors,PRRs)的概念是Charles Janeway等于1992年提出,标志着天然免疫的研究进入了一个新的阶段。PRRs主要分为5大类:Toll样受体(Toll-like receptors,TLRs)、C型凝集素受体(C-type lectin receptors,CLRs)、视黄酸诱导基因I样受体(retinoic acid inducible gene I-like receptors,RLRs),NOD样受体(NOD-like receptors,NLRs)及AIM样受体[absent in melanoma(AIM)-like receptors,ALRs]。TLRs是最早被发现的也是研究最深入的PRRs,它可以被病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs)激活,从而触发机体固有免疫,进而通过刺激信号级联反应引起多种炎性因子和活性物质生成,在多种感染性疾病的发生发展中起重要作用。幽门螺杆菌(Helicobacter pylori,Hp)是一种多鞭毛、螺旋状、微需氧的革兰氏阴性菌,具有严重的致病性,与慢性胃炎、消化性溃疡、胃癌等的发生密切相关。基因多态性影响机体对疾病的遗传易感性,有研究表明TLRs基因多态性可能与Hp感染以及Hp感染相关疾病有易感相关性。
1 TLRs简介
1.1 TLRs的发现和结构 Toll蛋白最早是在研究果蝇胚胎背腹部发育的过程中被发现的,随后,研究人员发现它不仅在胚胎的发育过程中起作用,还参与了成蝇的免疫反应。1997年,在哺乳动物体内首次分离出与果蝇Toll蛋白同源的蛋白,后被命名为TLR4[1]。TLRs是一个进化保守的Ⅰ型跨膜蛋白受体家族,包括胞外区,跨膜区和胞内区(见图1)。N端胞外区是19~25个富含亮氨酸的重复序列,空间结构折叠成马蹄状,使蛋白之间的粘附作用增强,并在识别PAMPs时发挥作用;跨膜区结构域富含半胱氨酸,与TLRs分子的亚细胞定位有关;TLRs的胞内区与白细胞介素-1受体(interleukin-1 receptor,IL-1R)的胞内区相似度极高,被称作Toll/IL-1受体(Toll/interleukin-1 receptor,TIR)结构域,包括3个保守盒(conserved boxes):Box1、Box2、Box3,能与细胞内含有TIR结构域的接头蛋白分子相互作用,参与信号的转导[2-3]。
1.2 TLRs的分布 迄今为止已经有13种TLRs家族成员在哺乳动物中被发现,其中,在人体中发现的有TLR1-TLR10[4]。不同的细胞和组织表达的TLRs各不相同,TLR1广泛分布于单核细胞、多核细胞、淋巴细胞、巨噬细胞、NK细胞、内皮细胞、成纤维细胞以及树突状细胞等多种细胞表面;TLR2多位于细胞膜表面和吞噬溶酶体内,也可表达于髓系单核细胞、NK细胞以及肥大细胞;TLR3位于树突状细胞表面;TLR4位于中性粒细胞、单核细胞、肥大细胞的细胞膜表面,也可位于肠道上皮细胞的高尔基体内;TLR5主要位于髓样树突状细胞、NK细胞、单核细胞以及上皮细胞表面;TLR6位于肥大细胞、B细胞;TLR7是胞内体,位于树突状细胞、嗜酸性粒细胞、B细胞;TLR8也是胞内体,位于T细胞以及NK细胞等;TLR9也为胞内体,位于扁桃体的表面[5];TLR10表达于B细胞以及浆样树突状细胞。

图1 TLRs的结构
1.3 TLRs的配体 TLRs胞内区高度保守,差别不大,而胞外区有较大的差异,这有助于与不同的配体结合。一种TLR可以识别多种不同的配体,而同一种病原体也可以被多种不同的TLR识别[6]。如TLR1的配体为可溶性细菌因子、三酰化脂肽;TLR2的配体可为细菌的脂多糖、肽聚糖,真菌的酵母聚糖,丙型肝炎病毒的核心和NS3结构以及密螺旋体热休克蛋白70(HSP70)和防御素等;TLR3的配体可为病毒的dsRNA和内源性mRNA等;TLR4的配体有细菌的脂多糖、病毒的包膜蛋白以及寄生虫[7];TLR5的配体为细菌的鞭毛、病毒等;TLR6的配体有酵母菌的酵母多糖、分支杆菌的双乙酰化脂肽以及表皮葡萄球菌的调制子;TLR7、TLR8的配体均为咪唑喹啉、病毒的ss-RNA;TLR9的配体为细菌和病毒未发生甲基化的CpG DNA和疱疹病毒DNA等。目前尚未发现TLR10的配体[8],但随着以后实验技术的提高以及研究的深入,将会有越来越多的配体被发现。
1.4 TLRs信号转导途径 研究表明,在TLRs信号通路中存在两种途径激活下游蛋白。一是依赖髓样分化蛋白 88(myeloid differentiation primary-response protein 88,MyD88)的信号转导途径,另一条是非依赖MyD88的信号转导途径(见图2)。在哺乳动物中,除TLR3之外的所有TLRs都可触发依赖MyD88的信号转导途径[9]。依赖MyD88的信号转导途径:MyD88分子包含296个氨基酸,包含两个保守蛋白结构域,分别是N端末端的死亡结构域(death domain,DD),C端末端的TIR结构域。TIR结构域与TLRs的TIR区相结合,当TLR被激活后,通过TIR-TIR的相互作用,MyD88被招募至被激活的TIR结构域;而通过其DD的相互作用,白介素1受体相关激酶4 (IL-1R-associated kinas 4,IRAK4)被招募至MyD88,进而IRAK4招募并磷酸化IRAK1和IRAK2,形成复合物,同时,肿瘤坏死因子受体相关因子6(tumor-necrosis-factor-receptor-associated factor 6,TRAF6)也被募集到这一受体复合物上。TRAF6是一种指环结构域泛素连接酶,能够催化K63泛素链的合成。K63泛素链与TAB2(TAK1-binding proteins,TAB)相结合,TAB2和TAB1是TAK1结合蛋白,并与转移生长因子β激活激酶1(TGF-β-activated kinase 1,TAK1)形成的激酶复合物。K63泛素链与TAB2的结合可激活TAK1。激活后的TAK1能够磷酸化IKK复合物(包括IKKα和IKKβ)中的IKKβ,活化后的IKK复合物磷酸化IκB,从而导致IκB降解,IκB和NF-κB的复合物中核因子κB被释放出来,且发生从胞质到胞核的转移,最终引发炎症反应细胞分化、增殖。另外,丝裂原活化蛋白激酶的激酶6(mitogen-activated protein kinase kinase 6,MKK6)或MKK7也可被活化的TAK1激活,从而激活下游的P38和JNK信号通路,最终导致CREP1和AP1的释放并进入细胞核。MyD88非依赖的信号转导途径:有研究表明,一种能诱导干扰素调节因子β(interferon regulatory factor β,IRFβ)的含有TIR结构域的衔接蛋白(Toll/interleukin-1 receptor do-main-containing adaptor inducing IFNβ,TRIF)参与了TLR3和TLR4介导的MyD88非依赖的信号转导途径。TLR4不能像TLR3一样直接与TRIF绑定,而是需要以TRIF相关接头分子(Trif-related adaptor molecule,TRAM)作为媒介来间接招募TRIF,进而通过TRIF3活化IRF3,最终诱导IRFβ的表达。此外,TLR4与TRIF结合后能够通过TRIF的羧基末端结构域和RIP1相互作用,激活TAK1,从而激活NF-κB。
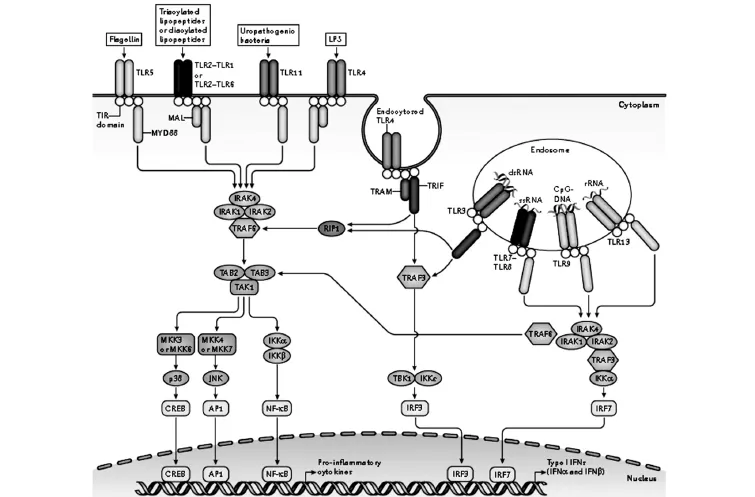
图2 TLRs的两条主要信号转导途径
2 TLRs在Hp致病中的作用
Hp感染是人类最常见的慢性感染之一,感染后不予治疗可能会终生定植,并导致许多相关疾病,如慢性胃炎、消化性溃疡、胃癌等[10]。有研究表明,Hp及其菌体成分,如脂多糖、HSP60,可通过TLR通路激活NF-κB和AP1等,启动一系列的炎症级联反应,从而诱导多种炎症因子的释放,最终导致胃黏膜的炎症反应[11-12]。还有研究表明,Hp感染及其菌体成分能够使得胃黏膜上皮细胞TLR的表达增多。Lagunes-Servin等[13]通过对25名Hp感染儿童的研究发现,与正常对照组相比较,Hp感染阳性组胃黏膜上皮细胞TLRs 2、4、5和9的表达量上调了,且IL-8、IL-10和TNF-α等炎症因子的表达量也上调了;Kawahara等[14]和Takenaka等[15]的研究表明,豚鼠胃小凹细胞TLR4在Hp及其脂多糖的刺激下表达量上调且被激活,诱使MKK1表达而促进炎症反应的发生。Basak等[16]的研究显示,胃上皮细胞凋亡可由Hp通过TLR信号通路诱导形成。以上研究均可表明,Hp及其菌体成分引起的炎症反应以及致病过程中,TLR的作用至关重要。
3 TLRs基因多态
基因多态性主要分为三种形式:分别是单核苷酸多态性(SNP)、DNA重复序列多态性、DNA片段长度多态性。其中目前研究最多的多态形式是SNP,它指染色体DNA序列中的某个位点由于单个核苷酸的变化而引起的多态性,在群体中的发生频率一般>1%。SNP在基因组中分布相当广泛,在人类基因组中总量大约在300万以上,SNP几乎出现在所有已知或未知的致病基因附近,人体的许多表型差异、对疾病的易感性等均可能与之有关,SNP目前已经被用于遗传病的单倍型诊断[17]。SNP在家系研究中常被用作为遗传标记,通过连锁分析来定位未知的致病基因。SNP目前的研究主要包括两个方面:一是对于未知SNP,即在基因组的范围内寻找新的SNP位点,Hapmap计划和千人基因组计划是全球范围内已经完成的;二是对于SNP与疾病的相关型研究,即研究某个SNP位点是否与特定疾病有相关关系。Arbour等[18]于2000年首次提出了TLR4基因多态性位点D299G和T399I能通过减低受体与脂多糖之间的相互作用,从而增加革兰阴性菌感染所致的败血症的风险。在随后十多年中,大量的研究表明几乎所有的TLRs都存在单核苷酸多态性位点[19]。
4 TLRs基因多态性与Hp感染及其所致相关疾病的关系
流行病学及病原学调查研究发现,全球大约有50%的人口感染Hp,尤其是在发展中国家,其感染率以及由其引起的发病率远高于发达国家[20]。我国自然人群Hp的感染率约为54.76%,平均为59%,其中最高地区是西藏,为84.62%,最低地区是广东省,为42%[21]。然而正常人群中Hp的感染率较高,仅有少部分感染者发展为胃十二指肠疾病,最终仅有1%~2%的Hp阳性患者发展成胃癌。这提示,除了生物因素和环境因素以外,宿主本身的遗传易感性可能起了重要的作用。目前,关于TLRs基因多态性与Hp感染及其所致相关疾病的关系,国内外许多学者做了大量研究,并且不同学者有不同的意见。研究最多的为TLR1、2、4、9、10的基因多态性与Hp感染以及慢性胃炎、消化性溃疡(包括胃溃疡和十二指肠溃疡)、萎缩性胃炎以及胃癌等的关系。
4.1 TLR1基因多态性与Hp感染及其所致相关疾病的关系 在基因多态性中,碱基的置换、缺失或者插入,会造成编码氨基酸的核苷酸序列发生改变,从而使得多肽或蛋白质合成时,遗传密码和阅读框架改变,最终导致基因转录水平和蛋白质肽链合成异常。TLR1的基因多态性与Hp相关胃黏膜病变的研究数量有限,而通过全基因组关联分析(genome-wide association study,GWAS)发现,TLR1的SNPs与Hp感染之前存在显著的相关关系。Tang等[22]研究发现,TLR1位点rs4833095携带等位基因C的个体比携带等位基因T的个体更易感Hp,且基因型为CC的个体相比基因型为TT的个体,发生胃黏膜病变和常上皮化生的危险也更大。
4.2 TLR2基因多态性与Hp感染及其所致相关疾病的关系 关于TLR2基因多态性与Hp感染及其所致相关疾病的关系,研究最多的是TLR2基因(-196)~(-174)ins/del突变。de Oliveira等[23]在巴西人群中的研究表明,胃癌组中携带基因型为-196~-174 ins/del或者(-196)~(-174)del/del患者比例明显高于健康对照 组 ,表 明 TLR2基 因 (-196)~(-174)ins/del或者-196~-174 del/del可能为胃癌的易感因素,并且类似的结论在中国人群中的研究中也得到了证实[24]。然而,Hishida等[25]在研究日本人群TLR2基因多态性与Hp感染及其相关疾病的关系中表明,TLR2基因(-196)~(-174)ins/del或者(-196)~(-174)del/del基因型分布频率在Hp感染阳性组和阴性对照组差异无统计学意义,并且TLR2(-196)~(-174)ins/del基因多态性与胃癌也没有易感相关性;此外,还有研究结果表明,TLR2 (-196)~(-174)ins/del基因多态性与Hp所致的慢性胃炎、胃溃疡以及十二指肠溃疡均没有易感相关性,但是与女性患者胃黏膜萎缩的程度和肠上皮化生化生的程度有关[26]。
4.3 TLR4基因多态性与Hp感染及其所致相关疾病的关系 目前,针对TLR4基因多态性性的研究主要集中在rs4986790和rs4986791这两个位点上,即甘氨酸取代了299位的天冬氨酸(Asp299Gly)和异亮氨酸取代了399位的苏氨酸(Thr399Ile)。因而TLR4的生物活性或功能发生改变,固有免疫应答中的信号转导也因此受到干扰。在研究TLR4基因rs4986790和rs4986791位点多态性与Hp感染及其所致的慢性胃炎以及胃癌遗传易感性的关系时,Bagheri等[27]在巴西人群中选取了174例胃癌患者、208例慢性胃炎患者和225例健康对照组做病例对照研究。结果表明,在胃癌组和慢性胃炎组中rs4986790位点携带等位基因G的个体明显多于健康对照组,而rs4986791位点携带等位基因T的个体在三组中差异无统计学意义,说明TLR4 rs4986790基因多态性与慢性胃炎以及胃癌的发生有显著的关联,而TLR4 rs4986791基因多态性并不增加慢性胃炎以及胃癌的患病风险。此外,Nader等[26]在伊朗人群中选取了195例Hp感染阳性患者和241例Hp阴性患者进行研究,发现TLR4基因rs4986790位点基因多态性与Hp感染并没有易感相关性;但是,Hp阳性组中TLR4基因rs4986790位点携带G等位基因型患者患慢性胃炎的风险明显要高于AA基因型患者。然而,目前在中国人群中有关上述两个位点多态性与Hp感染以及Hp感染相关疾病关系的研究尚未见报道。
4.4 TLR9基因多态性与Hp感染及其所致相关疾病的关系 TLR9主要识别DNA中CpG序列。TLR9基因rs5743836和rs187084基因多态性也是近年来研究较多的两个位点。Ng等[28]认为,TLR9 rs5743836基因多态性是胃癌癌前病变的一个重要风险因素,而Hold等[29]则认为TLR9 rs5743836基因多态性并没有增加患胃癌的风险。Wang等[30]认为TLR9 rs5743836和rs187084基因多态性不仅与胃癌的发病有相关性,还能影响胃癌的预后。
4.5 TLR10基因多态性与Hp感染及其所致相关疾病的关系 TLR10是抗炎模式识别受体,在中国人群胃癌的高危人群中,TLR10位点rs10004195的多态性与幽门螺旋杆菌感染及胃癌前病变相关,提示TLR10多态性可能与幽门螺旋杆菌的易感性和胃损伤的发病机制有关[31]。有研究发现,rs10004195 T等位基因在中国人群的幽门螺杆菌感染中的起保护作用。Tang等[22]的研究发现,在TLR10位点rs10004195携带A等位基因的个体比携带T等位基因的个体发生胃黏膜损伤的风险更大。各国学者在对不同地域的研究对象进行研究得出了不同的结论,表明人种及地区分布差异会影响TLRs的基因多态性,也就是不同人种或地区的同意突变位点的等位基因或基因型频率分布有显著差异,甚至特定的人种或地区有某些特定的突变位点。
综上所述,TLR作为一种重要的模式识别受体可以识别多种不同的PAMPs,进而触发刺激信号的级联反应,诱发多种炎症因子和细胞因子生成,对于Hp感染机体至关重要。但是,目前TLR基因多态性与HP感染所致相关疾病的关系仍很不一致,究其原因,除了与研究对象的遗传背景和实验室对基因多态性的检测方法有关外,最关键的问题是几乎所有研究的样本都不够大。因此,进一步的研究应该着眼于:①增大样本量及丰富样本种类,采集不同人种及地区的样本:②深入探索基因多态性与环境暴露因素之间的联合作用;③继续发展和探求更为简便、经济、稳定的检测方法,提高检测水平。
[1]Medzhitov R,Preston-Hurlburt P,Janeway CA Jr.A human homologue of the drosophila toll protein signals activation of adaptive immunity[J].Nature,1997,388(6640):394-397.
[2]Kang JY,Lee JO.Structural biology of the toll-like receptor family [J].Annual Review of Biochemistry,2011,7(80):917-941.
[3]Paracha RZ,Ahmad J,Ali A,et al.Formal aucasia of toll like receptor 4 and jak/stat aucasian pathways:Insight into the roles of socs-1, interferon-beta and proinflammatory cytokines in sepsis[J].PLoS One,2014,9(9):e108466.
[4]O'Neill LA,Golenbock D,Bowie AG.The history of toll-like receptors-redefining innate immunity[J].Nature Reviews Immunology, 2013,13(6):453-460.
[5]Zhang Y,Lin A,Sui Q,et al.Phosphorothioate modification of the tlr9 ligand cpg odn inhibits poly(i:C)-induced apoptosis of hepatocellular carcinoma by entry blockade[J].Cancer Letters,2014,355(1): 76-84.
[6]李肖然,鲁晓擘.TLR4在KSHV感染的卡波西肉瘤中表达的研究进展[J].海南医学,2014,25(12):1787-1789.
[7]杨海燕,李玉光.Toll样受体4与心血管疾病[J].医学综述,2012,18 (6):810-813.
[8]Chang ZL.Important aspects of toll-like receptors,ligands and their signaling pathways[J].Inflammation Research,2010,59(10):791-808. [9]Akira S,Takeda K.Toll-like receptor signaling[J].Nature Reviews Immunology,2004,4(7):499-511.
[10]Ferlay J,Autier P,Boniol M,et al.Estimates of the cancer incidence and mortality in aucas in 2006[J].Annals of Oncology,2007,18(3): 581-592.
[11]Ding SZ,Torok AM,Smith MF Jr,et al.Toll-like receptor 2-mediated gene expression in epithelial cells during Helicobacter pylori infection [J].Helicobacter,2005,10(3):193-204.
[12]Kabisch R,Mejias-Luque R,Gerhard M,et al.Involvement of toll-like receptors on Helicobacter pylori-induced immunity[J].PLoS One,2014,9(8):e104804.
[13]Lagunes-Servin H,Torres J,Maldonado-Bernal C,et al.Toll-like receptors and cytokines are upregulated during Helicobacter pylori infection in children[J].Helicobacter,2013,18(6):423-432.
[14]Kawahara T,Teshima S,Oka A,et al.Type I Helicobacter pylori lipopolysaccharide stimulates toll-like receptor 4 and activates mitogen oxidase 1 in gastric pit cells[J].Infection and Immunity,2001,69(7): 4382-4389.
[15]Takenaka R,Yokota K,Ayada K,et al.Helicobacter pylori heat-shock protein 60 induces inflammatory responses through the toll-like receptor-triggered pathway in cultured human gastric epithelial cells [J].Microbiology,2004,150(Pt 12):3913-3922.
[16]Basak C,Pathak SK,Bhattacharyya A,et al.The secreted peptidyl prolyl cis,trans-isomerase hp0175 of Helicobacter pylori induces apoptosis of gastric epithelial cells in a tlr4-and apoptosis signal-regulating kinase 1-dependent manner[J].Journal of Immunology, 2005,174(9):5672-5680.
[17]Hill AV.Aspects of genetic susceptibility to human infectious diseases[J].Annual Review of Genetics,2006,12(40):469-486.
[18]Arbour NC,Lorenz E,Schutte BC,et al.Tlr4 mutations are associated with endotoxin hyporesponsiveness in humans[J].Nature Genetics,2000,25(2):187-191.
[19]Netea MG,Wijmenga C,O'Neill LA.Genetic variation in toll-like receptors and disease susceptibility[J].Nature Immunology,2012,13 (6):535-542.
[20]Tamura T,Morita E,Kondo T,et al.Prevalence of helicobacter pylori infection measured with urinary antibody in an urban area of japan, 2008-2010[J].Nagoya Journal of Medical Science,2012,74(1-2): 63-70.
[21]张万岱,胡伏莲,萧树东,等.中国自然人群幽门螺杆菌感染的流行病学调查[J].现代消化及介入诊疗,2010,15(5):265-270.
[22]Tang FB,Li ZX,Wang YM,et al.Toll-like receptor 1 and 10 polymorphisms,Helicobacter pylori susceptibility and risk of gastric lesions in a high-risk Chinese population[J].2015,4(31):263-269.
[23]de Oliveira JG,Silva AE.Polymorphisms of the tlr2 and tlr4 genes are associated with risk of gastric cancer in a brazilian population[J]. World Journal of Gastroenterology,2012,18(11):1235-1242.
[24]曾红梅,潘凯枫,张阳,等.Toll样受体2及toll样受体9基因多态与胃癌易感性的关系[A].全国肿瘤流行病学和肿瘤病因学学术会议论文集[C],2011.
[25]Hishida A,Matsuo K,Goto Y,et al.No associations of toll-like receptor 2(tlr2)-196 to-174 del polymorphism with the risk of helicobacter pylori seropositivity,gastric atrophy,and gastric cancer in Japanese[J].Gastric Cancer,2010,13(4):251-257.
[26]Tahara T,Arisawa T,Wang F,et al.Toll-like receptor 2(tlr)-196 to 174del polymorphism in gastro-duodenal diseases in aucasia population[J].Digestive Diseases and Sciences,2008,53(4):919-924.
[27]Bagheri N,Azadegan-Dehkordi F,Sanei H,et al.Associations of a tlr4 single-nucleotide polymorphism with H.pylori associated gastric diseases in aucasi patients[J].Clinics and Research in Hepatology and Gastroenterology,2014,38(3):366-371.
[28]Ng MT,Van't Hof R,Crockett JC,et al.Increase in nf-kappab binding affinity of the variant c allele of the toll-like receptor 9-1237t/c polymorphism is associated with Helicobacter pylori-induced gastric disease[J].Infection and Immunity,2010,78(3):1345-1352.
[29]Hold GL,Rabkin CS,Gammon MD,et al.Cd14-159c/t and tlr9-1237t/c polymorphisms are not associated with gastric cancer risk in aucasian populations[J].European Journal of Cancer Prevention,2009,18 (2):117-119.
[30]Wang X,Xue L,Yang Y,et al.Tlr9 promoter polymorphism is associated with both an increased susceptibility to gastric carcinoma and poor prognosis[J].PLoS One,2013,8(6):e65731.
[31]Nagashima H,Iwatani S,Cruz M,et al.Toll-like Receptor 10 in Helicobacter pylori infection[J].J Infect Dis,2015,212(10):1666-1676.
Research progress about the relationship between the polymorphisms of TLRs and the infection and diseases ofHelicobacter pylori.
YANG Xiao-yan,ZHANG Ping-An.Department of Laboratory Science,Renmin Hospital of Wuhan University,Wuhan 430060,Hubei,CHINA
Toll-like receptors(TLRs),as important pattern recognition receptors(PRRs),are transmembrane signal transduction receptors discovered in recent years,which can induce the expression of cytokines and chemokines by the identification of pathogens relatively conservative pathogen-associated molecular patterns related to the inflammatory cascade activation.TLRs play an important role in Helicobacter pylori infection and its related diseases.The polymorphisms of TLRs can affect the body's genetic predisposition to diseases.Here we review the biological characteristics, the signal transduction pathway and the gene polymorphism of TLRs,as well as the relationship between TLRs and Helicobacter pylori infection and its related diseases.
Toll like receptors;Gene polymorphisms;Helicobacter pylori
R378.2
A
1003—6350(2016)17—2820—05
10.3969/j.issn.1003-6350.2016.17.023
2016-04-20)
张平安。E-mail:zhangpingan@aliyun.com
