Bacillus methylotrophicus γ-聚谷氨酸合成酶基因的克隆表达
2016-03-07彭英云沐万孟
彭英云, 张 涛, 江 波*, 沐万孟, 缪 铭
(1.盐城工学院 海洋与生物工程学院,江苏 盐城 224003;2.食品科学与技术国家重点实验室,江南大学,江苏无锡214122)
Bacillus methylotrophicus γ-聚谷氨酸合成酶基因的克隆表达
彭英云1,2, 张 涛2, 江 波*2, 沐万孟2, 缪 铭2
(1.盐城工学院 海洋与生物工程学院,江苏 盐城 224003;2.食品科学与技术国家重点实验室,江南大学,江苏无锡214122)
研究了一株非谷氨酸依赖型γ-聚谷氨酸(poly-γ-glutamic acid,γ-PGA)产生菌Bacillus methylotrophicus SK19.001合成酶基因在大肠杆菌中的克隆和表达。以pET-28a(+)载体构建含有pgsBCA合成酶基因的表达载体,转化至大肠杆菌Escherichia coli BL21构建重组菌。结果表明,在分别以葡萄糖和谷氨酸为底物的培养基中,重组工程菌都具有合成γ-PGA的能力,说明pgsBCA合成酶基因对于B.methylotrophicus SK19.001产γ-PGA是必需的。pgsBCA合成酶基因序列比对的结果的表明,pgsB和pgsC基因编码的氨基酸序列相对保守。
Bacillus methylotrophicus;非谷氨酸依赖型;γ-聚谷氨酸合成酶;克隆表达
γ-聚谷氨酸(Poly-γ-Glutamate,γ-PGA)是一种多功能生物可降解高分子材料,相对分子质量一般在10 000~1 000 000左右[1],通常由D-谷氨酸和L-谷氨酸通过酰胺键聚合而成。γ-PGA由于能被彻底生物降解,对环境无毒无害,又具有如良好的水溶性,超强的吸附性,可食用等独特性质,其在环保、农业、食品、医药、化工等领域具有广泛的应用前景,如作为土壤保水剂、食品增稠剂、污水絮凝剂、重金属吸附剂、药物或肥料缓释剂及药物载体等。γ-PGA目前多由微生物合成,根据培养基中是否需要谷氨酸,可以把γ-PGA产生菌分为谷氨酸依赖型菌株和非谷氨酸依赖型菌株,前者主要通过外源谷氨酸合成γ-PGA,后者则通过胞内合成途径将非谷氨酸底物如柠檬酸、葡萄糖等转化合成γ-PGA[2]。
目前,研究者已经从自然界筛选了许多株γ-PGA产生菌,其中大多为谷氨酸依赖型菌株如B.subtilis IFO3335[3],B.licheniformis ATCC9945[4],B.subtilis F-2-01[5]等。对这些菌株的研究包括发酵过程的优化设计和分子生物学的研究包括对产酶基因的克隆和表达、合成酶蛋白质的结构分析及蛋白质组学分析等,其中对pgsBCA合成酶基因的研究多为谷氨酸依赖型菌株的相关基因,而非谷氨酸依赖型的菌株的合成酶基因信息较为鲜见。
Bacillus methylotrophicus SK19.001是一株自然筛选得到的非谷氨酸依赖型γ-PGA产生菌,其特点是产量高,产物相对分子质量大,可通过多种非谷氨酸碳源如甘油、葡萄糖、可溶性淀粉等发酵得到 γ-PGA[6]。 作者主要对 B.methylotrophicus SK19.001产γ-PGA的合成酶基因进行研究。克隆SK19.001的产酶基因pgsBCA基因,对基因核苷酸序列和氨基酸进行比对和分析;以pET-28a(+)为载体构建含有pgsBCA合成酶基因的表达载体,转化至大肠杆菌E.coli构建重组菌,并测定工程菌合成γ-PGA的能力,这将为进一步研究微生物细胞合成生物大分子的机制提供基础信息。
1 材料与方法
1.1 菌株和质粒
菌株:B.methylotrophicus SK19.001,前期研究筛选得到[6];克隆宿主pET-28a(+)质粒:购自生工生物工程(上海)有限公司;表达载体E.coli BL21:购自Novagen公司。
1.2 工具酶和相对分子质量Marker
Pfu DNA聚合酶,NcoI、XhoI限制性内切酶,EZ-10离心柱式基因组DNA抽提试剂盒,SanPrep柱式PCR产物纯化试剂盒,SanPrep柱式DNA胶回收试剂盒,SanPrep柱式质粒DNA小量抽提试剂盒:购自生工生物工程(上海)有限公司。T4 DNA连接酶、DNA Maker:购自宝生物工程(大连)有限公司。
1.3 培养基
1.3.1 种子培养基(g/L) 葡萄糖20,酵母膏粉25,MgSO4·7H2O 0.5,K2HPO41;pH 7.0~7.2,37℃,200 r/min离心12 h。
1.3.2 LB培养基(g/L) 胰蛋白胨10,酵母提取物5,NaCl 10;pH 7.0~7.5,固体加琼脂粉20、0.1 MPa、121℃灭菌20 min。
1.3.3 E.coli BL21谷氨酸发酵培养基 (g/L) 添加L-谷氨酸20、MgCl2·6H2O 5(MnSO4·H2O 0.5)的LB培养基,pH 7.5、0.1 MPa、121℃灭菌20 min,使用前加入0.1%卡那霉素。
1.3.4 E.coli BL21葡萄糖发酵培养基 (g/L) 添加葡萄糖20、MgCl2·6H2O 5(MnSO4·H2O 0.5)的LB培养基,pH 7.5、0.1 MPa、115℃灭菌30 min,使用前加入0.1%卡那霉素。
1.4 仪器和设备
PCR仪:美国Thermo公司;核酸蛋白电泳电源系统、垂直板蛋白电泳系统、凝胶成像系统、核酸电泳槽:美国Bio-Rad公司;高速冷冻离心机:德国Eppendorf公司;Agilent 1100高效液相色谱仪:美国Agilent公司。
1.5 引物设计
参考B.amyloliquefaciens LL3 γ-PGA合成酶基 因 序 列 pgsBCA (GenBank accession No. HM034756.1,HM034757.1,HM034759.1)[7],设计B.methylotrophicus SK19.001合成酶基因pgsBCA PCR扩增引物。上游引物P1:ATGTGGTTACTCATTAT AGCCT,下游引物P2:TACACCAATGAGTAATATCG GA,将PCR扩增产物纯化并测序;根据测序结果设计 pET-28a-pgs载 体 构 建 上 游 引 物 P3:CATGCCATGGGAATGTGGTTA CTCATTATAG(含NcoI酶切位点),下游引物P4:CCGCTCGAGTCAC TCCGCT TTCTTT(含XhoI酶切位点),由上海生物工程公司合成。
1.6 B.methylotrophicus SK19.001 pgsBCA基因的克隆
1.6.1 基因组DNA的提取 按照 《分子克隆实验指南》进行 B.methylotrophicus SK19.001基因组DNA的提取[8],保存于-20℃。
1.6.2 pgsBCA 基 因 的 PCR 扩 增 以 B. methylotrophicus SK19.001基因组DNA为模板,用引物P1、P2扩增目的基因。PCR反应体系:DNA模板1 μL,引物P1和P2各4 μL,10×Buffer 10 μL,dNTP 8 μL,Pfu 2 μL,ddH2O 71 μL。反应条件:95℃预变性3 min,95℃变性30 s,55℃退火30 s,72℃延伸3.5 min,30个循环,72℃延伸2 min。扩增产物以1 g/dL琼脂糖凝胶电泳观察。
1.6.3 PCR产物纯化回收 PCR产物纯化回收按照SanPrep柱式PCR产物纯化试剂盒回收方法进行回收,并送至商业公司测序。
1.7 pET-28a-pgs重组质粒的构建
利用E.coli-BL21载体pET-28a(+)与γ-PGA合成酶基因pgsBCA双酶切后相连接,构建表达质粒pET-28a-pgs,采用引物为P3/P4,上下游引物的酶切位点为NcoI和XhoI。PCR回收产物双酶切体系:NcoI 1 μL,XhoI 1 μL,Buf Tango 5 μL,PCR产物 30 μL,ddH2O 13 μL;载体双酶切体系:NcoI 1 μL,XhoI 1 μL,Buf Tango 5 μL,pET-28a(+)37 μL,ddH2O 6 μL。将酶切回收后的目的基因片段与质粒连接,构建重组质粒pET-28a-pgs[9]。连接反应体系:T4连接酶1 μL,10×Buffer 2 μL,目的基因片段10 μL,pET-28a(+)1 μL,ddH2O 6 μL,连接反应于16℃反应12 h。
1.8 pET-28a-pgs重组质粒的转化和验证
采用CaCl2法转化至E.coli BL21感受态细胞中,采用菌落PCR和酶切进行阳性克隆的鉴定。将PCR验证和酶谱鉴定正确的工程菌株用DNA抽提试剂盒提取质粒后送上海生工生物工程有限公司测序。
1.9 工程菌株发酵和产物鉴定
1.9.1 重组质粒的诱导表达 从工程菌LB固体平板上挑取一单菌落,接种于含5 μL抗生素的5 mL LB液体培养基中,于37℃摇床培养12 h;取4 mL菌液接种到含100 μL抗生素的100 mL发酵培养基中,37℃、200 r/min振荡培养;当OD600nm达到
1.5 ~1.6时,加入IPTG至终浓度为1 mmol/L诱导pgsBCA基因表达,继续培养36 h。
1.9.2 γ-PGA产物的提纯和相对分子质量的测定
按照PENG Y等人的方法进行[6]。
1.9.3 γ-PGA产物中L-/D-谷氨酸比例测定 按照PENG Yingyun等人的方法进行测定[10]。
1.9.4 γ-PGA产物的鉴定 通过核磁共振H谱和C谱分析鉴定。
2 结果与讨论
2.1 B.methylotrophicus SK19.001 pgsBCA基因的克隆
以提取的B.methylotrophicus SK19.001基因组DNA为模板,采用引物 P1/P2,PCR扩增出的pgsBCA片段大小约为2.8 kb,见图1,与预期基本一致。纯化回收后的PCR产物,送至上海生工生物工程有限公司测序,pgsBCA基因片段大小共为2 812 bp,在GenBank上通过比对确定包含3个开放阅读框,分别为:pgsB(1 182 bp)、pgsC(450 bp)和pgsA(1 149 bp),分别编码393个、149个、382个氨基酸。在GenBank上提交获得序列号分别为:pgsB:KP698949;pgsC:KP698950;pgsA:KP698951。

图1 pgsBCA基因PCR扩增图谱Fig.1 PCR amplification of pgsBCA
2.2 pET-28a-pgs载体的构建与转化
采用pET-28a(+)为构建重组质粒的载体,pET-28a(+)的基因片段大小约为5 369 bp,将目的基因用带有酶切位点的引物P3、P4进行PCR扩增,扩增产物和质粒载体pET-28a(+)分别用NcoI和XhoI双酶切后,琼脂糖凝胶电泳切胶回收后连接,得到重组表达载体pET-28a-pgs,见图2。将构建的pET-28a-pgs质粒转化至E.coli BL21感受态细胞,提取转化工程菌质粒进行PCR验证和酶切验证并测序。图3(a)为采用引物P3和P4,PCR扩增出的pgsBCA片段大小约为2.8 kb,与预期基本一致。分别用NcoI、XhoI对从工程菌中提取的质粒进行单酶切,琼脂糖电泳只出现大约8.0 kb的一条带,见图3(b);用NcoI和XhoI对工程菌质粒进行双酶切,琼脂糖电泳出现约2.8 kb和5.2 kb两条带,见图3(c)。将工程菌提取质粒送至上海生工生物工程有限公司测序,测序结果与前面所测序列一致,说明pET-28a-pgs重组质粒构建成功。

图2 pET-28a-pgs载体的构建Fig.2 Construction of recombinant plasmid pET-28a-pgs
2.3 含pgsBCA基因的E.coli重组菌的发酵
在成功构建含γ-PGA合成酶基因的pET-28apgs重组质粒的基础上,对E.coli BL21基因工程菌进行了发酵研究,证明大肠杆菌工程菌确实具有γ-PGA的合成能力,并尝试分析不同培养基(分别含谷氨酸和葡萄糖)对谷氨酸非依赖型来源的pgsBCA基因的表达,即催化合成γ-PGA产量及相对分子质量大小等的影响。
2.3.1 含pgsBCA基因的工程菌发酵 分别采用添加L-谷氨酸或葡萄糖底物的LB培养基对E.coli工程菌进行发酵。诱导表达36 h后停止发酵,对发酵液进行处理,无水乙醇沉淀后透析脱盐,冷冻干燥获得γ-PGA。构建的E.coli基因工程菌在不同培养基中发酵合成γ-PGA的情况见表1。结果显示:葡萄糖和L-谷氨酸都能作为底物 (或碳源)合成γ-PGA,但产量远低于野生菌(33.84 g/L)[6],但与报道的E.coli基因工程菌合成γ-PGA的产量相近。曹名锋等[11]用B.amyloliquefaciens LL3中的pgsBCA酶基因构建的E.coli工程菌,以谷氨酸为碳源的γ-PGA的产量为0.558 g/L,以葡萄糖为碳源的γ-PGA的产量为0.376 g/L;江昊[12]以B.subtilis strain(chungkookjang)的pgsBCA酶基因构建的E.coli工程菌,以谷氨酸为碳源的摇瓶发酵产量为0.051 g/L。葡萄糖作为底物工程菌发酵γ-PGA的产量明显少于L-谷氨酸作为底物时γ-PGA的产量;发酵36 h后,两种培养基的发酵液pH有明显差异,这可能跟E.coli对碳源的利用有关。D-谷氨酸含量与野生菌(65%~70%)相比低了很多[10],可能因为E.coli工程菌中缺乏GLR消旋酶活性。本课题组前期的研究结果推测,pgsBCA合成酶基因可能对底物具有立体选择性[10],这可能也导致了E.coli工程菌中γ-PGA产量较低,在将来的研究中可考虑将谷氨酸消旋酶基因glr与pgsBCA合成酶基因一起导入工程菌,研究对γ-PGA产生的影响。相对分子质量测定结果表明,E.coli工程菌所产γ-PGA的相对分子质量大约在160 000~185 000,同样远低于野生菌所产γ-PGA相对分子质量(>107)[6],这可能是因为野生菌中PgsBCA复合酶系主要定位于细胞膜[1],而导入E.coli工程菌的酶组分可能位于膜内,对产物的跨膜运输效果可能不及野生菌。曹名锋等[11]研究的B.amyloliquefaciens LL3 pgsBCA基因在大肠杆菌中表达,合成的γ-PGA相对分子质量大约为40 000。

图3 PCR和酶切验证电泳图Fig.3 Electrophoresis analysis of PCR of recombinant plasmid pET-28a-pgs

表1 E.coli工程菌不同培养基中发酵生产γ-PGATable 1 γ-PGA product by E.coli BL21/pET-28a-pgs in different media
2.3.2 发酵产物的鉴定 对E.coli工程菌产物纯化后进行1H-NMR和13C-NMR检测。图4(a)为纯化产物的1H-NMR谱图,图4(b)为纯化产物的13CNMR谱图。出峰时间和数量可以表明纯化产物为γ-PGA,说明重组质粒pET-28a-pgs在E.coli中表达成功。
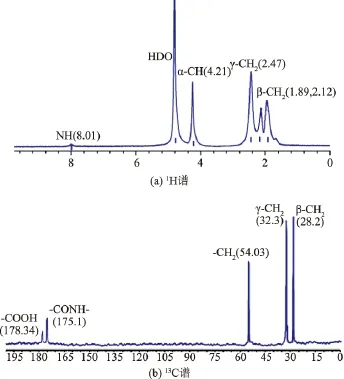
图4 E.coli工程菌发酵产物NMR图谱Fig.4 NMR spectra of the product by E.coli in D2O
2.4 B.methylotrophicus SK19.001 pgsBCA合成酶基因和编码蛋白质序列分析
将SK19.001 pgsBCA酶基因和编码蛋白质序列与 NCBI数据库已测定的 γ-PGA产生菌的pgsBCA合成酶基因进行比对,结果见表2。从表2可以看出,谷氨酸依赖型菌株和谷氨酸非依赖型菌株各自的pgsBCA合成酶基因序列一致性非常高,但依赖型和非依赖型菌株之间的pgsBCA合成酶基因序列一致性却较低,这说明产聚谷氨酸菌株的谷氨酸依赖性可能和pgsBCA合成酶基因有很大的关系。从表2还可以看出,pgsB和pgsC在不同菌株中具有更高的相似度,而pgsA相似度较低。
根据Ashiuchi等人[13-14]的分析,PgsB被认为是最主要的催化组分,是合成酶催化作用的能量ATP提供中心,它具有酰胺连接酶结构,负责酰胺键的链接;PgsC可能是酶的一个膜嵌入组分,也是最具疏水性的蛋白质,它含有跨膜螺旋结构,与N-乙酰谷氨酸合成酶中N-乙酰转移酶相似。PgsC与PgsB一起构成酶复合体的催化部位,通过两者的联合作用对底物谷氨酸进行聚合。PgsA具有膜锚定区并位于细胞表面。PgsA可能负责PGA的转运,从表2的数据分析,在依赖型和非依赖型菌株之间的pgsBCA合成酶基因和蛋白质序列有较大的差异,其中PgsB、C的酶蛋白序列差异达到6%~12%,这些氨基酸序列的差异可能存在于酶的结合和催化部位,从而造成酶对底物的结合和催化能力的差异;PgsA的差异更加显著,达到22%~35%,可能影响了γ-PGA的相对分子质量大小和产量。但详细的合成机制需要更多的研究来验证,如结合部位和催化部位如何起作用,关键的氨基酸有哪些,如何完成产物大分子的链接以及跨膜运输等。
微生物合成产生γ-PGA是一个复杂的过程,在整个合成过程中,需要各种酶的参与,PgsBCA合成酶是其中最重要的酶,但影响菌株是否具有谷氨酸依赖性的酶不仅仅取决于PgsBCA合成酶,而与TCA循环中的酶、谷氨酸合成途径相关的酶有关,要明确地了解菌株对谷氨酸底物的依赖性需要更多关于整个合成途径生物学信息的了解和分析,如对TCA循环α-KG支路相关的酶以及谷氨酸合酶、氨基转氨酶、谷氨酰胺酶等的研究,同时也需要更多的其它产γ-PGA菌株的基因信息进行比对研究,从而全面的了解γ-PGA在各菌株中的合成机制。

表2 产γ-PGA菌株的pgsBCA基因和相应的合成酶序列的比较Table 2 Comparison of the pgsBCA genes and PgsBCA synthetase complex of SK19.001 with those of other γ-PGA producing strains
3 结语
通过基因组DNA提取和PCR扩增得到非谷氨酸依赖型 γ-PGA产生菌株 B.methylotrophicus SK19.001 pgsBCA合成酶基因序列。利用该合成酶基因构建了表达载体pET-28a-pgs并成功导入宿主E.coli BL21,分别使用L-谷氨酸和葡萄糖作为碳源培养36 h,分别得到0.65 g/L和0.45 g/L的γ-PGA。说明pgsBCA合成酶基因对于B.methylotrophicus SK19.001产γ-PGA是必需的。
将pgsBCA合成酶基因和相应的编码蛋白质与GenBank中已获得的其它γ-PGA产生菌的酶基因序列进行比对,发现谷氨酸依赖型菌株之间pgsBCA合成酶基因相似性非常高,同样非谷氨酸依赖型菌株之间pgsBCA合成酶基因相似性也非常高,但依赖型和非依赖型菌株之间的pgsBCA合成酶基因相似性却较低,说明pgsBCA合成酶基因与菌株的谷氨酸依赖性有一定的关系;pgsB和pgsC在不同菌株中具有更高的一致性,而pgsA序列一致性较低,这可能导致了不同菌株相对分子质量和产量的不同。
[1]ASHIUCHI M.Occurrence and biosynthetic mechanism of poly-gamma-glutamic acid[M].Berlin Heidelberg:Springer,2010:77-93.
[2]SHIH I L,Van Y T.The production of poly-(γ-glutamic acid)from microorganisms and its various applications[J].Bioresource Technology,2001,79(3):207-225.
[3]KUNIOKA M.Biosynthesis of poly(gamma-glutamic acid)from L-glutamine,citric acid and ammonium sulfate in Bacillus subtilis IF03335[J].Applied Microbiology and Biotechnology,1995,44(3-4):501-506.
[4]TROY F A.Chemistry and biosynthesis of the poly (γ-d-glutamyl)capsule in Bacillus licheniformis properties of the membrane-mediated biosynthetic reaction[J].Journal of Biological Chemistry,1973,248(1):305-315.
[5]KUNIOKA M,GOTO A.Biosynthesis of poly(gamma-glutamic acid)from L-glutamic acid,citric-acid,and ammonium-sulfate in Bacillus-Subtilis IFO3335[J].Applied Microbiology and Biotechnology,1994,40(6):867-872.
[6]PENG Y,JIANG B,ZHANG T,et al.High-level production of poly(γ-glutamic acid)by a newly isolated glutamate-independent strain,Bacillus methylotrophicus[J].Process Biochemistry,2015(3):329-335.
[7]CAO M,GENG W,LIU L,et al.Glutamic acid independent production of poly-γ-glutamic acid by Bacillus amyloliquefaciens LL3 and cloning of pgsBCA genes[J].Bioresource Technology,2011,102(5):4251-4257.
[8]SAMBROOK J,RUSSEN D W.分子克隆实验指南(第三版)[M].黄培堂,等译.北京:科学出版社,2002(9):95-99.
[9]曹慧萍,郑璞,唐云平,等.谷氨酸棒杆菌中谷氨酰胺合成酶的克隆表达及固定化 [J].食品与生物技术学报,2016(8):883-889. CAO Huiping,ZHENG Pu,TANG Yunping,et al.Cloning,expression and immobilization of glutamine synthetase from Corynebacterium glutamicum[J].Journal of Food Science and Biotechnology,2016(8):883-889.(in Chinese)
[10]PENG Yingyun,ZHANG Tao,MU Wanmeng,et al.Intracellular synthesis of glutamic acid in Bacillus methylotrophicus SK19. 001,a glutamate-independent poly(γ-glutamic acid)-producing strain[J].Journal of the Science of Food and Agriculture,2016(1),66-72.
[11]曹名锋.微生物合成γ-聚谷氨酸及其分子生物学研究[D].天津:南开大学,2011.
[12]江昊.聚-γ-谷氨酸在枯草芽胞杆菌和大肠杆菌中的生物合成[D].武汉:华中农业大学,2007.
[13]ASHIUCHI M,NAWA C,KAMEI T,et al.Physiological and biochemical characteristics of poly gamma-glutamate synthetase complex of Bacillus subtilis[J].European Journal of Biochemistry,2001,268(20):5321-5328.
[14]ASHIUCHI M,NAKAMURA H,YAMAMOTO T,et al.Poly-γ-glutamate depolymerase of Bacillus subtilis:production,simple purification and substrate selectivity[J].Journal of Molecular Catalysis B:Enzymatic,2003,23(2):249-255.
Cloning and Expression of Poly-γ-Glutamic Acid Synthase Gene of Bacillus methylotrophicus
PENG Yingyun1,2, ZHANG Tao2, JIANG Bo*2, MU Wanmeng2, MIAO Ming2
(1.School of Marine and Biological Engineering,Yancheng Institute of Technology,Yancheng 224003,China;
2.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
The poly-γ-glutamic acid (γ-PGA) synthase gene pgsBCA ofa glutamic acid-independent γ-PGA producing strain Bacillus methylotrophicus SK19.001 was cloned and expressed in the Escherichia coli.The pET-28a-pgs vector harboring pgsBCA genes were constructed and transformed into E.coli BL21.E.coli BL21 could synthesize γ-PGA when cultivated in the flask culture of LB plus glucose and L-glutamate,respectively.The pgsBCA genes were proved be essential for the synthesis of γ-PGA in B.methylotrophicus SK19.001.The blast result of deduced amino acid sequence from the pgsBCA genes in SK19.001 comparing other reported strains showed that the pgsB and pgsC gene were relatively conservative gene for pgsBCA.
Bacillus methylotrophicus,glutamic acid-independent,poly-γ-glutamic acid synthase gene,cloning and expression
Q 812
A
1673—1689(2016)12—1253—07
2015-01-22
国家863计划项目(2013AA102102)。
彭英云(1976—),女,江苏无锡人,工学博士,讲师,主要从事食品生物技术方面的研究。E-mail:xying8@126.com
*通信作者:江 波(1962—),男,江苏无锡人,工学博士,教授,博士研究生导师,主要从事酶学方面的研究。E-mail:bjiang@jiangnan.edu.cn
