粘红酵母酪氨酸解氨酶在大肠杆菌中的异源表达
2016-03-07刘沛然堵国成周景文
刘沛然, 堵国成, 周景文, 陈 坚*
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122)
粘红酵母酪氨酸解氨酶在大肠杆菌中的异源表达
刘沛然1,2, 堵国成1,2, 周景文1,2, 陈 坚*1,2
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122)
酪氨酸解氨酶是苯丙氨酸代谢途径的关键酶之一。酪氨酸经其催化生成对香豆酸,可进一步生成白藜芦醇、柚皮素等具有抗氧化、抗衰老作用的苯丙素类天然产物。作者选取来源于粘红酵母(Rhodotorula glutinis)的酪氨酸解氨酶,对其基因进行大肠杆菌(Escherichia coli)密码子偏好性优化,合成基因后于E.coli BL21(DE3)中成功表达。经过硫酸铵分级沉淀、QFF阴离子交换层析、分子筛纯化后得到了纯化的酪氨酸解氨酶,比酶活达到1.78 U/mg。在相同的培养条件下,以不同的质粒作为表达载体,获得了不同的对香豆酸产量。其中以酪氨酸为底物发酵24 h,当以pET-32a(+)作为表达载体时,获得最高的对香豆酸产量196.3 mg/L。经密码子优化后的酪氨酸解氨酶基因可更好地应用于苯丙素类物质的合成途径构建,不同载体的应用也为生物法生产对香豆酸提供了更多的选择依据。
酪氨酸解氨酶;粘红酵母;大肠杆菌;异源表达
对香豆酸(p-Coumaric acid),又名对羟基肉桂酸,是一种天然酚类,在植物中广泛存在。对香豆酸具有抗菌[1]、抗癌[2]、抗氧化[3]、抗心血管疾病[3]及利胆利肝[4]等生理活性及药用功能。对香豆酸也是医药与香料工业中常用的中间体,是多种具有较高商业价值的苯丙素类药物、香精、化妆品、营养保健品的合成前体物质[5]。目前常见的对香豆酸生产方法为化学合成法,但其有反应温度高、能耗大、有毒物质参与等缺点[6]。因此,生物法生产对香豆酸因其环保、快捷、无季节限制等优点成为更好的选择。
在生物体内,对香豆酸的合成有两条途径。一是以苯丙氨酸为底物,经苯丙氨酸解氨酶(Phenylalanine ammonia-lyase,PAL)催化生成肉桂酸 (Cinnamic acid),再经细胞色素 P450酶系(CYP450)催化生成对香豆酸(p-Coumaric acid)[7]。而部分苯丙氨酸解氨酶被发现可以直接催化酪氨酸,生成对香豆酸,成为对香豆酸合成的另一途经,催化反应的酶也因此被命名为酪氨酸解氨酶(Tyrosine ammonia-lyase,TAL)[8]。在利用微生物生产对香豆酸时,以酪氨酸为底物,经TAL一步催化生产对香豆酸是较为快捷的途径。
除了在植物体内存在,微生物体内也陆续发现了 TAL的存在,如荚膜红细菌(Rhodobacter capsulatus)[9]、 球 形 红 细 菌 (Rhodobacters sphaeroides)[10]、丝孢酵母 (Trichosporon cutaneum)[11]、黄孢原毛平革菌(Phanerochaete chrysosporium)[12]等。其中,来源于粘红酵母(Rhodotorula glutinis)的TAL具有较高的胞内酶活力 (0.014 3 U/mg蛋白)和最低的PAL/TAL活性比系数(1.68)[13]。因此,作者以RgTAL为对象,进行密码子偏好性优化后在大肠杆菌(Escherichia coli)中表达,对RgTAL进行纯化及酶学性质的分析。此外,基于不同的表达载体,考察TAL催化酪氨酸产对香豆酸的情况。TAL的表达不仅实现了利用大肠杆菌生产对香豆酸,更为苯丙素类物质的合成途径构建提供了基础和依据。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒 菌株 E.coli JM109、E.coli BL21(DE3)及质粒pET-32a(+)(Ampr)、pETDuet-1(Ampr)、pET-28a(+)(Kanr)、pACYCDuet-1(Cmr)、pRSFDuet-1(Kanr)、pCDFDuet-1(Smr):均为作者所在实验室保藏。
1.1.2 主要试剂 KOD DNA聚合酶、DNA连接酶:TOYOBO东洋纺公司;氨苄青霉素、卡那霉素、氯霉素、链霉素、异丙基硫代半乳糖苷(IPTG)、M9CA培养基、质粒提取试剂盒、感受态细胞制备试剂盒:上海生工生物公司;蛋白胨、酵母提取物:Oxoid公司;标准相对分子质量蛋白质、蛋白质上样缓冲液、SDS-PAGE预制胶:Life Technologies公司;其它试剂均为国产或进口分装。
1.1.3 培养基
1)LB培养基:10 g/L蛋白胨、5 g/L酵母提取物、10 g/L NaCl,高压蒸汽灭菌。
2)TB培养基:12 g/L蛋白胨、24 g/L酵母提取物、10 g/L甘 油、17 mmol/L KH2PO4、72 mmol/L K2HPO4。
3)发酵培养基:13.3 g/L M9CA培养基、2 g/L葡萄糖、1 mmol/L硫酸镁、0.5 μg/mL盐酸硫胺素,过滤除菌。
1.2 实验方法
1.2.1 载体构建 根据已知的RgTAL核酸序列[14],利用http://www.jcat.de/进行密码子优化,使其具有大肠杆菌密码子偏好性。于基因两端添加NcoI、XhoI酶切位点,形成pUC57-TAL克隆载体(基因合成由南京金斯瑞公司完成)。载体构建采用分别双酶切基因与载体后连接的方法进行。基因的酶切、连接、转化,质粒的提取等操作步骤参照相应试剂盒说明书进行。取菌液提取质粒,对质粒进行双酶切,核酸电泳验证阳性克隆子。
1.2.2 诱导表达及胞内粗酶液的制备 将菌液在相应抗性的平板上划线纯化。挑取单菌落接种于LB培养基,37℃、220 r/min过夜培养(8~12 h)。以1%的接种体积分数转接于TB培养基,37℃、220 r/min培养至OD600为0.8,冷却至25℃后加入终浓度为0.4 mmol/L的IPTG进行诱导培养。取诱导培养一定时间的菌液,8 000 r/min离心收集菌体,以Tris-HCl缓冲液(50 mmol/L,pH 8.5)洗涤两次后重悬。利用超声破碎仪破碎菌体至澄清,10 000 r/min离心后收集上清液,即为胞内粗酶液。
1.2.3 纯化方法 采用硫酸铵沉淀、阴离子交换层析、分子筛对TAL进行纯化。收集200 mL诱导培养12 h的菌液,重悬于Tris-HCl缓冲液,超声破碎后离心取上清液,进行硫酸铵分级沉淀。取饱和度为40%~60%的沉淀部分,以Tris-HCl缓冲液溶解后进行透析。经过4次透析液的替换,透析约8~12 h后,使用微孔滤膜 (0.22 μm)处理酶液,进一步利用AKTA蛋白质纯化系统进行纯化。首先利用阴离子交换层析对酶液进行纯化(Hitrap QFF,1 mL)。上样缓冲液(A液)为50 mmol/L的Tris-HCl缓冲液,洗脱缓冲液(B液)为含1 mol/L NaCl的50 mmol/L的Tris-HCl缓冲液。以A液平衡柱子后上样,以15% B液洗去杂蛋白质,15%~40%线性洗脱10 CV,收集洗脱蛋白质。对收集的各段洗脱液进行酶活测定及SDS-PAGE分析,确定B液浓度为25%~33%时为目的蛋白质的洗脱峰。进一步利用分子筛(HiLoad 16/60 Superdex 200)进行纯化,对得到的洗脱峰进行酶活及SDS-PAGE分析,可得到纯度较高的酶液。
1.2.4 酶活测定、动力学及热稳定性分析 测定酶活的反应体系为1 mL,包含100 uL酶液、500 μL酪氨酸 (4 mmol/L),400 μL Tris-HCl缓冲液(50 mmol/L,pH 8.5),反应液置恒温40℃反应30 min,测其310 nm处吸光度[15]。1 min内生成1 μmol对香豆酸的酶量被定义为一个酶活单位。为测定动力学常数Km值的大小,在酶反应体系中添加不同浓度的酪氨酸,使其终浓度为0.2~3.8 mmol/L,在相同条件下进行反应,根据米氏方程,利用OriginPro 8.6软件拟合后得到Km值的大小。对于蛋白的热稳定性分析,利用差示扫描量热仪(MicroCal VP-Capillary DSC,GE)对TAL的变性温度(Tm值)进行测定,操作步骤按照仪器说明书进行,扫描范围为20~100℃,扫描速度为5 s/℃。
1.2.5 发酵生产对香豆酸 在相应抗性的平板上对菌体进行划线纯化。挑取单菌落接种于LB培养基,37℃、220 r/min过夜培养(8~12 h)。以4%的接种体积分数转接于发酵培养基,以500 mmol/L的酪氨酸为底物,添加0.4 mmol/L IPTG,28℃进行发酵培养。培养12 h后离心发酵液,取上清液,利用高效液 相 色 谱 法 (High-Performance Liquid Chromatography,HPLC)测定产物对香豆酸的含量。
2 结果与讨论
2.1 表达载体的构建
分别以限制性内切酶 NcoI、XhoI双酶切pUC57-TAL及大肠杆菌表达质粒pET-32a(+)、pETDuet-1、pET-28a(+)、pACYCDuet-1、pRSFDuet-1、pCDFDuet-1,两片段连接后得到重组质粒,分别命 名 为 pET32a-TAL、pET-TAL、pET28a-TAL、pACYC-TAL、pRSF-TAL及pCDF-TAL,转化至E.coli BL21(DE3)进行蛋白质表达,见图1。提取质粒双酶切验证,核酸电泳得到2 000 bp左右的条带,与Rgtal基因大小(2 082 bp)一致,见图2。前期构建载体过程中,为便于纯化,曾设计引物使TAL与质粒上的His-tag标签融合表达。但利用标签纯化后的目的蛋白质无法达到电泳纯级别,因此改变酶切位点及引物,使重组蛋白质两端不带有标签,并改变纯化方法,以获得电泳纯级别的蛋白质。
2.2 诱导表达及酶活检测
将含有表达载体的菌株在LB培养基中进行种子培养,转接TB培养基,待OD600达到0.8~1,以0.4 mmol/L的IPTG于25℃诱导培养。取培养12 h的菌体,以Tris-HCl缓冲液洗涤、重悬后超声破碎。破碎后离心取上清液即为胞内粗酶液,分别进行SDS-PAGE及酶活检测。TAL蛋白质的理论大小为75 000,pET32a载体启动子后第一个起始密码子距离NcoI酶切位点有约150 bp的距离,导致转录翻译后的TAL蛋白质变大,如图3中1号泳道所示。连接在其他载体上的蛋白质则维持原蛋白质大小,如图3中2~6号泳道所示。SDS-PAGE电泳得到的目的条带明显,说明蛋白质得到了较好的表达。由目的蛋白质电泳条带的差异也不难看出,含有载体pET32a-TAL(1号泳道)的重组菌目的蛋白质表达量最高,其次为pET-TAL及pCDF-TAL(2号、6号泳道),含有载体 pET28a-TAL、pACYC-TAL及pRSF-TAL(3-5号泳道)的表达量相对较低。检测重组菌胞内酶活,结果见表1,与胞内可溶性蛋白质表达量的大小差异基本一致。
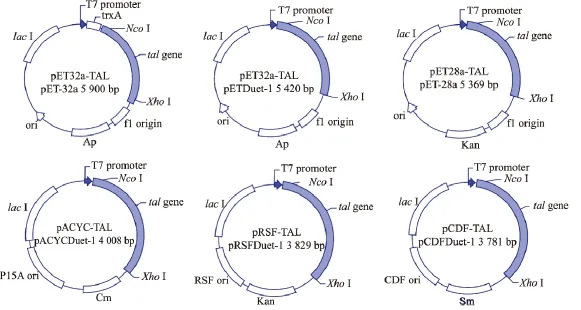
图1 表达载体构建示意Fig.1 Maps of different expression vectors

图2 表达载体酶切验证琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of expression vectors

图3 基于不同载体的TAL蛋白质表达SDS-PAGE分析Fig.3 SDS-PAGE analysisofTAL withdifferent expression vectors

表1 基于不同表达载体的重组菌胞内酶活Table 1 Enzyme activity ofstrains with differentexpression vectors
2.3 TAL的纯化及性质分析
TAL的纯化过程经由硫酸铵分级沉淀、阴离子柱纯化、分子筛纯化三个步骤。大肠杆菌胞内蛋白质种类多、含量高,因此采用硫酸铵分级沉淀法,达到去除部分杂蛋白质、浓缩目的蛋白质的效果。经酶活检测及SDS-PAGE验证,在硫酸铵浓度为40% ~60%时,目的蛋白质析出。利用阴离子柱Hitrap QFF对蛋白质进行纯化,线性洗脱得到目的蛋白质。进一步利用分子筛HiLoad 16/60 Superdex 200进行纯化,得到单一的目的蛋白质条带,见图4。对纯化后的蛋白质进行动力学分析,得到其Km值为382 μmol/L,Vmax值为0.91 μmol/(min·mg)。利用差示扫描量热法测得TAL的变性温度为 (73±2)℃,见图5。
2.4 基于不同表达载体的发酵产对香豆酸对比
将含有不同载体的重组质粒菌株在发酵培养基中分别培养,添加500 mmol/L的酪氨酸为底物,0.4 mmol/L IPTG、25℃诱导培养。含有pET32a-TAL、pET-TAL、pET28a-TAL、pACYC-TAL、pRSFTAL及pCDF-TAL的BL21菌株经24 h诱导培养后,对香豆酸产量分别为196.3、170.8、108.2、48.7、89.6、168.8 mg/L,见图6。由图6可知,对香豆酸产量由大到小对应的表达载体为pET32a-TAL>pETTAL>pCDF-TAL>pET28a-TAL>pRSF-TAL>pACYC-TAL,与胞内酶活的大小对比排序一致。在相同的诱导条件下,载体拷贝数、表达特定蛋白质能力的差异均可影响蛋白质表达,导致相同诱导条件下发酵所得对香豆酸产量的差异。在本研究涉及到的6种不同载体中,皆以T7启动子作为表达的起始,而由图1中pET32a-TAL的载体构建示意图可知,pET-32a(+)的T7启动子与目的蛋白TAL之间存在一段序列。这段可与TAL融合表达的蛋白质为硫氧还蛋白质(TrxA-Tag),起到了增加可溶性蛋白质比例的作用,因此含有载体pET32a-TAL的菌株得到了对香豆酸的最高产量196.3 mg/L。未经密码子优化的Rgtal基因在大肠杆菌中表达,发酵24 h获得了630 μmol/L(103 mg/L)的对香豆酸产量[13]。与之相比,含有pET32a-TAL表达载体的重组菌获得的对香豆酸产量提高了1.9倍。

图4 TAL纯化过程的SDS-PAGE分析Fig.4 SDS-PAGE analysis of the purification process of the TAL

图5 TAL酶的差示扫描量热曲线Fig.5 DSC curve of enzyme TAL

图6 基于不同载体重组菌的酶活及发酵产对香豆酸情况Fig.6 Enzyme activity and p-coumaric acid production from strains with different expression vectors
3 结语
植物次生代谢产物在医药、临床、化工、营养品等领域都有着重要的作用和广泛的应用。作为植物苯丙氨酸代谢途径的重要中间产物,对香豆酸自身具有抗癌、抗氧化等作用,也是多种苯丙素类化合物的合成前体。酪氨酸解氨酶(TAL)可经一步反应由酪氨酸催化生产对香豆酸。为了实现对香豆酸在微生物体内的高效积累,针对TAL的研究集中于发掘不同微生物来源的TAL,但其在宿主中的酶活较低。Vannelli等测定9种真菌的胞内TAL活性,其酶活处于0.01~0.7 U/mg之间[11],来源于R.glutinis的TAL酶活为 0.014 3 U/mg,然而其具有最低的PAL/TAL活性比系数(1.68)。因此,作者对来源于R.glutinis的TAL基因进行密码子优化并于大肠杆菌中实现了异源表达。对TAL进行纯化后,比酶活达到1.78 U/mg,高于原始菌的酶活0.014 3 U/mg[13]。同时,基于6种不同的原核表达体系,分别构建表达载体。将含有不同表达载体的重组菌发酵,发现对香豆酸的产量产生差异。这说明由于质粒拷贝数、载体元件、融合蛋白效应等原因,基因的表达及其导致的发酵产量会产生不同程度的变化,这也为基于不同表达载体进行表达调控提供了依据和基础。用于微生物转化的TAL还存在着催化效率不理想、酶活性较低的缺点。可通过结构性质分析、基因突变、固定化等方法,实现TAL酶活性的提高,更好地应用于天然产物的生产和转化。
[1]FERGUSON L R,ZHU S T,HARRISs P J.Antioxidant and antigenotoxic effects of plant cell wall hydroxycinnamic acids in cultured HT-29 cells[J].Molecular Nutrition&Food Research,2005,49(6):585-593.
[2]WALLERATH T,LI H G,GODTEL-AMBRUST U,et al.A blend of polyphenolic compounds explains the stimulatory effect of red wine on human endothelial NO synthase[J].Nitric Oxide-Biology and Chemistry,2005,12(2):97-104.
[3]ABDEL-WAHAB M H,EL-MAHDY M A,ABD-ELLAH M F,et al.Influence of p-coumaric acid on doxorubicin-induced oxidative stress in rat's heart[J].Pharmacological Research,2003,48(5):461-465.
[4]KIM S I,JEONG Y I,JUNG I D,et al.p-Coumaric acid inhibits indoleamine 2,3-dioxygenase expression in murine dendritic cells[J].International Immunopharmacology,2007,7(6):805-815.
[5]LIM C G,FOWLER Z L,HUELLER T,et al.High-yield resveratrol production in engineered Escherichia coli[J].Applied and Environmental Microbiology,2011,77(10):3451-3460.
[6]王磊,谢益民,刘洋.对羟基肉桂酸的合成及工艺条件优化[J].化学试剂,2009,31(2):131-134,154. WANG Lei,XIE Yiming,LIU Yang,et al.Synthesis of p-hydroxycinnamic acid and optimization of the technological conditions [J].Chemical Reagents,2009,31(2):131-134,154.(in Chinese)
[7]GABRIAC B,WERCKREICHHART D,TEUTSCH H,et al.Purification and immune characterization of a plant cytochrome p450:the cinnamic acid 4-hydroxylase[J].Archives of Biochemistry and Biophysics,1991,288(1):302-309.
[8]KINDL H.The regulation of the L-tyrosine ammonia-lyase activity by phenolic compounds[J].Hoppe-Seyler's Zeitschrift Fur Physiologische Chemie,1970,351(7):792-798.
[9]KYNDT J A,MEYER T E,CUSANOVICH M A,et al.Characterization of a bacterial tyrosine ammonia lyase,a biosynthetic enzyme for the photoactive yellow protein[J].FEBS Letters,2002,512(1-3):240-244.
[10]WATTS K T,MIJTS B N,LEE P C,et al.Discovery of a substrate selectivity switch in tyrosine ammonia-lyase,a member of the aromatic amino acid lyase family[J].Chemistry&Biology,2006,13(12):1317-1326.
[11]VANNELLI T,XUE Z,BREINIG S,et al.Functional expression in Escherichia coli of the tyrosine-inducible tyrosine ammonia-lyase enzyme from yeast Trichosporon cutaneum for production of p-hydroxycinnamic acid[J].Enzyme and Microbial Technology,2007,41(4):413-422.
[12]XUE Z,MCCLUSKEY M,CANTERA K,et al.Improved production of p-hydroxycinnamic acid from tyrosine using a novel thermostable phenylalanine/tyrosine ammonia lyase enzyme[J].Enzyme and Microbial Technology,2007,42(1):58-64.
[13]VANNELLI T,WEI Qi W,SWEIGARD J,et al.Production of p-hydroxycinnamic acid from glucose in Saccharomyces cerevisiae and Escherichia coli by expression of heterologous genes from plants and fungi[J].Metabolic Engineering,2007,9(2):142-151.
[14]SANTOS C N S,KOFFAS M,STEPHANOPOULOS G.Optimization of a heterologous pathway for the production of flavonoids from glucose[J].Metabolic Engineering,2011,13(4):392-400.
[15]ABELL C W,SHEN R S.Phenylalanine ammonia-lyase from the yeast Rhodotorula glutinis[J].Methods in Enzymology,1987,142:242-248.
Heterologous Expression of Tyrosine Ammonia Lyase from Rhodotorula glutinis in Escherichia coli
LIU Peiran1,2, DU Guocheng1,2, ZHOU Jingwen1,2, CHEN Jian*1,2
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
As one of the key enzyme in the phenylalanine metabolism pathway,tyrosine ammonia-lyase(TAL)catalyzes the formation of p-coumaric acid from L-tyrosine.p-Coumaric acid serves as a precursor of a wide array of anti-oxidative and anti-aging natural phenylpropanoid products,such as resveratrol and naringenin.In this study,the tal gene from Rhodotorula glutinis was selected,codon optimized and overexpressed in Escherichia coli BL21(DE3).After treatment with ammonium sulfate precipitation,therecombinantTAL was purified with anion exchange chromatography and gel filtration chromatography,resulting in specific activity of 1.78 U/mg enzyme.Under the same culture conditions,different expression vectors were constructed to get different productions of p-coumaric acid.Among them,the strain with pET-32a(+)as expression vector gained the highest yield of p-coumaric acid,up to 196.3 mg/L after 24 h fermentation fromL-tyrosine.The optimized tal gene can facilitate the construction of phenylalanine metabolism pathway.Different expression vectors used in this study also offered more options for biological production of p-coumaric acid.
tyrosine ammonia lyase,Rhodotorula glutinis,Escherichia coli,heterologous expression
Q 814
A
1673—1689(2016)12—1241—06
2015-01-23
国家自然科学基金项目(31370130);江南大学自主科研计划重点项目(JUSRP51307A)。
*通信作者:陈 坚(1965—),男,江苏扬州人,工学博士,教授,博士研究生导师,主要从食品生物技术及生化工程方面的研究。E-mail:jchen@jiangnan.edu.cn
