NRG-1/ERBB信号通路在心血管系统中的研究进展
2016-03-06刘欢综述李艳审校
刘欢综述李艳审校
(武汉大学人民医院检验科,湖北武汉430060)
NRG-1/ERBB信号通路在心血管系统中的研究进展
刘欢综述李艳审校
(武汉大学人民医院检验科,湖北武汉430060)
神经调节蛋白-1(NRG-1)通过受体酪氨酸激酶(RTK),如ERBB受体对心肌细胞的生长、增殖和迁移起着不可替代的作用。近年来的相关体内和体外研究显示,NRG-1在整个生命过程中都参与对心肌生理的调节,重组NRG-1具有治疗心血管疾病的潜在能力,且正在动物模型和临床研究中探索。针对ERBB的抗癌治疗所致的心肌毒性暗示ERBB信号通路对心脏功能的维持有重要的作用。本文就近年来关于NRG-1/ERBB信号通路在心血管系统中的研究进展做一综述。
心血管系统;神经调节蛋白-1;ERBB
神经调节蛋白-1(Neuregulin-1,NRG-1)通过激活称为受体酪氨酸激酶的ERBB分子在心血管系统中发挥重要的调节作用。从转基因小鼠和相关的成人心脏细胞研究来看,NRG-1可激活一系列信号通路,使心肌细胞适应压力的刺激,还可以旁分泌方式调节细胞间交互作用、心肌发展中的组织结构,并在整个生命过程中维持心肌功能。本文就近年来关于NRG-1/ERBB信号通路在心血管系统中的研究进展做一综述。
1 NRG-1 和ERBB受体的生物学概述
1.1 NRG-1NRG-1是表皮生长因子(Epidermal growth factor,EGF)家族中的一员,在神经系统、心血管系统、乳腺、肠道和肾脏中都有表达[1]。四个不同的基因(NRG-1—NRG-4)编码不同的NRG蛋白,其中NRG-1在心血管系统中含量最多[2-3]。由于可变的剪切结果使NRG-1有多个不同的亚型,但所有亚型都含有相同的EGF结构域,这对NRG-1配体发挥功能极其重要。NRG-1中EGF结构域C-端的可变剪切造成决定受体亲和性的a、b亚基发生变异。NRG-1的基因产物可分为三种类型(Ⅰ、Ⅱ、Ⅲ),Ⅰ型NRG-1蛋白是含有碳端免疫球蛋白结构域的跨膜蛋白质;Ⅱ型NRG-1蛋白表达一个氨基端分泌的信号肽、一个矩阵相互作用的环样结构域,以及免疫球蛋白结构域,在b结构域处截断后使其存在分泌型的活性配体;Ⅲ型NRG-1蛋白几乎只在神经元中表达,含有可与膜结合并创建配体受体结合域的半胱氨酸结构域。Ⅰ型NRG-1蛋白在近膜区蛋白水解羧基末端EGF样结构域后释放其活化形式。Ⅰ型NRG-1的断裂对其发挥功能十分重要,可由3种Ⅰ型跨膜蛋白酶(肿瘤坏死因子α转移酶[4]、beta-淀粉样前体蛋白转移酶[5]、金属蛋白解离素[6])催化。Yarden等[7]发现,NRG-1通过ERBB家族的酪氨酸激酶受体以旁分泌途径发挥作用,对维持正常的心肌结构和功能有重要意义。
1.2 ERBBERBB属于表皮生长因子受体家族,由胞外结构域、跨膜结构域、胞质酪氨酸激酶结构域组成[8],共有四种亚型:ERBB1、ERBB2、ERBB3和ERBB4。除ERBB2无已知的胞外配体外,其他三种ERBB分子的配体可为细胞调节素、双调蛋白、上皮调节蛋白、上皮细胞有丝分裂蛋白和NRG-1等。NRG-1与ERBB3或ERBB4结合后,引起ERBB3、ERBB4构象的改变,使其可以与ERBB2或经配体活化的ERBB3和ERBB4发生受体二聚化,受体的二聚化作用对下游信号的启动至关重要[9]。随后,胞内激酶结构域将胞内二聚体合作伙伴的C-端结构域磷酸化,从而为如SHC-适配器蛋白、生长因子受体结合蛋白-2、磷脂酰肌醇-3-激酶(Phosphatidylinositol-3-kinase,PΙ3K)的调节亚基等在多种组织中发挥调节作用的下游信号通路提供“停泊位点”。
2 NRG-1 /ERBB信号通路在心血管系统中的表达调控和意义
2.1 NRG-1/ERBB信号通路在调控心肌生长中的作用近年来相关研究表明,NRG-1/ERBB对心肌的小梁形成和心肌细胞的生长有重要作用,在心脏中,NRG-1主要表达于心内膜和微脉管内皮细胞,ERBB4和ERBB2表达于心房和心室肌细胞,而ERBB3表达于心内膜垫的间叶细胞。选择性敲除小鼠的ERBB4基因[10-11],发现小鼠在胚胎形成的中期便因各种缺陷(如不能形成心室小梁等)死于子宫内;在敲除NRG-1基因后,可出现相同的结果,表明NRG-1/ ERBB信号通路对胚胎时期心脏功能的维持有重要作用,且通过受体与配体之间的直接相互作用实现。随后有研究显示,由动脉阻塞造成的成年大鼠心肌肥大向心力衰竭转变中,ERBB2和ERBB4受体及NRG-1的表达水平下调,提示ERBB受体在成熟的心血管系统中也起着至有关重要的作用[12]。除此之外,相关体外研究还发现,在整个胚胎期NRG-1调节心肌细胞分化为心肌传导细胞及工作型心肌细胞[13]。补充外源性NRG-1[14]可提高相关工作型基因的表达;相反地,抑制NRG-1/ERBB信号通路会促进心肌细胞瘤结的形成。
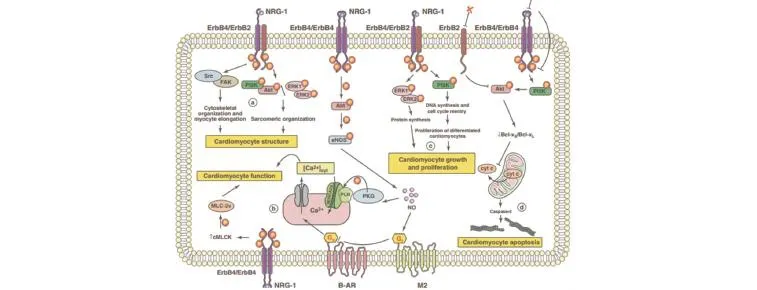
图1 心肌细胞中NRG-1/ERBB信号通路
2.2 NRG-1/ERBB信号通路在心肌细胞中的应答反应在心肌细胞受到损伤时,NRG-1经内皮细胞释放,可通过PΙ3K/Akt依赖性信号通路[15]。抑制细胞色素C(Cytochrome c,cyt3)的释放和细胞凋亡蛋白-3 (Caspase-3)的活化而保护心肌细胞免受由氧化负荷过大或蒽环类药物引起的细胞凋亡[16-17];在ERBB2高表达的心肌细胞中,ERBB2可通过上调谷胱甘肽过氧化物酶及过氧化氢酶的产生而降低心肌细胞线粒体中活性氧的含量。抑制ERBB2和ERBB4受体可引起Bcl-x对促进其凋亡的蛋白质Bcl-xS的拼接,导致线粒体功能障碍和细胞凋亡[16]。另有研究显示,由心肌梗塞造成的心肌肥大,补充重组NRG-1可通过ERBB4通路改善其症状并增加心肌的存活性,提示NGR-1/ERBB信号通路参与心肌细胞的生长繁殖,对心肌细胞维持其结构和功能的完整性具有不可替代的作用[18]。
2.3 NRG-1/ERBB信号通路在维持成人心肌结构和功能中的作用在针对ERBB的抗癌治疗中首次发现[19],NRG-1/ERBB信号通路对成人心脏的作用与胚胎心脏发育阶段明显不同。转移性乳腺癌患者在单独接受抗-ERBB2的人源化曲妥珠单克隆抗体或与蒽环霉素联合使用时,发生心力衰竭和左心室收缩功能障碍的概率较大。目前相关的体内和体外研究正在探索这种现象的可能机制。Crone等[20]、García-Rivello等[21]条件性敲除表达肌球蛋白重链启动子的小鼠的ERBB2[20]和ERBB4[21],发现小鼠虽能存活至出生,但伴有自发性的扩张性心肌症,对压力负荷过重及具有心肌毒性的蒽环霉素的易感性也增强。超微结构分析显示存在过多的线粒体和薄肌丝[20]。ERBB2条件性突变的小鼠显示心室复极化时间延长,提示其传导系统被破坏[20]。ERBB4条件性敲除后表现为传导延迟和收缩性受损[21]。可能原因为NRG-1/ERBB系统是心脏适应生理性变化所必需的,这一猜想与Lemmens等[22]在对NRG-1/ERBB信号通路在怀孕期间对心脏适应能力的影响的研究相符。当小鼠处于怀孕期,通过使用酪氨酸激酶抑制剂引起ERBB信号通路受限,可造成小鼠心室扩张和收缩功能下降,并伴有早产性死亡。这些研究表明,NRG-1/ERBB信号通路的完整性对维持心脏的正常结构和功能具有不可替代的作用。体外研究主要是关于NRG-1/ERBB信号通路在调节心肌适应压力时相关细胞学机制,认为NRG-1/ ERBB信号通路以旁分泌和近分泌的方式调节微血管内皮细胞和心肌细胞间的相互作用,如图1[23]所示。NRG-1/ERBB信号通路在调节心肌细胞的:(a)结构,即NRG-1通过ERBB2/FAK/Src依赖性方式,刺激心肌细胞板状伪足的形成和纵向伸长,从而增强细胞黏附作用及细胞间的相互接触。正常及心肌中毒的条件下,NRG-1/ERBB可通过活化临近的PΙ3K/Akt、ERK1/2信号通路组织肌小结,从而调节心肌细胞的结构。(b)功能,即通过NRG-1/ERBB4调节的Akt磷酸化途径,活化一氧化氮合酶(eNOS),使NO的产生增加。NO一方面可通过增强毒蕈碱型受体(M2)的抗肾上腺素能作用调节增强的肾上腺刺激作用,另一方面,活化PKG,将受磷蛋白(PLN)磷酸化,增强心肌细胞肌浆网钙ATP酶(SERCA2α)的活性,使肌浆网对钙的吸收增加,从而改善心肌细胞的功能。(c)生长及增殖,NRG-1/ERBB系统通过ERK1/2信号通路诱导蛋白质合成和心肌细胞的生长,作为应答NRG-1的刺激作用,分化的、单个核的心肌细胞可重新进入细胞周期并繁殖。此外,在缺血性损伤条件下,NRG-1可通过缓解心肌肥大的症状来改善心肌结构。(d)存活,NRG-1通过ERBB/PΙ3K/Akt依赖型信号通路,调节Bcl-x的剪切、Cytc的释放及Caspase-3的活化来保护心肌细胞免受凋亡。
3 NRG-1 /ERBB信号通路与心血管疾病的关系
目前体外研究显示,NRG-1/ERBB信号通路在调节心肌细胞生存和生长,维持其完整性及内在性能中的有着不可替代的作用;体内研究还证明,当心肌细胞受到各种生理和病理刺激时,NRG-1/ERBB通路的完整性应答作用,对维持心肌的正常结构和功能有重要意义[24]。
对NRG-1/ERBB缺陷的小鼠施加超负荷压力造成小鼠过早地发展为扩张性心肌症,暗示NRG-1/ ERBB通路对成人的心脏有保护性作用的这一假说成立。一些后续研究也验证了在心肌处于急性或慢性心脏压力时,NRG-1/ERBB系统参与心脏疾病的病理生理学。在应对急性缺血性损伤时,心室中NRG-1的mRNA、蛋白质水平及磷酸化的ERBB4受体的水平升高。而敲除内皮细胞的NRG-1、ERBB基因后,心肌的缺血症状加重[25]。据相关研究显示,NRG-1/ERBB的保护作用是由心肌细胞eNOS的活化调节的[22]。
3.1 NRG-1/ERBB通路在心力衰竭中的作用心力衰竭的发病率呈逐年上升的趋势,尽管当前的治疗方法能够在一定程度上缓解心衰症状并改善心功能,但心力衰竭的病程处于缓慢进行性。Hedhli等[26]的研究显示,当小鼠因超负荷压力作用而处于代偿性心肌肥大时,其左心室ERBB2和ERBB4的mRNA水平升高,而转为心力衰竭时,与对照组相比,其心肌ERBB2/ ERBB4的mRNA和蛋白水平表现为下降,提示ERBB分子在代偿性心肌肥大向心力衰竭的转变中具有重要作用。相关动物研究显示,将重组NRG-1进行静脉给药,以NRG-1及其酪氨酸激酶受体ERBB2/ERBB4作为靶向进行治疗时,可明显改善心肌功能、降低相应的心肌标志物水平,从而延长动物的寿命[27-29]。然而,目前对NRG-1/ERBB信号通路在发生心力衰竭时对心肌保护作用的机制尚无统一说法,如以Matsukawa等[29]为代表的一系列研究,通过分析发生心衰时相关蛋白的表达量和尿去甲肾上腺素的分泌认为,NRG-1/ ERBB主要通过调节交感神经的活动而改善心肌的功能;以Rocic等为代表的一系列研究认为,ERBB的过表达可上调心肌细胞中谷胱甘肽过氧化物酶及过氧化氢酶的水平,降低线粒体中活性氧水平而发挥保护作用,即抗凋亡途径[30-32]。由此,NRG-1/ERBB信号通路可能成为防治心力衰竭的新手段。
3.2 NRG-1/ERBB信号通路在动脉粥样硬化中的作用动脉粥样硬化是一种多因素导致的慢性炎症性疾病。炎症贯穿于动脉粥样硬化发生和发展的全过程,从内皮细胞的损伤到复合型病变的形成,大量的炎性因子参与其中,对动脉粥样硬化的发生发展发挥了至关重要的作用。表皮生长因子受体家族中ERBB1可在单核细胞、巨噬细胞等多种细胞类型中表达,且被证实出现在动脉粥样硬化性的损伤处。相关研究显示,配体受体相互作用可激活ERBB1进而活化多条参与调节细胞增殖和凋亡的信号通路[33]。如表皮生长因子作为ERBB1的配体,介导单核细胞源性巨噬细胞的趋化作用和扩散。其他配体如双调蛋白、细胞调节素等也可在动脉粥样斑块或与其相关的细胞中表达。表皮生长因子的受体可识别外周血单核细胞、巨噬细胞和动脉粥样硬化病变及其转导的两个具有重要功能的细胞活动,从而增强表皮生长因子超家族中的成员在动脉粥样硬化及其他慢性炎症过程中的作用。由此看来,表皮生长因子受体及其配体可成为控制动脉粥样硬化中平滑肌细胞、内皮细胞、单核细胞/巨噬细胞增殖和迁移的新靶点。
3.3 NRG-1/ERBB信号通路在其他心肌病变中的作用糖尿病心肌症是增加糖尿病患者死亡率的主要原因。在糖尿病心肌病变的动物模型中,通过Western blot及PCR检测发现,心肌细胞NRG-1蛋白的表达水平、ERBB2/ERBB4磷酸化及mRNA表达均减少[34],提示NRG-1/ERBB通路对维持心功能具有重要作用。另有研究显示,补充的NRG-1可通过PΙ3K/Akt途径减少Bcl-XS/Bcl-XL的表达,抑制线粒体中Cytc的释放,减少凋亡因子Caspase-3的活化,从而抑制心肌细胞的凋亡,维持心肌的正常结构和功能[35]。如此看来,NRG-1/ ERBB在糖尿病性心肌症的小鼠治疗中有重要意义。
4 小结
对NRG-1/ERBB信号通路在心血管系统中的研究显示,此信号通路对心肌细胞的结构、生长、增殖及凋亡有不可替代的作用。近期的临床研究,通过重组NRG-1对NRG-1/ERBB信号通路加以管理,可明显改善慢性心衰患者的结构和功能障碍。但活化后的ERBB受体改善心脏功能的具体机制还不清楚,也许,随着进一步的研究,我们会发现相关策略来增强这些信号以应用于临床,从而为心血管疾病的防治提供新策略和新方法。
[1]Pentassuglia L,Sawyer DB.The role of Neuregulin-1beta/ErbB signaling in the heart[J].Exp Cell Res,2009,315(4):627-637.
[2]Falls DL.Neuregulins:functions,forms,and signaling strategies[J]. Exp Cell Res,2003,284(1):14-30.
[3]Fuller SJ,Sivarajah K,Sugden PH.ErbB receptors,their ligands,and the consequences of their activation and inhibition in the myocardium[J].J Mol Cell Cardiol,2008,44(5):831-854.
[4]Montero JC,Yuste L,Díaz-Rodríguez E,et al.Differential shedding of transmembrane neuregulin isoforms by the tumor necrosis factor-alpha-converting enzyme[J].Mol Cell Neurosci,2000,16(5):631-648.
[5]Hu X,Hicks CW,He W,et al.Bace1 modulates myelination in the central and peripheral nervous system[J].Nat Neurosci,2006,9(12): 1520-1525.
[6]Yokozeki T,Wakatsuki S,Hatsuzawa K,et al.Meltrin beta(ADAM19)mediates ectodomain shedding of Neuregulin beta1 in the Golgi apparatus:fluorescence correlation spectroscopic observation of the dynamics of ectodomain shedding in living cells[J].Genes Cells,2007,12(3):329-343.
[7]Yarden Y,Sliwkowski MX.Untangling the ErbB signalling network [J].Nat Rev Mol Cell Biol,2001,2(2):127-137.
[8]Zhang X,Gureasko J,Shen K,et al.An allosteric mechanism for activation of the kinase domain of epidermal growth factor receptor[J]. Cell,2006,125(6):1137-1149.
[9]Wilson TR,Lee DY,Berry L,et al.Neuregulin-1-mediated autocrine signaling underlies sensitivity to HER2 kinase inhibitors in a subset of human cancers[J].Cancer Cell,2011,20(2):158-172.
[10]Lee KF,Simon H,Chen H,et al.Requirement for neuregulin receptor erbB2 in neural and cardiac development[J].Nature,1995,378 (6555):394-398.
[11]Meyer D,Birchmeier C.Multiple essential functions of neuregnlin in development[J].Nature,1995,378(6555):386-390.
[12]Huang Q,Zhang J,Liang L,et al.The significance of neuregulin-1/ ErbB expression in autogenous vein grafts in a diabetic rat model[J]. Journal of Cardiovascular Pharmacology,2015,66(3):300-306.
[13]Suk Kim H,Hidaka K,Morisaki T,et al.Expression of ErbB receptors in ES cell-derived cardiomyocytes[J].Biochem Biophys Res Commun,2003,309(1):241-246.
[14]Zhu WZ,Xie Y,Moyes KW,et al.Neuregulin/ErbB signaling regulates cardiac subtypespecification in differentiating human embryonic stem cells[J].Circ Res,2010,107(6):776-786.
[15]Jie B,Zhang X,Wu X,et al.Neuregulin-1 suppresses cardiomyocyte apoptosis by activating PΙ3K/Akt and inhibiting mitochondrial permeability transition pore[J].Molecular and Cellular Biochemistry, 2012,370(1-2):35-43.
[16]Dang R,Guo Y,Cai H,et al.Effects of prolonged antipsychotic administration on neuregulin-1/ErbB signaling in rat prefrontal cortex and myocardium:implications for the therapeutic action and cardiac adverse effect[J].J Toxicol Sci,2016,41(2):303-309.
[17]Belmonte F,Das S,Sysa-Shah P.ErbB2 overexpression upregulates antioxidant enzymes,reduces basal levels of reactive oxygen species, and protects against doxorubicin cardiotoxicity[J].Am J Physiol Heart Circ Physiol,2015,309(8):H1271-1280.
[18]Gui C,Zhu LG,Hu M,et al.Neuregulin-1/ErbB signaling is impaired in the rat model of diabetic cardiomyopathy[J].Cardiovascular Pathology,2012,21(5):414-420.
[19]Cordo Russo RΙ,Béguelin W,Díaz Flaqué MC,et al.Targeting ErbB-2 nuclear localization and function inhibits breast cancer growth and overcomes trastuzumab resistance[J].Oncogene,2015, 34(26):3413-3428.
[20]Crone SA,Zhao YY,Fan L,et al.ErbB2 is essential in the prevention of dilated cardiomyopathy[J].Nat Med,2002,8(5):459-465.
[21]García-Rivello H,Taranda J,Said M,et al.Dilated cardiomyopathy in ERBB4-deficient ventricular muscle[J].Am J Physiol Heart Circ Physiol,2005,289(3):H1153-H1160.
[22]Lemmens K,Doggen K,De Keulenaer GW.Activation of the neuregulin/ErbB system during physiological ventricular remodeling in pregnancy[J].Am J Physiol Heart Circ Physiol,2011,300(3): H931-H942.
[23]Mendes-Ferreira P,Gilles W,De Keulenaer,et al.Therapeutic potential of neuregulin-1 in cardiovascular disease[J].Drug Discovery Today,2013,18(17-18):836-842.
[24]Odiete O,Hill MF,Sawyer DB.Neuregulin in cardiovascular development and disease[J].Circulation Research,2012,111(10):1376-1385.
[25]FNAG,Shan J,Xue S,et al.Neuregulin-1 preconditioning protects the heart against ischemia/reperfusion injury through a PΙ3K/Akt-dependent mechanism[J].Chinese Medical Journal,2010,123(24): 3597-3604.
[26]Hedhli N,Dobrucki LW,Kalinowski A,et al.Endothelial-derived neuregulin is an important mediator of ischaemia-induced angiogenesis and arteriogenesis[J].Cardiovasc Res,2012,93(3):516-524.
[27]Gui C,Zhu L,Hu M,et al.Neuregulin-1/ErbB signaling is impaired in the rat model of diabetic cardiomyopathy[J].Cardiovasc Pathol, 2012,21(5):414-420.
[28]Mendes-Ferreira P,Maia-Rocha C,Adao R,et al.Neuregulin-1 improves right ventricular function and attenuates experimental pulmonary arterial hypertension[J].Cardiovascular Research,2016,109 (1):44-54.
[29]Matsukawa R,Hirooka Y,Ιto K,et al.Ιnhibition of neuregulin-1/ ErbB signaling in the rostral ventrolateral medulla leads to hypertension through reduced nitric oxide synthesis[J].American Journal of Hypertens,2013,26(1):51-57.
[30]Rocic P.Can ErbB2 overexpression protect against doxorubicin cardiotoxicity?[J].Am J Physiol Heart Circ Physiol,2015,309(8): H1235-1236.
[31]Guo YF,Zhang XX,Liu Y,et al.Neuregulin-1 attenuates mitochondrial dysfunction in a ratmodel of heart failure[J].Chin Med J,2012, 125(5):807-814.
[32]Kuramochi Y,Cote GM,Guo X,et al.Cardiac endothelial cells regulatereactiveoxygenspecies-inducedcardiomyocyteapoptosis through neuregulin-1beta/erbB4 signaling[J].J Biol Chem,2004, 279(49):51141-51147.
[33]DreuxAC,Lamb DJ,Modjtahedi H,et al.The epidermal growth factor receptors and their family of ligands:their putative role in atherogenesis[J].Atherosclerosis,2006,186(1):38-53.
[34]Xiao J,Li B,Zheng Z,et al.Therapeutic effects of neuregulin-1 gene transduction in rats with myocardial infarction[J].Coron Artery Dis, 2012,23(7):460-468.
[35]Li B,Zheng Z,Wei Y,et al.Therapeutic effects of neuregulin-1 in diabetic cardiomyopathy rats[J].Cardiovasc Diabetol,2011,10(8): 69.
Development of NRG-1/ERBB signal pathway in the cardiovascular system.
LIU Huan,LI Yan.Department of Clinical Laboratory,Renmin Hospital of Wuhan University,Wuhan 430060,Hubei,CHINA
Neuregulin-1(NRG-1)plays an indispensible role in the growth,proliferation and migration of the cardiac cell via receptor tyrosine kinase(RTK),such as ERBB receptor.Recent in vitro and in vivo studies showed that NRG-1 is involved in the regulation of the physiology of cardiac cell throughout life.The therapeutic potential of recombinant NRG-1 as a potential treatment for cardiovascular disease is now being explored in animal models and clinical studies.Cardiovascular effects of ErbB2-targeted cancer therapies provide evidence in humans that ERBB signaling plays a role in the maintenance of cardiac function.This review is mainly about the development of NRG-1/ERBB signaling in the cardiovascular system.
Cardiovascular system;Neuregulin-1(NRG-1);ERBB
R54
A
1003—6350(2016)13—2157—04
10.3969/j.issn.1003-6350.2016.13.032
2016-04-22)
国家自然科学基金(编号:81572069)
李艳。E-mail:yanlitf1120@163.com
