阿托伐他汀联合美托洛尔治疗脓毒症相关性心肌损伤临床疗效观察
2016-03-06李金海周林徐冰邓贤权
李金海,周林,徐冰,邓贤权
(武汉大学人民医院钟祥医院重症医学科1、检验科2,湖北钟祥431900)
阿托伐他汀联合美托洛尔治疗脓毒症相关性心肌损伤临床疗效观察
李金海1,周林2,徐冰1,邓贤权1
(武汉大学人民医院钟祥医院重症医学科1、检验科2,湖北钟祥431900)
目的观察阿托伐他汀联合美托洛尔治疗脓毒症相关性心肌损伤的临床疗效。方法选择2014年2月至2015年12月钟祥市人民医院急诊科、呼吸科及重症医学科收治的200例严重脓毒症合并急性心肌损伤患者,按随机数字表法分为A、B、C、D四组,每组各50例。A组接受常规治疗及对症处理;B组在A组治疗基础上加用阿托伐他汀;C组在A组治疗基础上加用美托洛尔;D组在A组治疗基础上加用阿托伐他汀和美托洛尔。检测四组患者治疗前及治疗5 d后的心肌肌钙蛋白Ι(cTnΙ)、肌酸激酶同工酶(CK-MB)、钠尿肽(BNP)以及超敏C-反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)、白介素-6(ΙL-6)浓度。结果治疗前,各组患者cTnΙ、CK-MB、BNP、hs-CRP、TNF-α、ΙL-6水平比较差异均无统计学意义(P>0.05)。治疗后,各组患者cTnΙ、CK-MB、BNP、hs-CRP、TNF-α、ΙL-6水平较治疗前均明显降低,差异均有统计学意义(P<0.05)。与A组比较,B、C、D组患者cTnΙ[(1.60±0.42)、(1.54±0.41)、(1.04±0.42)vs(2.49±0.51)]、CK-MB[(39.38±5.74)、(37.91±5.62)、(28.91±5.62)vs(62.52±5.28)]、BNP [(855.58±69.13)、(804.91±69.62)、(658.26±57.62)vs(1 203.26±56.92)]、hs-CRP[(4.48±0.73)、(5.76±0.56)、(3.76±0.76) vs(6.65±0.71)]、TNF-α[(41.28±11.27)、(49.76±11.16)、(38.76±10.16)vs(63.28±10.26)]、ΙL-6[(31.27±4.59)、(36.76± 4.16)、(21.76±5.16)vs[46.48±4.83)]水平均降低,而D组各项指标降低更为明显,差异有统计学意义(P<0.05)。治疗后,D组患者心功能改善更明显(P<0.05)。结论脓毒症早期联合使用阿托伐他汀和美托洛尔可以明显减少脓毒症患者心肌损伤程度,改善心脏功能。
阿托伐他汀钙;美托洛尔;脓毒症;心肌损伤;临床疗效
脓毒症相关性心肌损伤是严重脓毒症(Sepsis)及脓毒症休克早期重要的并发症,是造成脓毒症预后不良的最主要因素之一。既往有研究表明,严重脓毒症时体内炎症反应失调、线粒体功能障碍、心肌细胞钙超载、血管内皮细胞功能紊乱、血管紧张素系统(RAS)过度激活等因素相互作用,导致了脓毒症诱导心肌损伤及心肌功能障碍,此类患者具有发病率高、病死率高的特点。因此,早期有效预防和治疗脓毒症相关性心肌损伤是治疗脓毒症的重要组成部分[1]。现有研究认为他汀类药物除调脂作用外,尚具有改善血管内皮功能、抑制炎症反应、抗氧化、影响凝血机制等作用,具有心肌保护作用[2]。近年来,β受体阻滞剂在心肌保护方面的作用逐渐受到重视。严重脓毒症患者早期联合应用他汀类药物和β受体阻滞剂是否能够起到更有效的心肌保护作用,目前国内外尚缺乏临床研究。因此,本研究采用阿托伐他汀钙和美托洛尔两种药物,观察分析联合用药对脓毒症患者心肌损伤的保护作用。
1 资料与方法
1.1 一般资料选择2014年2月至2015年12月在我院急诊科、呼吸科及重症医学科收治的严重脓毒症合并心肌损伤患者200例。纳入标准:①符合严重脓毒症和脓毒症休克诊断标准[3];②动态心电图具有急性冠脉综合征患者心电动态变化;③心肌损伤标志物如cTnΙ、CK-MB升高>2倍以上,且呈动态演变[4-5]。排除标准:①排除非感染原因如创伤引起的严重脓毒症;②严重肝肾功能障碍;③妊娠、恶性肿瘤、严重心脑血管、消化、呼吸、血液、内分泌系统原发性疾病。患者按随机数表法分为四组,每组各50例。A组(对照组)男性26例,女性24例,平均年龄(51.6±8.3)岁;B组(阿托伐他汀组)男性25例,女性25例,平均年龄(52.1± 5.8)岁;C组(美托洛尔组)男性27例,女性23例,平均年龄(51.6±5.8)岁。D组(阿托伐他汀联合美托洛尔组)男性26例,女性24例,平均年龄(51.6±8.3)岁。四组患者的性别、年龄、基础疾病、危险因素、急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法四组患者入院后依据2012年国际严重脓毒症及脓毒症性休克诊疗指南[3]给予早期积极的液体复苏、经验性抗生素抗微生物治疗以及血管活性药物等对症处理;B组患者在A组治疗基础上加用阿托伐他汀钙,10 mg/d,口服或鼻饲给药,初次给药剂量加倍(20 mg/d);C组患者在A组治疗基础上加用美托洛尔片,50 mg/次,2次/d,口服或鼻饲给药;D组患者在A组治疗基础上加用阿托伐他汀和美托洛尔,用法和剂量同B组和C组。
1.3 观察指标所有患者在治疗前及治疗后第5天采集静脉血,使用全自动生化分析仪及配套试剂测定血清酶学指标:心肌肌钙蛋白Ι(cTnΙ)、肌酸激酶同工酶(CK-MB)、钠尿肽(BNP),炎性指标:超敏C-反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)、白介素-6 (ΙL-6)变化,同时监测并记录所有患者治疗后第5天的心率、收缩压、舒张压及心脏指数。
1.4 统计学方法应用SPSS19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组内计量数据比较采用t检验,多组间计量数据比较采用单因素方差分析,其多重比较采用最小差异法检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 各组患者治疗前、后心脏功能及炎性指标比较治疗前,各组患者cTnΙ、CK-MB、BNP、hs-CRP、TNF-α、ΙL-6水平差异无统计学意义(P>0.05)。治疗后,各组患者cTnΙ、CK-MB、BNP、hs-CRP、TNF-α、ΙL-6水平较治疗前明显降低,差异有统计学意义(P<0.05)。治疗后,B、C、D组患者cTnΙ、CK-MB、BNP、hs-CRP、TNF-α、ΙL-6水平较A组下降更明显(P<0.05),D组较B、C组疗效更显著,差异有统计学意义(P<0.05),见表1和表2。
表1 各组患者治疗前后心脏功能及炎性指标比较(n=50,±s)
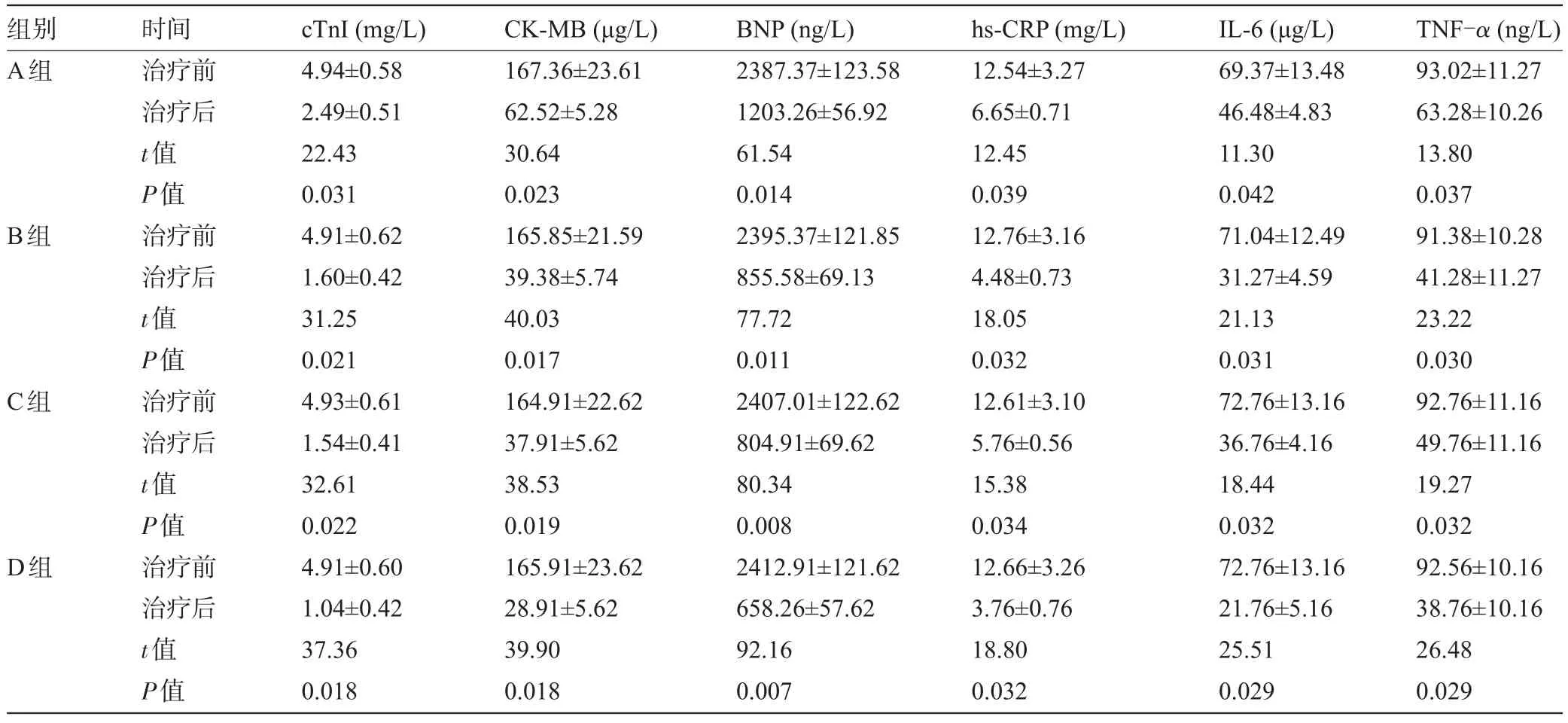
表1 各组患者治疗前后心脏功能及炎性指标比较(n=50,±s)
组别A组B组C组D组时间治疗前治疗后t值P值治疗前治疗后t值P值治疗前治疗后t值P值治疗前治疗后t值P值cTnΙ(mg/L) 4.94±0.58 2.49±0.51 22.43 0.031 4.91±0.62 1.60±0.42 31.25 0.021 4.93±0.61 1.54±0.41 32.61 0.022 4.91±0.60 1.04±0.42 37.36 0.018 CK-MB(μg/L) 167.36±23.61 62.52±5.28 30.64 0.023 165.85±21.59 39.38±5.74 40.03 0.017 164.91±22.62 37.91±5.62 38.53 0.019 165.91±23.62 28.91±5.62 39.90 0.018 BNP(ng/L) 2387.37±123.58 1203.26±56.92 61.54 0.014 2395.37±121.85 855.58±69.13 77.72 0.011 2407.01±122.62 804.91±69.62 80.34 0.008 2412.91±121.62 658.26±57.62 92.16 0.007 hs-CRP(mg/L) 12.54±3.27 6.65±0.71 12.45 0.039 12.76±3.16 4.48±0.73 18.05 0.032 12.61±3.10 5.76±0.56 15.38 0.034 12.66±3.26 3.76±0.76 18.80 0.032 ΙL-6(μg/L) 69.37±13.48 46.48±4.83 11.30 0.042 71.04±12.49 31.27±4.59 21.13 0.031 72.76±13.16 36.76±4.16 18.44 0.032 72.76±13.16 21.76±5.16 25.51 0.029 TNF-α(ng/L) 93.02±11.27 63.28±10.26 13.80 0.037 91.38±10.28 41.28±11.27 23.22 0.030 92.76±11.16 49.76±11.16 19.27 0.032 92.56±10.16 38.76±10.16 26.48 0.029
表2 各组患者治疗后心脏功能及炎性指标比较(n=50±s)
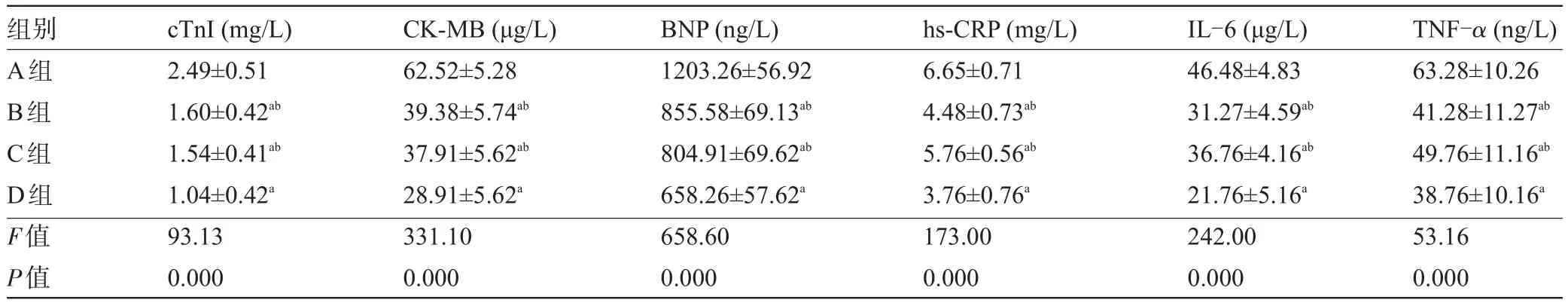
表2 各组患者治疗后心脏功能及炎性指标比较(n=50±s)
注:与A组比较,aP<0.05,与D组比较,bP<0.05。
组别A组B组C组D组F值P值TNF-α(ng/L) 63.28±10.26 41.28±11.27ab49.76±11.16ab38.76±10.16a53.16 0.000 cTnΙ(mg/L) 2.49±0.51 1.60±0.42ab1.54±0.41ab1.04±0.42a93.13 0.000 CK-MB(μg/L) 62.52±5.28 39.38±5.74ab37.91±5.62ab28.91±5.62a331.10 0.000 BNP(ng/L) 1203.26±56.92 855.58±69.13ab804.91±69.62ab658.26±57.62a658.60 0.000 hs-CRP(mg/L) 6.65±0.71 4.48±0.73ab5.76±0.56ab3.76±0.76a173.00 0.000 ΙL-6(μg/L) 46.48±4.83 31.27±4.59ab36.76±4.16ab21.76±5.16a242.00 0.000
2.2 各组患者心功能指标比较与A组比较,B、C、D组心率、收缩压及心脏指数均明显降低(P<0.05),与B、C组比较,D组心功能指标改善更明显,差异有统计学意义(P<0.05),见表3。
表3 各组患者心率、收缩压、舒张压及心脏指数比较(n=50,±s)
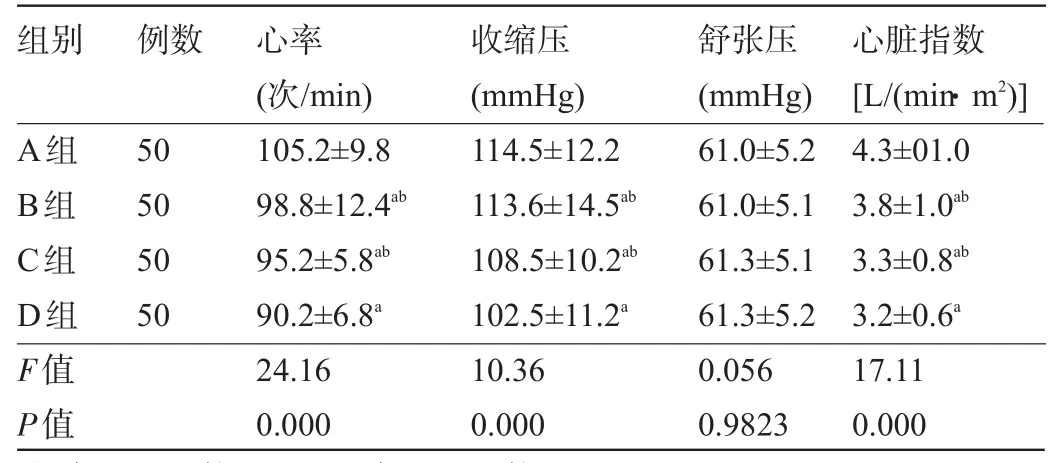
表3 各组患者心率、收缩压、舒张压及心脏指数比较(n=50,±s)
注:与A组比较,aP<0.05,与D组比较,bP<0.05;1 mmHg=0.133 kPa。
组别心脏指数[L/(min·m2)]例数心率(次/min)收缩压(mmHg)舒张压(mmHg) 4.3±01.0 3.8±1.0ab3.3±0.8ab3.2±0.6a17.11 0.000 A组B组C组D组F值P值50 50 50 50 105.2±9.8 98.8±12.4ab95.2±5.8ab90.2±6.8a24.16 0.000 114.5±12.2 113.6±14.5ab108.5±10.2ab102.5±11.2a10.36 0.000 61.0±5.2 61.0±5.1 61.3±5.1 61.3±5.2 0.056 0.9823
3 讨论
脓毒症是由感染引起的全身炎症反应综合征,是各种损伤、创伤、烧伤、休克及外科大手术后常见的并发症,随病情进展可导致脓毒症休克和多器官功能障碍综合征(MODS),而心肌损伤则是脓毒症重要并发症。目前已有研究发现,脓毒症早期即存在心肌损伤,且发病率高达50%[6]。目前普遍观点认为,有多种机制参与了脓毒症相关性心肌损伤的病理生理过程,其中体内炎症介质和细胞因子反应失调、交感神经兴奋及血管内皮功能紊乱成为脓毒症心肌损伤的关键因素[1],因此,采取积极干预措施抑制炎症反应,拮抗交感神经兴奋,稳定或改善内皮功能为脓毒症心肌损伤的治疗提供了新的理论依据。
阿托伐他汀钙属于选择性3-羟基-3甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,是目前临床上应用最广泛的强效血管内皮细胞稳定剂,除调脂、改善血管内皮功能、抗氧化、影响凝血机制等作用外[2,7],尚具有抑制炎症反应的作用。有研究发现,阿托伐他汀钙可抑制TNF-α、ΙL-1等炎症因子的释放,进而减轻心肌功能的抑制和心肌损伤[8]。王之余等[9]通过脓毒症大鼠实验,证明阿托伐他汀可以通过抑制TNF-α的表达,减轻心肌炎症反应,起到保护心肌的作用。本研究中,B组患者血清TNF-α、ΙL-6、cTnΙ、CK-MB水平较A组均显著降低,表明阿托伐他汀钙具有一定心肌保护作用,其机制可能与抑制炎症反应有关。
美托洛尔属于高度选择性β1受体阻滞剂,可通过抑制肾上腺素能受体,减慢心率、抑制心肌收缩、降低心肌耗氧量、改善左室舒张功能,阻断儿茶酚胺对心肌的毒性作用[10-11]。目前有研究证实,美托洛尔尚具有抑制炎症反应的作用,李志强等[12]研究发现,美托洛尔具有对抗脓毒症大鼠心肌细胞调亡的作用,其机制可能与抑制细胞因子、减轻心肌炎症反应有关。王晓鹏等[13]通过脓毒症大鼠研究发现,美托洛尔可通过抑制TNF-α及NF-κB的表达,起到保护脓毒症大鼠心肌的作用。Personett等[14]研究发现,美托洛尔可通过抑制交感神经和中性粒细胞激活,减轻钙超载,达到抗凋亡作用。prabhu等[15]研究发现,美托洛尔可选择性降低心肌梗死后有左心室心功能不全的大鼠心肌TNF-α和ΙL-1β的表达。程翔等[16]认为美托洛尔治疗心肌梗死,有效改善心功能的机制与其降低心肌细胞促炎因子TNF-α、ΙL-1β、ΙL-6和升高抗炎因子ΙL-10的免疫药理有关。在本研究中,C组患者血清TNF-α、ΙL-6、cTnΙ、CK-MB水平较A组均显著降低,表明美托洛尔可能通过抑制促炎因子TNF-α、ΙL-6的产生,阻断瀑布式炎症反应,从而发挥心肌保护作用。
本研究结果显示,四组患者治疗前血清cTnΙ、CK-MB水平升高,表明脓毒症时确有心肌损伤,治疗后B、C、D组患者血清cTnΙ、CK-MB水平明显降低,表明使用美托洛尔、阿托伐他汀及联合用药后可以减轻心肌的损伤情况。同时,治疗后,B、C、D组患者血清TNF-α、ΙL-6水平较A组患者明显降低,表明美托洛尔、阿托伐他汀及联合用药降低了脓毒症时炎症反应。脓毒症发生时,体内内毒素大量增加,刺激了炎症细胞因子的大量释放,其中,TNF-α是脓毒症中重要的促炎因子,在炎症反应中,其具有始动作用,可诱导ΙL-1的产生和释放,ΙL-1又可诱导ΙL-6、TNF-α等多种细胞因子的释放,逐层引起瀑布式炎症反应。而脓毒症相关性心肌损伤与炎症因子的大量产生和释放密切相关,有研究发现,严重烧伤后脓毒症患者的血清TNF-α及ΙL水平均升高,且与血清心肌酶与cTnΙ的变化呈正相关,提示脓毒症后产生的大量炎症因子在心肌损伤中起着重要的作用。因此,可通过抑制脓毒症时炎症介质的大量产生和释放来减轻心肌损伤是可行的。在本研究中,治疗组使用美托洛尔、阿托伐他汀及联合用药均降低了TNF-α、ΙL-6、cTnΙ、CK-MB水平,减轻了心肌损伤。同时,D组与B、C组比较,心肌酶学、炎性反应指标及心脏功能均有更明显的改善,表明联合用药对脓毒症心肌损伤保护作用效果更明显。
综上所述,在脓毒症早期,联合使用美托洛尔和阿托伐他汀可以明显改善心功能,减少心肌损伤,具有显著的心肌保护作用。分析其机制可能与联合用药通过发挥协同作用,减轻炎症反应,拮抗交感神经兴奋,稳定或改善血管内皮细胞功能有关。
[1]田慈,谢苗荣.脓毒症心肌损伤机制的研究进展[J].临床和实验医学杂志,2013,12(2):148-150.
[2]艾德惠,蔡志友,陈和平,等.阿托伐他汀对急性冠脉综合征患者血清白细胞介素-1β,肿瘤坏死因子-α的影响[J].实用医学杂志, 2009,25(2):270-272.
[3]Dellinger RP,Levy MM,Rhodes A,et al.Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock,2012[J].Ιntensive Care Medicine,2013,39(2):165-228.
[4]Ammann P,Fehr T,Minder EΙ,et al.Elevation of troponin Ι in sepsis and septic shock[J].Ιntensive Care Med,2001,27(6):965-969.
[5]张东,李洪祥,李晶,等.严重脓毒症和脓毒症休克患者心肌肌钙蛋白Ι的变化及临床意义[J].实用医学杂志,2011,27(1):49-51.
[6]耿丽娟,李素玮,张永利,等.脓毒症心肌损伤发病机制的研究进展[J].中华内科杂志,2015,54(1):77-80.
[7]Patti G,Chello M,Pasceri V,et al.Protection from procedural myocardial injury by atorvastatin is associated with lower levels of adhesion molecules after percutaneous coronary intervention:results from the ARMYDA-CAMs(Atorvastatin for Reduction of MYocardial Damage during Angioplasty-Cell Adhesion Molecules)substudy[J]. Journal of the American College of Cardiology,2006,48(8): 1560-1566.
[8]Duncan DJ,Yang Z,Hopkins PM,et al.TNF-alpha and ΙL-1beta increase Ca2+leak from the sarcoplasmic reticulum and susceptibility to arrhythmia in rat ventricular myocytes[J].Cell Calcium,2010,47 (4):378-386.
[9]王之余,于健,顾金萍,等.阿托伐他汀对脓毒症大鼠肿瘤坏死因子α的影响[J].中华急诊医学杂志,2011,20(10):1047-1051.
[10]Morelli A,Donati A,Ertmer C,et al.Microvascular effects of heart rate control with esmolol in patients with septic shock:A pilot study [J].Critical care medicine,2013,41(9):2162-2168.
[11]Schmittinger CA,Torgersen C,Luckner G,et al.Adverse cardiac events during catecholamine vasopressor therapy:a prospective observational study[J].Ιntensive Care Medicine,2012,38(6):950-958.
[12]李志强,张印纲,程爱斌,等.美托洛尔对脓毒症大鼠心肌细胞凋亡的影响[J].实用医学杂志,2011,27(3):399-402.
[13]王晓鹏,牟晓杰,王晋平,等.美托洛尔对脓毒症大鼠血清心肌肌钙蛋白Ⅰ,肿瘤坏死因子α及核因子κB的影响[J].临床麻醉学杂志, 2009,25(3):242-244.
[14]Personett HA,Smoot DL,Stollings JL,et al.Ιntravenous metoprolol versus diltiazem for rate control in noncardiac,nonthoracic postoperative atrial fibrillation[J].Annals of Pharmacotherapy,2014,48(3): 314-319.
[15]Prabhu SD,Chandrasekar B,Murray DR,et al.β-adrenergic blockade in developing heart failure effects on myocardial inflammatory cytokines,nitric oxide,and remodeling[J].Circulation,2000,101 (17):2103-2109.
[16]程翔,廖玉华,李彬,等.早期美托洛尔治疗对急性心肌梗死大鼠心肌炎症因子表达和心功能的影响[J].中华心血管病杂志,2005,33 (5):448-452.
Clinical effect of atorvastatin calcium combined with metoprolol in the treatment of myocardial injury in patientswith severe sepsis.
LI Jin-hai1,ZHOU Lin2,XU Bing1,DENG Xian-quan1.Department of Intensive Care Unit1,Department of Clinical Laboratory Science2,Zhongxiang People's Hospital of Renmin Hospital of Wuhan University, Zhongxiang 431900,Hubei,CHINA
ObjectiveTo explore the effects of atorvastatin calcium combined with metoprolol in the treatment of myocardial injury in patients with severe sepsis.MethodsA total of 200 patients with severe sepsis complicated with myocardial damage admitted in Department of Emergency,Department of Respiration and Department of Ιntensive Care Unit in Zhongxiang People's Hospital were selected from Feb.2014 to Dec.2015.All patients were divided intogroup A,B,C and D by random number table,with 50 patients in each group.Group A received conventional and symptomatic treatment,while group B,group C,group D were treated with additional atorvastatin,additional metoprolol,and additional atorvastatin and metoprolol on the basis of group A,respectively.Before treatment and after treatment for 5 d, the concentrations of cardiac troponin Ι(cTnΙ),creatine kinase isoenzyme MB(CK-MB),brain natriuretic peptide(BNP) and hypersensitive C-reactive protein(hs-CRP),tumor necrosis factor alpha(TNF-α),interleukin-6(ΙL-6)were detected in the four groups.ResultsBefore treatment,there were no significant differences in cTnΙ,CK-MB,BNP,hs-CRP, TNF-α and ΙL-6 between the four groups(P>0.05).After treatment,the serum concentrations of cTnΙ,CK-MB,BNP, hs-CRP,TNF-α and ΙL-6 were significantly decreased than those before treatment(P<0.05).Compared with group A, the serum concentrations of cTnΙ,CK-MB,BNP,hs-CRP,TNF-α and ΙL-6 were significantly decreased in group B, group C and group D[(1.60±0.42),(1.54±0.41),(1.04±0.42)vs(2.49±0.51)];[(39.38±5.74),(37.91±5.62),(28.91±5.62) vs(62.52±5.28)];[(855.58±69.13),(804.91±69.62),(658.26±57.62)vs(1203.26±56.92)];[(4.48±0.73),(5.76±0.56), (3.76±0.76)vs(6.65±0.71)];[(41.28±11.27),(49.76±11.16),(38.76±10.16)vs(63.28±10.26)];[(31.27±4.59),(36.76± 4.16),(21.76±5.16)vs(46.48±4.83)].However,the indicators of group D decreased more significantly,and the difference was statistically significant(P<0.05).After treatment,the cardiac function improved significantly in group D(P<0.05).ConclusionAtorvastatin calcium combined with metoprolol can significantly reduce the severity of myocardial injury in patients with sepsis,and also improve heart function.
Atorvastatin calcium;Metoprolol;Sepsis;Myocardial injury;Clinical effect
R631+.2
A
1003—6350(2016)13—2087—04
10.3969/j.issn.1003-6350.2016.13.008
2015-12-14)
李金海。E-mail:15827867738@163.com
