HBV相关慢加亚急性肝衰竭患者中Th17细胞、Treg细胞的变化及其与肝功能和HBV-DNA载量间的研究
2016-03-06沈敏林明强冯奇桃吕友凯李永武
沈敏,林明强,冯奇桃,吕友凯,李永武
(海南省农垦总医院感染性疾病科1、分子生物学实验室2,海南 海口 570311)
HBV相关慢加亚急性肝衰竭患者中Th17细胞、Treg细胞的变化及其与肝功能和HBV-DNA载量间的研究
沈敏1,林明强1,冯奇桃1,吕友凯1,李永武2
(海南省农垦总医院感染性疾病科1、分子生物学实验室2,海南 海口 570311)
目的 通过检测乙型肝炎病毒(HBV)相关慢加亚急性肝衰竭(HBV-ACLF)患者外周血中的Th17细胞、Treg细胞的水平,探讨Th17、Treg细胞在HBV-ACLF发病机制中的作用。方法流式细胞术检测22例HBV-ACLF患者、24例慢性乙型肝炎患者(CHB)以及20例健康对照者(HC)外周血Th17、Treg细胞的频率,荧光定量PCR法检测患者外周血HBV-DNA水平,同时分析Th17细胞、Treg细胞、Th17/Treg与谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TB)及HBV-DNA载量间的相关性。结果HBV-ACLF组患者的Thl7细胞、Treg细胞、Th17/ Treg较CHB组和HC组明显增高,CHB组又较HC组Th17细胞、Treg细胞、Th17/Treg升高,差异均有统计学意义(P<0.05);HBV-ACLF组外周血中Th17细胞与Treg细胞间存在正相关(r=0.873,P<0.05),CHB组外周血中Th17细胞与Treg细胞间存在正相关(r=0.638,P<0.05),HC组外周血中Th17细胞与Treg细胞间存在正相关(r=0.617,P<0.05)。HBV-ACLF组Thl7细胞与ALT呈正相关(r=0.612,P<0.05),Th17/Treg与ALT呈正相关(r=0.592,P<0.05);CHB组Thl7细胞与ALT呈正相关(r=0.636,P<0.05),Th17/Treg与ALT呈正相关(r=0.712,P<0.05)。HBV-ACLF组、CHB组和HC组Th17、Treg、Th17/Treg与AST和TB间无相关性。HBV-ACLF组和CHB组Th17细胞、Treg细胞、Th17/Treg与HBV-DNA载量间无相关性。结论Thl7细胞和Treg细胞在机体内可能处于一种平衡状态,在CHB和HBV-ACLF体内这种平衡可能已经打破。Thl7细胞、Treg细胞可能参与了慢性乙型肝炎和HBV相关慢加亚急性肝衰竭的发生发展,同时,Th17细胞有望成为评估HBV-ACLF患者肝脏损伤程度的一个免疫学指标。Th17细胞、Treg细胞与HBV-DNA载量无相关性。
Th17;Treg;HBV;慢加亚急性肝衰竭;谷丙转氨酶;谷草转氨酶
目前全球约有4亿人感染乙型肝炎病毒(Hepatitis B virus,HBV),而这4亿慢性HBV感染者中有约 1/3在中国[1-2],HBV相关慢加亚急性肝衰竭(Acute-on-chronic liver failure,HBV-ACLF)是在HBV感染的基础上引起的肝脏急性炎症坏死反应,临床上可以出现消化道出血、自发性细菌性腹膜炎、肝肾综合征、肝性脑病等并发症。目前,HBV-ACLF缺乏特异的治疗手段,临床上仍以内科综合治疗为主,预后差,死亡率高。关于HBV-ACLF的具体发病机制目前仍未完全清楚,很多研究表明机体免疫调节紊乱在HBV-ACLF的发生发展中发挥重要作用。Th17细胞和Treg细胞是近年来发现的CD4+T细胞新亚群[3-4],Th17细胞主要介导免疫炎症[5],Treg细胞主要介导免疫耐受,研究表明,它们在介导炎症反应、自身免疫性疾病、肿瘤和移植排斥等的发生和发展中发挥重要的作用[5-6]。本研究拟就HBV-ACLF患者外周血中Th17、Treg细胞频率的变化及其与肝功能和HBV复制水平的关系进行探讨,进一步了解HBV-ACLF的免疫学发病机制。
1 资料与方法
1.1 一般资料 选取海南省农垦总医院2013年4月至2014年12月的门诊、住院患者及健康体检者共66例,其中,HBV-ACLF组患者22例;慢性乙型肝炎组(CHB组)患者24例;健康对照组(HC组)20例。诊断参照2010年中华医学会肝脏病学分会制定的《慢性乙型肝炎防治指南》[7]和2006年中华医学会感染病学分会制定的《肝衰竭诊疗指南》[8],同时排除合并其他类型病毒性肝炎、HIV感染、酒精性肝病、自身免疫性疾病、甲亢等,发病前均未行系统的抗病毒治疗、免疫调节治疗和人工肝治疗。
1.2 主要试剂与仪器 改良型RPMI1640培养液(北京赛默飞世尔生物化学制品有限公司),人淋巴细胞分离液和胎牛血清(北京索莱宝科技有限公司),佛波酯(PMA)、离子霉素(Ion)、莫能霉素和Human Th17/ Treg Phenotyping Kit(BD Bioscience),PBS缓冲液(Hyclone)。美国BD公司CANTO-Ⅱ流式细胞仪,美国ABIABI 5700实时定量PCR扩增仪。
1.3 检测方法
1.3.1 血清HBV-DNA、ALT、AST、TB的检测 采用荧光定量PCR法检测患者外周血HBV-DNA水平,采用速率法检测血清ALT、AST(我院日立7600型全自动生化分析仪)。
1.3.2 外周血Th17、Treg细胞的培养与检测 取外周抗凝血300µl,加入含10%胎牛血清的RPMI 1640培养液900µl,加入佛波酯(PMA)及离子霉素1.2µl,莫能霉素0.8µl,充分混匀,置于温度为37℃、浓度为5%的CO2培养箱中培养10 h后离心。依次加入固定破膜液BufferA(1 500µl)、Buffer C(500µl),充分混匀后常温避光保存时间分别为20 min和30 min,最后加入染色剂Phenotyping Cocktail(4µl),用磷酸盐缓冲液(PBS)反复冲洗后上机检测Th17、Treg细胞占CD4+T的频率,具体操作按试剂盒说明书进行。
1.4 统计学方法 统计软件采用SPSS17.0进行统计分析。符合正态分布的计量数据以均数±标准差(±s)表示,非正态分布的数据采用中位数和百分位数(M±Q)表示,多个组之间的比较采用方差分析,两两比较采用t检验和秩和检验,相关分析采用Pearson相关检验分析。以α=0.05作为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 三组受检者的年龄、肝功能、HBV-DNA水平比较 三组受检者在性别构成方面差异无统计学意义(P>0.05),具有可比性。平均年龄HBV-ACLF组高于CHB组,CHB组高于HC组,差异有统计学意义(P<0.05),符合慢性HBV感染相关肝病的发展过程;肝功能指标(ALT、AST、TB)HBV-ACLF组高于CHB组,CHB组高于HC组,差异具有统计学意义(P<0.05),符合相关诊断标准。HBV-ACLF组和CHB组的HBV-DNA水平差异无统计学意义(P>0.05),见表1。
2.2 外周血Th17、Treg细胞检测结果 图1、图2显示HBV-ACLF组中Th17细胞和Treg细胞具有较大的荧光分布区;CHB组中Th17细胞和Treg细胞具有一般大小的荧光分布区;HC组中Th17细胞和Treg细胞具有较小的荧光分布区。对三组受检者Th17细胞、Treg细胞、Th17/Treg行方差分析发现:HBV-ACLF组中Thl7细胞、Treg细胞、Th17/Treg较CHB组和HC组显著升高;CHB组较HC组Th17细胞、Treg细胞、Th17/Treg升高,差异有统计学意义(P<0.05),见表2。
表1 三组受检者年龄、肝功能、HBV-DNA水平比较(±s)

表1 三组受检者年龄、肝功能、HBV-DNA水平比较(±s)
组别 性别 年龄(岁)ALT(U/L)AST(U/L)TB(μmol/L)HBV-DNA(lg copies/ml)女HBV-ACLF组(n=22) CHB组(n=24) HC组(n=20)检验值P值男8 1 4 10 14 10 10 χ2=2.244 0.33 47.94±10.87 36.82±9.63 28.12±4.39 F=12.579 0.00 460.76±280.42 136.50±78.59 26.48±13.54 F=9.478 0.00 173.35±125.67 88.87±52.59 18.37±8.62 F=10.376 0.00 182.24±121.45 42.34±16.53 10.48±6.83 F=12.478 0.00 6.27±1.78 5.89±1.35 0 Z=-1.91 0.13
表2 三组受检者外周血Th17细胞、Treg细胞、Th17/Treg检验结果比较(±s,%)

表2 三组受检者外周血Th17细胞、Treg细胞、Th17/Treg检验结果比较(±s,%)
组别Th17/CD4+T Treg/CD4+T Th17/Treg HBV-ACLF组(n=22) CHB组(n=24) HC组(n=20)检验值P值6.46±3.18 4.48±2.64 2.10±1.39 13.672 0.00 3.46±2.54 2.76±1.57 1.78±0.96 9.457 0.01 2.15±1.27 1.62±0.83 1.16±1.04 11.045 0.00
2.3 三组外周血Th17细胞、Treg细胞的相关性 对HBV-ACLF组、CHB组、HC组外周血中Th17细胞和Treg细胞采用Pearson法进行相关性分析,HBV-ACLF组Th17细胞与Treg细胞:r=0.873,P= 0.000<0.05,存在正相关(见图3);CHB组Th17细胞与Treg细胞:r=0.638,P=0.02<0.05,存在正相关(见图4);HC组Th17细胞与Treg细胞:r=0.617,P=0.000<0.05,存在正相关(见图5)。
2.4 两组患者的Th17、Treg、Th17/Treg与肝功能(ALT、AST、TB)、HBV-DNA载量的相关性 通过Pearson相关检验分析,HBV-ACLF组者外周血Th17细胞率与ALT(r=0.612,P=0.029)呈正相关关系(图6),Th17/ Treg与ALT(r=0.592,P=0.038)呈正相关关系(图7);CHB组外周血Th17细胞率与ALT(r=0.636,P=0.018)呈正相关关系(图8),Th17/Treg与ALT(r=0.712,P=0.008)呈正相关关系(图9)。Treg细胞与肝功能均无相关性。

图1 三组Thl7细胞的检测

图2 三组Treg细胞的检测

图3 ACLF组Th17与Treg相关性分析

图4 CHB组Th17与Treg相关性分析
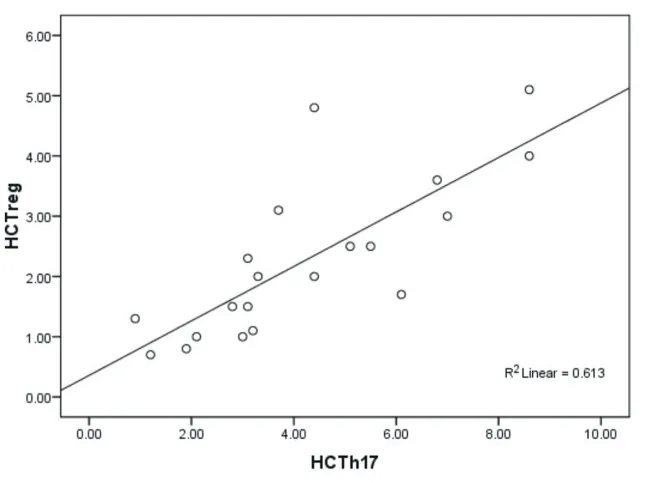
图5 HC组Th17与Treg相关性分析

图6 ACLF组Th17与ALT相关性

图7 ACLF组Th17/Treg与ALT相关性
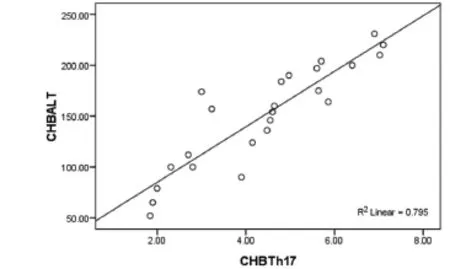
图8 CHB组Th17与ALT相关性
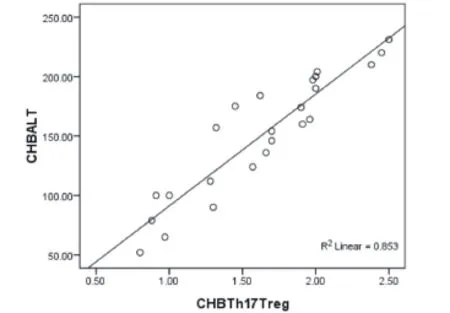
图9 CHB组Th17/Treg与ALT相关性
2.5 两组患者的Th17、Treg、Th17/Treg与HBV-DNA的相关性 HBV-ACLF组患者和CHB组患者Th17、Treg、Th17/Treg与HBV-DNA间均无相关关系,见表3。

组别HBV-ACLF组(n=22) Th17/Treg r=0.252 P=0.254 r=0.349 P=0.455 CHB组(n=24) Th17/CD4+T r=0.012 P=0.098 r=0.463 P=0.152 Treg/CD4+T r=0.038 P=0.231 r=0.083 P=0.237注:r为相关系数。
3 讨论
HBV-ACLF是HBV感染者在某种诱因下(如饮酒、劳累、药物等)导致的肝细胞大量坏死而出现的以肝功能严重受损为特征的综合征。肝衰竭的发生是病毒、宿主和环境相互作用的结果,其中,病毒诱发的机体免疫损伤在肝衰竭的发病过程中发挥着重要的作用[9-10]。Th17细胞和Treg细胞是近年来发现的一种新的不同于Th1、Th2的CD4+T细胞新亚群,Th17细胞可以通过分泌IL-17A、IL-17F、IL-22、IL-8、单核细胞趋化因子-1(MCP-1)、GM-CSF等相关炎症因子、趋化因子和集落刺激因子的生成,诱导中性粒细胞及单核巨噬细胞迁移到病灶,促进免疫反应[11-12];Treg细胞可以分泌TGF-β、IL-4、IL-10、等细胞因子,通过直接接触或分泌免疫因子发挥免疫调节作用[13-14]。本研究中HBV-ACLF组、CHB组Th17细胞与Treg细胞均存在正相关,且HBV-ACLF组和CHB组中Th17/Treg较HC组高,说明正常情况下Th17细胞和Treg细胞在体内处于一种平衡,在HBV-ACLF和CHB中这种平衡被打破。
本研究中HBV-ACLF患者外周血中Th17、Treg细胞的频率高于CHB组和HC组,Th17/Treg比率也明显升高,且Th17细胞、Th17/Treg与血清中ALT呈正相关。这说明在HBV-ACLF患者体内,Th17、Treg细胞都有所增加,但以Th17细胞的增加更显著,活化后的Th17细胞能募集各种炎性细胞增强机体的免疫反应,但是过强的免疫反应有致肝细胞损伤的作用;同时,Treg细胞的增加能避免过强的免疫反应造成肝细胞的大量坏死[15],所以Treg细胞的增加可能是机体因适应性的需要而产生的一种反馈调节。Th17细胞、Th17/Treg与血清中ALT呈正相关,且它们在HBV-ACLF组、CHB组、HC组依次降低,说明Th17可能是导致HBV相关肝病重症化的一个因素,这与国内外的研究结果基本符合[16-18],初步表明Th17介导的炎症反应可能参与HBV-ACLF疾病的发展。Zhang等[19]研究发现,Th17加重肝损伤的同时,也有清除乙型肝炎病毒(HBV)的作用;Yang等[20]的研究结果认为Treg细胞与HBV-DNA呈正相关。本研究中CHB组和HBV-ACLF患者组Th17、Treg、Th17/Treg与 HBV DNA间无相关性,与他们的结果不一致。说明Th17、Treg细胞并不能直接影响HBV-DNA的复制,HBV-ACLF患者中Th17、Treg细胞的分化、成熟是否受HBV或其他免疫细胞的影响,目前仍无定论,具体机制有待进一步的研究。
笔者通过在用药和系统治疗前观察HBV-ACLF患者外周血中Th17、Treg细胞的变化及其与肝功能和HBV-DNA间的关系,发现Th17和Treg细胞与HBV-ACLF的发生、发展密切相关,其在外周血中的变化可以协助判断机体的免疫状态,有望成为判断肝损伤患者严重程度的一个免疫标志。下一步的研究应该在用药或系统治疗后的不同时间点进一步观察Th17、Treg细胞的变化及其与肝功能和HBV-DNA间的关系,这有利于进一步阐明HBV-ACLF的发病机制,也对制订治疗方案、判断疗效有重要的指导意义。
[1]Liu Y,Wang CM,Cheng J,et al.Hepatitis B virus in tenofovirnaive Chinese patients with chronic hepatitis B contains no mutation of rtA194T conferring a reduced tenofovir susceptibility[J].Chin Med J,2009,122(13):1585-1586.
[2]Lee WM,Squires RH,Nyberg SL,et al.Acute liver failure:summary of a workshop[J].Hepatology,2008,47(4):1401-1415.
[3]Park H,Li Z,Yang XO,et al.A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17[J].Nature Immunology,2005,6(11):1133-1141.
[4]Sakaguchi S,Sakaguchi N,Asano M,et al.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains(CD25).Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases[J].Journal of Immunology(Baltimore,Md:1950),1995,155(3):1151-1164.
[5]Zhang JY,Zhang Z,Lin F,et a1.Interleukin-17-Producing CD4T cells Increase with severity of liver damage in patients with chronic hepatitis B[J].Hepatology,2010,51(1):81-91.
[6]Li J,Wu W,Peng GP,et al.HBeAg induces interleukin-10 production,inhibiting HBcAg-sp ecific Th l7 responses in chronic hepatitis B patients[J].Immunol Cell Biol,2010,88(8):834-841.
[7]中华医学会肝病学分会.中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华传染病学杂志,2011,29(3):65-80.
[8]中华医学会感染病学分会肝衰竭与人工肝学组.中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊疗指南[J].中华肝脏病杂志,2006,14(6):643-646.
[9]邹正升,陈菊梅,辛绍杰,等.慢性重型病毒性肝炎发病特点的探讨[J].中华实验和临床病毒学杂志,2002,16(4):322-325.
[10]祝成亮,李艳,袁丽.乙型肝炎病毒对白细胞介素35表达影响的研究[J].海南医学,2015,26(19):2874-2875.
[11]Sakaguchi S,Sakaguchi N,Asano M,et al.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains(CD25).Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases[J].Journal of Immunology(Baltimore,Md:1950),1995,155(3):1151-1164.
[12]Ouyang W,Kolls JK,Zheng Y.The biological functions of T helper 17 cell effector eytokines in inflammation[J].Immunity,2008,28 (4):454-467.
[13]Komijyama Y,Najae S,Matsuki T,et al.IL-17 plays an important role in the development of experimental autoimmune encephalomyelititis[J].J Immunol,2006,177:566-573.
[14]von Boehmer H,Mechanisms of suppression by suppressor T cells [J].Nature immunology,2005,6(4):338-344.
[15]刘志华,齐青松,张志安慢性HBV感染者血清IL-35含量和外周血Treg细胞的变化及意义[J].海南医学,2014,25(11):1638-1640.
[16]Miguel-Carrasco JL,Zambrano S,Blanca AJ,et al.Captopril reduces cardiac inflammatory markers in spontaneously hypertensive rats by inactivation of NF-KB[J].J Inflamm(Lond),2010,7:21.
[17]刘光亮,周小兰,陶鹏.Th17/treg细胞亚群数量变化在HBV相关ACLF临床转归中的作用[J].免疫学杂志.2014,30(7):623-627.
[18]Wu W,Li J,Chen F,et al.Circulating Th17 cells frequency is associated with the disease progression in HBV infected patients[J].Journal of Gastroenterology and Hepatology,2010,25(4):750-757
[19]Zhang GL,Xie DY,Lin BL,et al.Imbalance of interleukin-17-producing CD4 T cells/regulatory T cells axis occurs in remission stage of patients with hepatitis B virus-related acute-on-chronic liver failure[J].Journal of Gastroenterology and Hepatology,2013,28(3): 513-521
[20]Yang G,Liu A,Xie Q,et al.Association of CD4+CD25+FoxP3 regulatory T cells with chronic activity and viral clearance in patients with hepatitis B[J].International Immunology,2007,19(2):133-140.
Change of Th17 cell,Treg cell in patients with HBV-associated acute-on-chronic liver failure and its relationship with liver function and HBV-DNA load.
Shen Min1,LIN Ming-qiang1,FENG Qi-tao1,LV You-kai1,LI Yong-wu2.Department of Infectious Diseases1,Laboratory of Molecular Biology2,Hainan Provincial Nongken General Hospital,Haikou 570311,Hainan,CHINA
ObjectiveTo detect the levels of Th7 and Treg cells in patients with hepatitis B virus-associated acute-on-chronic liver failure(HBV-ACLF)and to analyze the effect of Th7 and Treg cells in the pathogenesis of HBV-ACLF.MethodsThe frequency of Th17 and Treg cells in peripheral blood of 22 patients with HBV-ACLF (HBV-ACLF group),24 patients with chronic hepatitis B(CHB group)and 20 healthy controls(HC group)were determined by flowcytometry.HBV-DNA loads were measured by fluorescent PCR.Finally,the correlations among Th17, Treg,Th17/Treg,alanine aminotransferase(ALT),aspertate aminotransferase(AST),total bilirubin(TB)and HBV-DNA loads were analyzed.ResultsThe levels of Th17,Treg and Th17/Treg in HBV-ACLF group were significantly higher than those in CHB group and HC group,and the levels in CHB group were significantly higher than those in HC group (P<0.05).Th17 was positively correlated with Treg in HBV-ACLF group,CHB group,and HC group(P<0.05),with the correlation coefficients of 0.873,0.638,0.617,respectively.Th17 was positively correlated with ALT in HBV-ACLF group and CHB group(r=0.612,P<0.05;r=0.636,P<0.05),and Th17/Treg was positively correlated with ALT in HBV-ACLF group and CHB group(r=0.592,P<0.05;r=0.712,P<0.05).Th17,Treg,Th17/Treg showed no correlation with HBV DNA load in HBV-ACLF group and CHB group,and also with AST and TB in the three groups(P>0.05).ConclusionTh17 and Treg may be in a balanced state in healthy people,and such state might be broken in patients with CHB and HBV-ACLF,which indicates that Th17 and Treg are involved in the occurrence and development of CHB and HBV-AVLF.Th17 cell could be used as an immunological marker for determination of the liver damage degree in HBV-ACLF.Th17,Treg have no correlation with the load of HBV-DNA.
Th17;Treg;Hepatitis B virus(HBV);Acute-on-chronic liver failure(ACLF);Alanine aminotransferase(ALT);Aspartate aminotransferase(AST)
R512.6+2
A
1003—6350(2016)05—0692—05
10.3969/j.issn.1003-6350.2016.05.004
2015-06-10)
沈敏。E-mail:531635658@qq.com
