缺氧诱导因子1-α基因C1744T多态与先天性心脏病的相关性研究
2016-03-04倪世宏刘兴元杨奕清
倪世宏 刘兴元 魏 东 杨奕清
200431 上海,复旦大学附属华山医院宝山分院儿科(倪世宏);200065 上海,同济大学医学院附属同济医院儿科(刘兴元);200040 上海,上海交通大学附属儿童医院儿科(魏 东);200030 上海,上海交通大学附属胸科医院心血管研究室(杨奕清)

缺氧诱导因子1-α基因C1744T多态与先天性心脏病的相关性研究
倪世宏刘兴元魏东杨奕清
先天性心脏病 (congenital heart disease, CHD) 是人类最常见的发育异常,可导致运动耐力降低、神经系统发育障碍、血栓栓塞、肺动脉高压、心力衰竭、心律失常和心源性猝死,而且是婴幼儿最常见非感染性死因[1-2]。越来越多的证据显示,遗传缺陷是CHD发生的重要原因,而且已经发现了许多基因变异与CHD有关[3-6]。近年来的研究发现,缺氧诱导因子1-α(hypoxia-inducible factor 1-alpha, HIF1α) 基因对心脏的正常发育、结构重构和功能具有重要作用。在小鼠,HIF1α基因敲除可导致胚胎期死亡,主要是由各种心血管发育缺陷所致,包括原始心管融合、环化障碍以及心肌特化、分化异常和心室畸形等。目前已经发现HIF1α基因多态与人类多种疾病有关,包括缺血性心脏病、肿瘤、糖尿病等[9-12]。由于位于HIF1α基因第12个外显子的C1744T多态(也被称为c.1744C>T、p.P582S、C1772T或rs11549465多态)已被证实对HIF1α的功能具有显著地增强作用[12],因此,本研究首先明确HIF1α基因C1744T多态与CHD的相关性。
1对象与方法
1.1研究对象
随机选取110例无血缘关系的中国汉族CHD患儿为病例组,其中男62例,女48例,年龄0~5岁,平均2岁;200名无血缘关系的中国汉族无CHD儿童为对照组,男115例,女85例,年龄0~5岁,平均2岁。详细询问病史、全面体检以及心脏彩色多普勒超声检查。全部CHD患儿均经心脏超声或心脏手术确诊,排除综合征型CHD患者。经儿童父母知情同意后收集其血常规检验后原本丢弃的剩余血,使用基因组DNA提取试剂盒(美国Promega公司),按照操作说明提取全部研究对象的基因组DNA。
1.2方法
1.2.1扩增HIF1α基因第12外显子的引物设计
登录美国的生物信息中心网站(http://www.ncbi.nlm.nih.gov/),进入核苷酸数据库(登录号NG_029606)下载HIF1α基因的基因组DNA序列,使用在线软件(http://primer3.ut.ee/)设计一对扩增HIF1α基因第12外显子的引物,由上海生工生物工程有限公司合成。其中正向引物序列是5’-GAAGTGACTTTGAGTTTCACTTGT-3’,反向引物序列是5’-CTCAAGAATTTGCGTTAGGGCAT-3’,所扩增片段的大小为639 bp。
1.2.2HIF1α基因第12外显子的扩增
以基因组DNA为模板,使用上述引物和HotStar Taq DNA聚合酶(德国Qiagen公司)等聚合酶链反应(polymerase chain reaction,PCR)试剂,在PE9700型热循环仪(美国Applied Biosystem公司)上扩增HIF1α基因第12外显子。PCR反应的总体积为25 μL,包括10×缓冲液2.5 μL,5×Q溶液5 μL,dNTP(各2.5 mmol/L)2 μL,基因组DNA(200 ng/μL)1 μL,上、下游引物(20 μmol/L)各0.5 μL, HotStar Taq DNA聚合酶(5 U/μL)0.25 μL和双蒸水13.25 μL。PCR反应条件:95 ℃预变性15 min,此后进入35个循环,每个循环94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸1 min,最后72℃延伸10 min。PCR反应结束后使用凝胶回收试剂盒(上海生工生物工程有限公司)纯化所扩增的DNA片段。
1.2.3HIF1α基因第12外显子多态扫描
使用上述正向引物、纯化的DNA片段和DNA测序试剂盒(美国Applied Biosystem公司)在PE9700型热循环仪(美国Applied Biosystem公司)上进行测序反应。测序反应的总体积为10 μL,包括预混合液4 μL,纯化的DNA(20ng/μL)2 μL,上游引物(2 μmol/L)1 μL和双蒸水3 μL。测序反应的条件是:总计30个循环,每个循环95 ℃变性20 s,50 ℃退火15 s,60 ℃延伸1 min。测序反应产物经纯化后在3130 XL 型DNA测序仪(美国Applied Biosystem公司)上进行测序。使用 DNA序列分析软件(美国Applied Biosystem公司)分析测序结果并将所测序列与核苷酸数据库中的已知HIF1α基因序列(登录号NG_029606)进行对比以识别HIF1α基因多态。
1.3统计学分析
使用SPSS16.0统计软件包对数据进行统计学分析。连续变量用均数±标准差表示。两组连续变量的比较使用非配对Student’st检验,两组分类变量的比较根据需要使用Pearson’sχ2检验或Fisher 精确概率计算。双侧统计值P<0.05表示差异具有统计学意义。
2结果
2.1CHD患儿的临床特点
对照组与病例组儿童的年龄和性别匹配,均无明确的CHD相关环境危险因素,如母亲在怀孕头3个月患病或服用药物、父母吸烟以及长期接触毒物或射线等。110例CHD患儿的基本临床特点见表1。
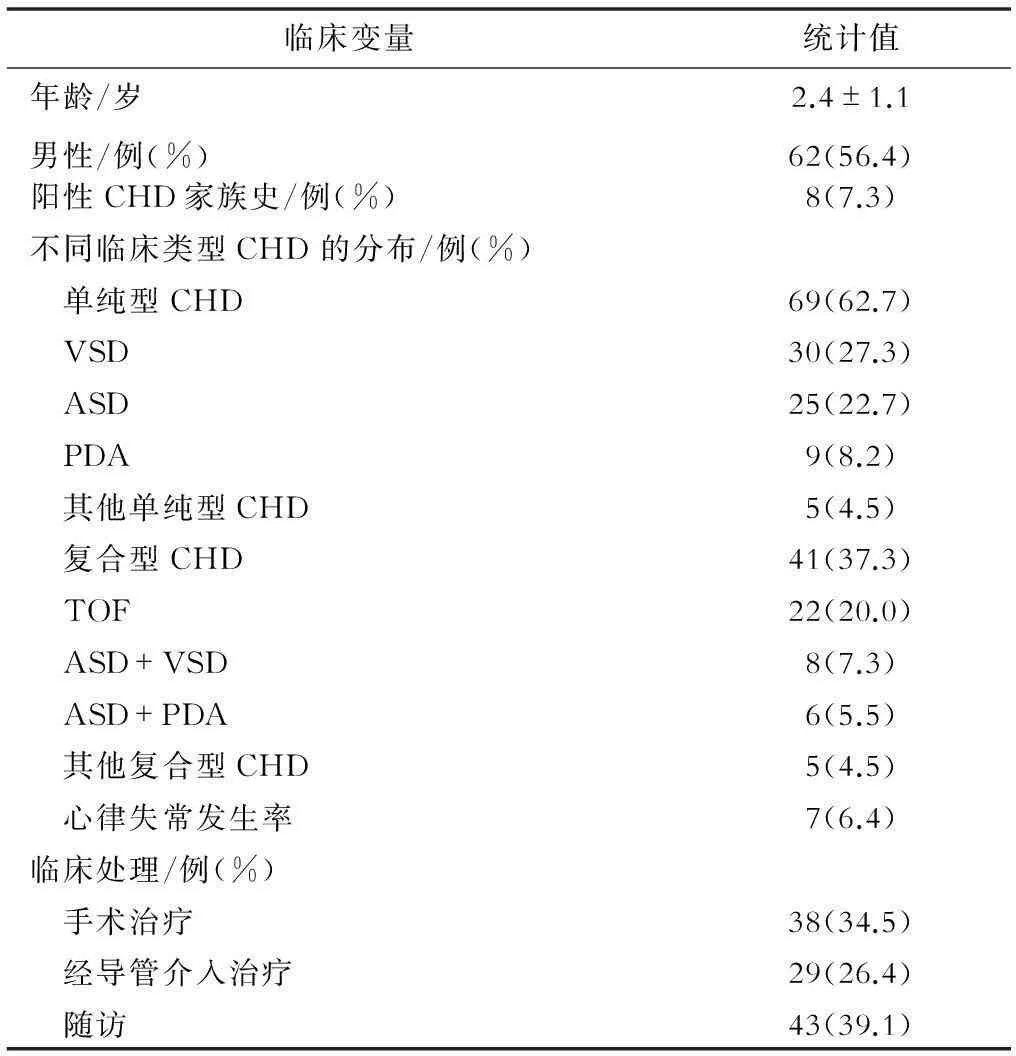
表1 110例CHD患儿的基本临床特点
注:CHD,先天性心脏病;VSD,室间隔缺损;ASD,房间隔缺损;PDA,动脉导管未闭;TOF,法洛四联症。
2.2HIF1α基因C1772T多态的发现
通过对研究对象进行PCR测序发现,在CHD患儿和健康儿童均存在HIF1α基因C1744T多态。显示HIF1α基因编码外显子序列第1744位的纯合等位基因C、纯合等位基因T以及杂合等位基因C/T的代表性测序结果见图1。
2.3HIF1α基因C1744T多态在2组中的频率差异
在HIF1α基因编码核苷酸序列第1744位的等位基因C、T及其构成的3种基因型CC、CT、TT在CHD在病例组和对照组间的频率分布存在显著性差异,病例组等位基因T及基因型CT和TT的频率较低(见表2)。两组等位基因频率经Fisher精确检验比较,P=0.0179;两组基因型频率经Fisher精确检验比较,P=0.0139。
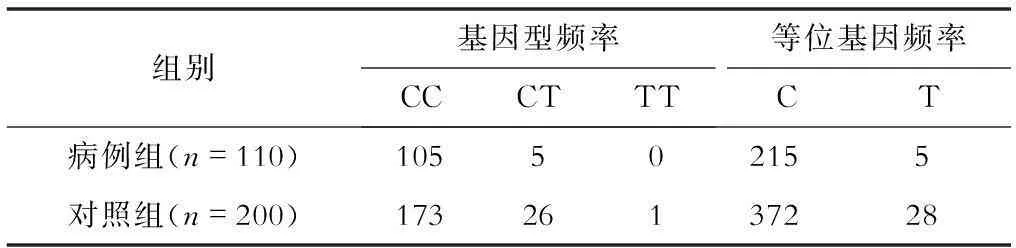
表2 CHD患儿和无CHD对照者的
注:两组基因型频率比较,P=0.0179;等位基因频率比较,P=0.0139
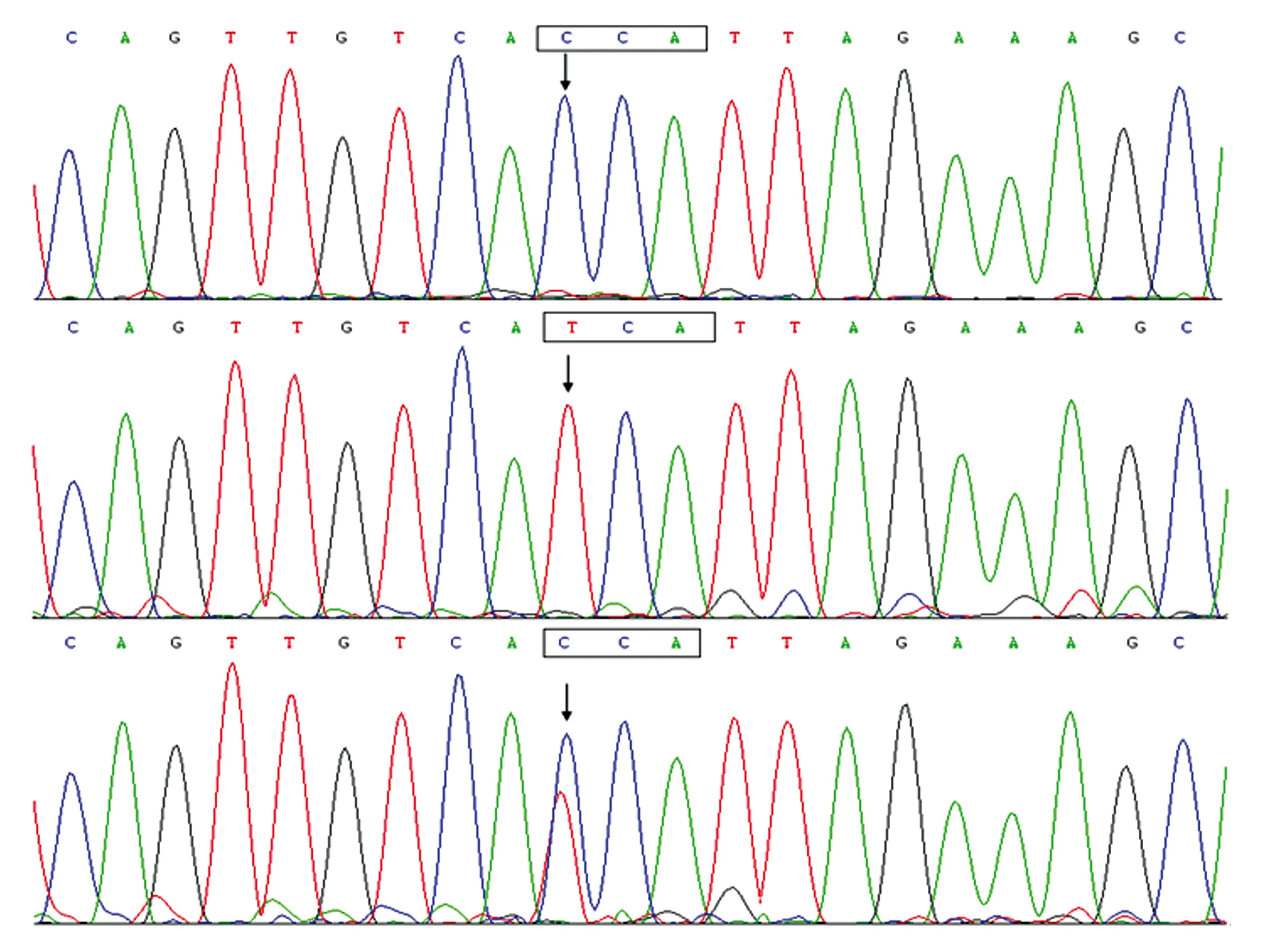
注:箭头所指为纯合等位基因C、纯合等位基因T以及杂合等位基因C/T图1 HIF1α基因c.1744C>T多态序列图
3讨论
本研究发现,HIF1α基因C1744T多态在病例组和对照组中的频率分布存在显著性差异,等位基因T及其构成的基因型CT和TT在病例组组显著低于对照组,提示等位基因T具有降低人类CHD易感性的保护性作用,HIF1α基因C1744T多态可能是人类进化选择的有益结果。
人类HIF1α基因定位于14q21-24,有15个外显子,编码一种由826个氨基酸所组成的HIF1的α亚单位,与β亚单位一起以异二聚体的形式构成功能性HIF1。HIF1是一种核转录因子,其中α亚单位既是调节亚单位又是活性亚单位,其蛋白稳定性和转录活性均受细胞内氧浓度的调节;而β亚单位为多种转录因子所共有,可在细胞核中持续表达,且不受氧浓度影响,其功能可能与维持HIF1α二聚体结构的稳定性及活性构象有关[13]。HIF1α是目前所识别的唯一一个高度特异性的、在低氧条件下能够发挥活性的转录因子,对氧浓度十分敏感,是专一调节氧稳态的重要蛋白,也被称为“缺氧基因表达的总开关”[13]。HIF1α作为转录因子与低氧反应元件结合,可以诱导100多个重要下游靶基因的表达,包括血管内皮生长因子基因、促红细胞生成素基因、血红素加氧酶l基因等,并通过调控这些靶基因而在心血管胚胎发育、红细胞生成、细胞生长等方面发挥重要的生理作用[9,13-14]。因此,HIF1α基因对心血管的正常发育尤其是在低氧等恶劣环境下的正常发育具有不可替代的关键调控作用。
在人类,目前已经发现多种疾病相关HIF1α基因多态,其中研究得最多的是rs11549465(即c.1744C>T、p.P582S或C1772T多态)和rs11549467(即c.1762G>A、p.A588T或G1790A多态)多态,这两种多态均显著增强HIF1α对靶基因的转录激活作用,而且rs11549465多态的功能增强性作用更强[15-17]。既往的研究表明,HIF1α基因的这些功能多态与肿瘤、糖尿病、缺血性心脏病和腰椎间盘退行性变等多种疾病有关[9-12]。本研究发现,HIF1α基因c.1744C>T多态与CHD有关,等位基因T降低CHD的易感性,提示HIF1α的功能增强对心血管的正常发育具有重要的保护作用。
总之,本研究发现人类HIF1α基因c.1744C>T多态与CHD的易感性降低有关,这为制定CHD防治策略提供了新的分子靶标。
参考文献
[1]Go AS, Mozaffarian D, Roger VL, et al. Heart disease and stroke statistics—2014 update: a report from the American Heart Association. Circulation, 2014, 129(3): e28-e292.
[2]Kahr PC, Diller GP. Almanac 2014: congenital heart disease. Heart, 2015, 101(1): 65-71.
[3]毛红柳,刘兴元.先天性心脏病相关GATA5基因突变研究.国际心血管病杂志, 2013, 40(3): 173-177.
[4]徐蕾, 袁方, 李若谷, 等. 先天性房间隔缺损相关GATA6基因新突变的识别. 国际心血管病杂志, 2014, 41(2): 121-124.
[5]Fahed AC, Gelb BD, Seidman JG, et al. Genetics of congenital heart disease: the glass half empty. Circ Res, 2013, 112(4): 707-720.
[6]Andersen TA, Troelsen Kde L, Larsen LA. Of mice and men: molecular genetics of congenital heart disease. Cell Mol Life Sci, 2014, 71(8): 1327-1352.
[7]Semenza GL. Hypoxia-inducible factor 1 and cardiovascular disease. Annu Rev Physiol, 2014, 76: 39-56.
[8]Compernolle V, Brusselmans K, Franco D, et al. Cardia bifida, defective heart development and abnormal neural crest migration in embryos lacking hypoxia-inducible factor-1alpha. Cardiovasc Res, 2003, 60(3): 569-579.
[9]Ye Y, Wang M, Hu S, et al. Hypoxia-inducible factor-1α C1772T polymorphism and cancer risk: a meta-analysis including 18,334 subjects. Cancer Invest, 2014, 32(4): 126-135.
[10]Nagy G, Kovacs-Nagy R, Kereszturi E, et al. Association of hypoxia inducible factor-1 alpha gene polymorphism with both type 1 and type 2 diabetes in a Caucasian (Hungarian) sample. BMC Med Genet, 2009, 10: 79.
[11]Resar JR, Roguin A, Voner J, et al. Hypoxia-inducible factor 1alpha polymorphism andcoronary collaterals in patients with ischemic heart disease. Chest, 2005, 128(2): 787-791.
[12]Lin WP, Wang XJ, Wang CR, et al. Polymorphism in the hypoxia-inducible factor 1alpha gene may confer susceptibility to LDD in Chinese cohort. PLoS One, 2013, 8(8): e73158.
[13]祁琳,张晓雷,毛立群,等.HIF-1与低氧性疾病关系的研究进展.武警后勤学院学报(医学版),2013,22(4):330-333.
[14]李海生,朱玲玲,范明.低氧诱导因子-1 结构、活性调节及其靶基因的研究进展.军事医学科学院院刊,2004,28(2):183-186.
[15]Hu X, Fang Y, Zheng J, et al. The association between HIF-1α polymorphism and cancer risk: a systematic review and meta-analysis.Tumour Biol, 2014, 35(2): 903-916.
[16]Tanimoto K, Yoshiga K, Eguchi H, et al. Hypoxia-inducible factor-1alpha polymorphisms associated with enhanced transactivation capacity, implying clinical significance. Carcinogenesis, 2003, 24(11): 1779-1783.
[17]Fu XS, Choi E, Bubley GJ, et al. Identification of hypoxia-inducible factor-1alpha (HIF-1alpha) polymorphism as a mutation in prostatecancer that prevents normoxia-induced degradation. Prostate, 2005, 63(3): 215-221.
(收稿:2015-07-25修回:2015-09-28)
(本文编辑:丁媛媛)
200431 上海,复旦大学附属华山医院宝山分院儿科(倪世宏);200065 上海,同济大学医学院附属同济医院儿科(刘兴元);200040 上海,上海交通大学附属儿童医院儿科(魏东);200030 上海,上海交通大学附属胸科医院心血管研究室(杨奕清)
【摘要】目的:研究缺氧诱导因子1-α(hypoxia-inducible factor 1-alpha, HIF1α)基因C1744T多态与先天性心脏病(congenital heart disease, CHD)的关系。方法:入选CHD患儿110例(病例组)及无CHD儿童200名(对照组),收集其临床资料和血标本,使用基因组DNA纯化试剂盒抽提基因组DNA。通过聚合酶链反应扩增HIF1α基因的第12个外显子,应用DNA测序试剂盒在DNA测序仪上对扩增片段进行测序。统计分析HIF1α基因C1744T多态在病例组和对照组间的频率分布。结果:HIF1α基因编码核苷酸序列第1744位的等位基因C、T及其构成的3种基因型CC、CT、TT在CHD在病例组和对照组间的频率分布存在显著性差异,病例组等位基因T及基因型CT和TT的频率较低(等位基因频率经Fisher精确检验比较,P=0.0179;基因型频率经Fisher精确检验比较,P=0.0139)。结论:HIF1α基因C1744T多态与CHD的易感性有关,等位基因T降低CHD的发生率。
【关键词】先天性心脏病;遗传学;基因多态性;缺氧诱导因子
Study on the association of the polymorphism of C1744T in the hypoxia-inducible factor 1-alpha gene with congenital heart diseaseNIShihong1,LIUXingyuan2,WEIDong3,YANGYiqing4. 1.DepartmentofPediatrics,BaoshanBranchofHuashanHospital,FudanUniversity,Shanghai200431,China; 2.DepartmentofPediatrics,TongjiHospital,TongjiUniversitySchoolofMedicine,Shanghai200065,China; 3.DepartmentofPediatrics,Children’sHospital,ShanghaiJiaotongUniversity,Shanghai200040,China; 4.DepartmentofCardiovascularResearchLaboratory,ChestHospital,ShanghaiJiaotongUniversity,Shanghai200030,China
【Abstract】Objective: To study the association of the polymorphism C1744T in the hypoxia-inducible factor 1-alpha (HIF1α) gene with congenital heart disease (CHD).Methods: A total of 110 children with CHD (case group) and 200 children without CHD (control group) were recruited. The clinical data and blood samples from all the study participants were collected. The genomic DNA was extracted with DNA purification kit. The twelfth coding exon of the HIF1α gene was amplified by polymerase chain reaction. The amplicons were sequenced with DNA sequencing kit under a DNA Analyzer. The frequencydistributions of the polymorphism C1744T in HIF1αwere statistically analyzed between the case and control groups. Results: Between the case and control groups, there was significant difference in the frequency distributions of the alleles C and T at coding nucleotide 1 744 of HIF1α, as well as the genotypes of CC, CT and TT, with lower frequencies of allele T and genotypes CT and TT observed in the case group (for the comparison of allelic frequency by Fisher’s exact test,P=0.0179; for the comparison of genotypic frequency by Fisher’s exact test,P=0.0139).Conclusion: The polymorphism of C1744T in HIF1αis associated with the susceptibility to CHD, with allele T contributing to a decreased prevalence of CHD.
【Key words】Congenital heart disease; Genetics; Gene polymorphism; Hypoxia-inducible factor
doi:10.3969/j.issn.1673-6583.2016.01.014
·基础研究·
基金项目:上海市宝山区自然科学基金(12-E-25)
通信作者:倪世宏,Email: ni_shihong@sina.com
