果桑肥大性菌核病菌多聚半乳糖醛酸酶基因(CsPG1)的克隆及功能分析
2016-03-03李孟娇吕蕊花蔡雨翔王传宏赵爱春余茂德
李孟娇 吕蕊花 余 建 蔡雨翔 王传宏 赵爱春 鲁 成 余茂德
西南大学生物技术学院, 重庆 400716
果桑肥大性菌核病菌多聚半乳糖醛酸酶基因(CsPG1)的克隆及功能分析
李孟娇吕蕊花余建蔡雨翔王传宏赵爱春鲁成余茂德*
西南大学生物技术学院, 重庆 400716
摘要:多聚半乳糖醛酸酶(polygalacturonase, PG)是一种细胞壁结构蛋白, 可以催化果胶分子多聚α-(1,4)-聚半乳糖醛酸的裂解, 使细胞壁结构解体, 导致果实软化。本文采用qRT-PCR方法, 分析不同生长阶段菌丝侵染的油菜叶片中多聚半乳糖醛酸酶基因的表达模式。结果表明: (1)采用RT-PCR从果桑肥大性菌核病菌(Ciboria shiraiana)菌核中扩增多聚半乳糖醛酸酶基因cDNA, 其全长为1143 bp, 命名为CsPG1 (GenBank登录号为KR296662), 编码380个氨基酸残基。根据侵染油菜叶片的表达量, 确认CsPG1为基因家族的主效基因; (2)将CsPG1基因连接pET28a(+)载体并转化大肠杆菌E. coli BL21 (DE3), 获得包涵体形式, 但对底物(聚半乳糖醛酸)没有活性的蛋白; (3)最适CsPG1包涵体溶解的尿素浓度6 mol L–1, 采用缓慢稀释低温复性的方法对重组蛋白CsPG1进行了重折叠复性试验, 经高亲和力的Ni-NTA树脂纯化后为得到单一条带, 获得可溶性蛋白, 复性后的多聚半乳糖醛酸酶比活力为5.02 U mg–1; (4)生物试验表明, CsPG1蛋白能够加速嘉陵40 (Morus atropurpurea Roxb.)桑椹的成熟和软化, 推测该蛋白与肥大性菌核病菌对桑椹的侵染有关。这一结果揭示了不同果桑品种对菌核病敏感性的差异, 为果桑生产中菌核病的防控提供了分子证据。
关键词:果桑; 肥大性菌核病菌; CsPG1; 蛋白表达活性
本研究由国家公益性行业(农业)科研专项经费项目(201403064), 国家自然科学基金项目(31360190)和国家现代农业产业技术体系建设专项(CARS-22)资助。
This study was supported by China Special Fund for Agro-scientific Research in the Public Interest (201403064), the National Natural Science Foundation of China (31360190), and the China Agriculture Research System (CARS-22).
第一作者联系方式: E-mail: lmj0929xjj@126.com, Tel: 18306031717
果胶酶是参与果胶降解的一组复合细胞壁降解酶, 能将高等植物的初生细胞壁和中胶层的果胶多聚物降解成聚合度逐步减低的寡聚半乳糖醛酸链和半乳糖醛酸单体[1]。根据果胶酶的作用底物和方式不同, 可将果胶酶分为果胶水解酶、果胶裂解酶、果胶酯酶和原果胶酶[2]。多聚半乳糖醛酸酶(polygalacturonase, PG) 是果胶水解酶类的一种, 可以降解植物细胞壁中的果胶, 破坏细胞的完整性, 从而为病原菌的生长和发育提供大量的营养物质[3-4]。Claudia等[5]认为PG是通过降解植物细胞壁中同源的多聚半乳糖醛酸区域起作用, 产生真菌的致病性和毒性, 从而引起组织溶解和原生质体死亡。
PG的多基因家族成员在植物发育不同阶段和不同组织中的表达量不同, PG能促进果实软化, 硬度下降, 已在番茄[6-7]、桃[8]、猕猴桃[9]、鳄梨[10-11]、草莓[12-13]等果实成熟过程中得到验证。同时与器官脱落[14]、豆荚和花药裂开[15]、花粉粒成熟和花粉管生长有关[16]。因此, PG一直是学者研究植物果实发育和成熟衰老的热点。
果桑肥大性菌核病菌感染桑椹时会产生大量的纤维素酶, 分解细胞壁中的纤维素等[17], 推测果胶酶中的PGs能够分解桑椹细胞壁的多聚α-(1,4)-聚半乳糖醛酸, 生成D(+)半乳糖醛酸。肥大性菌核病菌能够吸收桑椹中分解了的小分子营养物质, 为自身生长发育与侵染桑椹提供良好的营养源。本研究以果桑肥大性菌核病菌(Ciboria shiraiana)为材料, 从Sclerotinia sclerotiorum数据库信息入手, 克隆果桑肥大性菌核病菌的PG家族基因(CsPG), 并研究其主效基因的生物功能, 旨在为探索果桑肥大性菌核病菌的致病机制提供分子生物学依据。
1 材料与方法
1.1试验材料
果桑肥大性菌核病菌(Ciboria shiraian, 中国典型培养物保藏中心编号: CCTCCAF 2014019)由本实验室分离、鉴定并保存。大肠杆菌菌株DH5α、BL21(DE3)购自生工生物工程(上海)股份有限公司。pET28a(+)载体为本实验室保存, T/A克隆载体pMD19-T simple vector购自宝生物工程(大连)有限公司。T4 DNA连接酶、限制性内切酶EcoR I、Hind III、Taq DNA聚合酶、RNAiso Plus试剂盒、反转录酶M-MLV、蛋白质Maker均购自宝生物工程(大连)有限公司; 胶回收试剂盒、质粒抽提试剂盒均购自Omega公司; Ni-NTA亲和树脂购自南京金斯瑞生物科技有限公司。牛血清白蛋白(BSA)购自生工生物工程有限公司; 其他试剂均为国产分析纯。果实硬度计(型号GY-2)购自上海思为仪器制造有限公司。
接种油菜所用品种为中双10号, 在GXZ智能光照培养箱内培养。接种果桑所用品种为嘉陵40 (重庆市审定桑树品种), 种植于西南大学桑树资源圃。
1.2CsPG家族基因的克隆
利用已公布物种的多聚半乳糖醛酸酶基因序列, 在Sclerotinia sclerotiorum数据库中比对分析, 获得多聚半乳糖醛酸酶基因序列。对所获序列进一步鉴定, 获得6条PGs, 即AF501307.1、AF501308.1、AY496277.1、AY312510.1、AY312511.1、AY312512.1。利用Primer 5.0设计引物(表1), 引物由南京金斯瑞公司合成。以C. shiraian菌核为材料, 按照TaKaRa说明书反转录得到的cDNA为模板进行扩增。PCR产物经电泳检测后回收, 与pMD19-T simple vector载体连接并转化大肠杆菌DH5α感受态细胞, 将阳性单克隆送北京六合华大基因有限公司测序。
1.3果桑肥大性菌核病菌侵染不同时期PG基因的表达量分析
待油菜长到6~8片真叶时, 取生长一致的油菜叶片, 按照方中达[18]、吕蕊花等[19]方法其表面消毒,用灭菌的牙签轻轻刺伤表面, 然后在受伤部位接种生长旺盛的C. shiraian的菌丝块, 置灭菌培养皿中,每个处理重复3次, 移入培养箱(25℃恒温, 相对湿度90%), 每24 h取一次样, 分别收集C. shiraian的菌核、菌核萌发产生的子实体, 以及在查彼培养液培养5 d产生的菌丝。以果桑肥大性菌核病菌β-tubulin为内参基因[17], 设计引物(表1), 参照TaKaRa公司的SYBR Premix Ex Taq试剂盒操作说明书进行Real-time PCR分析, 反应体系为20 μL,每个引物最终浓度为400 nmol L–1, 热启动程序为95℃ 30 s, 95℃ 5 s, 60℃ 30 s, 共40个循环。分别提RNA进行qRT-PCR测定, 每个样品设3次重复取其平均值, 试验于Step OnePlus Real-time PCR仪(ABI公司)上进行, 将获得的数据采用2–ΔΔCt法进行
基因相对表达量[20]。对定量结果进行分析, 选取表达量最高的为主效基因, 命名为CsPG1, 使用ExPasy在线工具ProtParam (http://web.expasy.org/ protparam/)预测该主效基因编码氨基酸的基本理化性质, 使用ProtScale (http://web.expasy.org/protscale/)分析亲水性与疏水性, 使用SignalP (http: //www.cbs. dtu.dk/services/)预测蛋白质信号肽, 使用NetNGlyc (http://www.cbs.dtu.dk/services/NetNGlyc/)预测蛋白质糖基化位点。
1.4CsPG1基因原核表达载体的构建及诱导
预测信号肽切割位点后, 将CsPG1基因成熟肽cDNA片段链接到表达载体pET28a(+)中构建融合表达载体。根据所克隆的CsPG1的序列以及原核表达载体pET28a(+)多克隆位点序列, 设计1对引物, 其画线处为分别EcoR I、Hind III酶切位点(表1), 用EcoR I和Hind III双酶切PCR产物和pET28a(+)质粒, 分别回收目的片段, 二者经T4 DNA连接酶连接后转化大肠杆菌DH5α感受态细胞, 随机挑取抗性克隆, 然后将PCR及双酶切鉴定后的阳性克隆送南京金斯瑞生物科技有限公司测序, 将测序正确的重组表达载体命名为pET28a(+)-CsPG1。
将鉴定正确的含有pET28a(+)-CsPG1的阳性克隆子扩大培养后提取质粒, 质粒经热激转化E. coli BL21 (DE3), 涂布于含卡那霉素的LB平板上。挑选出pET28a(+)-CsPG1/BL21 (DE3)阳性克隆的菌接种于摇瓶生长至OD600= 0.6~0.8时, 加入终浓度为0.4 mmol L–1的IPTG, 在28℃下诱导5 h, 每小时取一次样, 同时以诱导的pET28a(+)空载菌株作为对照。以SDS-PAGE分析菌株中蛋白质表达情况。
1.5CsPG1包涵体的溶解
包涵体溶解程序是在Schoner等[21]设计的基础上略有改进, 将诱导菌液在4℃、13 225×g下离心5 min收集菌体, 将菌体重悬于细胞裂解缓冲液(Tris-HCl 50 mmol L–1, EDTA 1 mmol L–1, NaCl 100 mmol L–1, pH 8.0)中。将菌悬液进行超声波破碎, 破碎条件为Amplitude 37%, 破碎2 s, 停3 s, 共10 min。15 521×g离心20 min。弃去上清液, 沉淀依次重悬于1 mL含2、4、6和8 mol L–1尿素的包涵体溶解缓冲液(Tris-HCl 50 mmol L–1, EDTA 1 mmol L–1, NaCl 100 mmol L–1, β-巯基乙醇1%, pH 8.0, 加入不同浓度的尿素, 缓冲液现用现配[22])中, 在37℃摇床温育30 min后, 15 521×g离心15 min。各取适量上清液进行SDS-PAGE分析, 确认溶解效果最佳的尿素浓度。
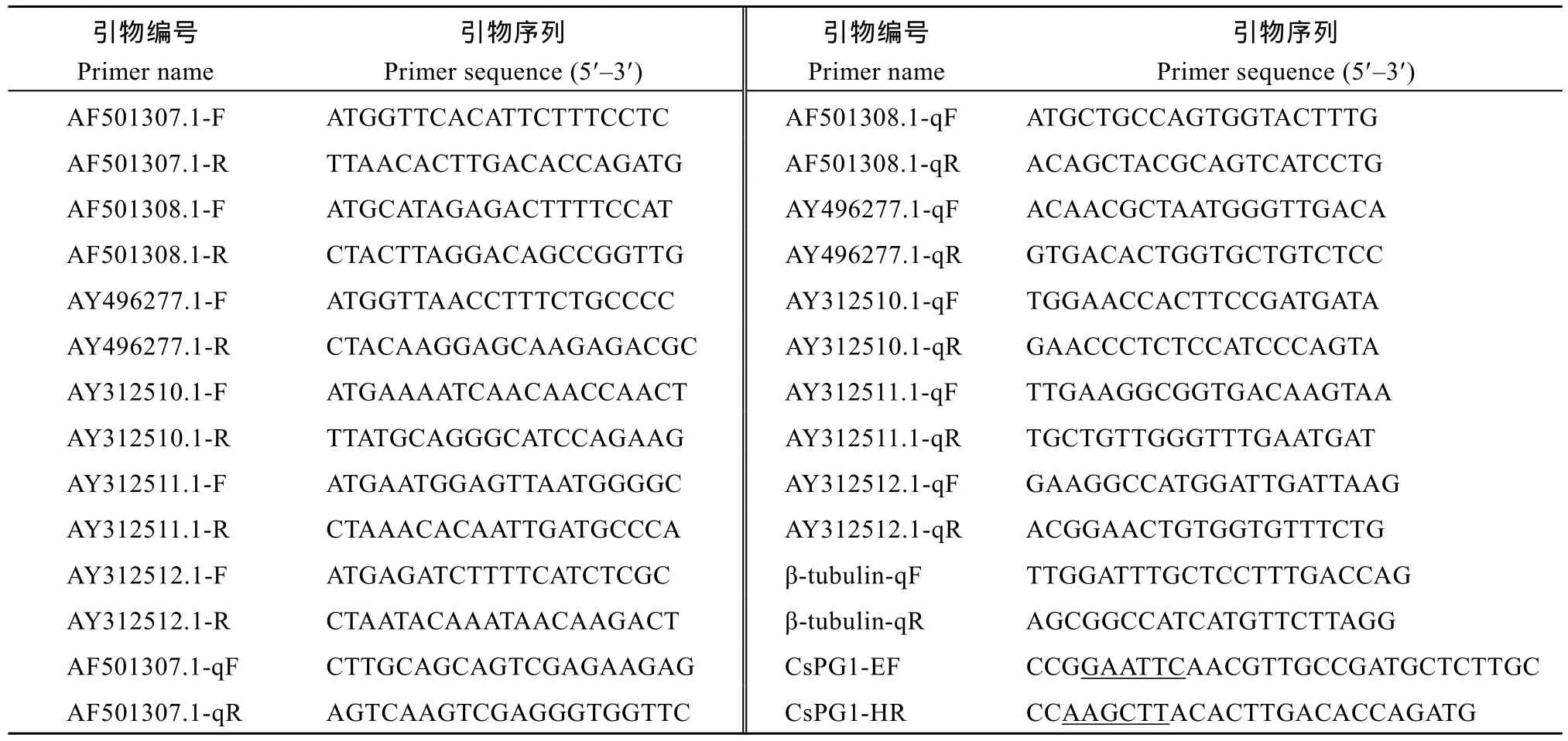
表1 引物编号与序列Table 1 List of primers and their sequences
1.6CsPG1包涵体复性及纯化
采用稀释法对溶解的CsPG1包涵体进行复性。采用1.5中筛选得到的最适尿素浓度充分溶解包涵体沉淀。4℃、15 521×g离心15 min, 上清液中缓慢加入稀释复性缓冲液(Tris-HCl 50 mmol L–1, 甘油10%, NaCl 0.5 mmol L–1, 0.4 mol L–1L-Arg, pH 8.0)进行稀释, 分别稀释5、10、50、100、150和200倍。将稀释酶液在4℃静置1 h进行充分复性。测定
每个稀释度的酶液酶活性且利用Bradford法测定重组蛋白浓度。采用Ni-NTA亲和层析柱纯化参照金斯瑞蛋白纯化试剂盒经过重折叠复性的CsPG1蛋白溶液。
1.7CsPG1活性测定及功能检测
在Lindsay[23]描述方法的基础上改进酶活性测定方法, 利用DNS法测定PG的活性并以生成D(+)半乳糖醛酸的量来表示。取0.5%的多聚半乳糖醛酸溶液(用100 mmol L–1NaAc-HAc, pH 5.0的缓冲液配制) 500 μL, 加CsPG1 300 μL, 用100 mmol L–1NaAc缓冲液补齐1 mL, 50℃水浴0.5 h。然后加入1 mL DNS试剂, 沸水浴5 min, 冷却后用水稀释至5 mL, 在紫外分光光度计540 nm波长下比色, 以不加CsPG1蛋白作对照, 记录其A值。平行测定3次取其平均值在标准曲线上查出反应液中相当于D-半乳糖醛酸的毫克数。一个酶活性单位定义为在标准反应条件下(pH 5.0, 50℃, 反应30 min), 每分钟释放1 μg D-半乳糖醛酸所需要的酶量。
取嘉陵40红色转为紫色的桑椹分为相等数量的试验组和对照组, 试验组用毛笔刷沾取复性后的CsPG1蛋白液, 均匀地涂于桑椹的表面, 5 min后用吹风机在冷风下吹干, 以沾取缓冲液的为对照组。两组在相同条件下, 经0、12和24 h观察桑椹颜色的变化。手握探头直径为2 mm的果实硬度计, 使硬度计垂直于桑椹表面, 探头均匀压入桑椹内, 此时驱动指针开始驱动, 指示指针同步旋转, 当探头压到的深度为3 mm处停止[24], 指示针指示的读数即为桑椹的硬度, 取3次平均值。试验组和对照组均3次重复。
2 结果与分析
2.1CsPG家族基因的鉴定与生物信息学分析
利用生物信息学方法从Sclerotinia sclerotiorum数据库筛选得到了6个CsPG相关基因, 其登录号分别为AF501307.1、AF501308.1、AY496277.1、AY312510.1、AY312511.1、AY312512.1。根据生物信息学分析结果, 我们从果C. shiraian菌核的cDNA进行CsPG家族基因克隆, 试验结果如图1所示, 进而预测CsPG家族基因的序列特征, 结果如表2所示。
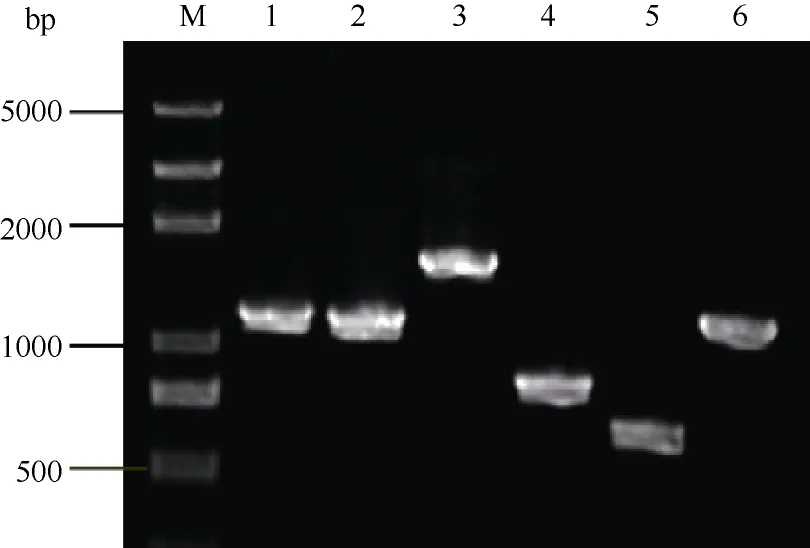
图1 CsPG家族基因cDNA电泳鉴定图Fig. 1 Agarose gel electrophoresis of CsPG gene family cDNA products

表2 CsPG家族基因的序列特征预测Table 2 Characteristics of the predicted CsPG gene family
2.2CsPG家族基因的表达及主效基因的确定
从Sclerotinia sclerotiorum数据库获得的CsPG家族基因, 经qRT-PCR数据分析, 发现AF501307.1随着侵染时间的增加而表达量逐渐减少, 但C. shiraian在不同生长阶段(图2, A~C)及菌丝侵染油菜的不同时间(图2, D-H), 其表达量均高于其他5个基因; AF501308.1和AY312510.1在C. shiraian不同的生长阶段及其菌丝侵染油菜不同的时间表达量均较低, AY496277.1、AY312511.1和AY312512.1的表达量均偏低(图3)。以β-tubulin内参基因作对照, C. shiraian的菌丝侵染油菜, 第1天侵染病斑不大, 但AF501307.1的CsPG表达量是对照的12倍; 第2天侵染病斑的面积是第1天的5倍, 但CsPG表达量
是对照的6倍, 为第1天表达量的50%, 第3天、第4天、第5天的CsPG表达量逐渐减少, 油菜叶片全部被感染时的表达量是对照的2倍。以上结果表明, C. shiraian在不同的生长阶段以及菌丝侵染油菜不同的时间中, AF501307.1的表达量均很高。参照Lü等[17]果桑肥大性菌核病菌纤维素酶主效基因的确定, 我们认为, AF501307.1是CsPG家族的主效基因。

图2 C. shiraiana各个生长阶段及其菌丝侵染油菜叶片(中双10号)的情况Fig. 2 Different development stages of C. shiraiana and the results of the myphae infection of rape leaf (Zhongshuang 10)

图3 CsPG基因家族的表达Fig. 3 Relative expression level of CsPG gene family
2.3CsPG1序列的获得与编码蛋白理化性质分析
以C. shiraian菌核的cDNA为模板, 通过RT-PCR扩增, 获得了大约1000 bp的条带。将该片段克隆到pMD19-T simple vector载体上, 测序结果表明, 该序列全长1143 bp, 含一个开放阅读框(ORF),编码一个由380个氨基酸残基组成的蛋白质(图4)。在线软件预测该蛋白质的分子量37.72 kD, 理论等电点为6.93, 分子式C1638H2634N448O55S9, 带负电荷残基
24个, 带正电荷残基24个, 平均亲水性(GRAVY) 0.139, 不稳定指数为21.54, 推测该蛋白属于稳定蛋白。将该cDNA及其推导的氨基酸序列在NCBI网站上进行Blast比对, 表明该cDNA及其推导的氨基酸序列与已报道的PG基因及其推导的氨基酸的序列同源性最高。分析结果表明, 本研究所克隆片段为C. shiraian的PG基因, 将其命名为CsPG1, 并提交给GenBank, 获得登录号为KR296662。蛋白质疏水性分析表明, 疏水性最大值为2.633, 最小值为–2.400, 而就整体来看, 疏水性氨基酸均匀分布在整个肽链中,且多于亲水性氨基酸。因此, 整个多肽链表现为疏水性, 没有明显的亲水区域。预测分析发现存在2个糖基化位点, 分别在蛋白序列中第314位和第361位处,其中第361位是天冬氨酸N-糖基化位点。

图4 CsPG1 cDNA的核苷酸序列及推导的氨基酸序列Fig. 4 Nucleotide sequence and deduced amino acid sequence of CsPG1 cDNA
2.4CsPG1编码氨基酸序列比对及分子进化关系分析
利用BlastP在NCBI上进行比对, 利用MEGA4.0构建系统进化树(图5), 结果表明, PG在整体上是趋异进化, 进化树总体上是根据物种类型而聚类, 明显地划分为细菌PG、真菌PG和植物PG类, 细菌PG位于树的基部, 在进化地位上是最原始的类型, 其次是真菌和植物PG, 结果符合生物起源进化的特证。CsPG1与Botryotinia fuckeliana (灰葡萄孢霉)的PG基因有100%的同源性, 与Saccharomyces cerevisiae (酿酒酵母)、Aspergillus flavus (黄曲霉)、Penicillium digitatum (绿霉菌)、Aspergillus aculeatus (棘孢曲霉)、Penicillium expansum (青霉菌等真菌)的物种进化同源性较近。而与Plant PGs和Bacterial PGs等物种进化同源性较远。

图5 基于NJ法构建的CsPG1氨基酸序列系统进化树Fig. 5 Phylogenic tree of CsPG1 amino acid sequence by Neighbor-Joining method
2.5CsPG1原核表达载体的构建和重组子鉴定
以CsPG1-EF和CsPG1-HR为引物, 克隆到一条大约1000 bp的条带(图6, 泳道1), 目的片段和pET28a(+)分别经EcoR I和Hind III双酶切后, 连接转化大肠杆菌, 挑选阳性克隆, 提质粒检测(图6, 泳道2), 经EcoR I和Hind III对阳性质粒pET28a-CsPG1双酶切鉴定, 分别在1000 bp和5000 bp处出现2条亮带(图6, 泳道3)。表明CsPG1基因原核表达载体pET28a-CsPG1构建成功。

图6 pET28a-CsPG1双酶切鉴定图Fig. 6 Agarose gel electrophoresis of the double enzyme digestion of pET28a-CsPG1
2.6CsPG1在大肠杆菌BL21中的异源表达
将重组表达载体pET28a-CsPG1转化大肠杆菌BL21 (DE3)进行异源表达, 同时以含有pET28a(+)空载体的菌株作为对照。经0.4 mmol L–1IPTG诱导表达后, 进行SDS-PAGE分析, 融合蛋白产生了一条约37.7 kD的特异蛋白条带, 与理论分子质量一
致(图7)。28℃、200 r min–1的诱导条件下, 目的蛋白2 h后即高效表达且5 h后表达量最高。诱导后大肠杆菌BL21 (DE3)菌液超声波破碎后, 经SDSPAGE分别电泳检测上清液和沉淀(图8, 泳道1、2),结果表明, 上清液中没有目的蛋白, 沉淀中的目的蛋白以包涵体形式存在。
2.7CsPG1包涵体的复性和纯化
依次使用不同浓度尿素(2、4、6和8 mol L–1)的缓冲液溶解包涵体, 经SDS-PAGE分析, 使用6 mol L–1的尿素浓度的溶解效果最好(图8, 泳道3~6)。经Ni+离子亲和层析后可纯化得到单一条带(图8, 泳道8)。采用Bradford法测定重组蛋白浓度, 标准曲线方程y = 2.0389x+0.443, R2=0.9977, 线性范围0.2~1.2 μg。以6 mol L–1的尿素缓冲液溶解包涵体,测定全蛋白含量为6.57 μg μL–1。利用梯度稀释法对上清液进行复性, 并且测定复性后PG的活性。D-半乳糖醛酸标准曲线公式y = 1.6097x–0.0052, R2= 0.9995, 线性范围0~0.8 mg。从图9可以看出,当稀释倍数超过100倍后, 酶活力基本保持稳定,达到33 U m L–1以上, 此时酶的比活力为5.02 U mg–1, 说明采用尿素溶解结合缓慢稀释复性方法,对重组CsPG1包涵体复性是成功的。
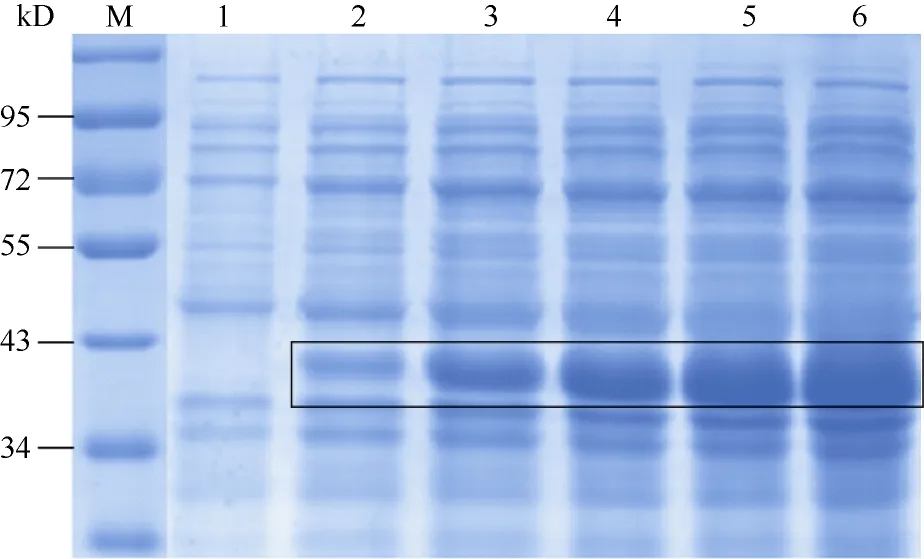
图7 重组CsPG1蛋白表达产物SDS-PAGE分析Fig. 7 SDS-PAGE analysis of the expressed product of recombinant CsPG1

图8 重组CsPG1蛋白表达产物SDS-PAGE分析Fig. 8 SDS-PAGE analysis of the expressed product of recombinant CsPG1
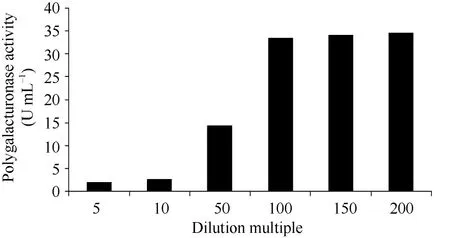
图9 重组CsPG包涵体复性效果Fig. 9 Renaturation of recombinant CsPG
2.8CsPG1蛋白功能验证
试验结果表明, 对照组0 h时, 颜色为紫红色, 12 h时紫红色, 24 h为紫黑色, 桑椹的颗粒饱满(图10); 试验组0 h时颜色为紫红色, 12 h后为紫黑色, 24 h后为黑色, 桑椹由饱满变为干瘪(图10)。硬度测定结果表明, 12 h时, 试验组比对照组降低了29.3%, 24 h时试验组比对照组降低了51.2% (图11), 试验组对桑椹的软化程度远远大于对照组。
3 讨论
本研究从Sclerotinia sclerotiorum数据库中, 经比对分析, 鉴定出CsPG基因家族中6个基因, 分别为AF501307.1、AF501308.1、AY496277.1、AY3125 10.1、AY312511.1、AY312512.1。利用qRT-PCR分析, 发现AF501307.1的表达量与对照进行比较, 其表达量为最高, 为此, 我们认为它是CsPG基因家族中的主效基因, 命名为CsPG1。进一步采用RT-PCR 从C. shiraian菌核中扩增CsPG1基因cDNA, 经分析
CsPG1的开放阅读框全长1143 bp, 编码380个氨基酸残基, 将CsPG1序列提交GenBank, 获得登录号为KR296662。CsPG1蛋白分子量37.72 kD, 等电点为6.93, 信号肽为N端20个氨基酸残基, 具有2个潜在的N-糖基化位点, 具有自身保守的半胱氨酸(Cys)残基位点。PG序列比对结果表明, CsPG1与Botryotinia fuckeliana的PG基因具100%的同源性, 与Saccharomyces cerevisiae、Aspergillus flavus、Penicillium digitatum、Aspergillus aculeatus、Penicillium expansum等真菌PG的物种进化同源性较近。而与植物PG和细菌PG等物种进化同源性较远。

图10 CsPG1作用于嘉陵40桑椹的不同时间效果Fig. 10 Effects of CsPG1 act on Jialing 40 mulberry at different time

图11 嘉陵40桑椹不同时间硬度的测定Fig. 11 Jialing 40 mulberry hardness measured at different time
C. shiraian的菌丝侵染油菜第2天侵染病斑面积是第1天的5倍, 但CsPG1的表达量只有第1天的50%。同样在Zafer等[25]的研究中, 核盘菌侵染同一片油菜叶片时, 发现高水平的SsPG1表达量在侵染边缘的损伤部位而不是在坏死或无症状的区域。同时在胡萝卜[26]和向日葵子叶[27]等中SsPg1的表达均在16 h, 继续增加到36 h达到最大值。在感染的大豆叶子[28], SsPg1表达量被发现在8 h, 在16 h表达量达到了最高。由于菌丝刚侵染油菜的致病力比较强,营养丰富, 酶活性较高, CsPG1可以分解果胶中的多聚半乳糖醛酸为半乳糖醛酸的小分子。Lumsden等[29]发现了黏性的还原型PGs在接种豆类植物后的12 h出现酶活性, 接种24 h后其酶活性达到一个高峰,此时高峰的出现是因为对胶质多聚体降解作用, 而后酶活性逐渐下降, 直到形成明显的侵染斑, 另一个还原活性高峰出现。
本试验克隆到的聚半乳糖醛酸酶基因, 虽然在大肠杆菌中得到表达, 但超声波破碎后, 通过SDS-PAGE检测破碎液上清液, 未发现聚半乳糖醛酸酶, 而沉淀中的聚半乳糖醛酸酶没有活性。对异源高效表达的聚半乳糖醛酸酶(CsPG1)包涵体的重折叠, 本文摸索出了包涵体溶解缓冲液用2、4、6 和8 mol L–1的不同尿素的浓度来溶解包涵体, 试验结果表明, 6 mol L–1的尿素溶解的效果最好, 用包涵体溶解缓冲液处理包涵体时, 尿素能很好地使CsPG1蛋白变性, 有效破坏非共价键结合的蛋白质,大大提高蛋白质的可溶性, β-巯基乙醇用于二硫键的还原, 用于保护CsPG1蛋白中自由的半胱氨酸巯基之间不会错误形成二硫键。包涵体在37℃摇床温育30 min, 使CsPG1蛋白得到了充分的溶解。复性后的包涵体离心后, 上清液中缓慢加入稀释复性缓冲液, 每次保证在较低的浓度下进行, 并且每次添加复性缓冲液时, 间隔足够的时间(1 h), 能使添加的变性蛋白在复性过程中, 越过易于形成蛋白聚集体的折叠中间体, 从而可以提高复性率。分别稀释5、10、50、100、150和200倍, 稀释酶液在4℃静置1 h进行充分复性, 0.4 mol L–1L-Arg具有抑制分子间作用, 降低聚集体生成速度, 有助于增加复性中间产物的溶解度。甘油具有稳定天然蛋白质的结构, 促进正确折叠产物的生成, 复性后的多聚半乳糖醛酸酶的比活力为5.02 U mg–1。
在桑椹成熟过程中, 原果胶不断降解为可溶性果胶, 即多聚半乳糖醛酸酶不断将聚半乳糖醛酸分
解为半乳糖醛酸, 细胞结构随之受损, 胞间层电子密度降低, 并且随着微纤维丝间果胶和纤维素物质的溶解, 微纤维丝结构变得松弛而软化, 细胞壁变薄, 大量细胞壁结构消失, 细胞变圆且趋于分散,果肉硬度随之下降[30]。桑椹软化的过程伴随着颜色的变化由红色变为紫红色, 变为紫黑色, 最后变为黑色。当桑椹表面均匀地涂抹复性后的CsPG1蛋白液后, 试验组的桑椹颜色比对照组更快变深, 很快变成黑色, 同时测定桑椹的硬度, 12 h时, 试验组比对照组降低了29.3%, 24 h时试验组比对照组降低了51.2%。表明该基因表达的蛋白能够促使桑椹细胞壁中的原果胶快速降解为可溶性果胶, 而有利果桑肥大性菌核病菌丝的侵染。
4 结论
鉴定出PG的基因家族共有6个基因, AF501307.1 是CsPG基因家族的主效基因, 命名为CsPG1。构建原核表达载体, 实现了该基因编码蛋白在大肠杆菌内的高效表达。经SDS-PAGE检测为包涵体, 经过缓慢稀释低温复性获得了可溶性CsPG1蛋白。该蛋白能够加速桑椹的颜色变深和软化, 推测CsPG1蛋白有利于果桑肥大性菌核病菌丝对桑椹的侵染。
References
[1] Cook B J, Clay R P, Bergmann C W, Albersheim P, Darvill A G. Fungal polygalacturonase exhibit different substrate degradation patterns and differ in their susceptibilities to polygalacturonase inhibiting proteins. Appl Environ Microbiol, 1999, 65: 1596–1602
[2] Alkorta I, Garbisu C, Llama M, Serra L J. Industrial applications of pectic enzymes: a review. Proc Biochem, 1998, 33: 21–28
[3] Hamann T. Plant cell wall integrity maintenance as an essential component of biotic stress response mechanisms. Front Plant Sci, 2012, 3: 77–82
[4] Esquerre Tugaye M T, Boudard G, Dumas B. Cell wall degrading enzymes, inhibitory proteins, and oligosaccharides participate in the molecular dialogue between plants and pathogens. Plant Physiol Biochem, 2000, 38: 157–163
[5] Claudia M, Giuliano D, Giulia D, Vittorio V. Doriano L. Isolation heterologous expression and characterization of an endopolygalactumnase produced by the phytopathogen Burkholderia cepacia. Protein Expres Pufif, 2007, 54: 300–308
[6] Dellapenna D, Lashbrook C C, Toenjes K, Giovannoni J J, Fischer R L, Bennett A B. Polygalacturonase isozymes and pectin depolymerization in transgenic rin tomato fruit. Plant Physiol, 1990, 94: 1882–1886
[7] Ali Z M, Chin L H, Lazan H. A comparative study on wall degrading enzymes, pectin modifications and softening during ripening of selected tropical fruits. Plant Sci, 2004, 167: 317–327
[8] Choi J H, Seongkoo L. Pectic substances associated with woolliness of peaches. J Korean Soc Hort Sci, 1999, 40: 574–576
[9] Bonghi C, Pagni S, Vidrih R. Cell wall hydrolases and amylase in kiwifruit softening. Postharvest Biol Technol, 1997, 9: 19–29
[10] Huber D J, Ódonoghue E M. Polyuronides in avocado and tomato fruits exhibit markedly different patterns of molecular weight downshifts during ripening. Plant Physiolol, 1993,102: 473–480
[11] Kutsunai S Y, Lin A C, Percival F W, Laties G G, Christoffersen R E. Ripeningrelated polygalacturonase cDNA from avocado. Plant Physiol, 1993, 103: 289–290
[12] Huber D J. Strawberry fruit softening: the potential roles of polyuronides and hemicellulose. J Food Sci, 2000, 49: 1310–1315
[13] Villarreal N M, Rosli H G, Maroinez G A, Civello P M. Polygalacturonase activity and expression of related genes during ripening of strawberry cultivars with contrasting fruit firmness. Postharvest Biol Technol, 2008, 47: 141–150
[14] Bonghi C, Rascio N, Ramina A, Casadoro G. Cellulase and polygalacturonase involvement in the abscission of leaf and explants of peach. Plant Mol Biol, 1992, 20: 839–848
[15] Meakin P J, Roberts J A. Anatomical and biochemical changes associated with the induction of oilseed rape pod dehiscence by Dasineura brassicae. Ann Bot, 1991, 67: 193–197
[16] Pressey R. Polygalacturonase in tree pollens. Phytochemistry, 1991, 30: 1753–1755
[17] Lü R H, Zhao A H, Li J, Liu C Y, Wang C H, Wang X L, Wang X H, Pei R C, Lu C, Yu M D. Screening, cloning and expression analysis of a cellulase derived from the causative agent of hypertrophy sorosis scleroteniosis Ciboria shiraiana. Gene, 2015, 565: 221–227
[18] 方中达. 植病研究方法. 北京: 中国农业出版社, 1998. pp 123–124 Fang Z D. Research Methods in Phytopathology. Beijing: China Agriculture Press, 1998. pp 123–124 (in Chinese)
[19] 吕蕊花, 金筱耘, 赵爱春, 吉洁, 刘长英, 李军, 蒲龙, 鲁成,余茂德. 果桑肥大性菌核病菌和油菜菌核病菌的交叉侵染、生物学特性及遗传关系. 作物学报, 2015, 41: 42–48
Lü R H, Jin X Y, Zhao A C, Ji J, Liu C Y, Li J, Pu L, Lu C, Yu M D. Cross infection, biological characteristics and genetic relationship between pathogens of hypertrophy sorosis sclerotenisis from mulberry and sclerotinia stem rot from oilseed rape. Acta Agron Sin, 2015, 41: 42–48 (in Chinese with English abstract)
[20] Livak K J, Schmittgen T D. Analysis of relative gene expression data using realtime quantitative PCR and the 2(-delta delta C(T)) method. Methods, 2001, 25, 402–408
[21] Schoner R G, Ellis L F, Schoner B E. Isolation and purification of protein granules from Escherichia coli cells overproducing bovine growth hormone. Nat Biotechno1, 1985, 3: 151–154
[22] Marston F A O, Lowe P A, Doel M T. Purfication of calf prochymosin (prorennin) synthesize in Eschesized coli. Nat Biothechnol, 1984, 2: 800–804
[23] Lindsay H. A colorimetric estimation of reducing sugars in potatoes with 3,5-dinitrosalicylic acid. Potato Res, 1973, 16: 176–179
[24] Liu C Y, Zhao A C, Zhu P P, Li J, Han L, Wang X L, Fan W, Lü R H, Wang C H, Wang X H, Lu C, Yu M D. Characterization and expression of Genes involved in the ethylene biosynthesis and signal transduction during ripening of mulberry fruit. PloS One, 2015, 10: e0122081
[25] Zafer D B, Roger R, George G, Khachatourians D, Hegedus D.
Factors governing the regulation of Sclerotinia sclerotiorum cutinase A and polygalacturonase during different stages of infection. Can J Microbiol, 2012, 58: 605–616
[26] Kasza Z, Vagvölgyi C, Fèvre M, Cotton P. Molecular characterization and in planta detection of Sclerotinia sclerotiorum endopolygalacturonase genes. Curr Microbiol, 2004, 48: 208–213
[27] Cotton P, Rascle C, Fevre M. Characterization of PG2, an early endoPG produced by Sclerotinia sclerotiorum, expressed in yeast. FEMS Microbiol Lett, 2002, 213: 239–244
[28] Sella L, Tomassini A, Ovidio R D, Favaron F. Expression of two Sclerotinia sclerotiorum endoPG genes correlates with endopolygalacturonase activity during Glycine max colonization. J Plant Pathol, 2005, 87: 199–205
[29] Lumsden D. Pectolytic enzymes of Sclerotinia sclerotiorum and their location in infected bean. Can J Bot, 1976, 54: 2630–2641
[30] Dawson D W, Melton L D, Watkins C B. Cell wall changes in nectarines: solubilization and depolymentation of pectic and neutral polyments during ripening and in mealy fruit. Plant Physiol, 1992, 100: 1203–1210
URL: http://www.cnki.net/kcms/detail/11.1809.S.20151008.1403.024.html
Cloning and Functional Analysis of Polygalacturonase Genes from Ciboria shiraiana
LI Meng-Jiao, LÜ Rui-Hua, YU Jian, CAI Yu-Xiang, WANG Chuan-Hong, ZHAO Ai-Chun, LU Cheng, and YU Mao-De*
College of Biotechnology, Southwest University, Chongqing 400715, China
Abstract:Polygalacturonase (PG) is a kind of cell wall structural proteins that can catalyes the decompocition of alpha-(1,4)-polymer of galacturonia acid, which makes the cell wall structure disintegration and fruit softening. In the paper, we analyzed the expression patterns of PG genes in the leaf infection by the hypha of C. shiraiana at different growth stages by using qRT-PCR methods. The results showed that the cDNA of CsPG1 gene was amplified from the sclerotia of C. shiraiana by RT-PCR, namely CsPG1 (GenBank accession number: KR296662) with 1143 bp of full length, encoding 380 amino acid residues. On the basis of the highest level of gene expression in the process of infecting rape leaf, the main gene of the CsPG gene family was confirmed. CsPG1 was cloned into pET-28a(+) vector and expressed in E. coli BL21 (DE3). The recombinant CsPG1 protein was expressed in the form of inclusion bodies without activity towards polygalaturonic acid. The optimal urea concentration for dissolving CsPG1 inclusion bodies was 6 mol L–1, CsPG1was renaturated by dilution gradiently at low temperature. We sorted out single band after purified by High-Affinity Ni-NTA Resin, and obtained soluble protein. The specific activity of renatured CsPG1 was 5.02 U mg–1. The result of biological test showed that the recombinant protein accelerated the fruit maturity and softening of Jialing 40 (Morus atropurpurea Roxb.). Therefor, we speculated that the CsPG1 protein is related to the infection of C. shiraiana to mulberry fruits. The result reveals the sensitivity difference among mulberry varieties to sclerotial disease, providing the
molecular evidence for preventing and controlling the sclerotial disease in mulberry cultivation.
Keywords:Mulberry; Ciboria shiraiana; CsPG1; Protein expression activity
收稿日期Received(): 2015-06-11; Accepted(接受日期): 2015-09-06; Published online(网络出版日期): 2015-10-08.
通讯作者*(Corresponding author): 余茂德, E-mail: yumd@163.com, Tel: 023-68250191
DOI:10.3724/SP.J.1006.2016.00190
