棉花GhHMGR基因在胚珠生长发育过程中的功能
2016-03-03马富磊李德谋杨卫娟罗小英
马富磊 李德谋 李 志 杨卫娟 周 雪 游 宇 罗小英
西南大学生物技术中心 / 农业部生物技术与作物品质改良重点开放实验室 / 重庆市农业生物技术重点实验室, 重庆400716
棉花GhHMGR基因在胚珠生长发育过程中的功能
马富磊李德谋李志杨卫娟周雪游宇罗小英*
西南大学生物技术中心 / 农业部生物技术与作物品质改良重点开放实验室 / 重庆市农业生物技术重点实验室, 重庆400716
摘要:采用植物基因工程技术, 选用CaMV35S组成型启动子驱动棉花3-羟基-3-甲基-戊二酰辅酶A还原酶基因GhHMGR在棉花中表达, 检测10 DPA (days post anthesis)棉花胚珠内HMGR (3-hydroxy-3-methylglutaryl coenzyme A reductase)酶及可溶性糖、脂质及蛋白质含量, 同时进行了胚珠离体培养。结果显示, GhHMGR在棉花光照部位(叶柄和铃壳)表达量相对较高, 非光照部位(根及胚珠)表达量低; 超量表达GhHMGR可部分恢复拟南芥hmgr突变体性状;相较野生型, 超量表达株系10 DPA胚珠的HMGR含量升高, 反义株系则降低; 且超量表达株系总脂质及蛋白含量升高, 可溶性总糖含量降低, 反义株系则出现相反结果; HMGR竞争性抑制剂洛伐他汀处理会导致胚珠发育畸形。以上结果表明, GhHMGR基因在棉花胚珠生长发育过程中扮演重要角色。
关键词:棉花; GhHMGR; 胚珠; HMGR
本研究由国家自然科学基金项目(31171596)和中央高校基本科研业务费项目(XDJK2014C067, XDJK2014D041)资助。
This study was supported by the National Natural Science Foundation of China (31171596) and the Fundamental Research Funds for the Central Universities (XDJK2014C067, XDJK2014D041).
第一作者联系方式: E-mail: stickler911@163.com
棉花是重要的经济作物, 其纤维是世界上最重要的天然纤维之一, 我国已成为世界上最大的棉花消费国和净进口国[1]。棉铃是整个棉花植株的主要器官, 由铃壳、种子和纤维组成。棉花纤维即种子表皮毛, 其所含纤维素占成熟棉纤维干重的95%以上[2]。棉铃体积的增大在根本上由种子表皮细胞面积的增加来决定。
3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)是甲羟戊酸(MVA)途径中的第一个限速酶[3]。MVA途径被认为是所有三大生命领域(细菌、原生生物、真
核生物)的最原始次级代谢产物合成途径[4], 该途径主要发生在胞质中。HMGR是一种疏水性膜蛋白,实验证明其主要定位在内质网膜上, 含4个亚基, 即N-末端、跨膜区、连接区和C-末端区[5]。具有催化活性的C-末端区和跨膜区在各植物种中高度保守。HMGR作为甲羟戊酸代谢类异戊二烯化合物途径的重要调控点, 对“碳流”的分配调控起重要的作用[6],而类异戊二烯化合物通过调控早期细胞分裂和后期细胞伸长来决定果实最终大小。在快速生长的植物组织中, HMGR活性总是很高, 而成熟组织中的活性则相对较低[7]。据报道, 在番茄内组成型表达甜瓜HMGR基因可以显著增大番茄果实[8]。我们推测HMGR可能在棉花胚珠的细胞分裂分化及细胞伸长生长中发挥重要作用。本文研究棉花胚珠发育过程中HMGR的功能, 为通过基因工程手段提高棉花产量及品质等方面提供理论依据。
1 材料与方法
1.1试验材料
植物表达载体pLGN及根癌农杆菌菌株LBA4404由本实验室保存, 胭脂碱型菌株GV3101由美国康奈尔大学Leon Kochian实验室惠赠。转GhHMGR基因棉花及拟南芥所用的表达载体pBI121-PGhHMGR::GUS均由作者构建。
棉花的遗传转化受体材料冀棉14 (Gossypium hirstutum L.)受赠于河北农业大学马峙英教授; 拟南芥遗传转化受体材料背景为Columbia型, 购于Arabidopsis Biological Resource Center (ABRC)。
1.2棉花及拟南芥遗传转化方法
参照Luo等[9]的方法进行棉花的遗传转化; 采用浸花法[10]进行拟南芥遗传转化。
1.3GhHMGR基因的表达分析
采用EASY Spin植物RNA快速提取试剂盒提取棉花材料总mRNA, 反转录获得cDNA。以GhHIS为内标基因, 以获得的cDNA为模板进行实时定量PCR, 程序为95℃ 3 min; 95℃ 30 s, 56℃ 30 s, 72℃30 s, 40个循环; 72℃ 5 min。引物序列为GhHIS-F: 5'-GAAGCCTCATCGATACCGTC-3', GhHIS-R: 5'-C TACCACTACCATCATGGC-3; GhHMGR-F: 5'-CCTT GGAAACATCCTTGCTAGACC-3', GhHMGR-R: 5'-CTTCCATTGAGGTTGGCACTGTTG-3'。
1.410DPA胚珠内HMGR的提取及含量测定
参照Bradford[11]、Ge和Wu[12]的方法提取HMGR及测定含量。
1.5胚珠离体培养
参照Beasley和Ting的方法[13-14]离体培养棉花胚珠。
1.610DPA胚珠内三类物质提取及测定分析
参照《现代植物生理学实验指南》[15]提取及测定可溶性糖。取适量新鲜植物材料(约1.5~3.0 g), 110℃杀青处理15 min, 37℃烘干; 用球磨机将烘干材料磨成细粉, 过筛(80目)后用滤纸包裹置密闭容器中进行水分平衡3~4 d, 转移样品粉末至指形管, 置近红外仪NIRFIex N-500测定总脂质、总蛋白含量。
2 结果与分析
2.1GhHMGR基因的表达模式分析
2.1.1GhHMGR及其启动子序列的克隆及同源性分析克隆了棉花GhHMGR基因, ORF长1758 bp,编码585个氨基酸, 理论分子量为62.7 kD, pI 5.99。用(DNAMAN 6.0.3.99)软件进行序列比对, 发现GhHMGR蛋白与龙眼、荔枝、可可、椴树、毛白杨和拟南芥的HMGR蛋白同源性较高(图1), 与龙眼HMGR相似性100%, 一致性79%; 与荔枝HMGR相似性97%, 一致性77%; 与可可HMGR相似性100%,一致性89%; 与椴树HMGR相似性为100%, 一致性86%; 与拟南芥HMGR相似性65%, 一致性75%。
系统进化树分析发现, 棉花HMGR与龙眼、荔枝、可可、椴树和毛白杨HMGR有较近的亲缘关系,而与拟南芥HMGR亲缘关系较远(图2)。
根据已公布雷蒙德氏棉基因组序列, 扩增获得了该基因的启动子序列PGhHMGR。在PlantCARE网站分析发现该启动子不仅包含大量转录起始位点(TATA-box), 转录增强子(CAAT-box), 还含有大量光反应、激素反应、组织特异表达、胁迫反应和转录结合位点等相关顺式作用元件(表1)。
2.1.2GhHMGR在棉花中的表达模式对野生型棉花中GhHMGR基因的表达分析发现其在棉花的根、胚珠等非光照部位中表达量相对较低, 而叶柄和铃壳等光照部位表达量相对较高(图3)。在胚珠不同发育时期, 其GhHMGR表达量随开花天数的增加而增高, 在10 DPA时达到最高(图4)。纤维中GhHMGR基因表达量总体随着开花天数增加而增高(图5)。对转基因植株暗处理后检测叶片中GhHMGR表达量发现(图6), 随处理时间的延长GhHMGR的表达量急剧下降, 推测光照是GhHMGR表达的必要条件。
2.1.3PGhHMGR::GUS转基因拟南芥组织化学染色分
析以pBI121-PGhHMGR::GUS表达载体转化拟南芥, T2代拟南芥纯合子组织化学染色结果显示(图7)该启动子主要在拟南芥莲座叶中央、花序起始部位及角果基部表达, 果柄上部也检测到GUS基因表达信号。

图1 棉花GhHMGR蛋白与其他物种HMGR蛋白的序列比对Fig. 1 Comparison of cotton GhHMGR and other species HMGR protein

表1 PGhHMGR存在的顺式作用元件Table 1 cis-acting element of PGhHMGR
2.2棉花遗传转化及转基因棉花的获得
将GhHMGR表达载体转入棉花, 筛选获得超量表达与反义抑制的转基因T0代植株共138株。其中超量表达量上调较显著的6个株系, 即35S-9-1、35S-25-2、35S-25-6、35S-26-1、35S-26-2、35S-8-2;反义抑制棉花植株中筛选出35S-5-1 (anti)、35S-9-1 (anti)、35S-12-1 (anti) 3个株系(图8)。

图2 GhHMGR蛋白与其他物种HMGR蛋白的系统进化分析Fig. 2 Phylogenetic analysis of GhHMGR protein in different species
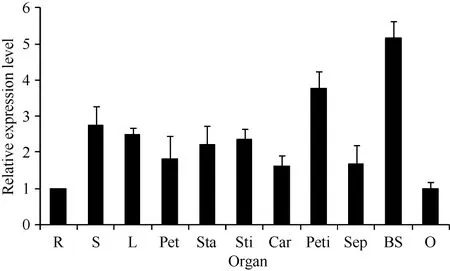
图3 棉花不同器官组织GhHMGR的表达水平Fig. 3 Relative expression level of GhHMGR in different tissues and organs

图4 不同时期胚珠GhHMGR的表达水平Fig. 4 Relative expression level of GhHMGR in developmental ovules

图5 不同时期纤维GhHMGR的表达分析Fig. 5 Relative expression level of GhHMGR in developmental fibers
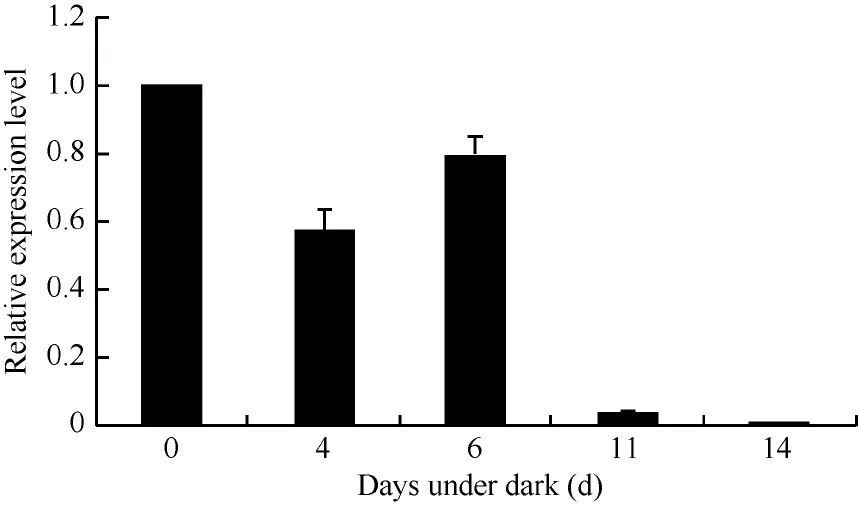
图6 暗处理不同天数后叶片GhHMGR表达分析Fig. 6 Relative expression level of GhHMGR in leaf under dark

图7 PGhHMGR::GUS在拟南芥T2代组织化学染色Fig. 7 Histochemical analysis of tissues in transgenic Arabidopsis expressing PGhHMGR::GUS
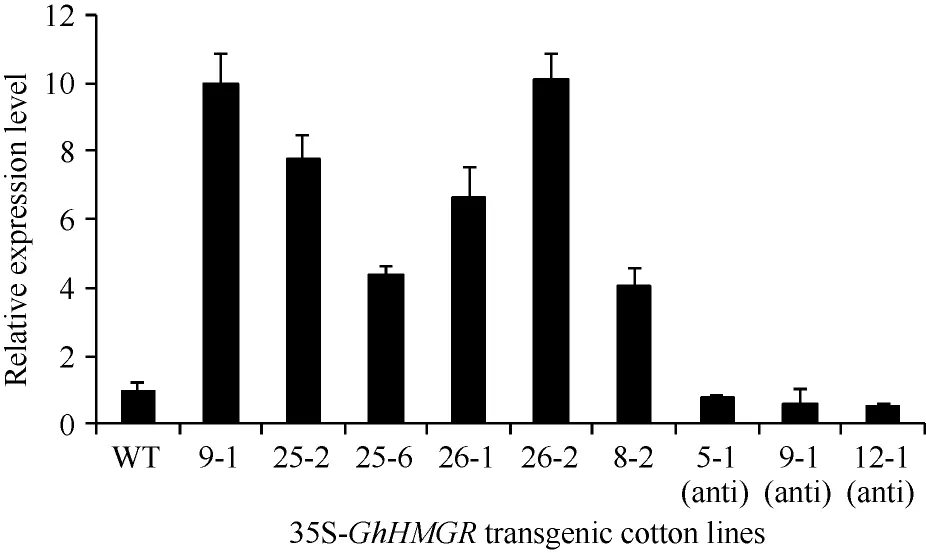
图8 35S-GhHMGR转基因株系表达量分析Fig. 8 Relative expression of 35S-GhHMGR in the ovule of control and transgenic cotton plants expressing GhHMGR gene
2.3hmgr拟南芥突变体的恢复
将筛选到的拟南芥hmgr纯合突变体再次种植, 用GhHMGR农杆菌菌液对其花序进行浸染转化, 相较于对照Col-0, hmgr纯合突变体的植株恢复正常,株高已恢复与Col-0型基本一致, 但长势孱弱, 且莲座叶、花序幼小(图9)。

图9 拟南芥hmgr突变体的恢复Fig. 9 GhHMGR functionally complemented hmgr mutant
2.410 DPA胚珠内HMGR含量测定
图10表明, WT胚珠HMGR含量为2.44 mg g–1,超量表达T0代株系9-1#、25-2#、26-1#、26-2#胚珠HMGR含量分别为2.54、4.75、3.72、2.64 mg g–1; 反义抑制T0代株系9-1#胚珠HMGR含量为1.95 mg g–1。相较WT, 超量表达T0代株系HMGR含量分别增加了4.28%、94.81%、52.82%、8.34%, 反义抑制T0代株系9-1#HMGR含量降低19.93%。可知GhHMGR基因调控决定了胚珠HMGR的含量。

图10 转基因株系和野生型株系胚珠(10 DPA) HMGR蛋白含量分析Fig. 10 Analysis of the HMGR content of transgenic and WT cotton ovule (10 DPA)
2.5胚珠离体培养
取转基因棉花开花当天的胚珠离体培养, 其培养基中分别加入10、20、50、100和200 μmol L–1的洛伐他汀, 32℃, 黑暗条件下培养10 d。结果显示, 20 μmol L–1及其以上浓度洛伐他汀条件下胚珠发育畸形, 纤维无法正常起始, 且其GhHMGR基因表达量随抑制剂浓度的增加呈上升趋势(图11), 推测原因是胚珠早期发育阶段, 抑制剂与HMGR的作用底物竞争性结合, 故棉花胚珠通过表达产生更多的HMGR来消除抑制剂带来的影响。
另外发现未添加抑制剂时, 超量表达转基因植株GhHMGR表达量是WT的8倍(图12), 且长势较WT好, 推测棉花胚珠通过超量表达GhHMGR基因来生成大量类异戊二烯物质, 满足胚珠早期发育需求, 从而使转基因棉花胚珠出现优势表型; 添加20 μmol L–1和50 μmol L–1抑制剂时, 超量表达GhHMGR基因的胚珠及纤维受到不同程度抑制而畸形(图12), GhHMGR基因的表达水平与上述的结果一致。
2.610DPA胚珠内三类物质的含量分析
表2表明,相较WT, T0代超量表达株系26-1#、8-2#可溶性总糖浓度分别下降了57.33%、60.99%, T0代反义抑制株系5-1#可溶性总糖浓度增加了48.3%; T0代超量表达株系26-1#、8-2#总脂质含量分别升高了19.94%、28.09%, 而T0代反义抑制株系则降低了4.52%; T0代超量表达株系26-1#、8-2#总蛋白含量分别升高24.23%、32.25%, T0代反义抑制株系则降低了6.31%。由此发现, GhHMGR促使可溶性糖转化为脂质及蛋白质。

表2 转基因株系和野生型(WT)株系胚珠(10 DPA)内三类物质含量Table 2 Contents of total sugar, oil, and protein of ovule (10 DPA) in transgenic and wild-type (WT) lines (mg g–1)
3 讨论
3.1GhHMGR同源性比对及其表达特性分析
序列比对分析显示, GhHMGR与龙眼、荔枝、可可、椴树、毛白杨、拟南芥等物种的HMGR蛋白具有较高的同源性。Xia等[16]发现荔枝LcHMGR通过调控早期细胞分裂和后期细胞分化对果实最终大小起决定性的作用, 快速生长的植物组织中, HMGR活性总是很高, 而成熟组织中的活性则相对较低。我们推测GhHMGR也应具有相似的功能。GhHMGR启动子顺式作用元件分析发现序列中存在大量的光反应元件, 且在棉花中的表达分析也发现光照是GhHMGR基因发挥其功能的必要条件。
3.2超量表达GhHMGR可恢复hmgr的部分突变表型
研究发现拟南芥AtHMGR突变后会使拟南芥植株矮小, 出现早衰、雄性不育等性状[17]。我们用GhHMGR超量表达转化拟南芥hmgr突变体植株,研究发现超量表达GhHMGR可恢复拟南芥hmgr突变体株高, 但植株长势依旧孱弱、叶片、花序幼小。说明棉花GhHMGR与AtHMGR生物学功能互补, 具
有决定株高以及育性的功能, 但无法完全恢复突变体的所有性状。
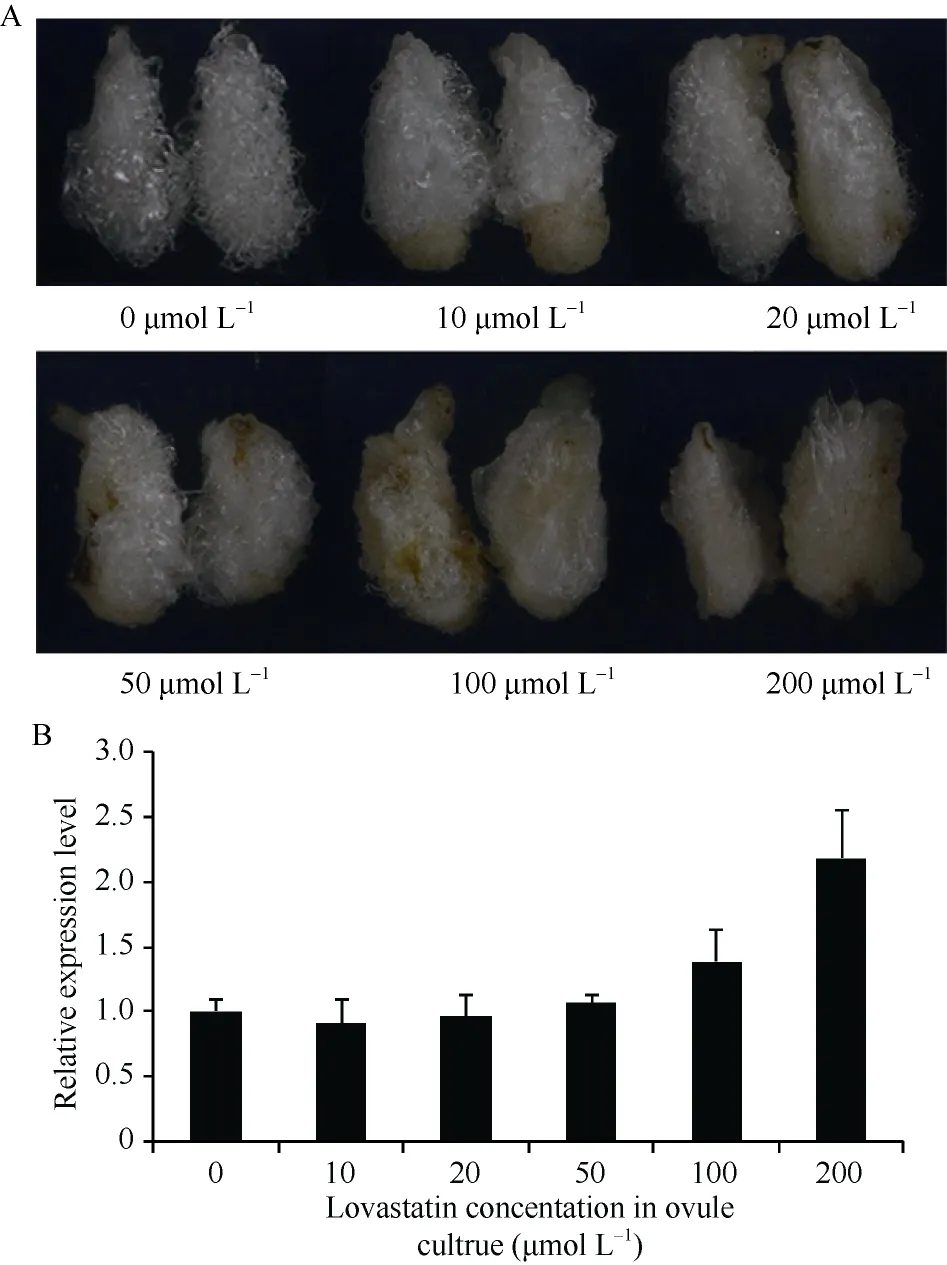
图11 胚珠离体培养及表达量分析Fig. 11 Ovule culture in vitro and relative expression level of GhHMGR
3.3GhHMGR基因严格调控胚珠内HMGR的表达
3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)是MVA途径中目前研究较多的一限速酶, 调控下游异戊二烯类化合物的生物合成及其分配流向。本文选取CaMV35S组成型启动子驱动GhHMGR基因在棉花植株中表达分析发现, 相较WT, 超量表达株系胚珠内的HMGR含量升高, 反义抑制株系胚珠内的HMGR含量降低。推测GhHMGR基因正调控HMGR的合成代谢, 但仍需进一步的研究来证明。
3.4HMGR受抑制剂专一性影响
洛伐他汀可抑制甲羟戊酸途径关键酶HMGR的活性[18], 胚珠离体培养结果发现, 超量表达株系胚珠及纤维发育较WT好, 且其胚珠对抑制剂也更敏感, 胚珠在20 μmol L–1以上洛伐他汀处理时出现畸形, 纤维发育不良。由此可见HMGR在棉花胚珠及纤维发育过程中不可或缺。但洛伐他汀抑制剂如何通过抑制HMGR来促使转基因胚珠的优势表达的作用机制仍不清楚, 仍需进一步的研究。

图12 胚珠离体培养(A)及表达量分析(B)Fig. 12 Ovule culture in virto (A) and relative expression level (B)
3.5GhHMGR可以促进可溶糖转化为蛋白及脂质
胚珠(10 DPA)三类物质的含量测定结果表明:相较WT, 超量表达株系可溶性总糖含量降低, 总脂质和蛋白含量升高; 而抑制株系则相反。结合以上结果推测, GhHMGR可以促进糖类物质转化为脂质或蛋白, 从而影响胚珠生长发育及种子的最终形成。与前人关于改变HMGR能够限制葡萄糖或丙酮酸在MVA途径中的代谢[19]这一研究结果相一致。但GhHMGR如何调控其下游代谢产物的产率及物质
相互间的分配转变比例还不清楚, 需进一步研究。
4 结论
光照是GhHMGR转基因表达的必要条件。GhHMGR启动子主要在拟南芥的花序、果柄基部表达。超量表达GhHMGR可部分恢复拟南芥hmgr突变体矮小、不育的表型。GhHMGR基因正调控决定胚珠HMGR含量。HMGR受抑制剂专一影响, 超量表达GhHMGR株系胚珠及纤维发育较WT好, 且其胚珠对抑制剂也更敏感。GhHMGR可促进胚珠内可溶性总糖类物质转化为蛋白及脂质而进一步影响胚珠及纤维的生长发育。综上可知, GhHMGR基因在棉花胚珠的生长发育过程中起着重要作用, 这也为我们结合基因工程手段进行作物育种带来了一种新思路。
References
[1] 杨红旗. 我国棉花生产现状与发展前景分析. 种子科技, 2010, (2): 5–6
Yang H Q. The analysis of cotton production and development prospect in China. Seeds Sci Technol, 2010, (2): 5–6
[2] Kim H J, Triplett B A. Cotton fiber growth in planta and in vitro Models for plant cell elongation and cell wall biogenesis. Plant Physiol, 2001, 127: 1361–1366
[3] Bach T J. Some new aspects of isoprenoid biosynthesis in plants—a review. Lipids, 1995, 30: 191–202
[4] Lombard J, Moreira D. Origins and early evolution of the mevalonate pathway of isoprenoid biosynthesis in the three domains of life. Mol Biol Evol, 2011, 28: 87–99
[5] Wang Y, Darnay B G, Rodwell V W. Identification of the principal catalytically important acidic residues of 3-hydroxy-3-metII-ylglutaryl coenzyme A reductase. J Biol Chem, 1990, 265: 21634–21641
[6] 陈大华, 叶和春, 李国凤, 刘彦. 植物类异戊二烯代谢途径的分子生物学研究进展. 植物学报, 2000, 42: 551–558
Chen D H, Ye H C, Li G F, Liu Y. Cloning and sequencing of HMGR gene of Solanum tubersosum and its expression pattern. Acta Bot Sin, 2000, 42: 724–727 (in Chinese with English abstract)
[7] Stermer B A, Bianchini G M, Korth K L. Regulation of HMGCoA reductase activity in plants. J Lipid Res, 1994, 35: 1133–1140
[8] Omura T, Watanabe S, Iijima Y, Aoki K, Shibata D, Ezura H. Molecular and genetic characterization of transgenic tomato expressing 3-hydroxy-3-methyl-glutaryl coenzyme A reductase. Plant Biotechnol, 2007, 24: 107–115
[9] Luo M, Xiao Y H, Li X B, Lu X F, Deng W, Li D M, Hou L, Hu M Y, Li Y, Pei Y. GhDET2, a steroid 5α-reductase, play an important role in cotton fiber cell initiation and elongation. Plant J, 2007, 51: 419–430
[10] Clough S J, Bent A F. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J, 1998, 16: 735–743
[11] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 1976, 72: 248–254
[12] Ge X, Wu J. Tanshinone production and isoprenoid pathways in Salvia miltiorrhiza hairy roots induced by Ag+and yeast elicitor. Plant Sci, 2005, 168: 487–491
[13] Beasley C, Ting I P. The effects of plant growth substances on in vitro fiber development from fertilized cotton ovules. Am J Bot, 1973, 130–139
[14] Beasley C A, Ting I P. Effects of plant growth substances on in vitro fiber development from unfertilized cotton ovules. Am J Bot, 1974, 61: 188–194
[15] 汤章城. 现代植物生理学实验指南. 北京: 科学出版社, 1999
Tang Z C. Modern Laboratory Manual of Plant Physiology. Beijing: Science Press, 1999 (in Chinese)
[16] Xia R, Li C Q, Lu W J, Du J, Wang Z H, Li J G. 3-hydroxy-3-methylglutaryl coenzyme A reductase 1 (HMG1 ) is highly associated with the cell division during the early stage of fruit development which determines the final fruit size in Litchi chinensis. Gene, 2012, 498: 28–35
[17] Suzuki M, Kamide Y, Nagata N, Seki H, Ohyama K, Kato H, Masuda K, Sato S, Kato T, Tabata S, Yoshida S, Muranaka T. Loss of function of 3-hydroxy-3-methylglutaryl coenzyme A reductase 1 (HMG1) in Arabidopsis leads to dwarfing, early senescence and male sterility, and reduced sterol levels. Plant J, 2004, 37: 750–761
[18] Bach T J, Lichtenthaler H K. Mevinolin: a highly specific inhibitor of microsomal 3-hydroxy-3-methylglutaryl-coenzyme A reductase of radish plants. Z Naturforsch, 1982, 37: 46–50
[19] Opitz S, Nes W D, Gershenzon J. Both methylerythritol phosphate and mevalonate pathways contribute to biosynthesis of each of the major isoprenoid classes in young cotton seedling. Phytochemistry, 2014, 98: 110–119
URL: http://www.cnki.net/kcms/detail/11.1809.S.20151008.1403.018.html
GhHMGR Gene Function in Ovule Development of Cotton (Gossypium hursutum L.)
MA Fu-Lei, LI De-Mou, LI Zhi, YANG Wei-Juan, ZHOU Xue, YOU Yu, and LUO Xiao-Ying*
Biotechnology Research Center of Southwest University / Key Laboratory of Biotechnology and Crop Quality Improvement, Ministry of Agriculture / Chongqing Key Laboratory of Agricultural Biotechnology, Chongqing 400716, China
Abstract:The constitutive promoter CaMV35S was selected to drive the expression of GhHMGR gene in cotton by using the plant genetic engineering technology. The HMGR contents of ovule (10 DPA) of transgenic lines were detected, and the contents of total sugar, oil and protein as well. Meanwhile, we also performed ovule culture in vitro. The results showed that the expression level of GhHMGR was higher in part organ under light, such as petiole and boll shell than in root and ovule in dark. The GhHMGR gene could partly recover Arabidopsis (Arabidopsis thaliana) hmgr mutant characteristics. Compared with wild-type (WT), the HMGR contents of ovule (10 DPA) in overexpression transgenic lines increased, whereas decreased in suppression expression lines. While the contents of total oil and protein of overexpression transgenic lines increased, and that of total sugar decreased. Meanwhile, the suppression expression lines performed in an opposite trend. The investigation of ovule culture in vitro showed that ovules became deformity after treated with the inhibitor. All of these implied that expression of GhHMGR gene plays a key role in the development of cotton ovule.
Keywords:Cotton (Gossypium hursutum L.); GhHMGR; Ovule; HMGR
收稿日期Received(): 2015-04-10; Accepted(接受日期): 2015-09-06; Published online(网络出版日期): 2015-10-08.
通讯作者*(Corresponding author): 罗小英, E-mail: luoxy@swu.edu.cn
DOI:10.3724/SP.J.1006.2016.00222
