转天麻抗真菌蛋白基因提高棉花对黄萎病抗性
2016-03-03肖松华刘剑光吴巧娟王义琴储成才俞敬忠喻德跃
肖松华 赵 君 刘剑光 吴巧娟 王义琴 储成才俞敬忠 喻德跃
1南京农业大学 / 作物遗传改良与种质创新国家重点实验室, 江苏南京210095;2江苏省农业科学院经济作物研究所, 江苏南京210014;3中国科学院遗传与发育生物学研究所, 北京100101
转天麻抗真菌蛋白基因提高棉花对黄萎病抗性
肖松华1,2赵君2刘剑光2吴巧娟2王义琴3储成才3俞敬忠1,*喻德跃1,*
1南京农业大学 / 作物遗传改良与种质创新国家重点实验室, 江苏南京210095;2江苏省农业科学院经济作物研究所, 江苏南京210014;3中国科学院遗传与发育生物学研究所, 北京100101
摘要:黄萎病是全球植棉业的主要病害, 严重缺乏抗黄萎病资源导致棉花抗黄萎病育种至今未取得显著进展。采用农杆菌介导法, 以下胚轴为受体, 将天麻抗真菌蛋白基因转化陆地棉品系苏研060, 通过愈伤组织诱导、胚性愈伤组织分化和植株再生, 获得大量再生苗。分别以NPT II基因、gafp基因、35S启动子-gafp基因特异引物对再生苗进行PCR检测, 将95个阳性再生苗嫁接到海7124幼苗砧木上, 获得37个成活植株。RT-PCR检测发现, 31个植株出现预期的540 bp扩增片段。盆栽花铃期花粉育性鉴定表明, 9个转基因植株雄性败育, 22个植株花粉育性正常, 通过人工自交得到T1代种子。通过转基因作物隔离区种植、特异引物PCR检测、卡那霉素抗性筛选、自交纯合与选择, 培育获得22个T3代转基因纯系。Southern blotting检测发现, 转基因植株体内有2个gafp基因拷贝。GAFP蛋白免疫印迹表明, 16个转基因纯系出现分子量为14 kD的GAFP蛋白, 另6个纯系表现出转录后水平上的基因沉默。黄萎病抗性鉴定结果证实, 获得3个抗落叶型黄萎病的棉花株系TG09、TG16和TG23。
关键词:棉花; 天麻; 抗真菌蛋白; 基因; 黄萎病; 抗性
本研究由国家转基因生物新品种培育重大专项(2014ZX08005), 国家高技术研究发展计划(863计划)项目(2012AA101108), 国家科技支撑计划项目(2013BAD01B03), 江苏省自然科学基金项目(BK20130699), 江苏省科技支撑计划项目(BE2013380)和江苏省农业科技自主创新资金项目[CX(13)2024]资助。
This study was supported by the Major Project of China on New Varieties of GMO Cultivation (2014ZX08005), the National High-tech R&D Program of China (863 Program) (2012AA101108), National Key Technology Research and Development Program of the Ministry of Science and Technology of China (2013BAD01B03), the Natural Science Fund of Jiangsu Province (BK20130699), the Science-technology Support Plan of Jiangsu Province (BE2013380) and the Independent Innovation Fund for Agricultural Science and Technology of Jiangsu Province [CX(13)2024].
第一作者联系方式: E-mail: njxsh@sina.com
黄萎病是棉花生产上的主要病害, 暴发年份严重地影响着棉花的产量和纤维品质。该病害自1935年伴随美棉的引进传入我国后, 在国内各产棉区逐渐扩散。20世纪90年代以来, 棉花黄萎病危害逐年加重, 一般年份发病面积约占全国植棉面积的50%,每年损失皮棉达7.5~10.0万吨, 直接经济损失16~ 20亿元[1]。尤其是2002—2003年黄萎病在全国各主产棉区暴发成灾, 重病田面积达300万公顷以上,损失皮棉20万吨以上, 直接经济损失超过40亿元,已经成为我国棉花生产实现高产稳产的主要障碍因素[2]。
采用病圃定向筛选, 未能在棉花抗黄萎病性状的改良上获得突破性进展[3]。通过种间杂交将海岛棉抗黄萎病性状转入陆地棉, 在中国、美国等国家育成一批黄萎病抗性有所提高的棉花新品种(系)[4-5],但海岛棉抗源品种海7124、Pima 90-53对强致病力落叶型黄萎病菌系表现感病[6]。棉花抗黄萎病育种进展缓慢的主要原因, 一是棉花黄萎病菌存在着多种生理小种的分化; 二是陆地棉中严重缺乏高抗黄萎病的种质资源。利用基因工程技术将外源抗真菌病害基因导入棉花, 为抗病育种提供了新的途径。国内外一些学者相继报道, 分别将几丁质酶基因(chitinase, Chi)、β-1,3-葡聚糖酶基因(β-1,3-glucanase, Glu)、葡萄糖氧化酶基因(glucose oxidase, Go)、萝卜抗真菌蛋白基因(Raphanus sativus antifungal proteins, Rs-AFPs)及几丁质酶与β-1,3-葡聚糖酶的融合基因导入陆地棉, 培育出一些对黄萎病具有抗性的转基因棉花新种质系[7-9]。
天麻抗真菌蛋白(gastrodia antifungal protein, GAFP)是从我国传统中草药天麻中分离到的一种具有广谱抗真菌活性的蛋白质, 对许多植物病原菌包括棉花黄萎病菌具有很强的抑制作用[10]。我国学者首先克隆了天麻抗真菌蛋白基因gafp[11], GenBank登录号为AF225410。王义琴等[12]采用花粉管通道法以CaMV35S启动子驱动的gafp基因转化彩色陆地棉, 通过病圃筛选和分子检测, 获得高抗枯斑型黄萎病的转gafp基因株系。陈大军等[13]利用落叶型黄萎病圃对这些转基因植株自交纯合后代进行抗病鉴定, 在10个供试的转gafp基因彩色棉品系中, 仅有2个品系对落叶型菌系的抗性达到抗级。采取花粉管通道法开展植物转基因研究, 存在着试验操作受人为因素和环境条件影响大、目的基因以随机方式整合到受体染色体组中导致多拷贝整合以及转基因植物后代遗传方式复杂等问题[14-15]。为了提高gafp基因在棉株体内的表达水平, 本研究通过对gafp基因植物表达载体的构建与优化, 采取农杆菌Ti质粒介导法转化陆地棉, 获得抗落叶型黄萎病的棉花新种质, 缓解了目前我国棉花抗黄萎病资源严重匮乏的状况, 为我国植棉业的可持续发展提供了种质保障和品种支撑。
1 材料与方法
1.1试验材料
陆地棉品系苏研060为转化受体材料, 海岛棉品系海7124为嫁接砧木。植物双元表达载体pBI121、大肠杆菌菌株DH5α和根癌农杆菌菌株LBA4404,由本实验室保存。维管束强启动子竹节花黄斑驳病毒启动子(P-CoY)由中国科学院微生物研究所提供, gafp基因两种表达载体pBI121-35S-gafp和pBI121-CoY-gafp由中国科学院遗传与发育生物学研究所构建, 其质粒T-DNA结构如图1-A、1-B所示。
1.2棉花遗传转化及再生植株PCR检测
参照吴慎杰等[16]报道方法, 以下胚轴为外植体,采取农杆菌介导法转化苏研060。
取再生植株嫩叶2~3片, 采用CTAB法[17]提取植株基因组DNA, 进行目的基因、启动子——目的基因和标记基因的PCR扩增, 将阳性小植株嫁接到温室内砧木上。棉花再生植株PCR检测所用特异引
物序列如下。gafp基因上游引物为5'-ATGGCCTC ACCCGCAAGCTCTG-3'; 下游引物为5'-CAGTGA TTGCAGCATTTCCAACG-3', 产物大小为433 bp。CoY-gafp/R的上游引物为5'-CACAATCCCACTATC CTTCG-3'; 下游引物为5'-CAGTGATTGCAGCATT TCCAACG-3', 产物大小为520 bp。选择标记基因NPT II的上游引物为5'-GAGGCTATTCGGCTAT GACTG-3'; 下游引物为5'-TAGAAGGCGATGCGCT GCGA-3', 产物大小为750 bp。
1.3再生植株嫁接
在装有营养土的盆钵中种植根系发达、抗逆性强的海岛棉品系海7124, 待棉苗3片真叶时, 采用劈接法[16]将转基因再生植株嫁接到砧木苗的接穗上,随即使用保鲜膜裹紧、外加棉线扎窂。
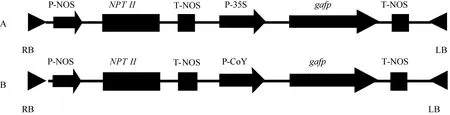
图1 gafp基因两种表达载体T-DNA区结构图Fig. 1 T-DNA structure of two plant expression vectors harboring disease-resistant gene gafp
1.4嫁接成活植株的RT-PCR检测
参照蒋建雄等[18]建立的CTAB/酸酚法提取棉花总RNA。RNA消化体系含50 μg总RNA、10 U DNase I、5 μL 10×DNaseI缓冲液、40 U RNase抑制剂, 用0.1% DEPC溶液补足至50 μL。RNA消化流程为, 37℃温育30~60 min, 用酚/氯仿抽提一次, 上层溶液加1/10倍体积的NaAc (pH 5.2)和2倍体积的无水乙醇, –20℃放置2 h后13 523× g离心20 min收集RNA沉淀, 沉淀用70%乙醇洗涤后真空干燥并溶解于20 μL 0.1%DEPC溶液中, 取1 μL溶液使用核酸蛋白分析仪测定其RNA浓度。
cDNA第1链的合成以5 μg RNA, 0.5 μg Oligo dT-Adaptor Primer, 加0.1%DEPC溶液至15 μL, 70℃水浴10 min, 置冰上; 再加1.25 μL dNTPs (10 mmol L–1)、0.625 μL RNase抑制剂(40 U μL–1)、5 μL 5×缓冲液、1 μL M-MLV (200 U L–1)、2.125 μL 0.1% DEPC溶液, 于42℃培养1 h, 70℃ 10 min灭酶活。将反转录产物稀释10倍用于PCR扩增模板。RT-PCR扩增体系含1 μL cDNA稀释样、2 μL 10×PCR缓冲液、0.4 μL dNTPs (10 mmol L–1)、1.2 μL MgCl2(25 mmol L–1)、1 μL上下游引物(10 μmol L–1)、0.2 μL Taq聚合酶(5 U μL–1), 加超纯H2O至总体积20 μL。gafp基因特异引物为, 上游引物5'-ATGGCCTCACC CGCAAGCTCTG-3'和下游引物5'-CGTATATGACA ACGTTACGGTC-3', 扩增产物为371 bp。RT-PCR程序为94℃预变性3 min; 94℃变性30 s, Tm值复性1 min, 72℃延伸1 min, 28个循环; 72℃延伸10 min。组成型表达的EF1α (GenBank登录号为AJ223969)特异引物为, 上游引物5'-AGACCACCAAGTACT ACTGCAC-3'和下游引物5'-CCACCAATCTTGTAC ACATCC-3', 以其作为内标引物进行平行PCR扩增。
1.5转gafp基因纯合株系培育
2010年花铃期对转gafp基因工程植株进行人工自交, 收获T1代种子。2011年在江苏省农业科学院转基因植物隔离种植区内, 将每个转基因工程植株T1代种子种植成株行, 蕾期使用直径1 cm2的滤纸蘸取2000 mg L–1的卡那霉素溶液, 放在植株倒二叶表面上, 7 d后观察并统计抗、感植株数量, 并对抗性植株进行人工自交, 收获得到T2代种子。2012年在转基因植物隔离种植区内, 种植卡那霉素抗性纯合的株行, 进行卡那霉素抗性检测, 每个株系检测30棵植株, 统计抗、感植株数量。对卡那霉素抗性纯合的T2株系进行人工自交, 获得抗性纯合的T3代株系种子。
从T1代植株上收获得到T2种子, 进行室内卡那霉素抗性检测。按单株收获T2种子, 从中随机选出50粒饱满的种子, 在无菌条件下剥去种皮, 接种于含2000 mg L–1卡那霉素的苗培养基上, 28℃培养, 7 d后观察子叶颜色变化情况, 绿色为抗性植株, 黄色为非抗性植株。
1.6Southern blot检测
使用CTAB法[17]提取棉花叶片基因组DNA。采取以地高辛随机标记gafp基因全长作为探针、化学发光信号检测为核心内容的Southern杂交技术[19]。
1.7Western blot检测
将提取的棉花叶片(七至八叶期幼嫩心叶)蛋白进行SDS-PAGE分离, 用半干法进行蛋白转膜,再与抗体反应, 最后使用NBT-BCIP染色试剂显色[20]。抗体稀释倍数一抗血清为1∶1000, 二抗为1∶4000。GAFP多克隆抗体和GAFP标准蛋白均由中国科学院遗传与发育生物学研究所提供。
1.8转基因株系黄萎病抗性鉴定
采用江苏通州强致病力落叶型菌系V991作为鉴定菌种, 由江苏省农业科学院植物保护研究所提供。
1.9苗期鉴定
以温室为鉴定场所, 2013—2014年春季将T3代转基因纯系种子播种于纸质营养钵中, 棉苗二叶一心时将营养钵撕底, 以达伤根目的。以黄萎病菌分生孢子悬浮液接种供试材料, 浓度为5×106个孢子mL–1, 每营养钵10 mL。以受体品系苏研060和阳性空载株系作为对照。设置3次重复, 在每个重复中,每个纯系种植50株以上, 考察所有植株的发病情况。接种3周后调查发病情况, 按照五级分类标准[21],调查转基因T3代株系、受体品系和阳性空载株系棉花叶片的病级。0级为健苗, 无病状; 1级为1~2片子叶表现病状, 子叶变黄发软, 真叶不显病症; 2级为子叶和1片真叶表现病状; 3级为子叶和2片真叶表现病状; 4级为全部叶片表现病状, 直到叶片脱落,顶心枯死。
1.10花铃期鉴定
分别取黄萎病菌系V991病圃土壤和经高压锅灭菌的营养土, 按照5∶1干重比例混合均匀, 装入口径38 cm、高40 cm的盆钵中。2013—2014年将转基因T3代种子播于盆钵中。以受体品系苏研060和转空载体pBI121株系作为对照。设置3次重复,在每个重复中, 每个纯系种植50株以上, 鉴定所有植株的抗病表现。8月初调查发病情况, 按照五级分类标准[22], 逐株调查各供试株系和品系的叶片受害病级。0级为健株, 叶片无病状; 1级为25%及以下的叶片表现症状, 即叶片出现叶肉变黄或呈现不规则形状的黄色病斑; 2级为26%~50%叶片表现病状,病斑颜色大部分变为黄色或黄褐色, 叶片边缘略有卷枯现象; 3级为51%~75%叶片表现病状, 少数病叶凋落; 4级为76%及以上的叶片表现病状, 多为褐色掌状枯斑, 严重时叶片大量脱落, 甚至棉株枯死。
根据调查结果, 分别计算苗期、花铃期各品系的发病率和病情指数。

在感病对照品种病情指数≥50的前提下, 按照病情指数划分供试品种(系)的抗病类型(表1)。
采用Microsoft Excel和SPSS软件进行病情指数的统计分析。
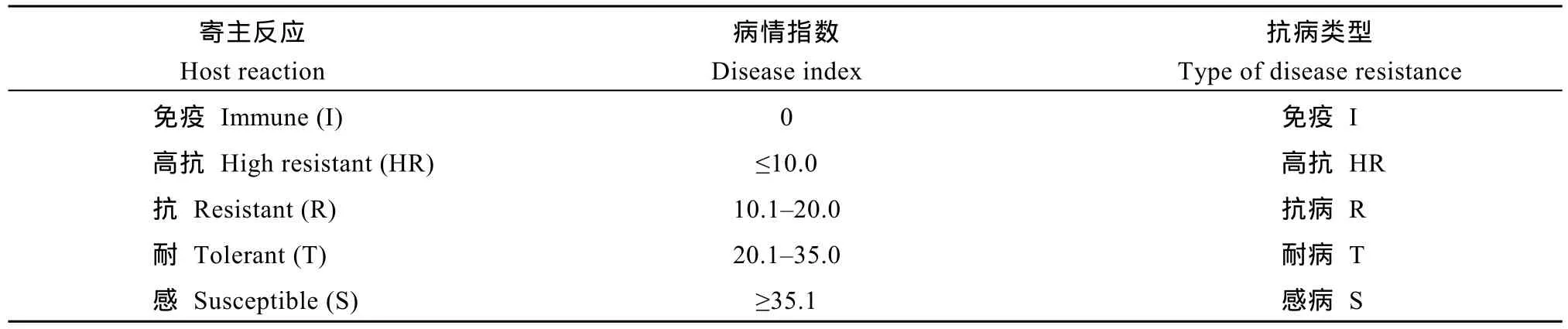
表1 棉花黄萎病圃鉴定抗病性的划分标准Table 1 Classification standard of cotton resistance to Verticillium wilt in nursery identification
2 结果与分析
2.1转基因植株的PCR检测
通过棉花体细胞再生途径获得了大量转基因植株。分别以NPT II基因、gafp基因、CoY启动子-gafp基因特异引物对再生苗进行PCR检测(图2), 将3种检测均为阳性的95个转基因幼苗嫁接到海岛棉品系海7124砧木上。
对嫁接成活的植株进行RT-PCR检测, 在37个嫁接成活的植株中, 有31个植株出现预期的540 bp扩增片段(图3), 另外6个植株中未扩增出特征条带。最终获得31个T0代转基因工程植株。
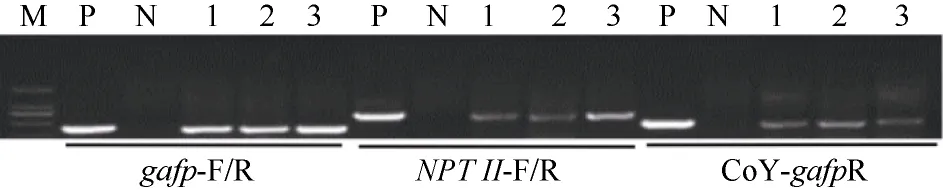
图2 转基因植株gafp基因、NPT II基因、CoY启动子-gafp基因特异引物的PCR检测Fig. 2 PCR analysis of the transgenic plants by using the primers of gafp, NPT II, and CoY-gafp, respectively
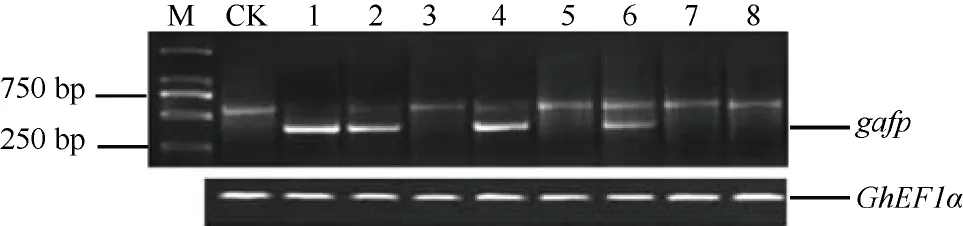
图3 半定量RT-PCR分析gafp基因在棉花中的表达情况Fig. 3 Analyses of gafp gene expression in cotton by RT-PCR
2.2转基因纯合株系的获得
追踪T0代转基因植株的转化克隆发现, 31个植株来自16个克隆, 其中G3系列克隆3个, 由35S启动子-gafp基因植物表达载体转化而成; SG3系列克隆13个, 由CoY启动子-gafp基因植物表达载体转化而成(表2)。
利用盆栽方式, 将31个转基因植株种植在人工网室内, 防止花粉飘移污染其他棉花种质资源, 冬季放入隔离温室保存。花铃期对转基因植株花粉活力显微镜检验表明, TG01、TG02、TG03、TG06、TG17、TG18、TG21、TG30、TG31等9个转基因植株花药空瘪, 花粉败育, 表现雄性不育(表2), 其他22个植株花药饱满, 散粉正常, 能够正常开花结实, 人工自交得到T1代种子。
将T1代转基因种子种成株行, 按单株提取叶片基因组DNA, 进行NPT II基因、gafp基因和CoY启动子-gafp基因特异引物的PCR检测。棉花蕾期田间检测T1代每1棵植株的卡那霉素抗性, 检测结果阳性的植株为转gafp基因植株后代。对T1代转基因植株人工自交, 分单株收获T2代种子。在实验室对T2代种子进行卡那霉素抗性检测, 每个T1代单株后代检测30粒种子, 全部表现卡那霉素抗性的判定为转基因纯合株系, 否则为杂合系。受体品系苏研060发芽4 d后的幼苗表现对卡那霉素敏感, TG09、TG10和TG11等22个T2代转基因株系和阳性空载对照全部表现卡那霉素抗性(图4)。
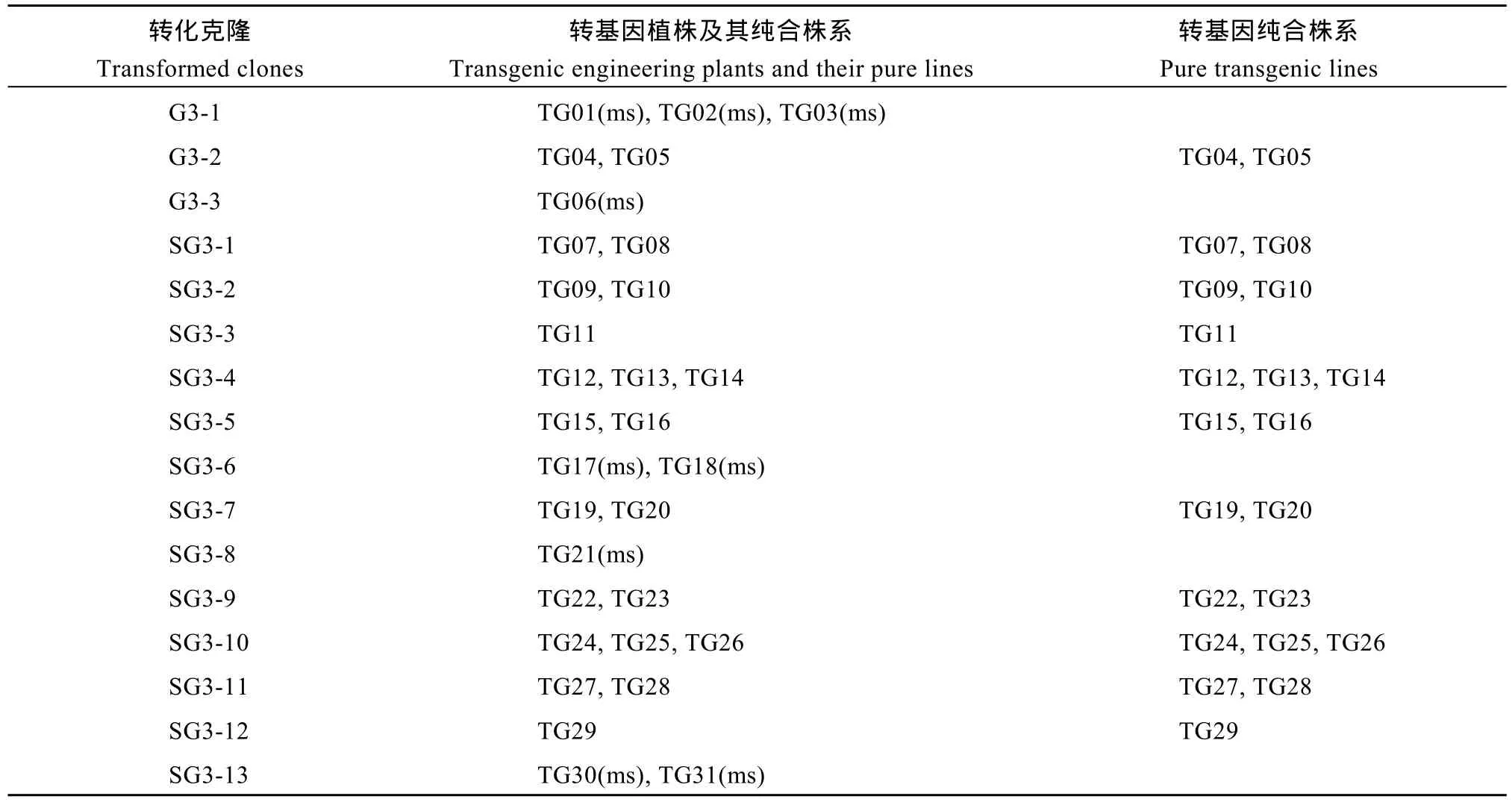
表2 转gafp基因工程植株及其纯合株系的转化克隆Table 2 Transformed clones of transgenic gafp engineering plants by Agrobacterium-mediated transformation in upland cotton

图4 转gafp基因棉花T2代株系TG09室内卡那霉素抗性筛选Fig. 4 Screening for Kanamycin resistance of transgenic gafp plants of T2strain TG09 in laboratory
通过苗期NPT II基因、gafp基因和CoY启动子-gafp基因特异引物的PCR检测和蕾期主茎倒二叶卡那霉素抗性鉴定(图5), 筛选获得22个T2代转基因纯合株系。对T2代转基因纯合株系人工自交, 获得22个T3代纯合株系种子(表2)。

图5 转gafp基因棉花T2代株系TG23田间卡那霉素抗性筛选Fig. 5 Screening for Kanamycin resistance of transgenic gafp plants of T2strain TG23 in field
2.3转基因纯合株系Southern blot
以gafp基因的全长作为探针, 对TG09、TG12、TG16和TG23这4个T3代转基因纯合株系进行Southern杂交验证, 4个转基因纯合株系均有2个拷贝的gafp基因整合到棉花基因组中(图6)。
2.4转基因纯合株系Western blot
以22个T3代转基因纯合株系和受体品系苏研060为材料, 进行Western blot分析, 有16个株系出现分子量为14 kD的GAFP蛋白条带(图8, 泳道2、3、4、8),说明转基因棉株体内的gafp基因能够准确地翻译成蛋白质; 然而TG04、TG05、TG11、TG24、TG25、TG26 等6个株系未出现GAFP蛋白特征条带(图7, 泳道5、6、7), 表现出转录后水平上的基因沉默[23-24]。

图6 转基因纯合株系Southern杂交Fig. 6 Southern blotting of cotton genomic DNA by using gafp gene as probe in T3pure transgenic lines

图7 转基因纯合株系Western杂交Fig. 7 Western blot of GAFP protein in T3pure transgenic lines
2.5转基因纯合株系黄萎病抗性鉴定
苗期接菌21 d后, 苏研060及其阳性空载株系棉苗表现典型的感病症状(图8-B), 发病率分别为88.99%、91.89%, 16个转基因株系发病率为31.43%~ 62.20%, 明显低于转基因阴性、阳性对照, 表明转基因棉花株系能够阻滞黄萎病菌的入侵。转基因株系之间、转基因株系与对照之间在病情指数上存在极显著差异, 其中TG09病情指数小于10, 高抗黄萎病(图8-A), TG14、TG15、TG16、TG23病情指数介于10.1~20.0之间, 抗黄萎病, 其他株系病情指数介于20.1~35.0之间, 耐黄萎病, 苏研060及其阳性空载株系病情指数均大于60, 感黄萎病(表3)。
花铃期鉴定的结果, 苏研060及其阳性空载株系发病率分别为97.37%、99.14%, 16个转基因株系发病率为38.89%~77.78%, 明显低于转基因阴性、阳
性对照。转基因株系之间、转基因株系与对照之间在病性指数上存在极显著差异, 其中TG09、TG16、TG23病情指数介于10.1~20.0之间, 抗黄萎病, TG10、TG12、TG13、TG14、TG15、TG22病情指数介于20.1~35.0之间, 耐黄萎病, TG07、TG08、TG19、TG20、TG27、TG28和TG29病情指数大于35, 感黄萎病, 苏研060及其阳性空载株系病情指数均大于70, 感黄萎病(表3和图9)。
花铃期病土条件下鉴定的发病率和病情指数普遍高于苗期温室鉴定, 但不同供试材料在2个时期对黄萎病的抗性表现趋势一致(表3)。花铃期是棉花产量、纤维品质形成的关键时期, 利用供试材料花铃期在人工病圃鉴定中的病情指数来评价棉花品种(系)对黄萎病的抗性具有实践价值和可操作性[25],因此本研究以花铃期病情指数作为评价转gafp基因株系对黄萎病抗性的主要依据。结果表明, 从16个转基因株系中, 筛选鉴定出3份抗黄萎病棉花新种质TG09、TG16、TG23。
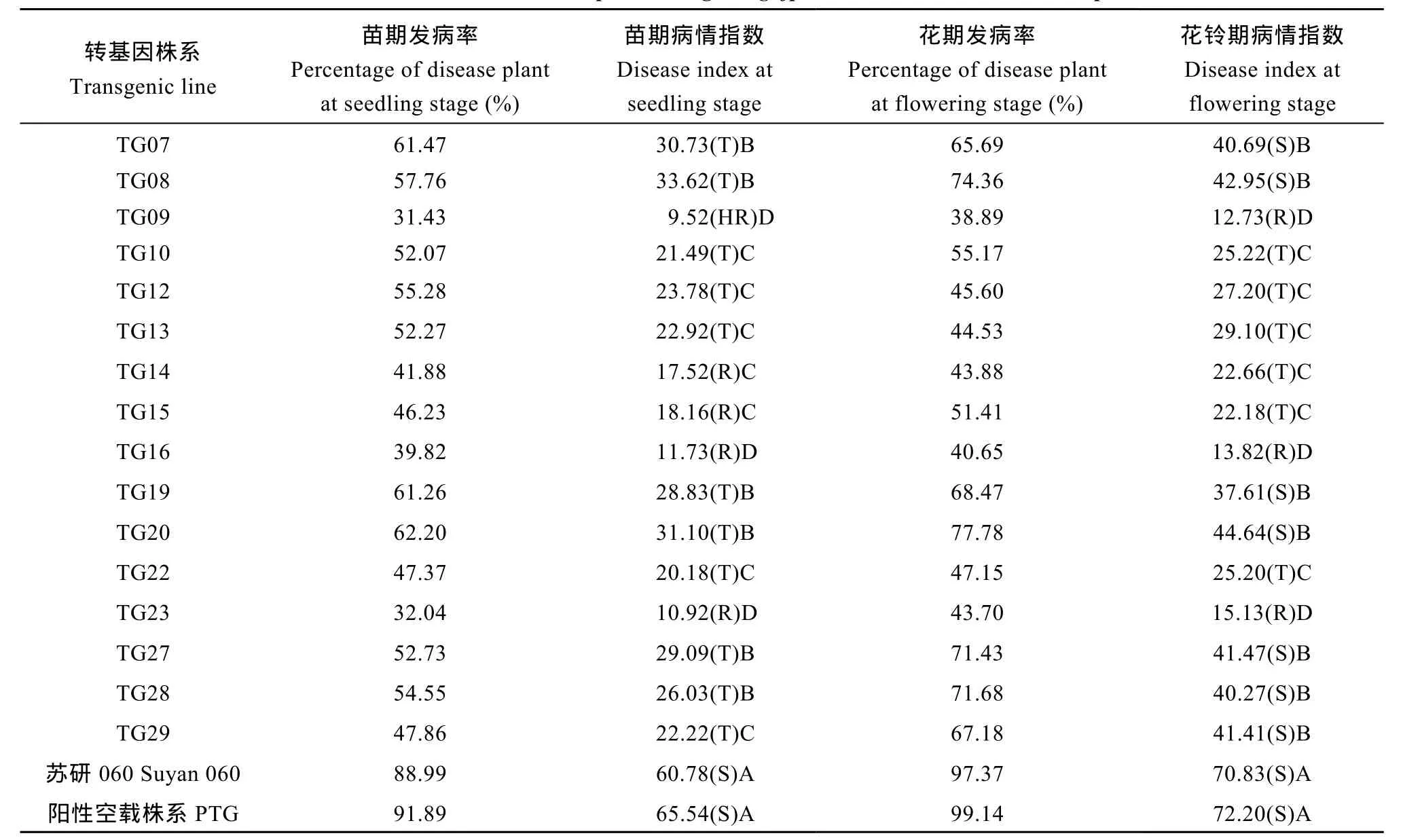
表3 转基因纯合株系抗黄萎病鉴定Table 3 Identification for resistance of pure transgenic gafp lines to Verticillium wilt in upland cotton

图8 转基因纯合株系TG09苗期温室接菌2周后的抗病性表现Fig. 8 Resistant phenotype of pure transgenic line TG09 to Verticillium wilt at seedling stage
3 讨论
棉花组织培养生根困难, 提高试管苗的移栽成活率是棉花基因工程研究的技术瓶颈。在离体培养条件下, 棉花叶片角质层很薄, 根系发育不够, 移栽成活率低[26]。采用农杆菌介导法开展棉花基因工程研究时, 在诱导培养基中加入抗生素, 杀死非转化细胞并抑制农杆菌的生长。使用抗生素筛选转化细胞, 能够大幅度地改变受体植物细胞DNA甲基化状态, 对植物愈伤组织的诱导、增殖、分化等均有负面影响, 引起愈伤组织增殖变慢、再生植株频率
低、生根困难、畸形苗比例增加、移栽困难, 难以实现规模化生产[27]。本研究采用农杆菌介导法实现gafp基因转化苏研060, 通过PCR检测获得95棵阳性转基因试管苗, 采用室外插皮接法将这些试管苗嫁接到砧木上, 仅获得37个成活植株, 成活率38.95%。针对转gafp基因试管苗嫁接过程中出现大量死苗现象, 后期研究开展棉花试管苗高效移栽技术的探索。若试管苗根系发育正常, 采用营养液水培法结合炼苗, 能够将试管苗直接移栽到营养钵中, 成活率高达95%以上; 若试管苗根系发育不良, 采用试管内嫁接法结合生根培养, 成活率高达92%以上。两种方法结合使用能够大幅度地提高试管苗的移栽成活率, 推动棉花基因工程研究的深入发展。
转gafp基因棉花工程植株及其衍生株系出现雄性败育、基因沉默等异常现象, 探究其形成原因有利于优化植物表达载体的构建技术, 同时为棉花突变体库的创建提供理论依据。本研究从37个成活的转基因植株中, 最终仅获得16个gafp基因在棉株体内能够稳定表达的转基因株系。大量研究表明, 采取农杆菌介导法获得的转基因植物, 目的基因进入受体基因组后, 可能引起受体DNA片段重排、丢失、异常重组, 而且目的基因在受体基因组内整合的随机性以及多拷贝整合, 导致目的基因在转基因植株体内出现多种表达方式, 可能出现目的基因高效表达、表达量过低、基因沉默、或干扰受体基因组其他功能基因的正常表达等现象[28-29]。目的基因可以插入植物染色体组任何一条染色体的任何位点, 但对转录活跃区域具有优先插入特性。通过对转基因植物体内T-DNA结构、边界序列和目的基因在染色体上的位置与其表达状况的相关性研究, 发现在稳定遗传和持续表达的基因位点上, 除含有简单的T-DNA序列外, 两端或至少一端旁侧富含AT序列,并在体外能与核基质结合; 而在不稳定表达的位点上, 含有多个不完整的T-DNA拷贝, 载体DNA直接与T-DNA右边界相连。FISH结果进一步表明, 整合在端粒附近的目的基因能够稳定表达, 而整合在染色体臂内或着丝粒附近的目的基因就不能稳定表达,说明目的基因T-DNA整合的完整性以及在染色体上整合的位置对外源基因稳定表达至关重要[30-31]。

图9 转基因纯合株系TG16花铃期病土条件下抗病性表现Fig. 9 Resistant phenotype of pure transgenic line TG16 to Verticillium wilt at flowering and boll setting stage
4 结论
已将gafp基因导入陆地棉, 转基因株系均有2个拷贝的gafp基因整合到棉花基因组中。16个T3代转基因株系出现分子量为14 kD的GAFP蛋白条带。获得3份转基因抗黄萎病棉花新种质TG09、TG16、TG23。
References
[1] 马存, 简桂良, 孙文姬.我国棉花抗黄萎病育种现状、问题及对策.中国农业科学, 1997, 30(2): 58–64
Ma C, Jian G L, Sun W J. Current status, problem and countermeasure on resistance breeding to Verticillium wilt of cotton in China. Sci Agric Sin, 1997, 30(2): 58–64 (in Chinese with English abstract)
[2] 简桂良, 卢美光, 仇家山, 王凤行, 张洪成. 棉花黄萎病防治策略. 中国植保导刊, 2004, 24(4): 30–31
Jian G L, Lu M G, Qiu J S, Wang F X, Zhang H C. Control strategy of Verticillium dahliae in cotton. China Plant Protect, 2004, 24(4): 30–31 (in Chinese)
[3] 朱荷琴, 冯自力, 宋晓轩, 刘雪英. 棉花黄萎病抗性的定向选育效果. 中国棉花, 2008, 35(6): 10–11
Zhu H Q, Feng Z L, Song X X, Liu X Y. Effect analysis of orientational selection for resistance to Verticillium wilt in upland cotton. China Cotton, 2008, 35(6): 10–11 (in Chinese)
[4] Zhang J, Sanogo S, Flynn R, Baral J B, Bajaj S, Hughs S E, Percy R G. Germplasm evaluation and transfer of Verticillium wilt
resistance from Pima (Gossypium barbadense) to upland cotton (G. hirsutum). Euphytica, 2012, 187: 147–160
[5] 陈红, 李吉莲, 刘萍, 宿俊吉, 宋庆平. 4个抗黄萎病海岛棉染色体片段导入系黄萎病抗性配合力分析. 棉花学报, 2014, 26: 356–362
Chen H, Li J L, Liu P, Su J J, Song Q P. Analysis on combining ability of resistance traits to Verticillium wilt in four chromosomal segment introgression lines in G. barbadense L. Cotton Sci, 2014, 26: 356–362 (in Chinese with English abstract)
[6] 霍向东, 李国英, 张升. 新疆棉花黄萎病菌致病性分化的研究.棉花学报, 2000, 12: 254–257
Huo X D, Li G Y, Zhang S. Pathogenic differentiation of Veticillium dahliae from cotton in Xinjiang. Acta Gossypii Sin, 2000, 12: 254–257 (in Chinese with English abstract)
[7] Murray F, Llewellyn D, Mcfadden H, Last D, Dennis E S, Peacock W J. Expression of the Talaromyces flavus glucose oxidase gene in cotton and tobacco reduces fungal infection, but is also phytotoxic. Mol Breed, 1999, 5: 219–232
[8] 程红梅, 简桂良, 倪万潮, 杨红华, 王志兴, 孙文姬, 张保龙,王晓峰, 马存, 贾士荣. 转几丁质酶和β-1,3-葡聚糖酶基因提高棉花对枯萎病和黄萎病的抗性. 中国农业科学, 2005, 38: 1160–1166
Cheng H M, Jian G L, Ni W C, Yang H H, Wang Z X, Sun W J, Zhang B L, Wang X F, Ma C, Jia S R. Increase of fusarium- and verticillium-resistance by transferring chitinase and glucanase gene into cotton. Sci Agric Sin, 2005, 38: 1160–1166 (in Chinese with English abstract)
[9] 吴家和, 张献龙, 罗晓丽, 田颖川. 转新型双抗虫基因棉花的遗传分析. 遗传学报, 2003, 30: 631–636
Wu J H, Zhang X L, Luo X L, Tian Y C. Inheritance and segregation of transformants in cotton with two types of insect-resistant genes. Acta Genet Sin, 2003, 30: 631–636 (in Chinese with English abstract)
[10] 舒群芳, 孙勇如. 抗真菌植物基因工程的策略和进展. 植物学报, 1997, 39: 91–96
Shu Q F, Sun Y R. Strategies and advances in antifungi genetic engineering of plant. Acta Botan Sin, 1997, 39: 91–96 (in Chinese with English abstract)
[11] 萨其拉, 王义琴, 李文彬, 张利明, 孙勇如. 天麻抗真菌蛋白基因的克隆及其启动子活性. 植物学报, 2003, 45: 229–233
Sa Q L, Wang Y Q, Li W B, Zhang L M, Sun Y R. Isolation of a genomic DNA for Gastrodia antifungal protein and analyses of its promoter in transgenic tobacco. Acta Bot Sin, 2003, 45: 229–233 (in English with Chinese abstract)
[12] 王义琴, 陈大军, 危晓薇, 吴明刚, 王冬梅, 姚正培, 黄全生,刘丰疆, 美丽古利, 李仁敬, 孙勇如. 天麻抗真菌蛋白基因(gafp)转化彩色棉的研究. 植物学通报, 2003, 20: 703–712
Wang Y Q, Chen D J, Wei X W, Wu M G, Wang D M, Yao Z P, Huang Q S, Liu F J, Meiliguli, Li R J, Sun Y R. Study of transferring the gene of gastrodia antifungal protein (gafp) into color cotton to enhance wilt resistance. Chin Bull Bot, 2003, 20: 703–712 (in Chinese with English abstract)
[13] 陈大军, 简桂良, 李仁敬, 张振南, 刘丰疆, 姚正陪. 转天麻抗真菌蛋白基因彩色棉新品系抗枯黄萎病研究. 分子植物育种, 2003, 1: 673–676
Chen D J, Jian G L, Li R J, Zhang Z N, Liu F J, Yao Z P. Study on resistance to fusarium wilt and verticillium wilt for transgenic GAFP colored cotton lines. Mol Plant Breed, 2003, 1: 673–676 (in Chinese with English abstract)
[14] 李付广, 刘传亮. 生物技术在棉花育种中的应用. 棉花学报, 2007, 19: 362–368
Li F G, Liu C L. Applications of biotechnology on the cotton breeding. Cotton Sci, 2007, 19: 362–368 (in Chinese with English abstract)
[15] 刘传亮, 田瑞平, 孔德培, 李凤莲, 商海红, 陈秀军. 棉花规模化转基因技术体系构建及其应用. 中国农业科学, 2014, 47: 4183–4197
Liu C L, Tian R P, Kong D P, Li F L, Shang H H, Chen X J. Establishment and application of efficient transformation system for cotton. Sci Agric Sin, 2014, 47: 4183–4197 (in Chinese with English abstract)
[16] 吴慎杰, 李飞飞, 陈天子, 郭旺珍, 张天真. 利用农杆菌介导法转化泗棉3号的研究. 作物学报, 2007, 33: 632–638
Wu S J, Li F F, Chen T Z, Zhang J, Guo W Z, Zhang T Z. Agrobacterium-mediated transformation of upland cotton Simian 3. Acta Agron Sin, 2007, 33: 632–638 (in Chinese with English abstract)
[17] Paterson A H, Brubaker C L, Wendel J F. A rapid method for extraction of cotton (Gossypium spp.) genomic DNA suitable for RFLP or PCR analysis. Plant Mol Biol Rep, 1993, 11: 122–127
[18] 蒋建雄, 张天真. 利用CTAB/酸酚法提取棉花组织总RNA.棉花学报, 2003, 15: 166–167
Jiang J X, Zhang T Z. Extraction of total RNA in cotton tissues with CTAB-acidic phenolic method. Cotton Sci, 2003, 15: 166–167 (in Chinese with English abstract)
[19] 周长发, 张锐, 张晓, 罗淑萍, 郭三堆. 地高辛随机引物法标记探针的Southern杂交技术优化. 中国农业科技导报, 2009, 11: 123–128
Zhou C F, Zhang R, Zhang X, Luo S P, Guo S D. Technological improvement of southern blot using digoxigenin-labeled probes with random-primed method. J Agric Sci Tech, 2009, 11: 123–128 (in Chinese with English abstract)
[20] 陆玲鸿, 韩强, 李林, 周练, 刘瑞芳, 宋张悦, 沈志成, 寿惠霞.以草甘膦为筛选标记的大豆转基因体系的建立及抗除草剂转基因大豆的培育. 中国科学(生命科学), 2014, 44: 406–415
Lu L H, Han Q, Li L, Zhou L, Liu R F, Song Z Y, Shen Z C, Shou H X. Establishment of an efficient transformation protocol for Soybean using glyphosate as selective agent and development of glyphosate-tolerant transgenic Soybean lines. Sci Sin Vitae, 2014, 44: 406–415 (in Chinese with English abstract)
[21] 吴征彬. 棉花枯黄萎病及其抗性鉴定技术. 植物遗传资源科学, 2000, 1: 47–51
Wu Z B. Fusarium and Verticillium wilts and techniques applied in the identification of cotton resistance to the diseases. J Plant Gene Res, 2000, 1: 47–51 (in Chinese with English abstract)
[22] 吴征彬, 孟艳艳. 棉花品种区域试验中的抗病鉴定技术. 华中农业大学学报, 2004, 23: 500–503
Wu Z B, Meng Y Y. Identification techniques of cotton resistances to diseases in regional variety trial. J Huazhong Agric Univ, 2004, 23: 500–503 (in Chinese with English abstract)
[23] Meins F J. RNA degradation and models for post-transcriptional gene-silencing. Plant Mol Biol, 2000, 43: 261–273
[24] Crete P, Leuenberger S, Iglesias V A, Suarez V, Schöb H, Holtorf H, Van Eeden S. Meins F Jr. Graft transmission of induced and spontaneous post-transcriptional silencing of chitinase genes. Plant J, 2001, 28: 493–501
[25] 吴翠翠, 简桂良, 王安乐, 刘方, 张先亮, 宋国立, 黎绍惠, 陈朝辉, 王春英, 张香娣, 王坤波. 棉花抗黄萎病QTL初步定位.分子植物育种, 2010, 8: 680–686
Wu C C, Jian G L, Wang A L, Liu F, Zhang X L, Song G L, Li S H, Chen C H, Wang C Y, Zhang X D, Wang K B. Primary detection of QTL for Verticillium wilt resistance in cotton. Mol Plant Breed, 2010, 8: 680–686 (in Chinese with English abstract)
[26] 谢德意, 金双侠, 郭小平, 张献龙. 棉花胚性愈伤组织的转化及转基因胚状体的有效萌发与成苗技术研究. 作物学报, 2007, 33: 751–756
Xie D Y, Jin S X, Guo X P, Zhang X L. Genetic transformation of cotton with embryogenic calli as explants and efficient transgenic somatic embryoid germination and plant recovery. Acta Agron Sin, 2007, 33: 751–756 (in Chinese with English abstract)
[27] Zhang B H, Liu F, Liu Z H, Wang H M, Yao C B. Effects of kanamycin on tissue culture and somatic embryogenesis in cotton. Plant Growth Regul, 2001, 33: 137–149
[28] Choi H W, Lemaux P G, Cho M J. Use of fluorescence in situ hybridization for gross mapping of transgenes and screening for homozygous plants in transgenic barley (Hordeum vulgare L.). Theor Appl Genet, 2002, 106: 92–100
[29] Kim S I, Gelvin S B. Genome-wide analysis of Agrobacterium T-DNA integration sites in the Arabidopsis genome generated under non-selective conditions. Plant J, 2007, 51: 779–791
[30] Iglesias V A, Moscone E A, Papp I, Neuhuber F, Michalowski S, Phelan T, Spiker S, Matzke M, Matzke A J. Molecular and cytogenetic analyses of stably and unstably expressed transgene loci in tobacco. Plant Cell, 1997, 9: 1251–1264
[31] Hoopen R T, Robbins T P, Fransz P F, Montijn B M, Oud O, Gerats A, Nanninga N. Location of T-DNA insertions in petunia by fluorescence in situ hybridization: physical evidence for suppression of recombination. Plant Cell, 1996, 8: 823–830
URL: http://www.cnki.net/kcms/detail/11.1809.S.20151207.1041.012.html
Transgenic Upland Cotton Lines of Gastrodia Antifungal Protein Gene and Their Performance of Resistance to Verticillium Wilt
XIAO Song-Hua1,2, ZHAO Jun2, LIU Jian-Guang2, WU Qiao-Juan2, WANG Yi-Qin3, CHU Cheng-Cai3, YU Jing-Zhong1,*, and YU De-Yue1,*
1Nanjing Agricultural University / National Key Laboratory of Crop Genetics and Germplasm Enhancement, Nanjing 210095, China;2Institute of Industrial Crops, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;3Institute of Genetics and Developmental Biology, Chinese Academy of Sciences, Beijing 100101, China
Abstract:Verticillium wilt is a major disease in worldwide cotton production. Up to now there are less progresses achieved by using conventional cotton breeding for controlling Verticillium wilt of upland cotton owing to lack of broad-spectrum resistant germplasm. The most effective approach of controlling cotton Verticillium wilt could be to create new strains with broad-spectrum resistance and then develop cultivars with improved horizontal resistance through transgenic manipulation. Transferring the gene of gastrodia antifungal protein (gafp) into upland cotton variety Suyan 060 was carried out by agrobacterium-mediated genetic transformation. Many regenerated plantlets were gained through embryogenic callus induction and plant regeneration by using hypocotyls as explants. PCR detection of plantlets using special primers from functional region of the target gene was performed and 95 positive plantlets were acquired. Thirty seven transgenic plants were eventually generated by grafting of all plantlets to Hai
7124 stock, and the survival rate of grafting reached 38.95%. RT-PCR results indicated that the characteristic band of 540 bp amplified fragment appeared in 31 plants while disappeared in the rest six plants. Pollen fertility identification in blossom stage showed that nine transgenic plants displayed male sterile, 22 plants performed male fertile and self-fertilized to T1seed. Twenty two pure T3transgenic gafp lines were identified by cultivating in the isolation area specific to transgenic crops, PCR detection using primers from functional region of gafp gene, kanamycin-resistance screening, self-fertilized purification and selection. Southern blotting showed that there were two copies of gafp gene integrated into the cotton genome. Western blotting confirmed that 16 pure transgenic lines had GAFP protein with molecular weight of 14 kD, the other six lines lacked the protein due to posttranscriptional gene silencing. Identification of resistance to Verticillium wilt indicated that three pure transgenic gafp lines TG09, TG16, TG23 were resistant to defoliated strain V991 of Verticillium wilt.
Keywords:Upland cotton; Gastrodia elata; Antifungal protein; Gene; Verticillium wilt; Resistance
收稿日期Received(): 2015-05-29; Accepted(接受日期): 2015-11-20; Published online(网络出版日期): 2015-12-07.
通讯作者*(Corresponding authors): 俞敬忠, E-mail: zhoucui6868@163.com; 喻德跃, E-mail: dyyu@njau.edu.cn
DOI:10.3724/SP.J.1006.2016.00212
