山豆根毛状根培养体系的建立与优化
2016-03-03李林轩韦坤华姚绍嫦唐美琼缪剑华
李林轩, 韦坤华, 姚绍嫦, 唐美琼, 韦 范, 缪剑华
山豆根毛状根培养体系的建立与优化
李林轩, 韦坤华, 姚绍嫦, 唐美琼, 韦 范, 缪剑华*
(广西壮族自治区药用植物园, 广西药用资源保护与遗传改良重点实验室, 广西 南宁 530023)
为探索定向培养山豆根植物细胞及器官获取有效药用成分的新途径,为山豆根有效药用成分的大规模生产奠定基础,采用共培养法研究发根农杆菌R1601感染诱导山豆根无菌苗子叶产生毛状根,并在此基础上从不同培养液、不同蔗糖浓度和外源激素对毛状根生长的影响方面筛选山豆根毛状根生长的最佳培养液。结果表明:利用发根农杆菌R1601感染山豆根无菌苗子叶16 min,在MS+AS 100 μmol/L的固体培养基上培养可诱导产生毛状根,且诱导率最高,达66.67%;1/2 MS+IAA 0.5 mg/L+5%蔗糖的培养液最有利于山豆根毛状根的生长。
山豆根; 毛状根; 农杆菌; 培养液; 药用植物
随着野生药用植物资源的日益匮乏,采用生物技术定向培养植物细胞及器官获取有效药用成分显得越来越重要。毛状根培养在生产植物次生代谢产物方面具有独特的优势和前景。研究发现,滇黄芩毛状根的黄芩苷含量是原药材的7.18倍[1],人参毛状根的总皂苷含量是原药材的1.7倍[2]。同时,毛状根培养与其他植物细胞培养相比,具有生长速度快、不需要添加激素等优点;与原植物根部次生代谢产物含量常常受根部细胞分化的影响相比,毛状根具有持续稳定的生产次生代谢产物的能力[3-5]。
山豆根(SophoratonkinensisGapnep.)又称广豆根,是著名的广西道地药材,属豆科植物,是临床常用中药,药用部位是根,为《中华人民共和国药典》所收载[6]。现代研究证明,从山豆根中分离出多种生物碱,其中,苦参碱(Matrime)和氧化苦参碱(Oxymatrime)等具有抗癌和抗霉菌的作用[7]。由于广西石山区的天然植被大量被砍伐,山豆根失去生存条件,加上该植物分布局限性大且零星,长期无计划的乱采乱伐已导致野生资源及生态环境受到严重破坏。目前,广西境内的山豆根已面临枯竭,且其人工栽培生长周期长、成本高,短期内难以满足市场需求。因此,如何利用高新技术实现山豆根资源的可持续发展已迫在眉睫。但关于山豆根的发根研究在国内还未见报道。为此,笔者针对山豆根开发后出现的资源可持续发展问题,利用现代生物技术通过发根农杆菌诱导山豆根发根从而建立山豆根毛状根培养体系,以期直接生产山豆根次生代谢产物,实现工厂化生产山豆根药用成分,为中药山豆根资源的开发探索新途径。
1 材料与方法
1.1 供试材料
发根农杆菌(Agrobacteriumrhizogenes)菌株R1601为广西药用资源保护与遗传改良重点本实验室保存。保存条件为超低温冰箱,于-70℃下保存。
山豆根种子来自广西药用植物园繁育圃,山豆根无菌苗为广西药用资源保护与遗传改良重点实验室提供。
试剂:植物基因组DNA提取试剂盒[天根生化科技(北京)有限公司],苦参碱对照品和氧化苦参碱对照品(天津马克生物科技有限公司),乙腈(色谱纯,Fisher公司),其余试剂为国产分析纯,高纯水为实验室自制。
培养基:YEB固体培养、YEB液体培养基、MS液体培养基、B5液体培养基和WPM液体培养基。
主要仪器设备:4K-15高速冷冻离心机(sigma),sub-cellGT水平电泳仪(BIORAD),ChemiDos XRS凝胶成像系统(BIORAD),T-Gradient梯度PCR仪(Biometra),高效液相色谱仪(Agilent 1 260 Infinity LC),色谱柱(Phenomenex Luna 5 u NH2 100 A,150×4.6 mm),ZHWY-211B全温摇床(常州锐品精密仪器有限公司)
1.2 发根农杆菌的培养
感染外植体前,首先需要对菌株进行活化。在YEB固体培养基上划线培养,待菌落长出后,挑取单菌落接种于YEB液体培养基,于28℃、220 r/min摇床上培养(图1),30 d后供感染体用。

图1 发根农杆菌的活化
1.3 R1601发根农杆菌对山豆根毛状根的诱导
将山豆根的无菌苗子叶放入R1601菌液中浸泡16 min取出,以无菌水为对照,然后用无菌滤纸吸取外植体表面多余的菌液,转移至含有乙酰丁香酮(AS)100 μmol/L的MS固体培养基上培养3 d,处理30瓶,每瓶1个无菌子叶。当诱导出的根长至约2 cm时,在无菌条件下将其剪下,于含有头孢噻肟钠(Cef) 300 mL/L的MS固体平板培养基上进行除菌培养,每5 d转接1次,直至无菌。
1.4 山豆根毛状根的鉴定
为确定山豆根毛状根的转化成功,取编号为12、22、23、26、27、33、43、46的山豆根毛状根材料各100 mg,按照CTAB法提取毛状根中的DNA制成检测样品,同时提取Ri质粒的DNA。根据rolB和rolC基因的序列设计引物,将各种DNA于下述PCR反应条件下进行扩增反应。产物在1.2%的琼脂糖凝胶上电泳(140 V电压,30 min)后,在UVP成像系统上观察DNA条带并拍照。
PCR反应条件:94℃ 3 min,94℃ 50 s,56℃45 s,72℃ 1 min 34个循环,72 ℃10 min,4℃保温20 min。电泳条件:1.2%的琼脂糖凝胶作为电泳支持物,缓冲液,Marker DNA为pUC 19DNA/ Msp I (Hpa II ),EB染色,0.5 XTBE缓冲液作为电泳,140 V,30 min。
1.5 山豆根毛状根生长曲线的绘制
山豆根毛状根接种到1/2 MS+IBA 0.2 mg/L+0.05%活性炭的固体培养基,每瓶接种约0.3 g鲜重,每个处理3瓶,每隔5 d测1次生长量,并根据生长量绘制山豆根毛状根生长曲线,确定最佳的生长观察期。
1.6 山豆根毛状根培养条件的优化
1.6.1 不同培养基对山豆根毛状根生长的影响 将山豆根毛状根接种到MS、1/2 MS、1/4 MS、B5和WPM等5种不同的液体培养基培养,其中B5和WPM属于低盐浓度培养基,1/2 MS和1/4 MS的大量元素分别为MS培养基的1/2与1/4,其余与MS相同,MS属于高盐浓度培养基。30 d后测定其鲜重并观察毛状根的生长情况。
1.6.2 不同蔗糖浓度对山豆根毛状根生长的影响 取毛状根接种到分别添加有1%、3%、5%、7%和9%蔗糖的培养液(1/2 MS)中,30 d后测定其鲜重。
1.6.3 不同外源激素处理对山豆根毛状根生长的影响 将大约0.3 g(鲜重)毛状根接入添加不同浓度的IAA、NAA、6-BA(表1)的1/2 MS培养液中,30 d后测定其鲜重并观察毛状根的生长情况。
表1 山豆根毛状根培养激素的水平设计
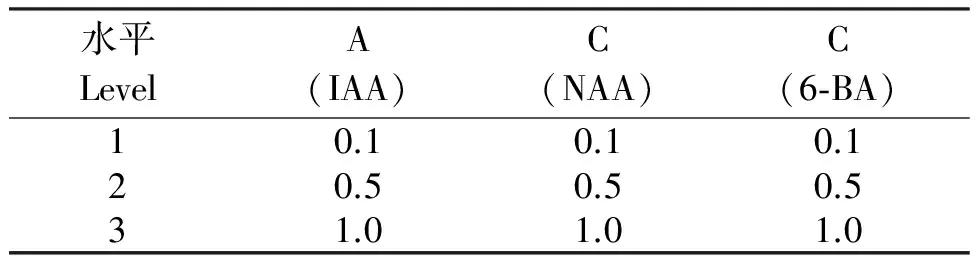
Table 1 Design of the culture hormone levels of S.tonkinensis hairy rootmg/L
1.7 山豆根毛状根的药效分析
采用苦参碱对照品和氧化苦参碱对照品作为试验对照,参照《中华人民共和国药典》(2015版)进行测定。(仪器:Agilent 1 260 Infinity LC;色谱柱:Phenomenex Luna 5 u NH2 100 A,150×4.6 mm;柱温:25 ℃;流动相:乙腈:异丙醇:3%磷酸(80∶5∶15);流速:0.5 mL/min;检测波长:210 nm)选取培养30 d的山豆根毛状根,按照药典含量山豆根测定的方法制备供试液;另取苦参碱对照品和氧化苦参碱对照品,加流动相分别配制成0.020 mg/mL的苦参碱溶液和0.150 mg/mL的氧化苦参碱溶液,分别精密吸取对照品溶液与供试液注入液相色谱仪进行测定。
2 结果与分析
2.1 R1601发根农杆菌处理山豆根毛状根的诱导率
从图2可见,培养10 d后,有的子叶伤口部位开始长出少量的愈伤组织,15 d后开始陆续在伤口部位长出白色的毛状根,长出的毛状根不具向地生长,少纤毛,2周后长至4~5 cm。具有高浓度抗生素的培养基不适合毛状根的生长,毛状根的根尖开始褐化且停止生长;随着培养时间的延长,受体子叶开始褐化而逐渐失去发根能力。侵染30 d后从伤口处长出毛状根,毛状根较粗壮、生长迅速。统计结果,R1601发根农杆菌对山豆根毛状根的诱导率为66.67%。

图2 R1601发根农杆菌处理山豆根子叶诱导的毛状根
Fig.2S.tonkinensishairy root cotyledons infected byA.rhizogenesR1601
2.2 山豆根毛状根的鉴定
从图3可见,除了26号外,其他编号的毛状根通过PCR均成功地扩增出rolB和rolC基因。说明,由R1601诱导出的毛状根已整合Ri质粒的T-DNA片段,成功实现山豆根毛状根的转化,而未进行转化的无菌苗的根没有扩增条带。
2.3 山豆根毛状根的生长曲线
由图4可见,毛状根接种后10 d内生长缓慢,可能是因为毛状根刚接种到新鲜培养基后有个适应期;在第10~30天时毛状根迅速生长,处于对数生长期;30 d后毛状根逐渐成熟,30~40 d生长速度减漫,40 d左右毛状根开始老化变黄。据此,将山豆根毛状根生长的观察期定为30 d较合适。
2.4 山豆根毛状根培养条件的优化
2.4.1 不同培养基处理山豆根毛状根的生长 一般情况下,毛状根在低盐培养基中生长良好,可能是因为NH4+、NO3-、PO43-、Ca2+等大量元素的减少有利于其生长。由表2和图5可见,不同培养基中山豆根毛状根的生长情况差异较大,5种培养基对毛状根生长都具有显著影响,表现为1/2 MS>WPM>B5>1/4 MS>MS。其中,1/2 MS培养基最有利于山豆根毛状根的生长,其鲜重增加倍数最多,约增加8.56倍,且毛状根生长迅速,无愈伤化现象;其次是WPM培养基,其毛状根鲜重约增加7.17倍,略低于1/2 MS处理,且毛状根生长较迅速,无愈伤化现象;MS培养基中的毛状根出现愈伤化,生长慢,估计与培养基中含有较高的铵盐有关。B5培养基也引起毛状根愈伤化,根较粗;1/4 MS培养基虽然铵盐浓度较低,但其他成分也较1/2 MS培养基少,估计养分不足而引起生长慢。因此,最适合毛状根生长的液体培养基是1/2 MS培养基,其次是WPM培养基。说明,山豆根毛状根适合在较低盐浓度的培养基生长。
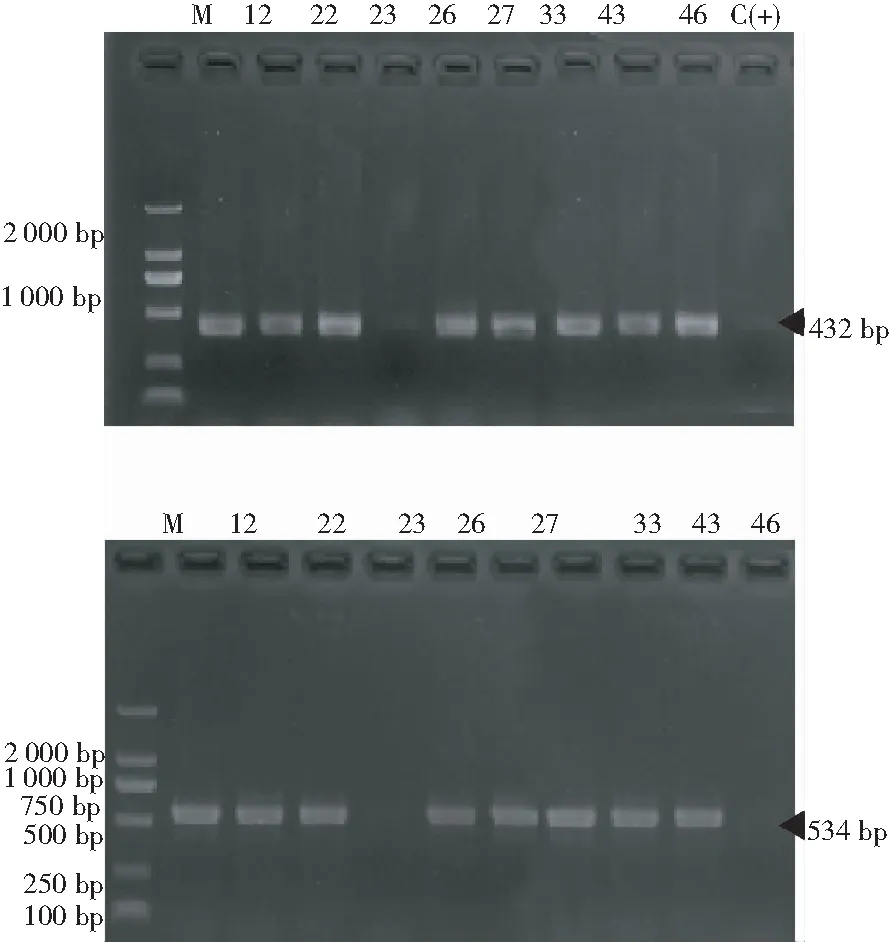
注:M-Marker,12、22、23、26、27、33、43和46均为毛状根编号,C(+)为发根农杆菌的Ri质粒,C(-)为组培苗的根。
Note: M-Marker,12,22,23,26,27,33,43 and 46 are the number ofS.tonkinensishairy root, C(+) isS.tonkinensishairy root cotyledons infected byA.rhizogenes, C(-)is the tissue culture seedling ofS.tonkinensishairy root
图3 山豆根毛状根的DNA 图(rolB基因,上;rolC基因,下)
Fig.3 The DNA electrophoresis spectrum ofS.tonkinensishairy root (rolb gene,upper and rolC gene,lower)
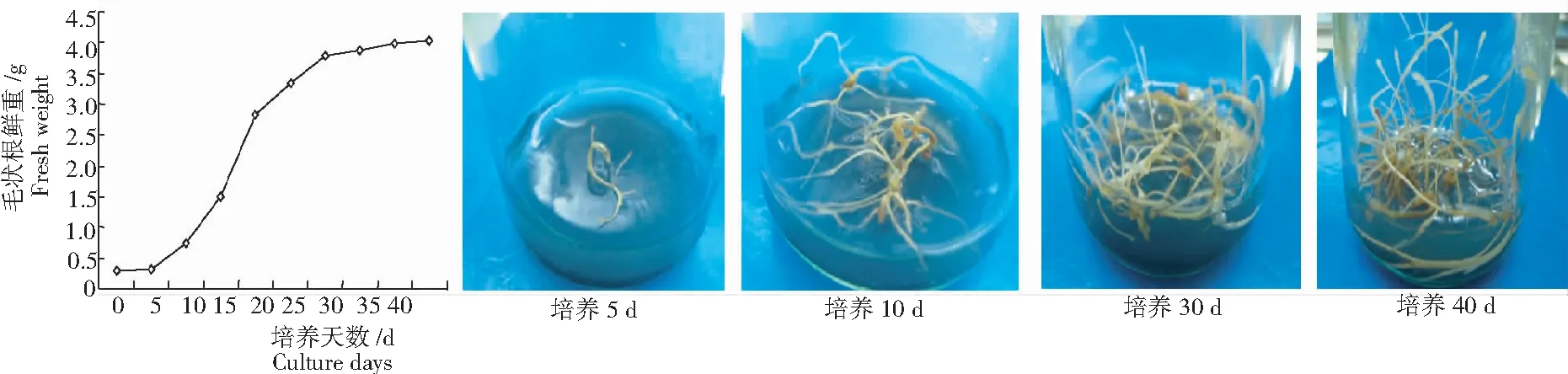
图4 山豆根毛状根的生长曲线与生长情况
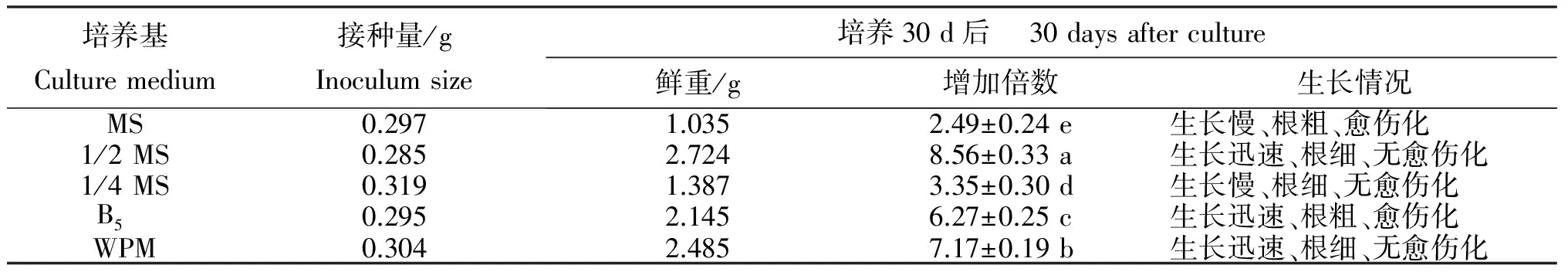
表2 不同培养基处理山豆根毛状根的生长情况

图5 不同培养基处理山豆根毛状根的生长(30 d)
Fig.5 Growth ofS.tonkinensishairy root(30 d)on different culture mediums
2.4.2 不同蔗糖浓度处理山豆根毛状根的生长量 从表3和图6可见,蔗糖浓度在1%~5%,随着浓度的升高山豆根毛状根的生长量呈升高趋势;当蔗糖浓度提高至5%时,最有利于山豆根毛状根生长量的积累,30 d后鲜重为3.387 g,增幅为10.105%;当浓度高于5%时,毛状根生长量反而呈下降趋势,蔗糖浓度为7%时,培养30 d,鲜重只有2.545 g。因此,5%蔗糖浓度最适合山豆根毛状根的培养。
表3 不同蔗糖浓度处理山豆根毛状根的生长量
Table 3 Growth ofS.tonkinensishairy root treated with different concentrations of sucrose
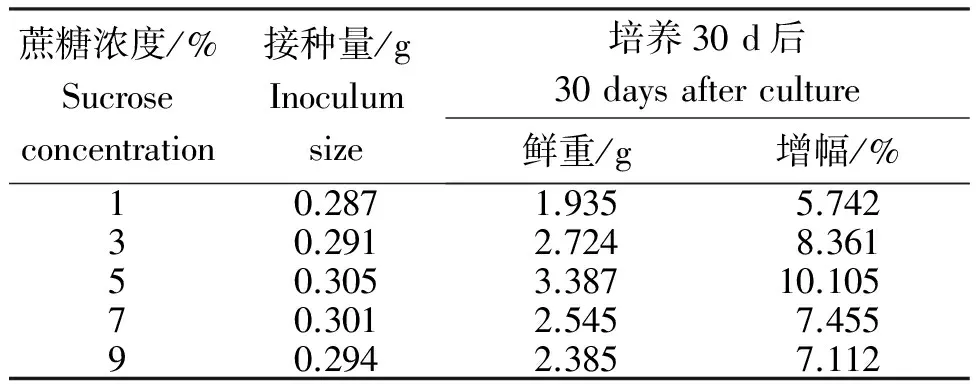
蔗糖浓度/%Sucroseconcentration接种量/gInoculumsize培养30d后30daysafterculture鲜重/g增幅/%10.2871.9355.74230.2912.7248.36150.3053.38710.10570.3012.5457.45590.2942.3857.112
2.4.3 不同外源激素处理山豆根毛状根的生长量 由表4可见,将约0.3 g(鲜重)的毛状根接种到不同外源激素处理的培养液上培养30 d后,培养液组合5的山豆根毛状根鲜重增加倍数最高,达17.3倍。从表5可见,IAA对山豆根毛状根的生长具有极显著影响(F=24.35,p<0.01),IAA的鲜重增加11.7~16.13倍。其中, IAA质量浓度为0.5 mg/L时,鲜重增加最多,增加16.13倍;当质量浓度超过0.5 mg/L时,IAA对山豆根毛状根生长有抑制作用,鲜重增加开始降低。生长素NAA对毛状根的生长影响不显著(p>0.05),但高浓度NAA会使毛状根愈伤化,严重影响毛状根质量。而6-BA的极差0.4比空白因子的极差1.03小。说明,6-BA的效应是不可靠的。因此,根据试验结果可以认为,山豆根毛状根培养的最佳培养液为1/2 MS+0.5 mg/L IAA,在此培养液上形成毛状根的频率较高,质量较好。
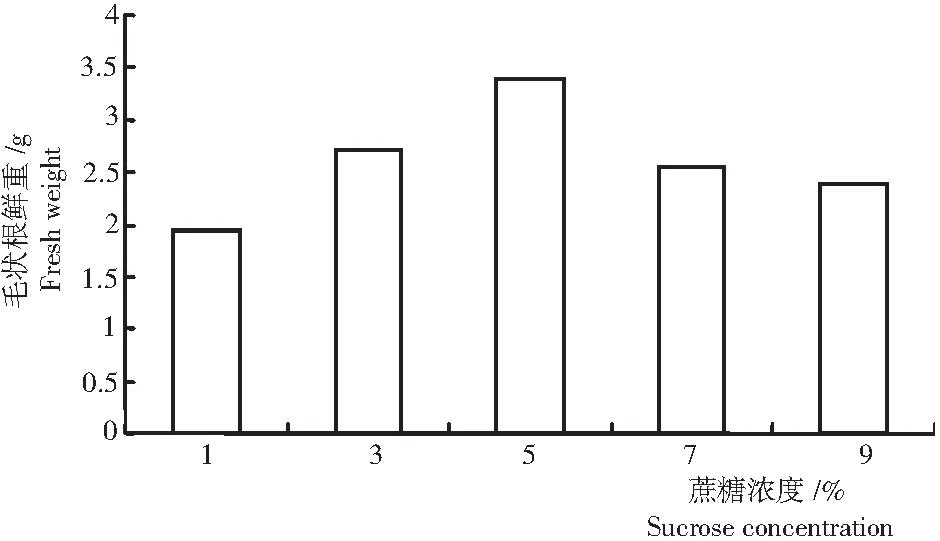
图6 不同蔗糖浓度处理山豆根毛状根的生长量
Fig.6 Growth ofS.tonkinensishairy root treated with different concentrations of sucrose
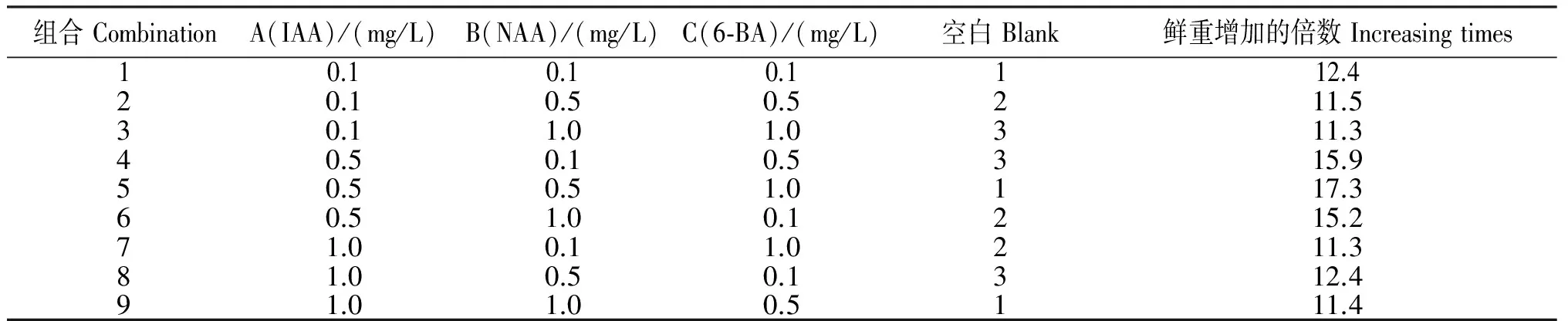
表4 不同外源激素处理对山豆根毛状根的鲜重增加量
表5 不同外源激素处理山豆根毛状根生长的均值与极差
Table 5 Mean and range of the growth ofS.tonkinensishairy root treated with different exogenous hormones
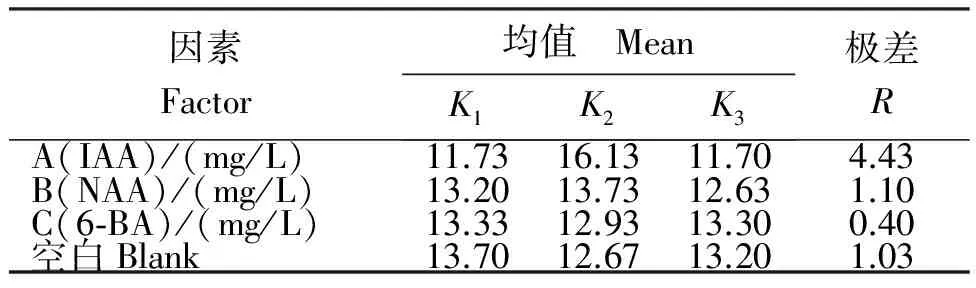
因素Factor均值 MeanK1K2K3极差RA(IAA)/(mg/L)11.7316.1311.704.43B(NAA)/(mg/L)13.2013.7312.631.10C(6⁃BA)/(mg/L)13.3312.9313.300.40空白Blank13.7012.6713.201.03
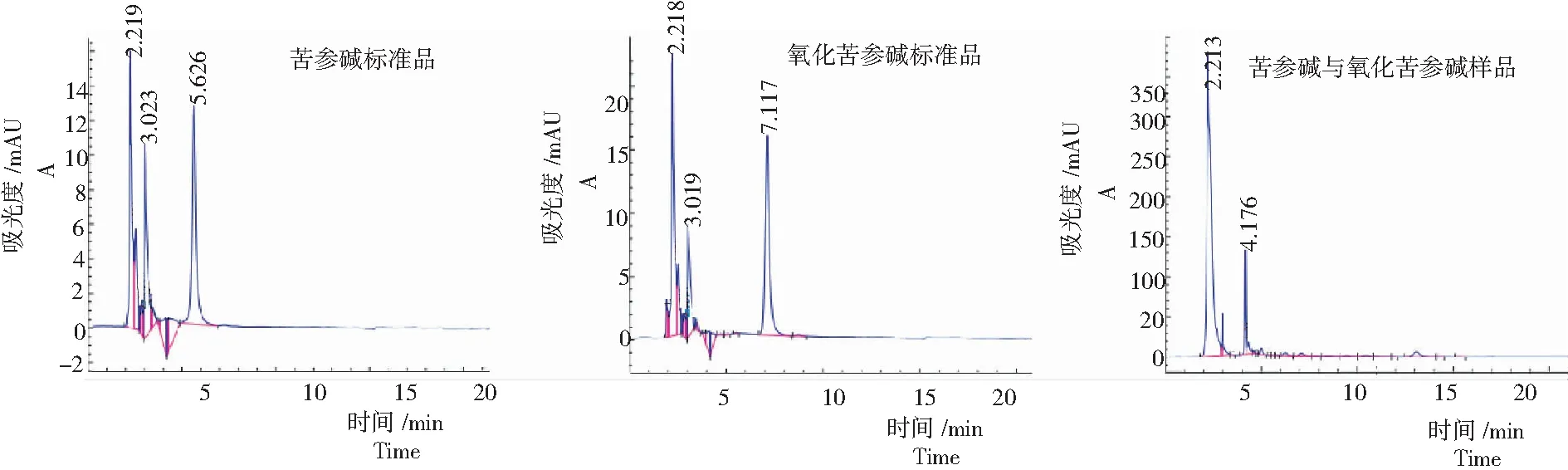
图7 山豆根毛状根的高效液相色谱
2.5 山豆根毛状根的药效
从图7可见,各样品都具有苦参碱与氧化苦参碱,其中,苦参碱含量为0.004 2%,氧化苦参碱含量为0.680 9%,其总量为0.685 1%,未能达到药典规定的0.7%标准,还需进一步深入研究。
3 结论与讨论
基本培养基提供植物生长所需的各种营养成分,包括大量元素、微量元素和维生素等[8]。试验结果可知,基本培养基选择对山豆根毛状根生长起到关键作用。B5和WPM属于低盐浓度培养基,MS属于高盐浓度培养基,1/2 MS和1/4 MS的大量元素分别为MS培养基的1/2与1/4,其余与MS相同,毛状根一般在低盐培养基中生长良好,B5培养基引起毛状根愈伤化,WPM培养基培养的效果略低于1/2 MS,1/4 MS养分又比1/2 MS低。因此,选用1/2 MS作为山豆根毛状根培养的基本培养基。
生长调节物质是培养基中不可缺少的,虽然用量极少,但对植物的生长起到重要的作用[9]。虽然毛状根不需要外源激素就能快速生长,但该研究发现,山豆根毛状根在添加0.5 mg/L IAA的1/2 MS培养液上的生长远高于不添加任何激素的1/2 MS培养液。这与周倩耘等[10-11]添加适当生长素可以促进毛状根生长的研究结果相符。
该试验使用发根农杆菌R1601侵染山豆根无菌苗子叶获得可以稳定继代的山豆根毛状根株系。通过对毛状根生长的培养液、蔗糖浓度和外源激素进行筛选发现,1/2 MS+IAA 0.5 mg/L+5%蔗糖的培养液最有利于山豆根毛状根的生长;但通过对山豆根毛状根有效成分的分析发现,其有效成分含量较低,还需进行深入研究与开发。
[1] 步怀宇,岑举人,王英娟.滇黄芩毛状根的诱导及其黄芩苷含量测定[J].基因组学与应用生物学,2010,29(1):179-184.
[2] 刘 峻,丁家宜,徐 红,等.Ri质粒人参转化系统的建立及鉴定[J].中国中药杂志,2001,26(2):95-98.
[3] BanerjeeS,Rahman L,Uniyal G C,et al.Enhanced production of valepotriates by Agrobacterium rhizogenes induced hairy root cultures of Valeriana wallichii DC[J].Plant Seience,1998,131:203.
[4] KittiPongPatana N,Hock R S,Porter J R.Production of solasodine by hairy root,callus, and cell suspension cultures of Solanum aviculare Forst[J].Organ Cult,1998,52:133.
[5] Robins R J,Bent E G,Rhodes M J C.Studies on the biosynthesis of tropane alkaloids by Datura stramonium L.transformed root cultures biosynthesis[J].Planta,1991,185:385.
[6] 国家药典委员会.中华人民共和国药典:I部[M].2010版.北京:中国医药科技出版社,2010.
[7] 何明焕,邱荣梁,戴保安,等.广豆根抗癌成分苦参碱注射液的研究[J].中成药研究,1981(3):36-38.
[8] 李素华,何松林.基本培养基和激素对常青白蜡腋芽诱导的影响[J].贵州农业科学,2009,37(12):175-176.
[9] 吴丽芳,陆伟东,丁 伟,等.不同激素配比对红掌叶片愈伤组织诱导的影响[J].贵州农业科学,2010,38(8):17-18.
[10] 周倩耘,丁家宜,刘 峻,等.植物激素对人参毛状根生长和皂甙含量的影响[J].植物资源与环境学报,2003,12(1):26.
[11] 张 悦,杨世海.黄秋葵毛状根的诱导及培养[J].时珍国医国药,2011,22(12):2991-2994.
(责任编辑: 王 海)
Establishment and Optimization ofSophoratonkinensisHairy Root Culture
LI Linxuan, WEI Kunhua, YAO Shaochang, TANG Meiqiong, WEI Fan, MIAO Jianhua*
(GuangxiBotanicalGardenofMedicinalPant,GuangxiKeyLaboratoryofMedicinalResourcesProtectionandGeneticImprovement,Nanning,Guangxi530023,China)
To find a new way to explore the orientation culture ofS.tonkinensisplant cells and organs acquiring validly medicinal ingredient and lay the foundation for large-scale production of effective medicinal ingredients. Using co-culture observing the aseptic seedling infected byAgrobacteriumrhizogenesR1601 impact ofS.tonkinensishairy root induction rate and select the best culture medium, according to the different culture medium, different concentrations of sucrose and exogenous hormones on hairy root growth. Results: The highest induction rate(66.67%)was the aseptic seedling infected byA.rhizogenesR1601 for 16 min in the MS + AS 100 μmol / L of solid medium, and the most conducive to the growth of the hairy root ofS.tonkinensisis in 1/2 MS + IAA 0.5 mg/L+ 5% sucrose culture medium.
Sophoratonkinensis; hairy root;Agrobacteriumrhizogenes; culture medium; medicinal plant
2015-04-06; 2015-07-30修回
广西自然科学基金“山豆根高产毛状根系培养体系及次生代谢产物生物合成机理研究”(2011GXNSFD018037),“广豆根多倍体诱导及其生物碱类成分的含量变化规律研究”(2013GXNSFBA019086);公益行业专项“中药饮片质量保障体系研究(一)”(201507002);国家科技重大专项“中药材种子种苗和种植(养殖)标准平台”(2012ZX09304006);广西壮族自治区卫生厅中医药科技专项“根瘤菌对山豆根生长及有效成分的影响研究”(GZPT13-38),“广豆根组培苗质量标准研究”(GZBZ14-14)
李林轩(1986-),男,助理研究员,从事中药资源保护与开发利用研究。E-mail: starry1125@sina.com
*通讯作者:缪剑华(1962-),男,研究员,博士,从事药用植物资源保护与开发利用究。E-mail:mjh1962@vip.163.com
1001-3601(2016)01-0009-0027-05
S482.3+9
A
