牛血清白蛋白荧光猝灭法测定甲紫含量
2016-03-01周谢海程煜凤李改茹
周谢海, 张 龙, 杨 兰, 程煜凤, 李改茹
(新疆医科大学药学院, 乌鲁木齐 830011)
·药学研究·
牛血清白蛋白荧光猝灭法测定甲紫含量
周谢海, 张龙, 杨兰, 程煜凤, 李改茹
(新疆医科大学药学院, 乌鲁木齐830011)
摘要:目的建立基于牛血清白蛋白(BSA)荧光猝灭测定甲紫(MV)含量的荧光分析法。方法选择激发波长为279 nm,发射波长为340 nm,MV与BSA相互作用使其内源性荧光产生猝灭,荧光强度的下降值△I与MV浓度呈线性相关,标准曲线法测定甲紫溶液中MV的含量。结果△I与MV的浓度在2 ~10 μg/mL内呈线性关系,△I=11.709C+0.95(r=0.999 2),加样回收率为97.3%~100.1%,RSD为0.24%~1.7%。3批次医用甲紫溶液中MV的平均含量分别为1.016%、1.011%、1.029%,与标示量一致。结论该法操作简便,灵敏度高,结果准确,可用于低含量甲紫样品的测定。
关键词:荧光猝灭法; 牛血清白蛋白; 甲紫; 含量测定
甲紫(Methyl violet, MV)又名龙胆紫、甲基紫,三苯甲烷类芳香族染料,其溶液稀释后可用作外用药品(紫药水),是皮肤科常用制剂[1]。由于其既可以杀死某些浅表真菌,又可以杀死细菌,因此常作为水产养殖抗真菌添加剂,具有较好的效果[2]。然而MV具有致癌、致畸、致突变等毒副作用,所以许多国家将其列为水产养殖的禁用药物,也成为药物残留监控的主要内容之一[3-4]。《中华人民共和国药典》(2015版)对皮肤科外用甲紫溶液的质量控制方法是重量分析法[5]。该法操作繁琐,耗时长,灵敏度低。血清白蛋白是人和动物血浆中含量最丰富的重要蛋白,具有特殊位点,能与许多金属离子、药物分子和小分子染料产生特异性结合[6-7]。研究表明,MV可通过疏水作用与牛血清白蛋白(BSA)结合,使BSA内源性荧光猝灭,且这种猝灭作用随甲基紫浓度的增大而增强[8]。本研究据此原理,建立MV含量测定的荧光分析法,测定医用甲紫溶液中MV的含量,现报道如下。
1仪器与试剂
荧光光谱仪(RF-5301PC型,日本岛津公司),牛血清白蛋白,BSA(Sigma公司,纯度≥98.5%,批号:SLBG8239V),甲紫(天津市致远化学试剂有限公司,批号:141127),甲紫溶液Ⅰ(河北健宁药业有限公司,批号:140901),甲紫溶液Ⅱ(河北武罗药业有限公司,批号:140801),甲紫溶液Ⅲ(广东恒健制药有限公司,批号:140611),三羟甲基氨基甲烷,Tris(Sigma公司,纯度≥98.5%,批号:WXBB4339V),其余试剂均为分析纯,实验用水为二次重蒸水。
2方法与结果
2.1对照品溶液的制备准确称取0.10 g甲紫,以无水乙醇溶解,用水定容至100 mL,配制成1 mg/L甲紫对照品溶液;另准确称取0.50 g牛血清白蛋白,以0.05 mol/L氯化钠水溶液定容至100 mL,配制成5 mg/L储备液,4℃冰箱保存,备用。
2.2供试品溶液的制备精密移取0.2 mL甲紫溶液至100 mL容量瓶中,蒸馏水定容。取该溶液1.0 mL于10 mL容量瓶中,加BSA适量,用pH为7.1的Tris-HCl缓冲溶液定容,静置10 min,待测。
2.3实验步骤在激发波长λex=279 nm、发射波长λem=340 nm条件下,测定系列甲紫对照品对BSA的荧光猝灭信号△I,以△I对甲紫浓度绘制校准曲线;同法测供试品,代入回归方程求取含量。
2.4甲紫与牛血清白蛋白相互作用的荧光光谱固定BSA浓度为135 μg/mL,以279 nm为激发波长,考察牛血清白蛋白-甲紫体系在340 nm处的荧光强度随甲紫浓度增大而变化的情况。实验结果表明,随甲紫浓度逐渐增大,即MV浓度依次为5、10、20、40、80 μg/mL时,BSA荧光强度呈下降趋势,但其最大发射波长保持不变,见图1。
2.5最佳实验条件的考察
2.5.1仪器记录信号的稳定性考察考虑到荧光物质的荧光强度随温度升高而下降,而待测液放入样品室的时间越长温度越高,而导致其荧光强度下降,故本实验考察待测液放入样品室后0、2、4、6、8、10、12、14、16、18、20 min时荧光强度的变化。结果表明,BSA-MV体系在2~5 min荧光强度稳定,5 min后荧光强度下降明显,见图2。

图1 随MV浓度增加BSA-MV体系荧光光谱变化情况

图2 仪器记录信号的稳定性考察
2.5.2最佳pH 的选择分别考察不同pH值的Tris-HCl缓冲溶液对BSA-MV体系荧光强度的影响。结果表明,当Tris-HCl缓冲液 pH为7.1时,体系的荧光强度最大,见图3。
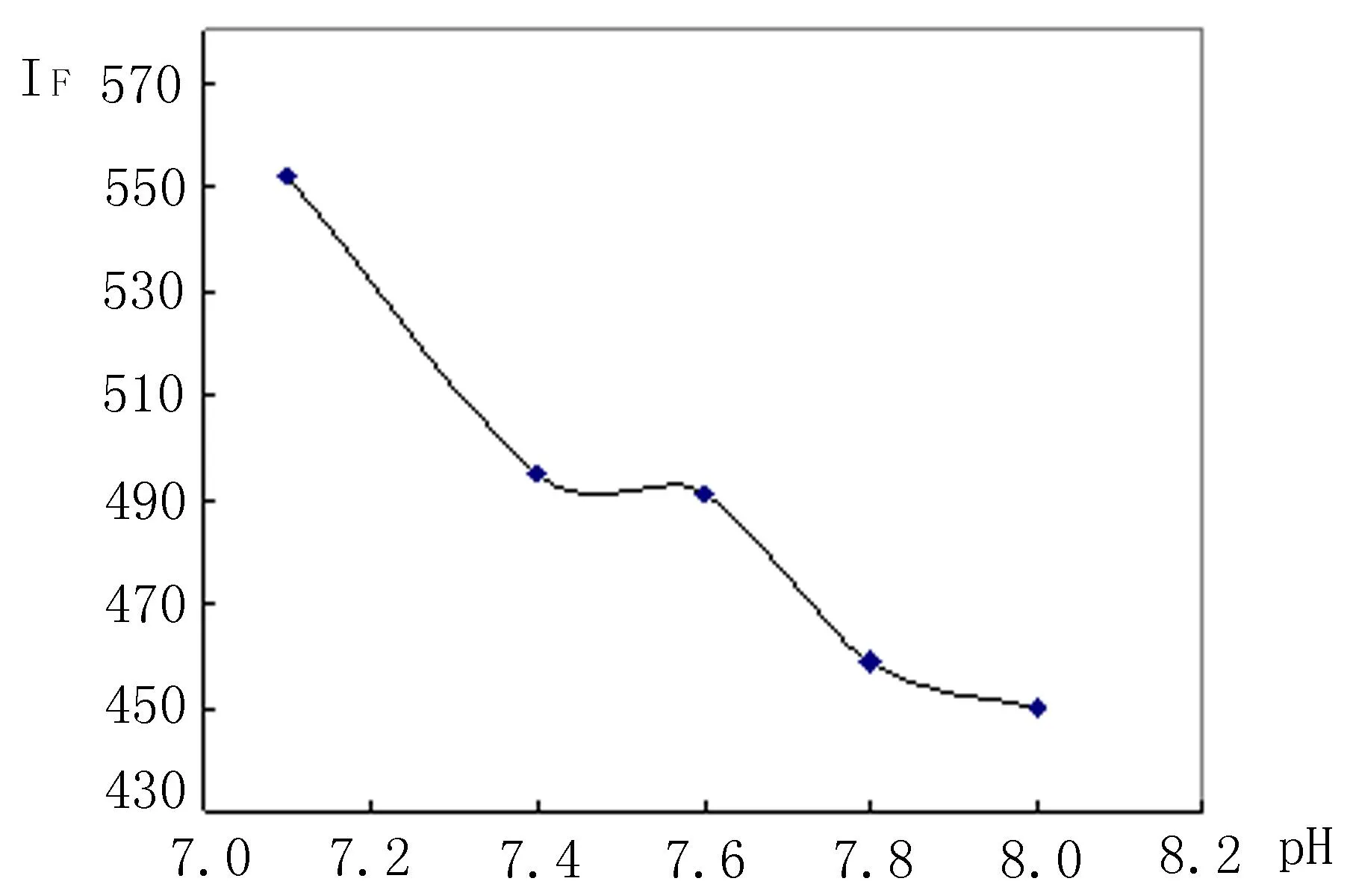
图3 不同pH值对BSA-MV体系荧光强度的影响
2.5.3BSA-MV体系稳定性考察为了考察BSA-MV体系的稳定性,本实验固定甲紫与牛血清白蛋白浓度,分别考察了BSA-MV体系在反应了0、5、10、15、30、60 min时的荧光强度,结果表明,测定体系在室温下反应10 min时荧光强度达到最大,30min后趋于稳定,见图4。
2.6标准曲线的制备固定BSA浓度为135 μg/mL,取“2.1”项下甲紫对照品溶液制成2、4、6、8、10 μg/mL系列BSA-MV测定溶液,按“2.3”项下光谱条件测定,以荧光强度下降值△I对MV浓度作标准曲线,其线性回归方程为△I=11.709C+0.95,相关系数r=0.999 2。说明MV对BSA的荧光猝灭信号与MV浓度线性显著相关。

图4 BSA-MV体系稳定性考察
2.7精密度试验固定BSA浓度为135 μg/mL,准确量取适量甲紫对照品溶液于10 mL容量瓶中,用pH为7.1的Tris-HCl缓冲溶液定容至刻度,配制成2、6、10 μg/mL溶液各3份,按“2.3”项下实验步骤,测得相对标准偏差为0.52%~2.8%。
2.8回收率试验精密移取供试品溶液0.5 mL,按照高、中、低浓度加入甲紫对照溶液1.0、0.4、0.2 mL制成系列测定溶液(n=9)。按“2.3”项下条件测定,并计算回收率,结果表明平均回收率为97.3%~100.1%,RSD为0.24%~1.7%。
2.9样品测定按“2.3”项下条件,分别测定了3批供试品,即甲紫溶液Ⅰ、甲紫溶液Ⅱ和甲紫溶液Ⅲ中MV含量,结果3批甲紫溶液中MV平均含量分别为1.016%、1.011%、1.029%,与标示量一致,见表1。

表1 3批甲紫溶液中甲紫含量(g/100 mL)
3结论
荧光是发射光,是分子、原子吸收光辐射被激发,然后发射出比吸收波长更长的光,是光致发光现象。荧光分析法具有灵敏度高、选择性好、简单快速,且取样量少等特点[9],是药品质量控制中常用的仪器分析法之一。
BSA的内源性荧光主要来源于BSA内部的色氨酸残基和酪氨酸残基[10],当MV与BSA通过疏水作用结合时,BSA 中荧光发色团的微环境及蛋白质分子构象行为的变化,使BSA的荧光强度下降[11~12]。基于此原理,本研究首先考察了BSA与MV作用的最佳实验条件,然后建立了测定MV的荧光猝灭分析法。结果表明,在pH为7.1的Tris-HCl缓冲溶液中,BSA-MV体系在室温下放置约30 min后趋于稳定,说明此时BSA与MV相互作用完全,因此本研究选择BSA-MV的作用时间为30min。并确保样品池放入仪器室中在5 min内完成信号测量,以免放置时间过长样品室内温度升高使信号降低,影响测量的稳定性。在所确定的最佳实验条件下,BSA-MV体系的荧光强度下降值△I在MV浓度为2 ~10 μg/mL内呈线性关系,△I=11.709C+0.95(r=0.999 2),加样回收率为97.3%~100.1%,RSD为0.24%~1.7%,符合方法学要求。用此法测定了3个批次医用甲紫溶液的含量,结果与标示量一致。该法操作简便,结果准确,重复性好,灵敏度高,适合低含量甲紫样品的测定。
参考文献:
[1]Solpana D, Duran S, Saraydin D, et al. Adsorption of methyl violet in aqueous solutions by poly(acrylamide-co-acrylic acid) hydrogels[J]. Radiation Physics and Chemistry, 2003, 66(2):117-127.
[2]Mittal AK, Gupta SK. Biosorption of cationic dyes by dead macro fungus Fomitopsis carnes: batch studies [J].Water Science and Technology, 1996, 34(10):81-87.
[3]赵玲子,迟赫,滕洪辉,等.甲基紫对牛血清白蛋白毒性作用的光谱学研究[J].辽宁化工,2011, 40(12):1237-1240.
[4]肖虎鹏, 周小理, 韩生. CE-UV-Vis法测定鲫鱼中结晶紫[J]. 化学世界, 2012, 53(1):13-23.
[5]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社, 2015:219-220.
[6]罗宗铭,张熳,崔英德,等.蛋白质与酸性染料相互作用的分光光度研究[J].光谱学与光谱分析,2001,21(11): 251-253.
[7]吴刚珂,颜承农,刘义.荧光分光光度法研究对乙酰氨基酚与牛血清白蛋白之间的相互作用[J].化学分册,2007, 43(11): 964-967.
[8]尹爱萍,白佛,李慧卿.甲基紫与牛血清白蛋白作用的荧光光谱研究[J].分析试验室,2012, 31(2): 71-74.
[9]郭德济.光化学分析法[M].重庆:重庆大学出版社,1990:173.
[10]陈芳,陈妍,张彦峥,等.牛血清白蛋白的荧光稳定性研究[J].应用化工,2011,40(9): 1508-1511.
[11]谭帼馨,崔英德,肖楚民.牛血清白蛋白与光谱探针相互作用机理的研究[J].分析试验室,2005, 24(10): 26-28.
[12]彭贞,张忠平,薛建跃.结晶紫与蛋白质相互作用的电化学行为的研究[J].化学世界,2006, 47(2):78-80.
(本文编辑施洋)
Determination of methyl violet by fluorescence quenching method base on the interaction of bovine serum albumin with methyl violet
ZHOU Xiehai, ZHANG Long, YANG Lan, CHENG Yufeng, LI Gairu
(CollegeofPharmacy,XinjiangMedicalUniversity,Urumqi830011,China)
Abstract:ObjectiveTo establish a quantitative analysis of Methyl violet(MV) by fluorescence spectroscopy. MethodsAt an excitation wavelength of 279 nm and an emission wavelength of 340 nm, the entogenous fluorescence of bovine serum albumin (BSA) was quenched as the interaction of bovine serum albumin with methyl violet. The decrease of fluorescence △I and the MV concentration showed a linear correlation. The content of MV in Methylrosanilinium Chloride Solution was determined by calibration curve method. ResultsThe △I showed a good liner relation with the concentration of the MV in 2~10 μg/mL, △I=11.709C+0.95(r=0.999 2). The recovery was 97.0%~100.4%, and RSD was 0.24%~1.7%. Three batches of medical Methylrosanilinium Chloride Solution were determined, and the average concentrations were 1.016%, 1.011%, 1.029%,respectively,which were consistent with the labeled amounts. ConclusionThe proposed method is simple, accurate and sensitive, and it can be applied to determine the trace amount of the Methyl violet.
Keywords:fluorescence quenching method; bovine serum albumin (BSA); Methyl violet; quantitative analysis
[收稿日期:2015-11-9]
doi:10.3969/j.issn.1009-5551.2016.02.013
中图分类号:R914
文献标识码:A
文章编号:1009-5551(2016)02-0184-03
作者简介:周谢海(1992-),女,在读本科,研究方向:药物分析。通信作者:李改茹,女,硕士,副教授,研究方向:药物分析,E-mail:gruli104@163.com。
基金项目:新疆医科大学大学生创新基金(CX2014031)
