3-甲氧基异甘草素的合成及其对宫颈癌细胞的影响
2016-03-01杨旭超西力扎提阿不来提木合布力阿布力孜任丙昭
杨旭超, 西力扎提·阿不来提, 木合布力·阿布力孜, 任丙昭
(新疆医科大学药学院药物化学有机教研室, 乌鲁木齐 830011)
3-甲氧基异甘草素的合成及其对宫颈癌细胞的影响
杨旭超, 西力扎提·阿不来提, 木合布力·阿布力孜, 任丙昭
(新疆医科大学药学院药物化学有机教研室, 乌鲁木齐830011)
摘要:目的以异甘草素(ILG)为先导化合物进行化学合成其衍生物3-甲氧基异甘草素(3-MO-ILG),探讨其体外抗宫颈癌活性。方法采用硼酸催化高温法、羟基保护法、微波辅助碱催化法3种方法进行羟醛缩合反应而制备目标化合物;以人宫颈癌SiHa细胞为体外模型,用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)法测定对癌细胞增长的抑制率;用流式细胞仪测定促进癌细胞凋亡作用,以顺铂作为阳性对照组。结果用硼酸催化高温法、羟基保护法、微波辅助碱催化法3种方法所得到的3-甲氧基异甘草素产率分别为8.9%、9.27%和57.60%。3-甲氧基异甘草素对SiHa细胞具有较强抑制增殖作用,当药物浓度为20 ~150 μg/mL、作用时间为24 h时,其抑制率可达93.5%;当作用时间达到72 h时,抑制率最强。3-甲氧基异甘草素在100 μg/mL时,对SiHa细胞早期凋亡率为38.6%,晚期凋亡率为1.4%,具有明显的促细胞凋亡作用。结论微波辅助碱催化方法在查尔酮类化合物的合成中具有产率较高的方法。3-甲氧基异甘草素对SiHa细胞具有较强抑制增殖作用,并且具有明显浓度和时间依赖性;同时对SiHa细胞具有明显的促细胞凋亡作用。
关键词:3-甲氧基异甘草素; 羟醛缩合反应; 人宫颈癌SiHa细胞; 抗癌活性
目前在全世界,子宫颈癌(cervical carcinoma)是引起妇女因癌症死亡的主要原因之一,仅次于乳腺癌[1]。我国妇女宫颈癌的病死率大约占全世界的1/3[2]。尤其是在遗传易感性较高的维吾尔族妇女子宫颈癌的发病率显著高于其他民族[3]。
目前对于癌症,化疗是一种有效的治疗方法,然而临床现有的化疗药物存在毒性大和耐受性差的缺点。传统天然药物具有毒副作用少和抗癌活性较显著等特点[4]。查尔酮广泛分布于大多数的植物体中的黄酮类和异黄酮类生物合成最重要前体化合物,其化学结构是1,3-二苯基丙烯酮,由2个芳香环和3个碳原子的α,β-不饱和羰基连接组成,具有较大的柔性,能与不同的受体结合,呈现出广泛的生物活性,如抗氧化[5]、抗癌[6-8]、降血糖[9]、抗组胺[10]、抗病毒[11]、细胞保护[12]及抗炎[13]。
本课题组前期研究发现,与异甘草素及其他衍生物相比较,3-甲氧基异甘草素(高紫铆查尔酮)在低浓度时对Bel-7402细胞具有较强的抗增殖活性[14]。因此,此类化合物具有在体内研究抗癌活性的价值。由于异甘草素衍生物属于多羟基查尔酮类化合物,在羟醛缩合反应中,多羟基查尔酮含有多个羟基,在很大程度上能够阻碍反应进行,羟基越多反应产率越低,甚至没有反应。
为了解决这个问题,本研究主要是针对本课题组前期利用酸性催化剂、羟基保护法和微波固相合成的方法来提高目标化合物的产率,寻找一种绿色无污染、操作简便、成本低、产率高的方法;并选择此方法合成异甘草素衍生物,利用人子宫颈癌SiHa细胞为体外模型,采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)法和流式细胞仪法研究各衍生物对癌细胞增殖的抑制活性及促进癌细胞凋亡作用,筛选出具有抗癌活性强、对正常细胞的毒性小、不良反应少、易于临床应用的候选药物;为化学结构修饰及药理活性筛选研究,为后续研究奠定重要的物质基础。
1材料和方法
1.1仪器CW-2000 型超声微波协同萃取仪(上海新拓分析仪器科技有限公司),定性鉴别用TLC板(Silica gel 60 F254, merck),旋转蒸发仪(N-1001,上海爱朗仪器),磁力搅拌水浴锅(PS-1000,Tokyo Rikakikai COLTD),恒温循环水槽(HX-205,北京长流科学仪器),电热套(DRT-SX型,郑州长城科工贸),增力电动搅拌器(JJ-1,江苏省金坛市医疗仪器),暗箱式自动紫外分析仪(2F-2C型上海安亭电子仪器厂),超声仪器(SK3200H,上海科导超声仪器),电子分析天平(AB104-N,梅特乐托利多),抽滤泵(SHB-Ⅲ,郑州长城科工贸),WRS-1A型数字熔点测定仪(上海精密仪器),核磁共振仪(1HNMR Varian CDCl3)。
1.2试药2,4-二羟基苯乙酮,香草醛,中性氧化铝,氯甲基甲醚,硼酸,乙二醇,3-甲氧基异甘草素标准品,氢氧化钾,氢氧化钠,无水碳酸钾,无水硫酸钠,冰醋酸,浓盐酸,稀盐酸,无水乙醇,乙醚,环己烷,丙酮,石油醚,乙酸乙酯, 柱层析硅胶(200~300目,青岛海洋化工厂分厂),上述化学试剂均为分析纯。
1.3方法
1.3.1合成方法 采用3种方法进行合成目标化合物:(1)硼酸催化高温法:2,4-二羟基苯乙酮和香草醛,在以硼酸为催化剂的条件下进行羟醛缩合反应,得到目标化合物;(2)羟基保护法:采用选择性高的羟基保护剂——氯甲基甲醚,对羟基进行保护,然后羟醛缩合,再脱保护,得到目标化合物;(3)微波辅助碱催化法:采用以中性氧化铝为固相载体的方法,以碱为催化剂,在微波辐射的作用下得到目标化合物。如图1所示。
1.3.2 合成操作
1.3.2.1硼酸催化高温法(a)在三口烧瓶中依次加入香草醛4.56 g (0.03 mol)、2,4-二羟基苯乙酮4.56 g (0.03 mol)、H3BO42.00 g (0.03 mol)、乙二醇15 mL(起助溶作用)和环己烷加热至反应温度70~80℃时,呈液体状;再迅速升高温度至100℃以上,反应开始进行,羟醛缩合脱水,此时环己烷带走水分,有利于反应向正方向移动;随着温度继续升高,溶液的颜色从无色逐渐变成橙黄色,当温度升高至120~130℃时反应6 h,溶液的颜色变成深红棕色。将反应液倒入盛有20 mL水的烧杯中,瓶内剩余物用热水洗出,水浴加热烧杯,趁热滤出上清液,清液冷却后即析出未反应完全的香甲醛,沉淀经硅胶柱层析(Ⅴ石油醚∶Ⅴ乙酸乙酯=2∶1)洗脱,得黄色针状结晶0.72 g,产率约8.9%。清液回收香甲醛2 g。
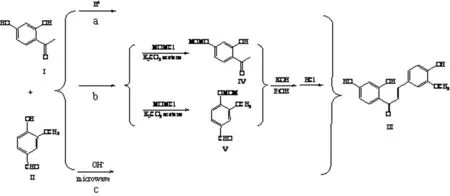
图1 3-甲氧基异甘草素合成途径
1.3.2.2羟基保护法(b)化合物IV合成:将2,4-二羟基苯乙酮7.61 g(0.05 mol)、碳酸钾4.15 g(0.03 mol)和丙酮(200 mL)放置在500 mL圆底烧瓶中,室温下快速滴加用丙酮50 mL稀释的氯甲基甲醚12.5 mL(0.15 mol)溶液,加毕之后室温下反应2 h,滤除碳酸钾,蒸干滤液,得到淡黄色油状物。经TLC薄层鉴定,采用硅胶柱层析分离,以Ⅴ石油醚∶Ⅴ乙酸乙酯=4∶1为洗脱剂,得到白色的粉末状Ⅳ固体4.785 0 g,产率约为48.8%。
化合物Ⅴ合成:将香草醛7.61 g(0.05 mol)、碳酸钾4.15 g(0.03 mol)和丙酮(200 mL)放置于500 mL圆底烧瓶中,室温下快速滴加用丙酮50 mL稀释的氯甲基甲醚 12.5 mL(0.15 mol)溶液,加毕之后,室温下反应2 h,滤除碳酸钾,Ⅴ石油醚∶Ⅴ乙酸乙酯=4∶1为洗脱剂,得到白色的粉末状V固体4.127 6 g,产率约为42.5%。
将所得Ⅳ和Ⅴ加入适量乙醇溶解,在冰浴下滴加50%氢氧化钾乙醇溶液(约7.2 mL),结束之后自然升温,在室温下搅拌24 h,TLC跟踪反应。反应完毕之后用乙酸乙酯萃取,有机层用无水硫酸钠干燥,所得到黄色块状固体Ⅳ;所得化合物VI的甲醇(约10 mL)溶解,缓慢滴加稀盐酸,在70℃条件下搅拌回流25 min。加少量的水用乙酸乙酯(3×20 mL)萃取,合并有机相,依次用蒸馏水,饱和食盐水洗涤,再用无水硫酸钠干燥。除去干燥剂,减压蒸去溶剂,用硅胶柱层析分离,得到黄色粉末状Ⅲ固体0.475 2 g,产率约为9.27%。
1.3.2.3微波辅助碱催化合成法(c)将2,4-二羟基苯乙酮(2 mmol×5)和香草醛(2 mmol×5)与中性氧化铝(1.6 g×5)混合均匀,加入研细的氢氧化钾(0.8 g×5),放置在研钵中进行充分研磨。所得混合物放入超声-微波协同萃取仪进行微波反应,设定功率为150 W,反应时间为100 s。反应结束之后,反应生成物变成红橙色固体,通过TCL监测。将反应混合物冷却到室温,加入预先冷冻的冰蒸馏水250~300 mL进行充分搅拌溶解;然后把水不溶性固体抽滤,所得滤液用2 mol/L HCl进行酸化,并不断充分搅拌溶液使得pH值达到1~2,出现大量的沉淀,放入冰箱中静置10 min之后进行抽滤,用蒸馏水洗涤3次,得到黄色固体粗品,干燥后称量得5.0 g。最后,用硅胶柱层析进行纯化,以Ⅴ石油醚∶Ⅴ乙酸乙酯=2∶1为洗脱剂,收集黄色馏分,减压蒸去有机溶剂,得黄色固体1.65 g,产率为57.60%。
1.4体外抗癌活性研究以人子宫颈癌SiHa细胞作为体外抗癌生物模型,采用MTT法测定目标化合物对子宫颈癌细胞增殖抑制活性;采用流式细胞仪技术的Annexin V-FITC/PI 双染法检测目标化合物对癌细胞的凋亡作用,以顺铂为阳性对照组。
1.4.1样品溶液制备将目标化合物以100% DMSO溶解之后,分别用RPMI1640培养基和DMEM培养基稀释成含有5%DMSO母液,经0.22 μm过滤器除菌后备用。药物浓度梯度12.5、25、50、100、150、200 μg/mL进行配制。将目标化合物DMSO溶液与培养基溶液体积之比定位药物浓度。
1.4.2细胞培养在37℃和5%CO2条件下,将SiHa细胞置于含有10%胎牛血清(FBS)、100 U/mL青霉素、100 U/mL链霉素的DMEM完全培养基中培养,每隔2~3天更换其所需培养基,待细胞融合度达80%时,用胰蛋白酶(0.25%)消化法以1∶3或1∶4比例传代。
1.4.3MTT法测定细胞增殖活性取对数期的人宫颈癌SiHa细胞,接种于96孔板(1×104个/mL),每孔200 μL,使细胞数量控制在1×104个/孔,分散均匀,培养24 h之后,进行药物干预实验;分别采用阴性对照组、阳性对照组和药物实验干预组。其中,阴性对照组用DMSO作为对照,阳性对照组用市售顺铂注射液作为对照,药物实验干预组按照12.5、25、50 、100、150、200 μg/mL的浓度梯度进行干预,分别对SiHa细胞干预24、48和72 h,最后采用酶标仪在单波长570 nm处测定OD值,按照细胞生长抑制率(IR)(%)=[(OD空白组-OD实测组)/OD空白组]×100%,计算细胞存活率和细胞抑制率。
1.4.4流式细胞仪测定细胞凋亡活性取对数期生长人宫颈癌SiHa细胞,接种于6孔培养板,使细胞数量控制在1×105个/孔,分散均匀,培养24 h之后进行药物干预实验;药物实验干预组按照高、中、低3个的浓度梯度进行配制,分别对SiHa细胞干预24 h,制成细胞悬浮液,然后1 000 r/min离心5 min,用PBS充分洗涤2次,加入500 μL的Binding Buffer悬浮细胞,加入5 μL Annexin V-FITC混匀后,加入PI 5 μL,混匀,室温、避光反应5~15 min,分别用荧光显微镜、流式细胞仪检测细胞凋亡情况。
1.5统计学处理使用SPSS17.0统计软件进行统计学分析,采用单因素方差分析进行同一时间点,药物干预组与阳性对照组比较,以P<0.05为差异有统计学意义。
2结果
2.1化合物的结构鉴定化合物(E)-1-(2,4-dihydroxyphenyl)-3- (3′-oximethyl-4′-hydroxyphenyl)-2- propen-1-one(3-甲氧基异甘草素):黄色针状结晶,mp: 192℃~194℃。不溶于水,微溶于氯仿,溶于无水乙醇和DMSO,易溶于碱性水溶液。1H-NMR(DMSO) δppm:6.39 (1H, d, J=5Hz, CH=),6.72~6.92(3H, m, ArH),7.45~7.69(3H, m, ArH), 7.76(1H, d, J=15Hz, CH=),10.628(1H, s, OH),13.67(1H, s, OH)。 IR (KBr) cm-1:3342(OH), 1628(Cα=Cβ)。 MS m/s 计算值(calcd for) C16H14O5:M+286.0828;测定值(Found):M+286.082 0。
2.2化合物Ⅲ对SiHa细胞增殖活性采用MTT法测定目标化合物3-甲氧基异甘草素(3-MO-ILG)对人宫颈癌SiHa细胞的抑制率的实验结果,经过反复多次实验,当药物浓度为50~200 μg/mL、药物作用时间为24、48、72 h时对子宫颈癌SiHa细胞增殖的抑制率分别为29.8%~93.5%、33.2%~96%、36.7%~97.9%。在同一时间点时,随着药物浓度的增加,药物对照组的细胞抑制率高于阳性对照组,其差异具有统计学意义(P<0.05)。随着药物作用时间的增加,3-甲氧基异甘草素对SiHa细胞的抑制率具有较强的时间依赖性(表1)。

表1 3-MO-ILG以不同浓度在24、48和72 h对SiHa细胞抑制率/%
注:与空白对照组比较,*P<0.05。
2.3流式细胞仪测定化合物对SiHa细胞凋亡作用DMSO阴性对照组的早期凋亡率为1.8%,晚期凋亡率为0.5%;顺铂阳性对照组的早期凋亡率为16.8%,晚期凋亡率为0.2%;浓度为12.5 μg/mL的药物干预组早期凋亡率为8.7%,晚期凋亡率为0.5%;浓度为100 μg/mL药物干预组的早期凋亡率为38.6%,晚期凋亡率为1.4%;浓度为6.25 μg/mL药物干预组的早期凋亡率为8.2%,晚期凋亡率为0.2%(图2)。
3讨论
鉴于传统化疗药物的毒副作用大的问题,从天然药物有效成分中筛选作用机理独特、抗癌生物活性强而毒副作用少的新型抗癌候选药物,已成为抗癌新药研究热点。异甘草素是甘草中一种含量非常微量的查尔酮类化合物,因对多种肿瘤有抑制作用而对正常细胞的毒性小而显示出较好的天然先导化合物的潜力。本课题组前期研究发现,在查尔酮类化合物中,多羟基查尔酮的抗癌生物活性比较强,具有潜在的研究价值[14]。根据药物设计原理,对异甘草素进行甲氧基化修饰制备甲氧基查尔酮类衍生物3-甲氧基异甘草素(3-MO-ILG, 化合物Ⅲ)。本研究试过硼酸催化高温法和羟基保护法[15],均没有微波固相合成产率高。对其制备工艺进行筛选和优化,筛选出微波固相合成方法,该方法操作方便,需要反应的时间短,绿色无污染,产率较高,可达57.60%。

注:A: 阴性对照组DMSO; B: 阳性对照组顺铂; C: 浓度为12.5 μg/mL药物干预组; D: 浓度为100 μg/mL药物干预组; E: 浓度为6.25 μg/mL药物干预组。
图33-MO-ILG对人子宫颈癌SiHa细胞凋亡作用
微波干法有机反应是将反应物在氧化铝中进行的微波反应。无机固体载体与微波只有弱偶合作用。而固体介质表面上所吸附的有机反应物能充分吸收微波能量,活化后使反应速率大大提高。微波辐射加热方式不同于传统的加热,在极短的时间内,能提供更大的能量,更有利于化学键的断裂。由于反应中不存在因溶剂挥发而形成高压、高热的危险,可在相对安全、温和的条件下利用普通微波炉在敞口容器中进行,具有安全、高效、操作方便、产物纯化容易、装置简单等优点,避免了大量有机溶剂的使用,对解决环境污染具有现实意义。
经过多次试验,得到最佳反应功率为150~200 W。当功率<100 W时,反应物几乎未见变化;功率>250 W时,由于单位时间的能量过高,反应物会燃烧、碳化,从而导致产率下降。
在体外活性研究中,选用570 nm为MTT法检测波长,以消除目标化合物自身的颜色对光吸收的干扰。然后以人子宫颈癌SiHa细胞为模型,目标化合物对其进行细胞增殖的抑制活性进行研究,结果表明,目标化合物(3-MO-ILG)对SiHa细胞具有较强抑制增殖作用,浓度在150 μg/mL时其抑制率可达93.5%,而且化合物对癌细胞的增长抑制率显示出比较强的浓度和时间依赖性,当作用时间达到72 h时,抑制率最强。
为了进一步验证MTT法的结果,采用流式细胞仪法测定3-甲氧基异甘草素对SiHa细胞的凋亡作用,结果表明3-甲氧基异甘草素在100 μg/mL时,其对SiHa细胞的凋亡率可达40%(早期凋亡率为38.6%,晚期凋亡1.4%),具有明显的促进凋亡作用。总之,此结果对查尔酮类化合物的结构设计及抗癌药理作用机制的研究将提供重要的参考依据。
参考文献:
[1]Saslow D, Castle PE, Cox JT, et al. American ancer society guideline for human papillomavirus vaccine(HPV) use to prevent cervical cancer and its precursors[J]. CA Cancer J Clin,2007,57(1):7-28.
[2]Li S, Hu T, Lv W, et al. Changes in prevalence and clinical characteristics of cervical cancer in the People’s Republic of China: a study of 10,012 cases from a nationwide working group[J]. Oncologist,2013,18(10):1101-1107.
[3]Parkin DM, Bray F, Ferlay J, et al. Estimating the world cancer burden: Globocan 2000[J]. Int J Cancer, 2001,94(2):153-156.
[4]Aggarwal BB, Shishodia S. Molecular targets of dietary agents for prevention and therapy of cancer[J]. Biochem Pharmacol, 2006, 71(10): 1397-1421.
[5]Thanigaimani K, Arshad S, Khalib NC, et al.A new chalcone structure of (E)-1-(4-Bromophenyl)-3-(napthalen-2-yl)prop-2-en-1-one: Synthesis, structural characterizations, quantum chemical investigations and biological evaluations[J]. Spectrochim Acta A Mol Biomol Spectrosc,2015,149:90-102.
[6]Akram SMM, Peerzadah GM, Banday AH. Scope of non-estrogenic steroidal congeners against breast cancer[J]. J Adv Chem,2013,5:626-632.
[7]Banday AH, Giri AK, Parveen R,et al. Design and synthesis of D-ring steroidal isoxazolines and oxazolines as potential antiproliferative agents against LNCaP, PC-3 and DU-145[J]. Steroids,2014,83:93-98.
[8]Martel-Frachet V, Keramidas M, Nurisso A, et al. IPP51, a chalcone acting as a microtubule inhibitor with in vivo antitumor activity against bladder carcinoma[J]. Oncotarget,2015,6(16):14669-14686.
[9]Dimmock JR, Elias DW, Beazely MA, et al. Bioactivities of chalcones[J]. Curr Med Chem,1999,6(12):1125-1149.
[10]Detsi A, Majdalani M, Kontogiorgis CA, et al. Natural and synthetic 20-hydroxy-chalcones and aurones: synthesis, characterizationand evaluation of the antioxidant and soybean lipoxygenaseinhibitory activity[J]. Bioorg Med Chem,2009,17(23):8073-8085.
[11]Mahapatra DK, Asati V , Bharti SK, et al. Chalcones and their role in management of diabetes mellitus: structural and pharmacological perspectives[J]. Eur J Med Chem, 2015,92:839-865.
[12]Han JY, Cho SS, Yang JH, et al. The chalcone compound isosalipurposide (ISPP) exerts a cytoprotective effect against oxidative injury via Nrf2 activation[J]. Toxicol Appl Pharmacol,2015,287(1):77-85.
[13]Martinez RM, Pinho-Ribeiro FA, Steffen VS, et al. Hesperidin methyl chalcone inhibits oxidative stress and inflammation in a mouse model of ultraviolet B irradiation-induced skin damage[J]. J Photochem Photobiol B,2015 ,148:145-153.
[14]徐方野,木合布力·阿布力孜,高苗苗,等. 甘草查尔酮类化合物对人肝癌 Bel-7402细胞的抗癌活性研究[J]. 新疆医科大学学报,2013,36(2):143-149.
[15]戈夏,李建其.木犀草素和奥罗波尔的合成[J]. 中国医药工业杂志,2003,34(4):159-161.
(本文编辑杨晨晨)
Study on the synthesis of 3-Methoxy isoliquiritigenin and its influence on cervical cancer cells
YANG Xuchao, Shirzat Ablat, Mourboul Ablise,REN Bingzhao
(DepartmentofMedicinalandOrganicChemisty,CollegeofPharmacy,
XinjiangMedicalUniversity,Urumqi830011,China)
Abstract:ObjectiveTaking isoliquiritigenin as the lead compounds to synthesize 3-Methoxy isoliquiritigenin, which is the derivatives of isoliquiritigenin, and explore its anticancer activity to human cervical cancer cell in vitro. MethodsThe target compound was prepared by aldol condesation reaction with three methods (catalyzed method on high temperature by boric acid, hydroxyl protected method , microwave-assisted base-catalyzed method). Taking human cervical cancer SiHa as the vitro model, the inhibition rate of SiHa cell was detected by MTT method and the apoptosis of SiHa cell was measured by flow cytometry.Cisplatin was positive control group. ResultsThe yield of the target product was 8.9%, 9.27% and 57.60% respectively by using above three methods. 3-methoxy isoliquiritigenin had a stronger inhibitory effect on SiHa cells. When the drug concentration of 3-MO-ILG was 20-150 μg/mL, and the action time was 24h, the inhibition rate was 93.5%. When the drug concentration of 3-MO-ILG was 100 μg/mL, it had the clear pro-apoptotic effect on Siha cells(the rate of early period apoptotic was 38.6%, and the rate of late apoptotic was 1.4%). ConclusionMicrowave-assisted base-catalyzed method has higher yield on synthesis of chalcones. 3-methoxy isoliquiritigenin had a stronger inhibitory effect and pro-apoptotic effect on SiHa cells and had significant concentration and time dependence.
Keywords:3-Methoxy isoliquiritigenin; aldol condesation reaction; the SiHa cell of human cervircal cancer; antitumor activity
[收稿日期:2015-10-23]
doi:10.3969/j.issn.1009-5551.2016.02.011
中图分类号:R966
文献标识码:A
文章编号:1009-5551(2016)02-0173-06
作者简介:杨旭超(1991-),男,硕士,研究方向:天然药活性成分的药用研究。通信作者:木合布力·阿布力孜,男(维吾尔族),教授,博士,博士生导师,研究方向:天然药活性成分的药用研究,E-mail: mourboul@hotmail.com。
基金项目:国家自然科学基金(81260379); 新疆研究生科研创新项目(XJGRI2014094)
