大鼠在体单向肠灌流模型研究石榴皮多酚中鞣花酸的肠吸收动力学
2016-03-01张慧慧高晓黎
田 莉,张慧慧,谢 莉,畅 静, 高晓黎
(1新疆医科大学中医学院; 2新疆名医名方与特色方剂学重点实验室; 3新疆医科大学药学院, 乌鲁木齐 830011)
大鼠在体单向肠灌流模型研究石榴皮多酚中鞣花酸的肠吸收动力学
田莉1,2,张慧慧1,谢莉1,畅静1, 高晓黎3
(1新疆医科大学中医学院;2新疆名医名方与特色方剂学重点实验室;3新疆医科大学药学院, 乌鲁木齐830011)
摘要:目的考察石榴皮多酚中鞣花酸的大鼠在体肠吸收动力学特征。方法采用大鼠在体单向肠灌流模型,选用HPLC法测定灌流液中鞣花酸在大鼠不同肠段以及在不同质量浓度下的吸收情况。结果鞣花酸在不同肠段均有吸收,在实验浓度范围内,大鼠十二指肠、空肠、回肠和结肠中鞣花酸单体的吸收速率常数(Ka)分别为4.44×10-2~7.11×10-2/min、6.58×10-2~8.60×10-2/min、5.61×10-2~7.02×10-2/min、3.92×10-2~5.95×10-2/min;石榴皮多酚精制物中鞣花酸的Ka分别为7.00×10-2~7.81×10-2/min、6.32×10-2~7.96×10-2/min、4.97×10-2~5.58×10-2/min、3.50×10-2~4.68×10-2/min。鞣花酸单体和石榴皮多酚精制物中的鞣花酸的Ka和表观渗透系数(Papp)差异有统计学意义(P<0.05)。结论鞣花酸在大鼠肠道内不存在特殊“吸收窗”,石榴皮多酚精制物中的其他成分可能对鞣花酸的吸收有促进作用,在不同肠段鞣花酸的质量浓度对Ka和Papp值影响不大,吸收机制可能为主动转运。
关键词:石榴皮多酚; 鞣花酸; 肠吸收; 单向肠灌流模型; HPLC
石榴多酚主要分布于石榴皮中,含有安石榴苷、鞣花酸、没食子酸、儿茶素、原花青素及少量黄酮类等多酚成分[1-2]。鞣花酸是一种可水解的单宁物质,为没食子酸的二聚衍生物,约占石榴皮多酚的20%[3],分子式为C14H6O8,分子量为302.28。现代研究表明,鞣花酸体内外均具有很强的抗氧化活性,具有抑制肿瘤生长及抗动脉粥样硬化等作用[4-5]。药物肠吸收动力学特性在一定程度上可反映药物口服后的整体吸收情况,是决定口服药物生物利用度的重要因素之一,可为药物制剂设计提供生物学依据。本实验采用大鼠在体单向肠灌流法,考察石榴皮多酚中鞣花酸的肠吸收特性,为其剂型设计和临床应用提供药动学依据。
1仪器与材料
1.1实验仪器Agilent1220型高效液相色谱仪(安捷伦公司),DKZ型系列恒温振荡浴槽(上海恒科学仪器有限公司),XS105型电子天平(梅特勒-托利多仪器有限公司),TDL-40B型高速冷冻离心机(上海安亭科学仪器厂),752型紫外可见分光光度计(上海菁华科技仪器有限公司)。
1.2药品与试剂石榴皮多酚提取物(新疆医科大学药学院制备),经HPLC测定,鞣花酸含量为19.22%,鞣花酸对照品(成都曼思特生物科技有限公司,生产批号:MUST-13010903,纯度≥98%),甲醇(Fisher Scientific,色谱纯),水为双蒸水;其余试剂均为分析纯。
1.3实验动物健康雌性SD大鼠,SPF级,体质量(200±10)g,由新疆医科大学实验动物中心提供,动物合格证号SCXK(新)2011-0004。
2方法与结果
2.1色谱条件YMC-Triart C18色谱柱(4.6 mm×250 mm,5 μm),流动相:甲醇∶0.4%磷酸(55∶45),柱温35℃,检测波长254 nm,流速1 mL/min,进样量10 μL。理论塔板数按鞣花酸峰面积总和计算不低于2 000,分离度R>1.5,拖尾因子在0.95~1.05范围内,符合检测分析条件。
2.2溶液的配制
2.2.1鞣花酸对照品储备液精密称取鞣花酸对照品适量置于25 mL棕色容量瓶中,加入少量二甲基亚砜(DMSO)溶解,再用甲醇稀释至刻度,即得浓度为230 μg/mL鞣花酸对照品储备液。
2.2.2Krebs-Ringer’s 肠营养液配制现配制的K-R液每升中含有NaCl 7.8 g、KCl 0.35 g、CaCl20.37 g、NaH2PO40.32 g、NaHCO31.37 g、MgCl20.02 g、葡萄糖1.4 g。
2.2.3鞣花酸肠灌注液精密称取鞣花酸对照品适量,用K-R液稀释定容至100 mL,配制成浓度分别为53.81、131.70 μg/mL的鞣花酸肠灌流液。
2.2.4石榴皮多酚精制物肠灌注液精密称取石榴皮多酚精制物适量,用K-R液稀释定容至100 mL,配制成浓度分别为279.97、685.22 μg/mL的石榴皮多酚精制物肠灌流液。
2.2.5空白肠灌注液用37℃生理盐水将肠内容物冲洗干净后,用不含药物的K-R液迅速充盈肠段,以0.2 mL/min 的速度连续泵入肠段,在出口处收集流出液,作为空白肠灌注液。
2.3样品处理取样品液2 mL置于离心机中,10 000 r/min离心10 min,取上清液过滤,取续滤液10 μL进样测定。
2.4方法学考察
2.4.1专属性考察取空白肠灌注液、鞣花酸对照品液、单体肠灌注液样品、石榴皮多酚精制物肠灌注液样品分别进样10 μL,按“2.1”项下色谱条件测定,鞣花酸对照品与鞣花酸肠灌注液特征峰保留时间一致,空白肠灌注液无干扰,见图1。
2.4.2线性范围考察精密吸取鞣花酸对照品储备液各0.1、1.0、2.0、4.0、6.0、8.0、10.0、14.0 μL,按“2.1”项下色谱条件进样,记录峰面积。以峰面积(A)对含量(X,μg)进行回归,得回归方程为A=30 283 359X-88 795(r2=0.999 9),表明鞣花酸在0.023~3.220 μg浓度范围内线性关系良好。
2.4.3精密度试验 取不同体积鞣花酸对照品储备液,置10 mL棕色容量瓶中,用K-R液稀释至刻度,得鞣花酸高(230.00 μg/mL)、中(115.00 μg/mL)、低(57.50 μg/mL)浓度的对照品工作液。以1 d内测定5次,计算日内精密度;连续测定3 d,计算日间精密度。鞣花酸对照液高、中、低浓度的日间精密度RSD值分别为3.00%、3.91%、2.30%;日内精密度RSD值分别为4.48%、5.22%、3.51%,表明仪器精密度良好。

A:空白肠灌注液

B:鞣花酸对照品
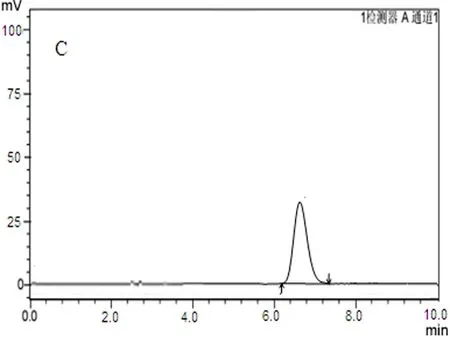
C:鞣花酸单体肠吸收样品
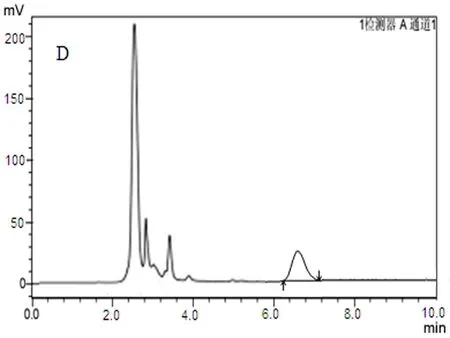
D:石榴皮多酚精制物肠吸收样品
图1鞣花酸HPLC色谱图
2.4.4稳定性试验取高、中、低浓度鞣花酸对照品工作液,每个浓度平行制备4份样品,分别考察在常温、37℃及4℃下保存4 h(每小时测定1次)、-20℃冷冻放置3 d的稳定性。结果测得不同浓度鞣花酸在不同考察条件下的RSD值为0.92%~5.93%,表明K-R液中样品在上述条件下均稳定。
2.4.5方法回收率试验空白灌流液中加入鞣花酸对照品,分别配制230.00、115.00、57.50 μg∕mL的溶液,按“2.3”项下方法进行处理,每个质量浓度平行制备3份,测定,计算得方法平均回收率分别为98.39%、97.77%、101.53%;RSD%值分别为7.84%、10.17%、7.73%,符合测定要求。
2.5鞣花酸的大鼠在体单向肠灌流实验
2.5.1药物在蠕动泵管路中的物理吸附及摄取考察配置鞣花酸浓度为230.00 μg/mL和57.50 μg/mL的肠灌流液,使用蠕动泵装置,流速0.2 mL/min,分别在 0、1、2、3 h取适量流出液,测定鞣花酸峰面积,计算RSD值。结果测得高、低浓度鞣花酸的RSD值分别为2.48%、1.16%,说明蠕动泵管路对鞣花酸几乎无吸收摄取作用。
2.5.2肠壁对鞣花酸的物理吸附、摄取、代谢的考察取大鼠空白肠段,剖开,翻转肠壁,用生理盐水反复冲洗多次,置于115.00 μg/mL供试液中,37℃恒温水浴锅中孵育3 h后测定供试液中鞣花酸的含量,计算得孵育液中鞣花酸的剩余百分率为(95.56±0.01)%(n=3),表明大鼠肠壁对鞣花酸无明显吸附、摄取或代谢。
2.5.3大鼠在体肠灌流实验方法[6]取禁食12 h (自由饮水) SD大鼠,腹腔注射10% 水合氯醛溶液麻醉,背部固定,控温灯保持体温37℃,沿腹中线打开腹腔约3 cm,分离长度约10 cm待考察肠段,于两端切口并插入蠕动泵管,进入端连接恒流泵,用37℃生理盐水冲净内容物,用空气排尽生理盐水,以浸有生理盐水的脱脂棉覆盖腹腔。
将肠灌流液迅速泵入考察肠段,待肠段内充满药液后,流速调至 0.2 mL/min,待流速稳定且吸收达平衡后(约30 min)开始实验。入口处用装有供试液的带盖小瓶进行灌流,出口处连接作为接收瓶的带盖小瓶,每隔 15 min进行一组实验,快速更换样品液小瓶和收集液小瓶,直至实验结束。称量样品瓶和收集瓶,计算灌入和收集的供试液含量。实验结束后,剪下所灌注肠段,测量其长度和周长。按“2.1”项下色谱条件进样分析,测定鞣花酸浓度。


式中Cin和Cout分别为进出口灌注液的浓度(μg/mL);Qin和Qout分别为进出口灌注液的体积(mL);Q为灌流速度;V为灌流肠段的体积(cm3);r和l分别为灌流肠段的半径(cm)和长度(cm)。
2.6 鞣花酸在各肠段的Ka和Papp统计学分析分别对各肠段的高、低剂量组求得的Ka和Papp进行随机区组方差分析。结果显示,鞣花酸单体在各肠段的Ka值差异有统计学意义(P<0.05),Papp值差异无统计学意义(P>0.05)。低浓度时的吸收速率常数:空肠>回肠>十二指肠>结肠;高浓度时的吸收速率常数:十二指肠>回肠>空肠>结肠;石榴皮多酚精制物中鞣花酸在各肠段的Ka值差异有统计学意义,低浓度时,十二指肠>空肠>回肠>结肠;高浓度时,空肠>十二指肠>回肠>结肠。根据Papp>0.2×10-4cm/s时,药物吸收完全[7],判断吸收性能鞣花酸在整个肠段吸收良好,其中鞣花酸单体在回肠的Papp最高,表明在此肠段具有较好的吸收,而石榴皮多酚精制物中的鞣花酸在各肠段的Papp无统计学意义。在同一肠段下,鞣花酸单体和石榴皮多酚精制物中鞣花酸的Ka和Papp有统计学意义(P<0.05),后者优于前者,见表1、2。
3讨论
在体肠段灌流模型是一种原位实验模型,通过测定药物经过肠段后在灌流液中减少的量来估算药物的Ka和Papp,与其他模型相比,在体肠段灌流模型既能保证肠道神经和内分泌系统的完好,又能避免胃肠道内容物对指标成分吸收的影响,同时可通过药物剩余量来计算相关吸收参数,有助于排除首过效应及药物在胃肠道中的吸附、摄取、代谢等生物转化,相对于体外实验,该法测得的相关吸收参数可更真实地反映指标成分的透膜特性[8]。单向灌流法以约0.2 mL/min的较低流速灌流药液,能较好模拟肠道正常蠕动状态,从而能更好地预测药物在肠道的吸收情况,近年来国内外大多采用“单向灌流法”来研究药物的肠吸收[9]。本研究采用大鼠在体单向灌流肠吸收模型,低流速进行肠段灌流,考察鞣花酸单体和石榴皮多酚精制物中鞣花酸在不同肠段灌注液中药物含量的变化。
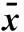
表1 鞣花酸在各肠段的吸收速率常数 (Ka )(±s, n=5)
注:与高浓度比较,*P<0.05。
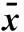
表2 鞣花酸在各肠段的药物表观吸收系数(Papp)(±s, n=5)
注:与高浓度比较,*P<0.05。
实验过程中,灌流液中药物量的减少,不仅是胃肠道吸收了药物,胃肠壁的物理吸附、细胞对药物的摄取以及肠道菌或酶对药物的代谢等也会导致药物含量的降低[8]。本实验考察肠壁对鞣花酸的吸附结果表明,大鼠肠壁对其并无明显的吸附、摄取或代谢。
鞣花酸在不同肠段均有吸收,其在大鼠肠道内不存在特殊“吸收窗”。 鞣花酸高、低剂量在大鼠小肠内的肠吸收Ka和Papp值差异有统计学意义,表明鞣花酸有自身浓度抑制作用,在此浓度范围内可能以主动转运吸收进入体循环。石榴皮多酚精制物中鞣花酸的吸收速率常数Ka和表观吸收系数Papp均优于鞣花酸单体,这可能是石榴皮多酚精制物中某种或某些成分对鞣花酸的吸收有促进作用,有待进一步研究确证。
参考文献:
[1]Olaniyi AF, Nokwanda PM, Umezuruike LO. Antibacterial, antioxidant and tyrosinase-inhibition activities of pomegranate fruit peel methanolic extract[J]. BMC Complement Altern Med, 2012, 12: 200-202.
[2]Fawole OA, Opara UL, Theron KI. Chemical and phytochemical properties and antioxidant activities of three pomegranate cultivars grown in south Africa[J]. Food Bioprocess Tech, 2012, 5(7): 2934- 2940.
[3]丁楠,高晓黎.HPLC法测定石榴皮提取物中鞣花酸的含量[J].新疆医科大学学报,2012,35(6): 770-772.
[4]Jimenez DR,Ramazanov A,Sikorski S, et al. A new method of standartization of health-promoting pomegranate fruit ( Punica granatum) extract[J]. J Georgian Med News, 2006, 140: 70-77.
[5]热依木古丽·阿布都拉,来海中,马依努尔·拜克力,等.石榴皮化学成分及生物活性研究进展[J]. 新疆医科大学学报,2013,36(6):737-740.
[6]徐本亮,王冰,浦益琼,等.丹皮酚平衡溶解度与油水分配系数测定及大鼠在体肠吸收研究[J].中成药 2012,34(10) :1892-1896.
[7]Fagerholm U, Johansson M, Lennernas H. Comparison between permeability coefficients in rat and human jejunum[J]. Pharm Res,1996,13(9) : 1336-1342.
[8]Tang TT, Hu XB, Liao DH, et al. Mechanisms of microemulsion enhancing the oral bioavailability of puerarin: comparison between oil-in-water and water-in-oil microemulsions using the single-pass intestinal perfusion method and a chylomicron flow blocking approach[J]. Int J Nanomedicine, 2013, 8: 4415-4426.
[9]Yu F, He C, Waddad AY, et al. N-oct-yl-N-argininechitosan (OACS) micelles for gambogic acid oral delivery: preparation, characterization and its study on in situ intestinal perfusion[J].Drug Dev Ind Pharm, 2014, 40(6): 774-782.
(本文编辑施洋)
Intestinal absorption dynamics study on ellagic acid of pomegranate peel polyphenols by in situ single-pass perfusion model in rats
TIAN Li1,2,ZHANG Huihui1, XIE Li1, CHANG Jing1, GAO Xiaoli3
(1CollegeofTCM,XinjiangMedicalUniversity;2XinjiangKeyLaboratoryofFamousPrescription
andScienceofFormula;3CollegeofPharmacy,XinjiangMedicalUniversity,Urumqi830011,China)
Abstract:ObjectiveTo study the intestinal absorption kinetics of ellagic acid of pomegranate peel polyphenols in rats. MethodsA single-pass intestinal perfusion model was used to measure the intestinal absorption of ellagic acid in different absorption segments and the content of ellagic acid was assayed by HPLC method. The effect of mass concentrations on intestinal absorption was detected. ResultsEllagic acid could be absorbed in the whole intestine,and its absorption rate was influenced by the intestinal segments. The absorption rate of ellagic acid in duodenum,jejunum,ileum and colon was 4.44×10-2~7.11×10-2/min, 6.58×10-2~8.60×10-2/min, 5.61×10-2~7.02×10-2/min, 3.92×10-2~5.95×10-2/min, respecvticvely; The absorption rate of ellagic acid in pomegranate peel polyphenols purification in duodenum, jejunum, ileum and colon was 7.00×10-2~7.81×10-2/min, 6.32×10-2~7.96×10-2/min, 4.97×10-2~5.58×10-2/min, 3.50×10-2~4.68×10-2/min respecvticvely. The Ka and Pappof ellagic acid monomers and the ellagic acid in pomegranate peel polyphenols extraction have significant difference (P<0.05). ConclusionEllagic acid has no a special “absorption window”. Some compositions of polyphenol extractions may have played a catalytic role in ellagic acid absorption. The concentrations have little influence on Kaand Pappof ellagic acid in different absorption segments. The absorption of ellagic acid may active transport in the general intestinal segments.
Keywords:pomegranate peel polyphenols;ellagic acid;intestinal absorption;single-pass perfusion intestines model;HPLC
[收稿日期:2015-10-23]
doi:10.3969/j.issn.1009-5551.2016.02.001
中图分类号:R965
文献标识码:A
文章编号:1009-5551(2016)02-0131-05
作者简介:田莉(1974-),女,博士,教授,硕士生导师,研究方向:中药民族药新制剂研究与开发, E-mail: tianli109@126.corn。
基金项目:国家自然科学基金(81260668);新疆医科大学“ 天山英才工程” 专项基金(Y0382002)
