急性脑梗死患者血清内脂素含量的变化及对颈动脉粥样硬化斑块形成和稳定性的影响
2016-03-01李新萍
李新萍
河北以岭医院 石家庄 050091
急性脑梗死患者血清内脂素含量的变化及对颈动脉粥样硬化斑块形成和稳定性的影响
李新萍
河北以岭医院石家庄050091
【摘要】目的观察急性脑梗死(ACI)患者血清内脂素水平,探讨其与颈动脉粥样硬化斑块形成和稳定性的关系。方法对68例ACI患者及45例健康人群(对照组)进行颈动脉彩色多普勒超声检查,根据血管超声检查颈动脉粥样硬化斑块结果,对ACI患者分组并检测血清内脂素水平。结果68例ACI患者中,稳定斑块组31例,不稳定斑块组25例,无斑块形成(无斑块组)12例;3组内脂素水平分别为(28.25±8.06)μg/L、(34.25±8.75)μg/L、(16.58±6.02)μg/L,对照组为(14.56±6.12)μg/L;不稳定斑块组高于稳定斑块组,稳定斑块组高于无斑块组及对照组,组间比较差异有统计学意义(P<0.05)。结论血清内脂素与ACI患者颈动脉粥样硬化斑块的形成及不稳定性的形成关系密切。
【关键词】急性脑梗死;内脂素;颈动脉粥样硬化斑块;稳定性
颈动脉粥样硬化斑块是脑梗死的危险因素目前已被证实,而斑块的不稳定性造成斑块脱落或斑块破裂形成栓子导致血管栓塞是引起缺血性脑卒中的关键环节[1]。内脂素(visfatin)是一种新型脂肪因子,具有类似胰岛素的作用,研究发现[2],内脂素与胰岛素抵抗、血管内皮功能紊乱、炎症反应及动脉粥样硬化斑块形成均息息相关。本研究对急性脑梗死(ACI)患者的血清内脂素水平进行检测,探讨ACI患者血清内脂素水平的变化及与颈动脉粥样硬化斑块形成及稳定性的关系。
1资料与方法
1.1一般资料2013-06—2014-12我院诊治的68例ACI患者,男36例,女32例;年龄48~70岁,平均(62.51±8.78)岁;均经头颅CT或MRI检查证实,符合第4届脑血管学术会议修订的ACI的诊断标准[3]。试验前半年内未服用类固醇、他汀类及免疫抑制药物,且未发生严重外伤。排除标准:(1)合并糖尿病、自身免疫性疾病、恶性肿瘤者;(2)严重肝、肾功能不全者;(3)严重心律失常者。
1.2分组对照组于体检当日采用彩色多普勒超声诊断仪进行颈部血管超声检查证实无颈动脉粥样硬化斑块,而ACI患者根据颈部血管超声检查结果分组。斑块形成:颈动脉内-中膜厚度>1.2 mm;稳定斑块:斑块表面光滑、内部回声强或均匀中等回声;不稳定斑块:斑块表面粗糙,内部无回声或低回声不均匀[4]。选取同期健康检者45例为对照组。各组年龄、性别等比较差异无统计学意义(P>0.05)。见表1。
1.3观察指标抽取受试者空腹静脉血5 mL,采用美国R&D公司的人内脏脂肪素试剂盒,采用ELISA法测定内脂素浓度,所有操作严格按照试剂盒说明书进行,检测灵敏度1.0 ng/mL。计算所有受试者BMI,测量其血压。
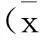
2结果
2.1ACI患者颈动脉血管超声检查结果68例ACI患者中,56例颈动脉粥样硬化斑块形成,其中稳定斑块组31例(45.59%),不稳定斑块组25例(36.76%),无斑块形成(无斑块组)12例(17.65%)。
2.2各组血清内脂素水平比较4组受试者内脂素、BMI及血压组间比较差异有统计学意义(P<0.05)。见表1。
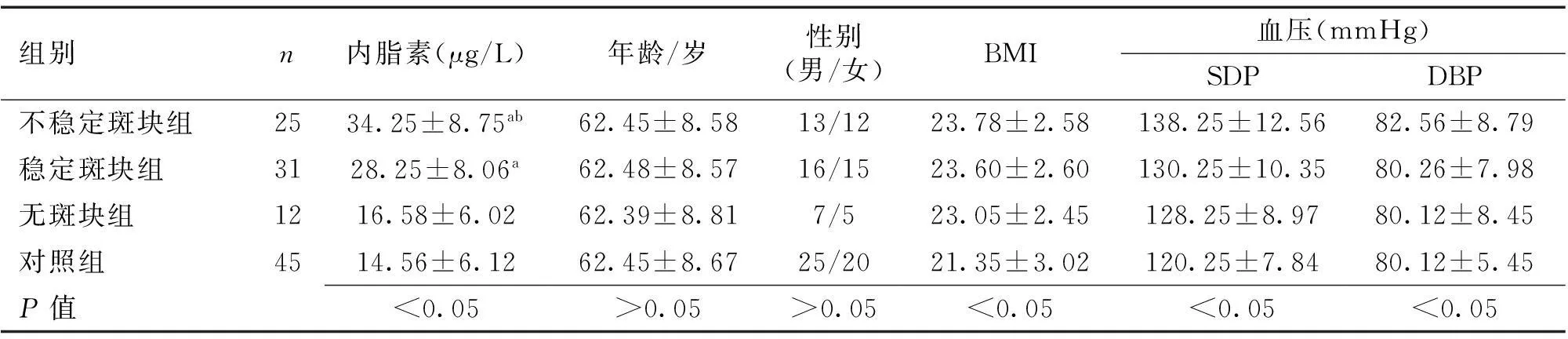
表1 各组受试者一般资料及血清内脂素水平比较
注:与对照组及无斑块组比较,aP<0.05;与稳定斑块组比较,bP<0.05
3讨论
颈动脉粥样硬化与ACI的发生、发展密切相关,研究表明[5],81.2%的缺血性脑卒中患者存在颈动脉粥样硬化。动脉粥样硬化斑块主要由纤维帽及脂核组成,分为稳定斑块和不稳定斑块,不稳定斑块脱落、破裂是导致大面积或多发性脑梗死的重要因素。而颈动脉位置表浅,其斑块可反映全身动脉粥样硬化情况的“窗口”[6]。因此,及时了解颈动脉粥样硬化斑块的形成及稳定性,对于ACI的防治具有重要意义。
动脉粥样硬化的发生机制目前尚未完全明确,国内外学者相继提出多种学说,但一致认为其发生与血管内皮功能受损、VSMCs(血管平滑肌细胞)增殖、迁移、凋亡、脂代谢异常等多因素参与有关。内脂素是国外学者Fukuhara等于2005年发现,由491个氨基酸的单肽构成,内脂素在内脏脂肪中的巨噬细胞中呈高水平表达,在肝脏、脾脏、子宫及肌肉组织等器官组织中也有表达。泡沫细胞的形成是动脉粥样硬化早期典型的病理特征,ATP结合转运蛋白A1(ABCA1)表达下调可导致细胞内游离胆固醇流出减少,内脂素可诱导巨噬细胞中ABCA1表达下调,从而导致巨噬细胞中胆固醇的聚集,导致泡沫细胞的形成,进而参与动脉粥样硬化斑块的形成[7]。内脂素对IL-1(白介素-1)、IL-6(白介素-6)等具有诱导作用,可增加CAMs(细胞黏附分子)、VCAM-1(血管细胞黏附分子-1)的表达,从而诱发血管炎症反应,而动脉粥样硬化斑块实质是一种血管慢性炎症,其发生发展由动脉管壁局部炎症平衡所调控。且炎症因子通过趋化炎症细胞向血管损伤部位浸润,促进VSMCs凋亡及降解,促进斑块不稳定性的发生。内脂素可通过内皮细胞的EPL途径促进血管生成,还可通过MAPK及P13K/Akt信号途径诱导VEGF(血管内皮生长因子)、MMP-2/9(基质金属蛋白酶2/9)及FGF-2(成纤维细胞生长因子)等的表达介导血管再生,而斑块内的血管再生是促使斑块发展为不稳定斑块的重要机制,是心脑血管事件发生的重要危险因素[8]。MMP-9又称明胶酶B,可降解细胞外基质(ECM),促进平滑肌细胞的迁移及增殖,促进“纤维帽”降解,从而加速斑块硬化进程及破裂。研究证实[9],脑梗死患者内脂素表达水平与颈动脉粥样硬化斑块的易损性明显相关,是动脉粥样硬化斑块易损性的重要的预测标志。因此,内脂素可能通过上述机制在动脉粥样硬化斑块的形成及发展中扮演重要的角色。Dahl等[10]研究发现,急性心肌梗死患者破裂的动脉粥样硬化斑块内富含脂质处的内脂素水平表达显著增高,而且在颈动脉粥样硬化斑块有症状的患者中斑块内内脂素含量也显著增高。本研究显示,4组受试者血压及BMI组间比较有显著差异,而BMI及血压水平是动脉粥样硬化的危险因素早已公认。本研究还显示,ACI组血清内脂素水平显著高于对照组,而不稳定斑块组血清内脂素水平显著高于稳定斑块组及无斑块组,与文献[5]报道相符。
总之,ACI患者血清内脂素水平明显升高,且内脂素水平与颈动脉粥样硬化斑块的形成及斑块的不稳定性均密切相关,检测血清内脂素水平有可能作为一个预测动脉粥样硬化斑块形成及判断斑块稳定性的临床指标,也可能为缺血性脑血管病的诊治提供一个新的思路。
4参考文献
[1]李庆玉,崔勇,齐登斌,等.脑梗死患者血浆内脂素水平的变化及临床意义[J].山东医药,2012,52(25):38-39.
[2]任海艳,林黎明,彭芳,等.急性脑梗死患者血清内脂素水平的改变及其与颈动脉粥样硬化斑块形成和稳定性的关系[J].临床神经病学杂志,2014,27(5):372-373.
[3]林春艳. 内脂素与动脉硬化性脑梗死的相关研究[D]. 沈阳: 中国医科大学,2014.
[4]常万生,王秀霞,许光霞,等.血清内脂素、CRP水平与脑梗死患者颈动脉粥样硬化斑块稳定性的相关性研究[J].滨州医学院学报,2015,38(2):94-96.
[5]齐艳,李东燕.急性脑梗死患者血清内脂素水平及其相关性[J].兰州大学学报:医学版,2010,36(3):54-57.
[6]段新辉.2型糖尿病合并脑梗死患者血清内脂素水平的研究[D]. 石河子:石河子大学,2013.
[7]Wang P,Guan YF,Du H,et al. Induction of autophagy contributes to the neuroprotection of nicotinamide phosphoribosyl transferase in cerebral ischemic stroke [J]. Autophagy,2012,8(1):77-87.
[8]杨莉莎. 急性缺血性脑卒中患者血浆内脂素的变化及丹红注射液的影响[J].中国实用神经疾病杂志,2015,18(7):46-49.
[9]韩亚州,张洋,闫军,等.急性脑梗死患者颈动脉内-中膜与炎症因子IL-18和脂联素的关系分析[J].中国实用神经疾病杂志,2010,13(22):42-43.
[10]Dahl TB,Yndestad A,Skjelland M,et al. Increased expression of visfatin in macrophages of human unstable carotid and coronary atherosclerosis: possible role in inflammation and plaque destabilization [J].Circulation,2007,115(8):972.
(收稿2015-02-12)
【中图分类号】R743.33
【文献标识码】A
【文章编号】1673-5110(2016)03-0103-02
基金项目:河北科技局项目(编号:2014-010452)
·脑梗死专题研究·
