全脑放疗联合替莫唑胺化疗对脑转移肿瘤的疗效及安全性
2016-03-01任爱军
任爱军
山东禹城市人民医院肿瘤科 禹城 251200
全脑放疗联合替莫唑胺化疗对脑转移肿瘤的疗效及安全性
任爱军
山东禹城市人民医院肿瘤科禹城251200
【摘要】目的观察全脑放疗联合替莫唑胺化疗对脑转移肿瘤的疗效,评价其安全性。方法80例脑转移肿瘤患者随机分为2组,对照组(n=40)行全脑对穿照射,DT:40 Gy,2 Gy/次,分为20次,4周完成;观察组(n=40)在对照组基础上加服替莫唑胺75 mg/(m2·d),放疗结束后每28 d口服5 d为1个周期,共6周期;观察2组生存率和不良反应。结果观察组缓解率高于对照组(P<0.05);观察组和对照组的中位生存期分别为(8.5±1.2)个月和(5.5±0.9)个月,2组比较差异有统计学意义(P<0.05);观察组不良反应率与对照组相比差异无统计学意义(P>0.05),且均可耐受。结论全脑放疗联合替莫唑胺化疗治疗脑转移肿瘤疗效显著,可延长患者生存时间,且具有较高安全性。
【关键词】脑转移肿瘤;全脑放疗;替莫唑胺;不良反应
肿瘤脑转移是导致治疗失败的常见原因,预后极差,若不积极治疗,其中位生存期仅为1~2个月[1]。据文献[2]统计,各种肿瘤进展期8%~10%会发生脑转移。肿瘤的类型不同,出现脑转移的风险也有差异。据统计,肺癌、乳腺癌、黑色素癌出现脑转移的风险分别为40%~50%、15%~25%、5%~20%[3],是出现脑转移最为常见的肿瘤类型。全脑放疗是治疗脑转移肿瘤的标准方法,临床研究表明[4],即便施行全脑放疗,脑转移肿瘤患者的中位生存期也仅为2.4~4.8个月。最近一项研究显示[5],在对脑转移肿瘤患者给予放疗的同期给予低剂量替莫唑胺,可以获得良好的近期疗效,其不良反应在可耐受范围内。本研究选择80例脑转移肿瘤患者,分别给予全脑对穿照射与全脑对穿照射+替莫唑胺化疗的联合治疗方案,结果表明联合治疗的效果更优。现报告如下。
1资料和方法
1.1纳入标准(1)年龄≥18周岁;(2)原发病灶已经病理学确诊,脑转移病灶数量经头颅MR/CT检查证实≥3个;(3)治疗前Karmofsky评分≥60分,预计生存期≥3个月;(4)严重的心、肺、肝及肾功能障碍且骨髓储备充足(白细胞≥4.0×109L-1,血小板≥100×109L-1,血红蛋白≥70 g/L);(5)入组前患者已从既往化疗的毒性反应中完全恢复;(6)医院伦理会研究同意,且患者及家属知情同意并签署知情同意书。
1.2排除标准(1)临床资料不完整,影响统计分析者;(2)合并心血管、肾脏和造血系统严重原发性疾病者;(3)患精神病者;(4)距离上次化疗时间≤3个月;(5)既往有脑转移灶放疗史者;(6)不能配合治疗或不能按时随诊者。
1.3一般资料采用前瞻性随机双盲对照研究方法,选择2012-06—2014-06我院住院治疗的80例脑转移肿瘤患者为研究对象。采用随机数字表进行分层随机抽样法将所有患者分为对照组(n=40)和观察组(n=40)。对照组男25例,女15例;年龄32~70岁,平均(46.5±8.7)岁;原发癌症:肺癌28例,乳腺癌12例。观察组男26例,女14例;年龄34~71岁,平均(47.2±7.9)岁;原发癌症:肺癌27例,乳腺癌13例。2组一般资料差异无统计学意义(P>0.05),具有可比性。
1.4治疗方法对照组采用直线加速器6 MV光子线连续放射治疗,采取常规体位并对进行固定,行全脑对穿照射,DT:40 Gy,2 Gy/次,分为20次,4 周完成。观察组全脑放疗的方法和剂量与对照组相同,放疗结束后加服替莫唑胺胶囊75 mg/(m2·d),每28 d口服5 d为1个周期,共6周期。2组治疗期间为减轻全脑放疗导致的脑组织水肿,均根据病情变化给予地塞米松、甘露醇进行脱水治疗;观察组化疗期间需要密切关注患者的血象变化,并给予粒细胞集落刺激因子皮下注射行升白细胞治疗,若有必要,也可加止吐治疗。
1.5效果评价参照WHO标准分为完全缓解(CR):颅内灶消失,无新病灶,维持此状态时间≥4周;部分缓解(PR):颅内灶最大径之和减少≥30%,维持此状态时间≥4周;稳定(NC):颅内灶最大径之和减少<30%或增大<20%;进展(PD):颅内灶最大径之和增加≥20%,绝对值增加≥5 mm,或出现新病灶。近期有效=CR+PR。
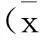
2结果
2.1近期疗效2组缓解率比较差异有统计学意义(χ2=35.632,P=0.025)。见表1。观察组中位生存期(8.5±1.2)个月,对照组(5.5±0.9)个月,2组中位生存期比较差异有统计学意义(t=4.150,P<0.05)。
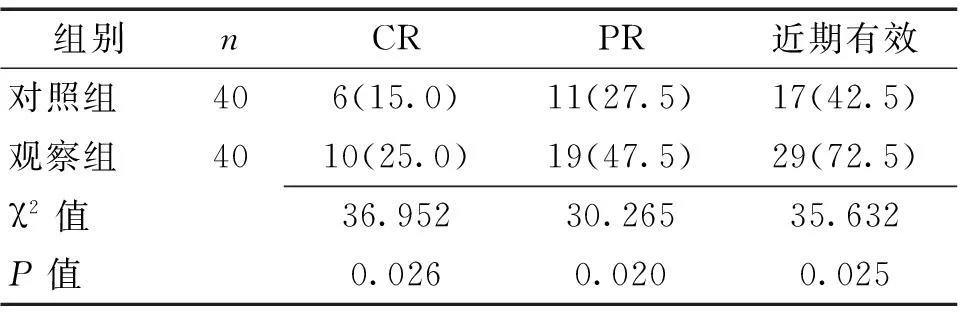
表1 2组近期效果比较 [n(%)]
2.2不良反应观察组不良反应包括血液系统毒性32例(80.0%),胃肠道反应35例(87.5%),头痛6例(15.0%);对照组血液系统毒性30例(75.0%),胃肠道反应33例(82.5%),头痛4例(10.0%);组间比较差异无统计学意义(P>0.05),患者均可耐受。
3讨论
全脑放疗依然是转移病灶超过3个的多发脑转移瘤患者最主要的治疗方式,但治疗效果不甚理想,文献[6]报道临床有效率仅为50%左右。脑转移肿瘤最终会因脑肿瘤进展或原发肿瘤未控制或其他脏器衰竭而死亡,所以,有必要研究其他治疗方法以改善患者预后、延长患者生存时间。医学界一直对全脑放疗联合静脉化疗治疗多发脑转移瘤存在较大争议,主要原因在于血脑屏障会降低脑脊液中化疗药物浓度,不仅无法达到治疗所需的药物作用浓度,还会带来较多的不良反应,多数患者会无法耐受而导致治疗不能顺利进行,所以全脑放疗联合静脉化疗一直不能在临床获得广泛应用。
正是基于以上考虑,全脑放疗同步化疗在选择化疗药物时需慎重,要求化疗药物不仅要有非常强的肿瘤细胞杀伤能力以及较好的放射增敏作用,还应具有较高的血脑屏障穿透能力以提高病灶局部的药物浓度;同时,化疗药物的不良反应还要相对轻微,以利于治疗的顺利进行[7]。
替莫唑胺属于咪嗪类衍生物,是一种全新的口服第二代烷化剂。替莫唑胺的口服生物利用度非常高,接近100%,且对血脑屏障具有很好的穿透能力,其脑脊液的药物浓度约为血浆药物浓度的1/3[8]。替莫唑胺的作用机制也非常独特,能够在生理pH值下实现快速转化,将自身分解为甲基三氮烯咪唑酰胺(MTIC)并水解为5-氨基-咪唑-4-酰胺(AIC)及甲基肼,能够对肿瘤细胞分裂进行全时期作用,尤其对于恶性胶质瘤还体现出显著的抗肿瘤效能。除此之外,因替莫唑胺诱导肿瘤细胞停滞在G2/M期,进而发生凋亡,同时G2/M期是放疗最敏感的阶段,所以,替英唑胺在发挥细胞毒性作用同时有放疗增敏作用[9]。本研究中,观察组近期疗效和中位生存期均优于对照组,表明全脑放疗联合替莫唑胺化疗对脑转移肿瘤的疗效显著,也在一定程度上证实了上述论断;同时,2组不良反应发生率差异不大,也表明全脑放疗联合替莫唑胺化疗的不良反应不大,具有较高的安全性。
综上所述,全脑放疗联合替莫唑胺化疗对脑转移肿瘤的疗效显著,可延长生存时间,且具有较高安全性。
4参考文献
[1]章耀鸿,刘坚和. 替莫唑胺联合全脑放疗治疗乳腺癌脑转移的临床观察[J]. 临床医学工程,2012,19(6):945-946.
[2]毕卓菲,刘宜敏,何艳,等. 替莫唑胺联合全脑放疗治疗脑转移瘤的疗效评价[J]. 中国新药杂志,2012,21(4):412-418.
[3]杨妤,杨新辉,苏加利. 替莫唑胺联合全脑放疗治疗非小细胞肺癌脑转移瘤的疗效[J]. 广东医学,2013,34(7):1 115-1 117.
[4]潘永,要洁,冯威健,等. 替莫唑胺应用于脑恶性胶质瘤的研究现状[J]. 山东医药,2012,52(12):96-97;100.
[5]程元芝,张海宝,王姗. 三维适形放疗联合替莫唑胺化疗用于恶性脑胶质瘤术后疗效观察[J]. 浙江临床医学,2012,14(12):1 500-1 501.
[6]黄骏. 口服替莫唑胺同步放射治疗脑转移瘤的疗效与安全性探讨[J]. 中国实用神经疾病杂志,2013,16(19):88-89.
[7]Patricia S,Evangelia T,Eftychia K,et al. Investigating brain tumor differentiation with diffusion and perfusion metrics at 3T MRI using pattern recognition techniques[J]. Magn Reson Imaging,2013,31(9):1 567-1 577.
[8]陈雁秋,林清,容景瑜,等. 全脑放疗同步替莫唑胺化疗治疗脑转移瘤[J]. 肿瘤基础与临床,2014,27(2):166-167.
[9]梁惠,董士丽. 国内恶性脑胶质瘤术后放疗联合替莫唑胺化疗疗效与安全性的Meta分析[J]. 现代肿瘤医学,2010,18(12):2 345-2 348.
(收稿2015-01-12)
【中图分类号】R730.5
【文献标识码】A
【文章编号】1673-5110(2016)03-0085-02
