阿托伐他汀对局灶性脑缺血大鼠脑组织中自噬及血管新生的影响*
2016-02-23王金兰闫莹莹刘海燕
王金兰,乐 婷,闫莹莹,刘海燕
郑州大学第二附属医院神经内科 郑州450014
阿托伐他汀对局灶性脑缺血大鼠脑组织中自噬及血管新生的影响*
王金兰,乐婷#,闫莹莹,刘海燕
郑州大学第二附属医院神经内科 郑州450014
关键词阿托伐他汀;局灶性脑缺血;大鼠;自噬;肌醇酶1;LC3-Ⅱ;血管新生
摘要目的:观察阿托伐他汀对局灶性脑缺血大鼠脑组织中自噬及血管新生的影响。方法:雄性SD大鼠63只,随机分为假手术组、模型组、他汀组,每组21只。模型组和他汀组采用大脑中动脉栓塞法造模,假手术组不栓塞。术前1周,他汀组给予阿托伐他汀钙片4 mg/(kg·d)灌胃,其余两组给予等量生理盐水灌胃。术后24 h处死大鼠,TTC染色观察脑梗死面积,免疫组化法检测脑组织中CD105、IRE1的表达,RT-PCR检测血管内皮细胞生长因子(VEGF) mRNA, Western blot法检测自噬蛋白LC3-Ⅱ。结果:与假手术组相比,模型组及他汀组脑组织皮层及皮层下有明显梗死灶,缺血半暗带区CD105、IRE1、VEGF mRNA、LC3-Ⅱ表达升高(P<0.05);他汀组上述变化较模型组更显著(P<0.05)。模型组、他汀组脑组织中VEGF mRNA与LC3-Ⅱ表达有明显线性正相关关系(r=0.837、0.850,P均<0.05)。结论:阿托伐他汀可通过增强自噬,促进局灶性脑缺血血管新生。
AbstractAim: To observe the effect of atorvastatin on autophagy and angiogenesis in brain tissue of focal cerebral ischemia rats.Methods: A total of 63 male SD rats were randomly allocated into sham operation group, model group and treatment group, and each group contained 21 rats.One week before surgery, the treatment group received a gavage of atorvastatin at 4 mg/(kg·d), and the other 2 groups were given the same amount of normal saline. All rats were killed 24 h after operation. The area of cerebral infarction was measured by TTC staining. The expressions of CD105 and IRE1 protein in brain tissue were detected by immunohistochemistry. The expression of VEGF mRNA was detected by RT-PCR. The expression of LC3-Ⅱprotein was detected by Western blot.Results: Compared with those of sham operation group, the cortex and subcortical brain tissue of model group and treatment group showed obvious infarction.The expressions of CD105,IRE1,VEGF mRNA and LC3-Ⅱ in ischemic penumbra area in model group and treatment group were higher. Compared with those of the model group,the indexes mentioned above in treatment group were much higher(P<0.05). In model group and treatment group, the expression of LC3-Ⅱ and that of VEGF mRNA had positive linear relationship (r=0.837,0.850,P<0.05).Conclusion: Atorvastatin can promote angiogenesis in focal cerebral ischemia tissue by enhancing autophagy.
治疗缺血性脑卒中的第一要务是尽早恢复缺血区血供,抢救缺血半暗带,但对于错过溶栓窗口期及其他原因不适合溶栓的患者,恢复缺血区血供主要依靠缺血组织的代偿性血管新生。自噬(autophagy)是一种利用溶酶体将胞内已衰老、过剩或严重受损的生物大分子(如蛋白质)及细胞器清除、降解和回收利用的过程。研究[1]表明3-羟基-3-甲基戊二酰辅酶A还原酶抑制剂(他汀)可通过上调NO水平促进血管新生。在缺血心肌细胞、癌细胞、结核分枝杆菌感染的巨噬细胞、冠状动脉管壁肌细胞中,他汀类药物与自噬的关系复杂[2-5];而无论是在整体水平还是在细胞水平,自噬均参与了缺血后血管新生的过程[6]。而他汀类药物对缺血后脑组织内血管新生有何影响,其是否可通过调节内质网应激、增强自噬起作用而促血管新生,目前尚不清楚。血管内皮生长因子(VEGF)是内皮细胞最具特异性的生长因子,在体内外均可诱导血管新生;CD105是新生血管内皮细胞特异性标志物,常用于测定微血管密度。肌醇酶1(inositol-requiring enzyme 1,IRE1)是哺乳动物内质网膜上感应和传递未折叠蛋白反应的感应蛋白之一,内质网应激激活后可通过IRE1信号通路调节自噬,所以IRE1可反映体内自噬激活水平;微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)可与自噬体膜结合,LC3-Ⅱ水平可反映自噬体的数量[7]。作者拟观察阿托伐他汀对局灶性脑缺血大鼠脑组织IRE1、LC3-Ⅱ表达及血管新生的影响,探讨他汀类药物、自噬与血管新生的关系。
1材料与方法
1.1实验动物及试剂雄性SD大鼠63只,体重(300±20) g,购自河南省实验动物中心,合格证号SCXK(豫)2010-0002。兔抗鼠CD105抗体、兔抗鼠IRE1抗体、兔抗鼠LC3-Ⅱ抗体、羊抗兔SP二抗试剂盒、羊抗兔IgG抗体均购自美国Santa Cruz公司, RT-PCR试剂盒、Trans DNA Marker Ⅰ购自北京Transgene公司。阿托伐他汀钙片由北京嘉林药业股份有限公司生产,生产许可证号H19990258。
1.2实验分组及模型建立方法采用随机数字表法将大鼠分为假手术组、模型组、他汀组,每组21只。采用大脑中动脉栓塞法制备局灶性脑缺血模型。大鼠经水合氯醛(3 mL/kg)腹腔注射麻醉,仰卧位固定,颈部备皮、消毒,颈部正中切口,分离左侧颈总动脉(CCA)、颈内动脉(ICA)、颈外动脉(ECA),结扎ECA远心端,动脉夹夹闭CCA及ICA,剪断ECA,沿ECA残端向ICA插入鱼线,进入长度达17.5~18.5 mm时,可感阻力,停止插线,ECA残端结扎并固定鱼线。清理切口,逐层缝合。术后白炽灯直接照射,保持肛温在37 ℃。模型组和他汀组按上述方法造模。假手术组只分离,不结扎,不插线。术前1周,他汀组给予阿托伐他汀4 mg/(kg·d)灌胃,其余两组给予等量生理盐水灌胃。
1.3标本采集及保存所有大鼠术后24 h处死。每组随机选取1只用于红四氮唑(TTC)染色。随机选取10只大鼠,经心脏灌注多聚甲醛后取脑,多聚甲醛固定24 h后,选取视交叉后6 mm组织常规脱水、透明、浸蜡、包埋。参考文献[8]的方法,在距额叶前端3 mm和9 mm处进行冠状切片;取中间6 mm厚的脑组织块,然后沿此脑块矢状缝右侧约2 mm处,从上至下切去右侧半球的正中结构,余下的左侧脑块再沿矢状切面旁开2 mm处、并与矢状切面呈30°斜切,其中外侧皮层为缺血核心区,内侧皮层为缺血半暗区,常规制备石蜡切片,厚度5 μm。其余10只断头处死、新鲜取脑,选取左侧大脑半球视交叉后6 mm组织液氮迅速冷冻,并保存于-80 ℃冰箱中。
1.4TTC染色断头取脑,去掉嗅球、小脑和低位脑干,将大脑从前向后冠状切5刀分为6片,TTC染色。
1.5检测指标
1.5.1脑组织CD105和IRE1蛋白的检测采用免疫组化SP法。石蜡切片常规脱蜡、水化,高压抗原修复5 min,自然冷却,滴加体积分数8%山羊血清封闭,加兔抗鼠CD105多克隆一抗(130稀释)50 μL,室温下孵育60 min;加生物素标记羊抗兔IgG二抗(1100稀释)50 μL/片,室温孵育60 min,DAB显色,苏木精复染,脱水,透明及封片。100倍镜下选取5个不重复视野,400倍镜下进行平均光密度(LOD)测定。同样方法检测IRE1蛋白,一抗1150稀释,二抗1100稀释。
1.5.2脑组织VEGF mRNA的检测采用RT-PCR法。Trizol一步法提取总RNA,用紫外分光光度计定量,取少量进行RNA含量及纯度测定。总RNA用RNase H处理后,进行cDNA 的合成及PCR反应。VEGF引物序列为5’-GCTGTACCTCCACCATGCCAAGT-3’和5’-CACGCACTCCAGGGCTTCAT-3’,GAPDH引物序列为5’-AAGTTCAACGGCACAGT CAA-3’和5’-CGCCACAGCTTTCCAGAGGG-3’。PCR共进行35个循环(94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min),72 ℃总延伸6 min。产物经琼脂糖凝胶电泳鉴定,紫外线投射仪下拍照,用D-140图像记录分析系统进行分析,目的基因mRNA的表达量=目的条带灰度值/GAPDH条带灰度值。
1.5.3脑组织LC3-Ⅱ蛋白的检测采用Western blot法。把左侧大脑半球视交叉后6 mm新鲜组织剪切成小块,按5~10 μL/mg加入蛋白裂解液,14 000 r/min离心5 min,取上清,BCA法测定蛋白浓度,SDS-PAGE电泳,每孔上样30 μL,样品分离后转移至PVDF膜,100 V恒压80 min,硝酸纤维素封闭。按11 000稀释兔抗鼠LC3-Ⅱ一抗,4 ℃摇床孵育过夜,TBST洗膜,按14 000稀释羊抗兔IgG抗体,37 ℃孵育45 min,TBS洗膜、蒸馏水漂洗后,ECL显影,暗室压片。以GAPDH为内对照。将胶片扫描后用Bandscan 5.0进行灰度分析。目的蛋白表达量=目的条带灰度值/GAPDH条带灰度值。
1.6统计学处理采用SPSS 17.0对数据进行统计分析,多组间比较采用单因素方差分析,两两比较采用LSD-t法,计量资料相关分析采用Pearson积矩相关,检验水准α=0.05。
2结果
2.1TTC染色假手术组大鼠脑组织未见梗死灶,呈均匀一致红色;模型组和他汀组大鼠左侧大脑半球皮层和皮层下可见明显白色梗死灶,右侧大脑半球脑组织正常呈红色,且他汀组各层面梗死面积均小于模型组,见图1。
2.23组脑组织CD105和IRE1蛋白的表达免疫组化染色结果见图2。假手术组可见少量散在的CD105阳性细胞,呈棕黄色;极少量IRE1阳性细胞。模型组可见中等量CD105阳性细胞,且可见少量新生血管,呈管腔样;IRE1阳性细胞增多。他汀组可见大量CD105阳性细胞,且管腔样新生血管增多;可见大量IRE1阳性细胞。他汀组、模型组CD105和IRE1蛋白表达较假手术组升高,他汀组较模型组升高(表1)。
2.33组脑组织VEGF mRNA和LC3-Ⅱ蛋白的表达见图3、图4和表2。他汀组、模型组脑组织VEGF mRNA和LC3-Ⅱ蛋白表达较假手术组升高,他汀组较模型组升高。
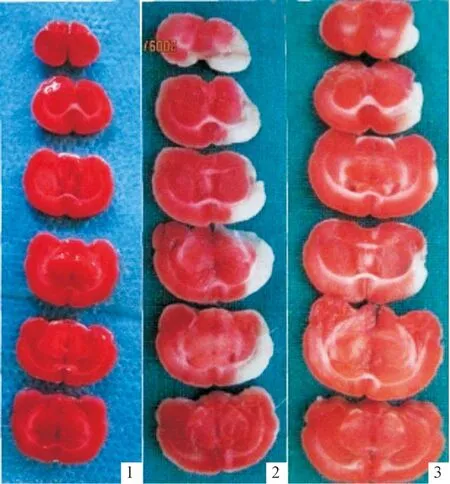
1:假手术组 2:模型组 3:他汀组。图1 脑组织TTC染色
2.43组脑组织中VEGF mRNA与LC3-Ⅱ蛋白表达的相关分析假手术组脑组织中VEGF mRNA与LC3-Ⅱ蛋白表达不存在线性相关(r=-0.263,P=0.462),而模型组和他汀组脑组织中VEGF mRNA与LC3-Ⅱ蛋白表达之间存在线性正相关(r=0.837,P=0.003;r=0.850,P=0.002)。
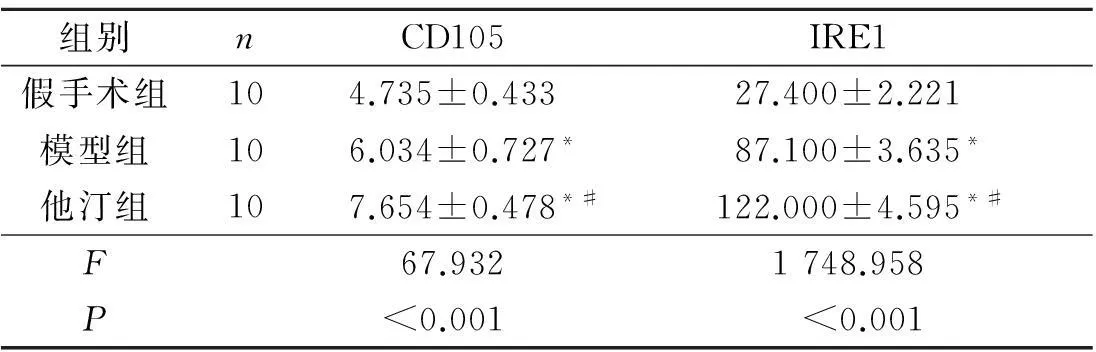
表1 3组间CD105和IRE1蛋白表达的比较
*:与假手术组比较,P<0.05;#:与模型组比较,P<0.05。

A:假手术组;B:模型组;C:他汀组。图2 3组脑组织CD105(1)和IRE1(2)蛋白表达(SP,×400)

1:假手术组;2:模型组;3:他汀组。图3 3组脑组织VEGF mRNA的表达
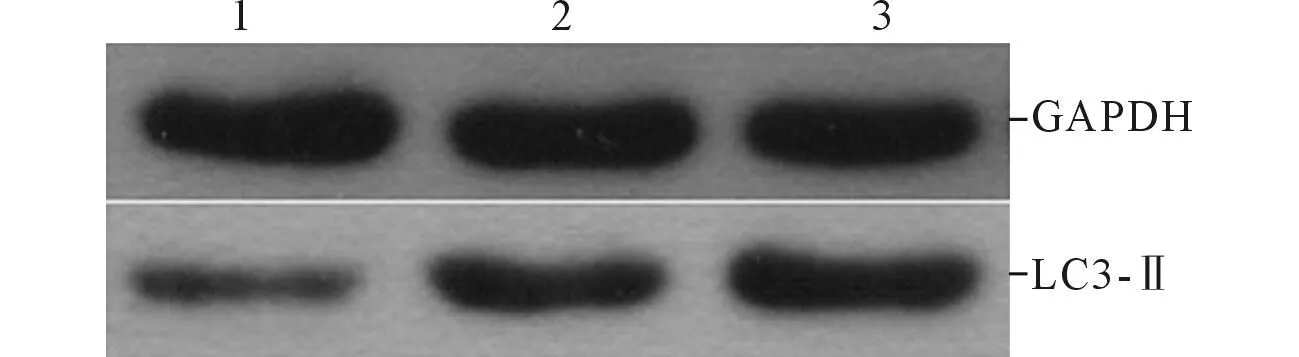
1:假手术组;2:模型组;3:他汀组。图4 3组脑组织LC3-Ⅱ蛋白的表达

表2 3组脑组织
*:与假手术组比较,P<0.05;#:与模型组比较,P<0.05。
3讨论
近年来研究[7]表明内质网应激可诱导细胞自噬,且主要通过IRE1通路,同时自噬也可以负反馈调节内质网应激,避免内质网应激过强,但过度的自噬同样可以导致自噬性细胞死亡。LC3是自噬标志性蛋白,其表达水平可反映自噬体的数量。
该研究结果显示:模型组脑组织中CD105及VEGF mRNA表达较假手术组增加,说明局灶性脑缺血后缺血半暗带区存在血管新生现象,这与以往学者研究[8]结论相吻合。他汀组脑组织中CD105及VEGF mRNA表达较模型组增加,说明阿托伐他汀通过上调VEGF表达,促进了缺血半暗带区的血管新生。进一步研究发现,假手术组脑组织中仅少量表达IRE1和LC3-Ⅱ,模型组IRE1和LC3-Ⅱ的表达高于假手术组,说明脑缺血可以激活内质网应激和自噬;他汀组脑组织中IRE1和LC3-Ⅱ表达高于模型组,说明阿托伐他汀可增强脑缺血后内质网应激和自噬效应。 作者还发现,在模型组和他汀组脑组织中VEGF mRNA与LC3-Ⅱ的表达均呈正相关关系,提示血管新生与自噬有关。
该研究中阿托伐他汀上调自噬的现象与张圣雪等[9]研究结果相悖,后者认为阿托伐他汀通过抑制血管内皮细胞的自噬,从而改善血管内皮细胞功能。也有研究[2]认为他汀可以抑制肿瘤组织的转移,此效应与其增强自噬有关。而Sabe等[2]研究发现,在患有代谢综合征的奥斯萨巴猪体内,阿托伐他汀可促进非缺血区心肌细胞自噬,抑制缺血区心肌细胞自噬。以往研究对他汀和自噬关系的看法不尽相同,但都未明确损伤因素作用时间,也就是自噬发生时间。自噬是一把双刃剑,一方面可维持细胞内环境稳定,另一方面则可导致细胞自噬性死亡,而利弊的关键取决于自噬的发生时间。有研究[10]表明损伤因素作用后24 h内,自噬多为保护性因素,而24 h以后,自噬则转化为损伤性因素,导致细胞死亡。张圣雪等用Hanks液替代培养基培养30 min,诱导血管内皮细胞发生自噬,尽管时间在24 h之内,但其细胞直接暴露于无培养液的Hanks液中,短时间内足以导致自噬性死亡。而此次研究是在整体水平上的研究,机体可有一定代偿机制,所以并不能否认阿托伐他汀可通过IRE1途径上调自噬蛋白LC3-Ⅱ,进而促进局灶性脑缺血组织血管新生。
综上所述,作者认为阿托伐他汀可通过内质网应激中IRE1通路上调自噬,促进血管新生。但该研究仅对VEGF mRNA与LC3-Ⅱ蛋白做了相关分析,对于判定二者的因果关系仍有不足,可以在今后研究中给予相应激活剂和阻滞剂,进一步明确阿托伐他汀促进血管新生的机制。
参考文献
[1]ZAITONE SA,ABO-GRESHA NM.Rosuvastatin promotes angiogenesis and reverses isoproterenol-induced acute myocardial infarction in rats: role of iNOS and VEGF[J].Eur J Pharmacol,2012,691(1/3):134
[2]SABE AA,ELMADHUN NY,SADEK AA,et al.Differential effects of atorvastatin on autophagy in ischemic and nonischemic myocardium in Ossabaw swine with metabolic syndrome[J].J Thorac Cardiovasc Surg,2014,148(6):3172
[3]ZHANG J,YANG Z,XIE L,et al.Statins, autophagy and cancer metastasis[J].Int J Biochem Cell Biol,2013,45(3):745
[4]PARIHAR SP,GULER R,KHUTLANG R,et al.Statin therapy reduces the mycobacterium tuberculosis burden in human macrophages and in mice by enhancing autophagy and phagosome maturation[J].J Infect Dis,2014,209(5):754
[5]WEI YM,LI X,XU M,et al.Enhancement of autophagy by simvastatin through inhibition of Rac1-mTOR signaling pathway in coronary arterial myocytes[J].Cell Physiol Biochem,2013,31(6):925
[6]肖卉.自噬及内质网应激在内皮细胞管型形成中的作用[D].长沙:中南大学,2013.
[7]付裕,李滢,杨方万,等.内质网应激诱导自噬的分子机制及意义[J].现代生物医学进展,2013,13(12):2393
[8]张爱梅.脑缺血后血管内皮生长因子的表达及保护作用研究[D].天津:天津医科大学,2004.
[9]张圣雪,邱龄,肖传实,等.阿托伐他汀对血管内皮细胞自噬作用中Beclin-1和Map1lc3基因mRNA表达的影响[J].中西医结合心脑血管病杂志,2009,7(6):696
[10]张立沙.自噬和内质网应激在大鼠脑缺血预适应中的作用和药物干预[D].苏州:苏州大学,2009.
*郑州大学第二附属医院院内基金资助(2015年)
Effect of atorvastatin on autophagy and angiogenesis in brain tissue of focal cerebral ischemia rats
WANGJinlan,YUETing,YANYingying,LIUHaiyan
DepartmentofNeurology,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014
Key wordsatorvastatin;focal cerebral ischemia;rat;autophagy;inositol-requiring enzyme 1;LC3-Ⅱ;angiogenesis
中图分类号R743
通信作者#,女,1987年2月生,硕士研究生,住院医师,研究方向:脑血管疾病,E-mail:563556741@qq.com
doi:10.13705/j.issn.1671-6825.2016.01.030
