HPV-16 L1甲基化和HPV E6/E7 mRNA检测宫颈病变的临床价值*
2016-02-23李肖甫智艳芳荣守华樊婷婷
李肖甫,邱 翠,智艳芳,李 雅,荣守华,樊婷婷
郑州大学第三附属医院细胞室 郑州 450052
△男,1964年7月生,硕士,教授,研究方向:肿瘤细胞病理学诊断,E-mail:lixiaofu1964@163.com
HPV-16 L1甲基化和HPV E6/E7 mRNA检测宫颈病变的临床价值*
李肖甫△,邱翠,智艳芳,李雅,荣守华,樊婷婷
郑州大学第三附属医院细胞室 郑州 450052
△男,1964年7月生,硕士,教授,研究方向:肿瘤细胞病理学诊断,E-mail:lixiaofu1964@163.com
关键词人乳头瘤病毒;宫颈病变;HPV-16 L1甲基化;HPV E6/E7 mRNA
摘要目的:探讨HPV-16 L1甲基化程度、HPV E6/E7 mRNA表达水平在检测宫颈病变中的临床价值。 方法:选择50例HPV-16感染患者的宫颈脱落细胞学标本,其中CIN1 11例、CIN2 11例、CIN3 21例、宫颈鳞癌(SCC)7例,另取11例病理检测HPV-16阴性或慢性炎症者为对照。采用甲基化敏感性高分辨溶解曲线法检测HPV-16 L1甲基化水平,采用bDNA技术检测HPV E6/E7 mRNA的表达情况。 结果:对照组、CIN1组、CIN2组、CIN3组和SCC组HPV-16 L1甲基化阳性率分别为9.1%、72.7%、81.8%、90.5%、100.0%,HPV E6/E7 mRNA阳性率分别为45.5%、72.7%、90.9%、100.0%、100.0%;CIN2以上病变中HPV-16 L1甲基化阳性率均高于对照组,而CIN3以上病变中HPV E6/E7 mRNA阳性率均高于对照组(P均<0.005)。HPV-16 L1甲基化程度和HPV E6/E7 mRNA水平均随宫颈病变严重程度的增加而升高(rS=0.638和0.525,P均<0.001);HPV-16 L1甲基化程度与HPV E6/E7 mRNA表达水平呈正相关(rS=0.420, P=0.001)。结论:HPV-16 L1甲基化与HPV E6/E7 mRNA检测在分流HPV感染或细胞学阳性患者方面具有良好的临床应用前景。
AbstractAim: To evaluate the clinical value of HPV-16 L1 methylation and HPV E6/E7 mRNA testing for the detection of cervical lesions.Methods: Fifty cervical cytology samples(11 cases of CIN1, 11 cases of CIN2, 21 cases of CIN3 and 7 cases of SCC). Another 11 samples with histology-negative or chronic inflammation were used as control. The HPV-16 L1 methylation and HPV E6/E7 mRNA levels were detected using MS-HRM assay and bDNA technique, respectively.Results: The overall positive rates of HPV-16 L1 methylation and HPV E6/E7 mRNA for control, CIN1,CIN2,CIN3 and SCC groups were 9.1%,72.7%,81.8%,90.5%,100.0% and 45.5%,72.7%,90.9%,100.0%,100.0%, respectively. The HPV-16 L1 methylation positive rate in CIN2+groups was higher than that of control group, while the HPV E6/E7 mRNA positive rate in CIN3+groups was higher than that of control group(all P<0.005). The HPV-16 L1 methylation degree and HPV E6/E7 mRNA level increased with the severity of cervical lesions(rS=0.638,0.525, all P<0.001). Additionally, the HPV-16 L1 methylation and HPV E6/E7 mRNA level had positive correlation (rS=0.420,P=0.001).Conclusion: The HPV-16 L1 methylation and HPV E6/E7 mRNA testing may have good applied prospect for the triage of women with HPV-infection or cytology-positive in clinical practice.
宫颈癌是威胁女性健康的第三大恶性肿瘤[1]。高危型人乳头瘤病毒(high-risk human papillomavirus,HR-HPV)持续感染是宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)和宫颈癌发生的主要病因[2-3]。目前已经发现有40种HPV亚型能入侵生殖器官,其中最主要的是HPV-16型,据统计,约50%的宫颈癌病例中能够发现此型HPV[4]。目前,临床上用于宫颈癌筛查的主要手段是宫颈液基薄层细胞学检查(thinprep cytologic test,TCT)联合HR-HPV DNA检测,但这两种方法反映的仅是宫颈当前的病理状态,并不能预测宫颈病变的进展及回退。因此,寻找筛查高危宫颈病变的新的生物标志已成为一个研究热点。近期研究[5]显示HPV-16 L1有望成为分流HPV感染患者的良好的生物标志物。此外,高危型HPV癌基因E6和E7的表达对于恶性肿瘤的转化和维持起着重要作用,监测HPV E6/E7 mRNA的表达具有非常重要的意义[6]。该研究通过收集细胞学检查后剩余液基标本,分别采用甲基化敏感性高分辨溶解曲线法(methylation-sensitive high resolution melting,MS-HRM)检测HPV-16阳性患者HPV-16 L1甲基化水平,QUANTIVIRUS@HPV E6/E7 mRNA 3.0 Assay(b-DNA)法检测HPV E6/E7 mRNA的水平,评估这两个指标在检测宫颈病变中的临床价值。
1对象与方法
1.1研究对象选取2012年1月至2013年5月在郑州大学第三附属医院行常规TCT检查、经PCR分型检测确认为单纯HPV-16阳性且经随访阴道镜检查获得组织活检结果的患者50例,其中CIN1组11例,CIN2组11例,CIN3组21例,宫颈鳞癌(SCC)组7例;另取11例宫颈检查HPV-16阴性或慢性炎症者为对照。纳入研究的61例患者年龄25~76岁,中位年龄39岁。该研究获得了郑州大学第三附属医院生命科学伦理委员会批准。
1.2HPV-16 L1甲基化检测
1.2.1甲基化标准品的配制HPV-16 L1基因 100%甲基化标准和0%甲基化标准均根据目标序列合成,并克隆到E.coli(南京金思特科技有限公司),两个标准品DNA浓度均由荧光定量PCR精确定量后,用0%甲基化标准品将100%甲基化标准品分别按比例稀释,配制成1%、10%、25%、50%和75% 5个甲基化程度的标准品,与0%、100%共计7个标准品,用于随后的MS-HRM检测。
1.2.2DNA提取和重亚硫酸盐修饰将TCT剩余标本4 000 r/min离心5 min,取适量沉淀物加入20 μL蛋白酶K,56 ℃水浴箱中过夜处理。提取的DNA经NanoDrop-2000超微量分光光度计(美国热电公司)定量检测后,取900 ng用于重亚硫酸盐修饰,EpiTect Bisulfite试剂盒购自德国Qiagen公司,操作严格按照说明书进行。所有修饰后的DNA及剩余TCT标本分别存放于-80 ℃和4 ℃冰箱。
1.2.3HPV-16 L1基因甲基化状态检测采用MS-HRM法。所测HPV-16 L1基因区域为nt5576~5636(NCBI 登记号:NC_001526.2),相应特异甲基化PCR上游引物序列为5’-GCGCATTATTGTTGAT GTAGGTGATTTTTATTTATATTTTAG-3’,下游引物序列为5’-GCCGCACTAAACAACCAAAAAAACATC TAAAAAAAAATA-3’。PCR扩增体系:5.0 μL 2×EpiTect HRM PCR Master Mix,上、下游引物(10 mg/L)各0.6 μL,1.0 μL修饰后DNA,2.8 μL无菌水。PCR扩增条件:95 ℃ 1 min;95 ℃ 30 s, 退火从60 ℃到52 ℃ 30 s(每个循环下降 0.2 ℃),72 ℃ 30 s,40个循环;72 ℃ 1 min。PCR产物经18 g/L凝胶电泳验证。扩增后,在LightCycler480上进行高分辨溶解曲线分析,条件为:95 ℃ 1 min, 40 ℃ 1 min, 65 ℃ 1 s, 以0.02 ℃/s的速度从72 ℃上升至95 ℃,收集溶解曲线数据,每1 ℃采集荧光25次,40 ℃ 冷却1 min。所有标本和标准品同时检测。最后,运行gene scanning程序,根据样本与标准品溶解曲线荧光值高低判断样本甲基化程度。以10%甲基化为临界点判定甲基化阳性率。
1.3HPV E6/E7 mRNA检测试剂盒购自科迪亚生物技术有限公司。采用bDNA法定量检测标本中HPV E6/E7 mRNA水平,具体按文献[7]操作:将TCT剩余标本3 000 r/min离心5 min后弃去上清,用2 mL去离子水洗涤后再次离心,弃上清,加入裂解液,放65 ℃恒温箱过夜;经配制检测缓冲液、布板、信号放大,上冷光仪检测,得标本、空白及阳性质控的发光值,用相关光单位(RLU)表示,将所得数据导入专用软件处理。当标本RLU和阳性质控的cutoff值≥1.00时,判定标本为阳性。
1.4统计学处理采用SPSS 17.0处理数据。宫颈病变级别与HPV-16 L1甲基化程度和HPV E6/E7 mRNA水平间,以及HPV-16 L1甲基化程度与HPV E6/E7 mRNA水平间的相关性采用Spearman秩相关分析,采用χ2检验比较不同级别宫颈病变组织中HPV-16 L1甲基化阳性率和HPV E6/E7 mRNA阳性率的差异。检验水准α=0.05。
2结果
2.1不同级别宫颈病变组织中HPV-16 L1甲基化程度和HPV E6/E7 mRNA水平的比较所有标准品HPV-16 L1甲基化程度均被成功检测(图1)。HPV-16 L1甲基化程度随宫颈病变严重程度的增加而升高(rS=0.638,P<0.001)。HPV E6/E7 mRNA的水平随宫颈病变严重程度的增加而升高(rS=0.525,P<0.001)。
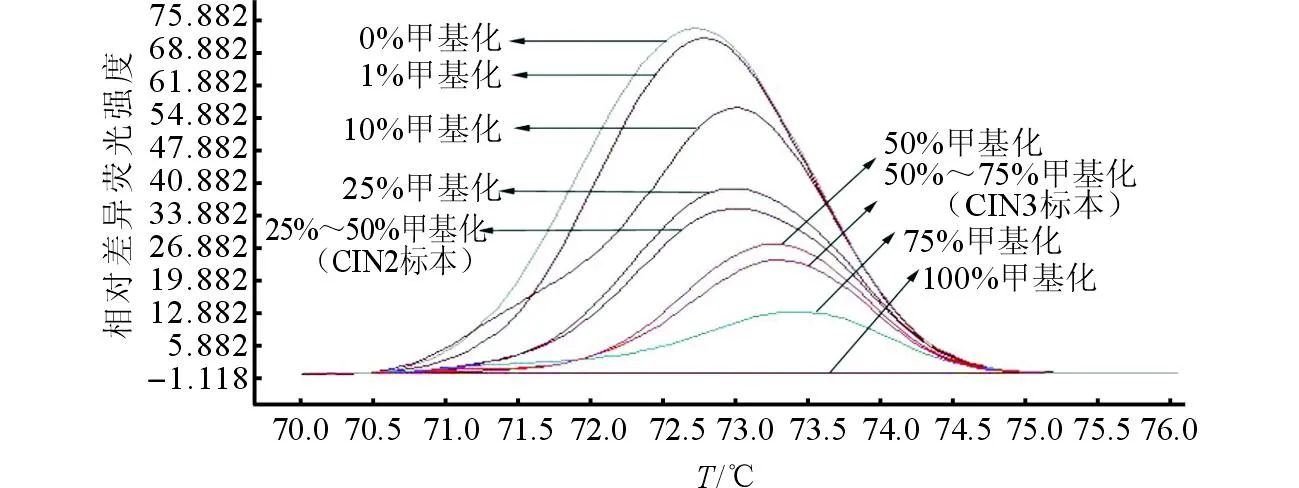
图1 MS-HRM方法检测HPV-16 L1不同甲基化程度标准品和标本的差异标准曲线图
2.2宫颈病变组织中HPV-16 L1甲基化程度与HPV E6/E7 mRNA水平间的关系HPV-16 L1甲基化程度与HPV E6/E7 mRNA水平呈正相关(rS=0.420,P=0.001)。
2.3不同宫颈病变HPV-16 L1甲基化阳性率和HPV E6/E7 mRNA阳性率比较见表1。

表1 不同宫颈病变HPV-16 L1甲基化
*:与对照组相比,P<0.005。
2.4不同检测方法诊断CIN2以上病变的敏感性、特异性、阳性预测值和阴性预测值见表2。

表2 不同检测方法诊断CIN2以上病变的敏感性、特异性、阳性预测值和阴性预测值 %
3讨论
有研究[8-9]指出,HPV DNA 的甲基化状态可以提示HPV感染者CIN2及以上瘤变。HR-HPV感染是宫颈癌发生的重要始动因素。在全球范围内,HPV-16型目前已经证实是宫颈癌中最常见的型别;HPV-16致癌性最强,且从最初感染到进展为宫颈癌的发病时间也相对其他类型的HR-HPV要短很多。HPV-16 L1壳蛋白具有较强的免疫原性,可诱导先天性或获得性免疫应答,有利于机体清除感染细胞。HPV-16 L1基因甲基化则在一定程度上可能影响L1壳蛋白的表达,使得其免疫效应弱化,最终导致宫颈疾病的发生和进展。因此,HPV-16 L1甲基化有望成为分流HPV感染患者的良好生物标志物。
近年来,人们对DNA甲基化认识不断提高,并研究开发了一系列检测DNA甲基化的方法。HPV基因组长7 000~8 000 bp,由于其基因组中没有典型的CpG岛,所以目前多采用特异位点甲基化的检测手段,就方法学而言各有其特点[10]。与其他方法相比,MS-HRM方法具有以下优点:①能够定量检测DNA甲基化程度。②高通量且能够减少工作量。③节约成本。④快速且敏感性高。作者选择MS-HRM作为检测方法,结果显示,HPV-16 L1甲基化程度随宫颈病变严重程度的增加呈上升的趋势,且CIN2以上病变组HPV-16 L1甲基化阳性率高于对照组,和以往研究[11]结果一致。
HPV的早期基因E6/E7编码的早期蛋白在宿主细胞中表达是导致宫颈癌的关键因素[12],其机制可能为E6/E7蛋白抑制了抑癌基因p53和pRB[13-14],引起细胞过度增殖,最终导致宫颈癌的发生[15]。因此,作为E6/E7蛋白翻译模板的mRNA的检测有利于区别短暂性HPV感染和高级别宫颈病变相关的HPV感染,较之DNA 检测特异性更高,也更具有临床指导意义[16]。
该研究采用的bDNA技术是一种三明治结构的核酸杂交方法。该方法采用bDNA分子放大捕获的目标RNA信号。该技术特点是检测样本不需呈指数增长的扩增过程,通过支链DNA和化学发光两种信号放大技术达到检测微量样本的能力,克服了传统的实时PCR技术中操作复杂、易污染的弊端。该研究结果显示,HPV E6/E7 mRNA的水平随宫颈病变级别的升高而升高,且CIN3以上病变组HPV E6/E7 mRNA的阳性率高于对照组,与上述理论及作者以往的研究[17]一致,也与有关研究[18-19]结果相似。
此外,该研究结果还显示:HPV-16 L1甲基化程度与HPV-16 E6/E7 mRNA水平呈正相关;在对CIN2以上病变检测时,两种方法及两种方法联合检测的敏感性、特异性、阳性预测值和阴性预测值间无明显差异,说明两种方法及两种方法联合对宫颈病变诊断具有相同作用。
综上所述,HPV-16 L1甲基化与HPV E6/E7 mRNA与宫颈癌病变关系密切,在分流HPV感染患者方面应具有良好的临床应用前景。HPV-16 L1甲基化检测或HPV E6/E7 mRNA检测可与HPV DNA检测互为补充,为妇科医师临床诊治HPV感染患者及评估临床疗效提供依据。
参考文献
[1]JEMAL A,BRAY F,CENTER MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69
[2]胡滨,崔金全,邓克红,等.宫颈癌组织高危型HPV感染与HWAPL蛋白表达的关系[J].郑州大学学报(医学版),2014,49(6):862
[3]吴余,崔静,王虹,等.HPV16相关宫颈癌组织中MUC16和E6表达的关系[J].郑州大学学报(医学版),2015,50(1):41
[4]LI N,FRANCESCHI S,HOWELL-JONES R,et al.Human papillomavirus type distribution in 30,848 invasive cervical cancers worldwide:variation by geographical region, histological type and year of publication[J].Int J Cancer,2011,128(4):927
[5]BRYANT D,ONIONS T,RAYBOULD R,et al.Increased methylation of human papillomavirus type 16 DNA correlates with viral integration in vulval intraepithelial neoplasia[J].J Clin Virol,2014,61(3):393
[6]SPATHIS A,KOTTARIDI C,CHRANIOTI A,et al.mRNA and DNA detection of human papillomaviruses in women of all ages attending two colposcopy clinics[J].PLoS One,2012,7(11):e49205
[7]沈勇.HPV E6/E7 mRNA对宫颈癌的诊断价值[D].郑州:郑州大学,2013.
[8]SNELLENBERG S,SCHUTZE DM,CLAASSEN-KRAMER D,et al.Methylation status of the E2 binding sites of HPV16 in cervical lesions determined with the Luminex®xMAPTMsystem[J].Virology,2012,422(2):357
[9]SUN C,REIMERS LL,BURK RD.Methylation of HPV16 genome CpG sites is associated with cervix precancer and cancer[J].Gynecol Oncol,2011,121(1):59
[10]李懿,李光润,陈宏.DNA甲基化检测技术进展及经验总结[J].医学综述,2015,21(2):204
[11]CLARKE MA,WENTZENSEN N,MIRABELLO L,et al.Human papillomavirus DNA methylation as a potential biomarker for cervical cancer[J].Cancer Epidemiol Biomarkers Prev,2012,21(12):2125
[12]LI J,LI LK,MA JF,et al.Knowledge and attitudes about human papillomavirus(HPV) and HPV vaccines among women living in metropolitan and rural regions of China[J].Vaccine,2009,27(8):1210
[13]VOUSDEN K.Interactions of human papillomavirus transforming proteins with the products of tumor suppressor genes[J].FASEB J,1993,7(10):872

[14]LIVINGSTONE LR,WHITE A,SPROUSE J,et al.Altered cell cycle arrest and gene amplification potential accompany loss of wild-type p53[J].Cell,1992,70(6):923
[15]SHAIKH F,SANEHI P,RAWAL R.Molecular screening of compounds to the predicted protein-protein interaction site of Rb1-E7 with p53-E6 in HPV[J].Bioinformation,2012,8(13):607
[16]CUZICK J,MAYRAND MH,RONCO G,et al.Chapter 10:new dimensions in cervical cancer screening[J].Vaccine,2006,24(Suppl 3):90
[17]智艳芳,李肖甫,沈勇,等.人乳头瘤病毒癌基因E6/E7 mRNA检测在宫颈病变中的临床意义[J].国际遗传学杂志,2014,37(1):7
[18]姜俊,陈宜刚,王华,等.人乳头瘤病毒E6/E7 mRNA的检测在宫颈癌筛查中的初步评价[J].南京医科大学学报(自然科学版),2013,9(9):1261
[19]KOTTARIDI C,TSIODRAS S,SPATHIS A,et al.Clinical performance of human papillomavirus E6, E7 mRNA flow cytometric assay compared to human papillomavirus DNA typing[J].Anal Quant Cytol Histol,2011,33(6):305
(2015-04-22收稿责任编辑徐春燕)
*河南省科技厅基础科技攻关课题资助项目122300410036
Clinical value of HPV-16 L1 methylation and HPV E6/E7 mRNA testing in detection of cervical lesions
LIXiaofu,QIUCui,ZHIYanfang,LIYa,RONGShouhua,FANTingting
DepartmentofCytopathology,theThirdAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
Key wordshuman papillomavirus;cervical lesion;HPV-16 L1 methylation;HPV E6/E7 mRNA
中图分类号R737.3
doi:10.13705/j.issn.1671-6825.2016.01.012
