Egr-1对妊娠期糖尿病大鼠肝脏组织中PEPCK和G-6-Pase mRNA表达的影响*
2016-02-23赵继红王崇贤辛雅萍张苏河付艳芹
赵继红,王崇贤,辛雅萍,张苏河,付艳芹
郑州大学第二附属医院内分泌科 郑州 450014
Egr-1对妊娠期糖尿病大鼠肝脏组织中PEPCK和G-6-Pase mRNA表达的影响*
赵继红,王崇贤,辛雅萍,张苏河#,付艳芹
郑州大学第二附属医院内分泌科 郑州 450014
关键词胰高血糖素;妊娠期糖尿病;糖异生;早期应激蛋白-1;大鼠
摘要目的:探讨Egr-1是否参与妊娠期糖尿病(GDM)大鼠肝脏糖异生。方法:45只健康SD雌性大鼠随机分为正常饮食非孕鼠组(NC组)、正常饮食孕鼠组(NGT组)、高脂高糖饮食孕鼠组(GDM组),每组15只。妊娠第21天,应用全自动生化检测仪检测空腹血糖(FPG),ELISA法测定空腹胰岛素(FINS)、空腹胰高血糖素(FHGF),并计算胰岛素抵抗指数(HOMA-IR)。应用RT-PCR检测肝脏组织中Egr-1和PEPCK、G-6-Pase mRNA表达水平。结果:与NC组比较,NGT组、GDM组大鼠HOMA-IR、FHGF和肝脏组织中Egr-1、PEPCK、G-6-Pase mRNA表达水平均升高(P均<0.05);与NGT组比较,GDM组大鼠HOMA-IR、FHGF和肝脏组织中Egr-1、PEPCK、G-6-Pase mRNA表达水平均升高(P均<0.05)。在GDM组大鼠中,肝脏Egr-1的表达与FHGF、PEPCK和G-6-Pase的表达均呈正相关(r=0.855、0.975和0.897,P均<0.05)。结论:Egr-1通过影响胰高血糖素调控的肝脏糖异生参与GDM的发病。
AbstractAim: To explore whether early growth response protein-1(Egr-1) engages in gluconeogenesis in liver of gestational diabetes mellitus(GDM) ras.Methods: A total of 45 healthy SD female rats were randomly allocated into three groups:normal diet virgin rat(NC) group,normal diet pregnant rat(NGT) group,high sucrose and fat diet pregnant rat(GDM) group.On the 21st day of gestation, fasting plasma glucose(FPG) was tested by fully automatic biochemical detector, ELISA was employed for the examination of serum fasting insulin(FINS) and serum fasting glucagon(FHGF), and IR index(HOMA-IR) was calculated.RT-PCR technology was utilized to assess the levels of Egr-1, PEPCK, and G-6-Pase mRNA in liver.Results: The mice of both the NGT and the GDM groups had much higher levels of HOMA-IR, FHGF and PEPCK, Egr-1, G-6-Pase mRNA in liver than those of the NC group(P<0.05).Nevertheless, HOMA-IR, FHGF and PEPCK, Egr-1, G-6-Pase mRNA levels in liver of mice in the GDM group were significantly higher compared with those of the NGT group(P<0.05). In the GDM group, there were positive correlations between the level of Egr-1 mRNA in liver and FHGF, PEPCK or G-6-Pase mRNA(r=0.855,0.975,0.897,P<0.05).Conclusion: Egr-1 engages in the development of GDM through impacting the gluconeogenesis controlled by glucagon.
妊娠期糖尿病(gestational diabetes mellitus,GDM)发病率在全球范围内逐年上升,其对母婴近期及远期危害均较严重。GDM的发病机制与2型糖尿病(T2DM)相似,其中肝脏糖异生的异常被认为是T2DM重要的致病因素[1]。肝脏糖异生主要受胰高血糖素调控[2-3]。研究[4]显示,随着胰高血糖素浓度的增加,早期应激蛋白-1(early growth response protein-1,Egr-1)的表达也增加,并且胰高血糖素可调节肝脏糖异生关键酶磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)及6-磷酸葡萄糖脱氢酶(glucose-6-phosphate dehydrogenase,G-6-Pase)的表达水平,促进肝脏糖异生,从而导致体内糖代谢紊乱。作者建立了一种GDM动物模型,检测其空腹胰高血糖素(FHGF)及肝脏组织中Egr-1、PEPCK、G-6-Pase mRNA表达水平,研究胰高血糖素参与肝脏糖异生的机制,为临床上靶向治疗GDM提供新的思路。
1材料与方法
1.1实验动物选取及分组实验动物为购于河南省实验动物中心的4周龄SD雌性大鼠45只和雄性大鼠10只(体重180~200 g),饲料为普通饲料(标准啮齿类)及高脂高糖饲料[5]。将45只健康雌性SD大鼠先用普通饲料适应性喂养1周,然后采用随机数字表法分为3组(n=15):正常饮食非孕鼠组(NC组)、正常饮食孕鼠组(NGT组)、高脂高糖饮食孕鼠组(GDM组)。所有大鼠均不限制食、水。喂养6周之后,将孕鼠组与雄性SD大鼠按照21的比例合笼,次晨镜检精子(+)判为妊娠第1天,标记后隔离孕鼠。雄性大鼠均用普通饲料喂养。
1.2大鼠FHGF、空腹血糖(FPG)和空腹胰岛素(FINS)及胰岛素抵抗指数(HOMA-IR)的检测妊娠第21天时所有大鼠隔夜禁食12 h以上,腹腔注射麻醉,取股静脉血,4 ℃、3 000 r/min离心10 min分离血清,置于-20 ℃冰箱保存待测。采用全自动生化检测仪检测FPG,采用FINS ELISA检测试剂盒(美国贝克曼库尔特有限公司)测定FINS,由此计算HOMA-IR,采用FHGF ELISA检测试剂盒(北京北方生物科技研究所)测定FHGF。
1.3大鼠肝脏组织中Egr-1和PEPCK、G-6-Pase mRNA表达水平的测定大鼠采血后立即处死(颈椎脱臼法),取新鲜肝脏组织迅速置于液氮中冻存24 h 后,-80 ℃保存。应用RT-PCR法检测肝脏组织中Egr-1和PEPCK、G-6-Pase mRNA的表达。取约100 mg肝脏组织放入液氮中研磨至细颗粒状,加入Trizol 1 mL,提取总RNA,逆转录成cDNA,取2 μL cDNA 作为模板行PCR 扩增。RT-PCR引物见表1。反应条件:94 ℃ 预变性2 min;94 ℃ 变性及退火各30 s(Egr-1和PEPCK、G-6-Pase 退火温度均为55 ℃,GAPDH 为55 ℃),72 ℃延伸2 min,共35 个循环;72 ℃总延伸6 min。取5 μL 扩增产物行琼脂糖凝胶电泳,EB 染色,应用紫外线投射仪观察电泳条带,应用D-140 图像记录分析系统计算目的基因的相对表达量。
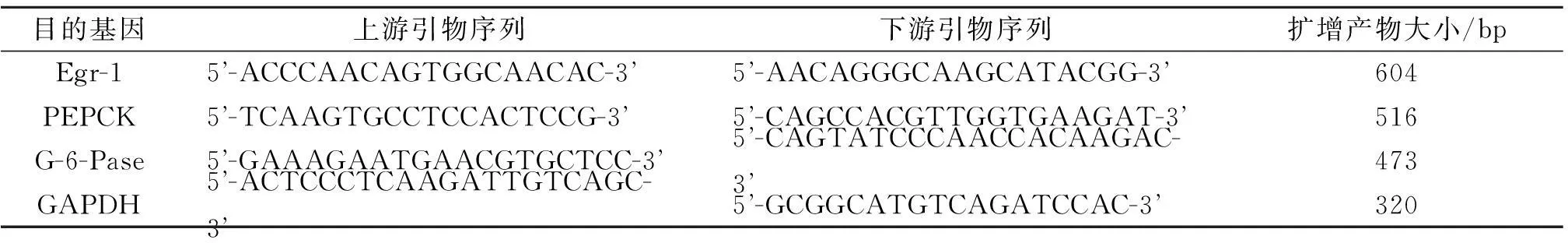
表1 RT-PCR引物
1.4统计学处理应用SPSS 16.0对数据进行处理。3组间FPG、FINS、HOMA-IR、FHGF及Egr-1、PEPCK、G-6-Pase mRNA相对表达量的比较采用单因素方差分析,组间两两比较采用LSD-t检验;GDM组大鼠肝脏组织中Egr-1 mRNA相对表达量与FHGF、肝脏组织中PEPCK和G-6-Pase mRNA相对表达量的关系采用Pearson直线相关性进行分析。检验水准α=0.05。
2结果
2.13组大鼠FPG、FINS 和HOMA-IR 的比较结果见表2。与NC组比较,NGT组、GDM组大鼠FPG、FINS和HOMA-IR均升高;与NGT组比较,GDM组大鼠FPG、FINS和HOMA-IR均升高。
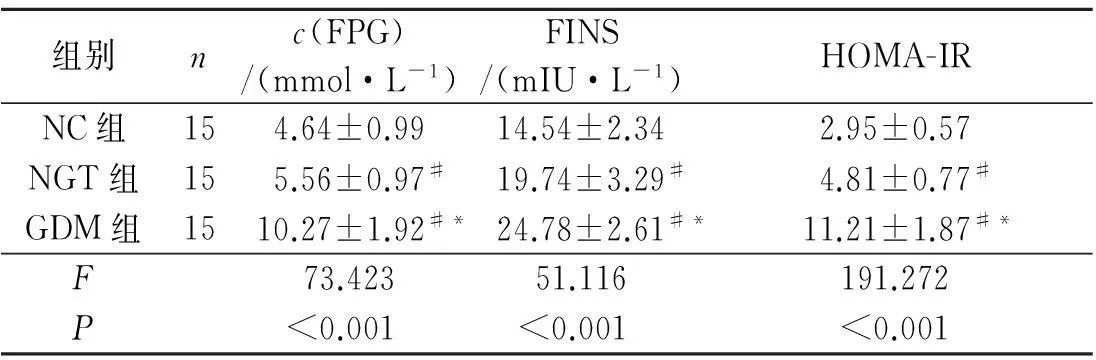
表2 3组大鼠FPG、FINS 和HOMA-IR 的比较
#:与NC组比较,P<0.05;*:与NGT组比较,P<0.05。
2.23组大鼠FHGF和肝脏组织中Egr-1、PEPCK、G-6-Pase mRNA表达水平的比较结果见图1及表3。与NC组比较,NGT组和GDM组大鼠FHGF和肝脏组织中Egr-1、PEPCK、G-6-Pase mRNA表达水平均升高;与NGT组比较,GDM组大鼠FH-GF和肝脏组织中Egr-1、PEPCK、G-6-Pase mRNA表达水平均升高。
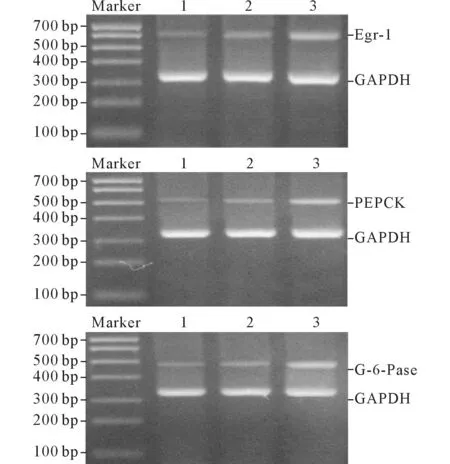
1:NC组;2:NGT组;3:GDM组。图1 大鼠肝脏组织中Egr-1(上)、PEPCK(中)、G-6-Pase(下)mRNA的表达水平
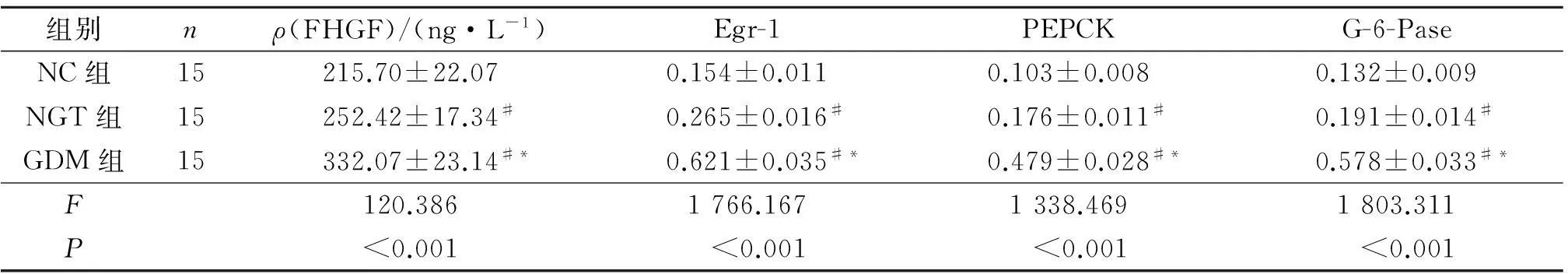
组别nρ(FHGF)/(ng·L-1)Egr-1PEPCKG-6-PaseNC组15215.70±22.070.154±0.0110.103±0.0080.132±0.009NGT组15252.42±17.34#0.265±0.016#0.176±0.011#0.191±0.014#GDM组15332.07±23.14#*0.621±0.035#*0.479±0.028#*0.578±0.033#*F120.3861766.1671338.4691803.311P<0.001<0.001<0.001<0.001
#:与NC组比较,P<0.05;*:与NGT组比较,P<0.05。
2.3GDM组大鼠肝脏组织中Egr-1 mRNA相对表达量与FHGF、肝脏组织中PEPCK和G-6-Pase mRNA相对表达量的相关性GDM组大鼠肝脏组织中Egr-1 mRNA的相对表达量与FHGF呈正相关(r=0.855,P=0.020),与肝脏组织中PEPCK和G-6-Pase mRNA的相对表达量均呈正相关(r=0.975和0.897,P均<0.001)。
3讨论
T2DM的主要表现是FPG的异常升高,而影响FPG水平的主要因素是胰高血糖素调节的肝脏糖异生[6-7]。最新研究[4]表明,Egr-1的表达随着胰高血糖素浓度的增加而增加,此外胰高血糖素可以调节肝脏糖异生关键酶PEPCK及G-6-Pase的表达水平,促进肝脏糖异生,从而导致体内糖代谢紊乱。Egr-1是一种转录因子,含有3个锌指结构,在肝脏及脂肪组织中分布,可以通过调控下游基因参与T2DM的发病过程[8]。肝脏糖异生是GDM形成的重要原因。妊娠期,胰腺胰高血糖素分泌增多,但关于其是否通过调控Egr-1调节肝脏糖异生,并参与GDM的发病,相关研究却较少。
该研究结果显示:NGT组大鼠 HOMA-IR较NC组升高,这是由于在正常妊娠中晚期,体内激素发生巨大变化,许多升糖激素(如雌激素、孕激素等)分泌增多,胰岛素分泌相对增加,形成一种生理性胰岛素抵抗,以保证胎儿可以获得足够的葡萄糖;GDM组大鼠HOMA-IR较NC组及NGT组明显升高,提示妊娠期高脂高糖饮食使胰岛β细胞代偿性分泌的胰岛素发生失代偿,加重胰岛素抵抗,提示造模成功[9]。与NC组比较,NGT组大鼠FHGF升高,可能因为妊娠时期机体的代谢需求增加,导致胰岛α细胞代偿性增多;与NGT组比较,GDM组大鼠FHGF明显升高,这可能是由于GDM患者胰岛素水平偏高或正常,α细胞长期处于高胰岛素环境中,发生病理性胰岛素抵抗,削弱了胰岛素抑制α细胞分泌胰高血糖素的正常负反馈机制, 从而导致血液中胰高血糖素升高[10]。另外,NC组、NGT组及GDM组大鼠FPG及肝脏组织中PEPCK、G-6-Pase mRNA表达水平依次增高,这是由于胰高血糖素调节的肝脏糖异生是影响FPG的主要因素,而在GDM中胰高血糖素异常升高,引起肝脏糖异生关键酶生成增多,从而导致FPG升高。该研究结果还显示:在GDM组中,Egr-1 mRNA的表达与FHGF呈正相关,PEPCK和G-6-Pase mRNA的表达与Egr-1 mRNA的表达呈正相关,提示胰高血糖素可能通过调控Egr-1通路调节了肝脏糖异生关键酶PEPCK及G-6-Pase的表达,促进糖异生。
目前,临床上药物治疗GDM除了应用胰岛素外,尚无其他治疗方法。Egr-1作为胰高血糖素介导的肝脏糖异生调节的关键因子,与GDM大鼠模型中的糖异生关键酶PEPCK和G-6-Pase的表达呈正相关。那么通过靶向调控Egr-1减少肝脏糖异生,是否会延缓GDM的发生发展,能否成为GDM治疗的新靶点,为GDM的预防及治疗提供新的途径,有待进一步的研究。
参考文献
[1]KIM DK,GANG GT,RYU D,et al.Inverse agonist of nuclear receptor ERRγ mediates antidiabetic effect through inhibition of hepatic gluconeogenesis[J].Diabetes,2013,62(9):3093
[2]EDGERTON DS,CHERRINGTON AD.Glucagon as a critical factor in the pathology of diabetes[J].Diabetes,2011,60(2):377
[3]CRYER PE.Minireview:glucagon in the pathogenesis of hypoglycemia and hyperglycemia in diabetes[J].Endocrinology,2012,153(3):1039
[4]沈宁.早期应激蛋白Egr-1及其相关信号通路调控机体血糖稳态的研究[D].南京:南京大学,2013.
[5]李变锋,付艳芹,张东铭,等.饮食干预对高脂高糖诱导的妊娠期大鼠胰岛素抵抗状态的影响[J].郑州大学学报(医学版),2013,48(4):499
[6]HANCOCK AS,DU A,LIU J,et al.Glucagon deficiency reduces hepatic glucose production and improves glucose tolerance in adult mice[J].Mol Endocrinol,2010,24(8):1605
[7]WANG MY,CHEN L,CLARK GO,et al.Leptin therapy in insulin-deficient type Ⅰ diabetes[J].Proc Natl Acad Sci U S A,2010,107(11):4813
[8]CRONIGER CM,MILLWARD C,YANG J,et al.Mice with a deletion in the gene for CCAAT/enhancer-binding protein beta have an attenuated response to cAMP and impaired carbohydrate metabolism[J].J Biol Chem,2001,276(1):629
[9]李变锋,辛亚萍,王崇贤,等.高脂高糖喂养诱导妊娠期胰岛素抵抗大鼠模型的建立与评价[J].广东医学,2013,34(11):1667
[10]杜瑞琴,李宏亮,杨文英,等.胰岛素信号转导基因表达的改变与α细胞胰岛素抵抗的实验研究[J].中华医学杂志,2006,86(36):2542
*河南省医学科技攻关计划基金资助项目201403091
Implication of Egr-1 on mRNA expressions of PEPCK and G-6-Pase in liver from mice with gestational diabetes mellitus
ZHAOJihong,WANGChongxian,XINYaping,ZHANGSuhe,FUYanqin
DepartmentofEndocrinology,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014
Key wordsglucagon;gestational diabetes mellitus;gluconeogenesis;early growth response protein-1;mouse
中图分类号R587.1
通信作者#,女,1956年2月生,博士,教授,主任医师,研究方向:妊娠期糖尿病,E-mail:zhangsuhe@126.com
doi:10.13705/j.issn.1671-6825.2016.01.018
