腔内隔绝术用覆膜支架顺应性的研究意义及进展
2016-02-16关国平
关 颖 关国平,2 林 婧,2 王 璐,2#*
1(东华大学 纺织学院,上海 201620)2(纺织面料技术教育部重点实验室,上海 201620)
腔内隔绝术用覆膜支架顺应性的研究意义及进展
关 颖1关国平1,2林 婧1,2王 璐1,2#*
1(东华大学 纺织学院,上海 201620)2(纺织面料技术教育部重点实验室,上海 201620)
小口径人工血管与宿主血管间顺应性不匹配,是导致其植入后远期通畅率低的重要因素;而目前已有文献证明,腔内隔绝术用覆膜支架(SG)与宿主血管间顺应性不匹配,也是引起术后远期滑移、内漏、血流紊乱等并发症的原因。但是,这一领域的研究十分有限。综述SG顺应性的评价方法,包括通过SG体积、压力的变化计算其体积顺应性,或通过脉搏波速和瘤体压力间接反映SG的顺应性。关于SG顺应性的研究主要包括:验证SG的植入对宿主血管的影响,不同结构SG对宿主血管的影响,以及顺应性随疲劳时间推移的可能变化。同时,对改变结构优化SG顺应性进行简要综述。
腔内隔绝术;覆膜支架;顺应性;人工血管;裸金属支架
引言
人体动脉血管管壁具有弹性,在体内脉动压力下,其管壁随脉动压力的变化,扩张和收缩持续交替,从而维持体内血流稳定。舒张功能是动脉血管的重要特性[1]。顺应性又称弹性,是指由于血管内压力的变化引起血管容积的变化,是用于表征血管在人体血液系统压力作用下管壁变形响应性的重要参数[2]。小口径人工血管植入后易出现吻合口内膜增生、再狭窄等并发症,中远期通畅率仍有待提高,而其与宿主血管顺应性的不匹配是人工血管植入失败的重要原因。宿主血管与人工血管间顺应性匹配程度的提高有助于减少内膜增生,提高人工血管移植成功率[3-5]。因此,顺应性的匹配是人工血管生物力学性能中的一个主要问题[6]。目前,针对顺应性的研究多集中于小口径(内直径小于6 mm)人工血管,从血管材料、结构和后处理等方面对顺应性的影响因素和改善方法进行了细致研究[7],而对腔内隔绝术用覆膜支架(stent graft,SG)顺应性的研究十分有限。为此,笔者对SG顺应性的研究意义及现有研究进展两方面进行了文献综述和分析讨论,指出现有研究存在的不足之处,提出该领域当下可能的研究方向。笔者在对SG的顺应性研究现状进行综述之前,还对小口径人工血管和裸金属支架的顺应性研究分别进行了综述。这是由于小口径人工血管的顺应性研究已较为丰富,且其材料、结构与SG的覆膜部分相同,裸金属支架的材料与结构和SG的金属支架部分相似,故这二者的顺应性研究对SG的顺应性研究具有指导意义。
1 腔内隔绝术用覆膜支架
腔内隔绝术以其创伤小、失血少以及术后死亡率和发病率低等特点,逐渐取代了开腔手术[8-10],其治疗的关键器械SG因此得到了广泛的关注和临床应用。SG通常是由金属支架、覆膜和缝合线构成。在SG的早期设计中,金属支架材料通常是采用不锈钢,随后由超弹性形状记忆合金——镍钛合金取代,因为镍钛合金同时还具有优良的生物相容性、耐久性和抗腐蚀、扭转和疲劳等性能。SG的覆膜通常是用轻质、高强和低孔隙率的机织物,目前最常用的覆膜材料是涤纶(polyethylene terephthalate, PET)或膨体聚四氟乙烯(expanded polytetrafluoroethylene, ePTFE)。各厂家生产的商用SG的详细信息见表1。
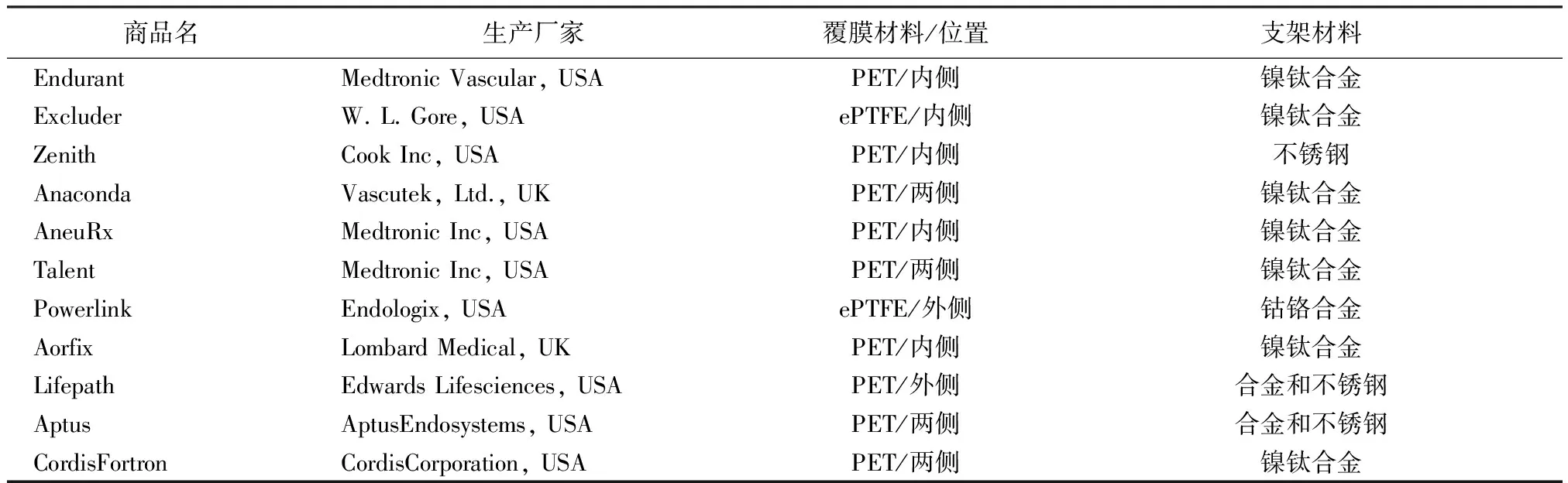
表1 目前商用的SG及其材料[11-14]
2 SG顺应性的研究意义
尽管腔内隔绝术治疗具有诸多优势,但其术后远期仍可能发生SG滑移、内漏,血栓,导致动脉瘤破裂等并发症[15-19]。Mehta等针对1 768名动脉瘤腔内修复的病人进行了长达34个月的随访记录,其中19.2%的病人需要对动脉瘤相关并发症进行二次治疗[12]。术后并发症发生,如若处理不及时,将危及患者生命,因此这一问题不容忽视。
SG近、远端的锚定稳定与否对血管内支架的远期临床结果至关重要[15, 20-23]。仅靠SG的径向力使支架位置固定,会使病变处的血管颈部直径逐渐扩大,SG近、远端锚定不稳,引起Ⅰ型内漏和SG滑移,从而导致动脉瘤暴露于系统脉动血压下,最终引起动脉瘤的破裂。为防止远端移位,以延长近端锚定区为主要措施的跨肾动脉的裸支架固定是最常采用的方式。例如,在裸支架上和/或近端覆膜支架部分,增加倒钩和倒刺等刚性结构,以增加周向固定力和摩擦力[24]。但倒钩和倒刺在刺入血管壁的同时,也会使宿主血管壁受到损伤,引起该部位血管增生。尽管如此,支架远端移位问题尚无法根除[15],主要原因:一是支架移植物主要是依靠其周向固定力和摩擦力锚定在近端瘤颈,但随着心动周期而搏动的高速高压的血流在不间断地向支架移植物施加向远端移位的作用力;二是人站立时的地心引力作用,这也是导致支架移植物远端移位的原因;三是从流体力学的角度考虑,当支架移植物的稳定力小于使其向远端移位的作用力时,就会发生支架移植物的远端移位;四是治疗时的主动脉瘤瘤颈,从某种概念上说应该是未成熟的动脉瘤,随着动脉硬化病变的进展,很多患者的动脉瘤瘤颈发生扩张。倒钩的加入并没有增加覆膜支架的径向力[25],而且倒钩的存在还会引起释放过程中SG上的覆膜和支架结构的不均匀扩张[26],从一定程度上说明刚硬的支架可能并不能阻止SG的滑移。这提示需要一个更具柔顺性的固定系统,可以承受复杂的血管系统环境,降低支架材料与宿主血管的不匹配性。
所报道的这些SG移植后的临床结果不仅与其近端固定有关,而且与SG植入后的血流动力学特征有关[15]。SG植入后,其内部血流动力学特征的改变也是源于SG和动脉血管壁之间的顺应性不匹配。顺应性不匹配,导致血流动力学因素发生变化,主要包括血液远端灌注的减少、压力波反射增加和吻合口界面处机械应力的增加等。血流紊乱,导致中风、冠状动脉疾病等[27]。脉搏波速每增加1m/s,心血管疾病的风险将增加14%[28]。以上两方面都说明,理想的SG需要具有与宿主血管相匹配的顺应性,且与文献[29]得出的结论一致。因此,为了减少SG移植后远期不良结果的发生,方便SG的输送,提高其与不规则瘤径的匹配程度,支架设计时需要赋予SG足够的顺应性[30]。Morris等通过实验证明,目前商用的SG与宿主血管顺应性并不匹配,将其植入后将降低宿主血管的顺应性[31]。因此,SG的顺应性是一个亟待研究的重要问题。
3 SG顺应性的研究
3.1 顺应性的测试方法
3.1.1 人工血管顺应性的测试方法
目前,人工血管的顺应性测试方法可以参考ISO 7198—1998心血管植入物-管状人工血管[32]这一国际标准,顺应性的计算如下:
(1)
式中:C是顺应性,%/100 mmHg;P1是低压值,mmHg;P2是高压值,mmHg。
上述计算得到径向顺应性的物理意义为压力变化100 mmHg时直径的变化百分率。
临床上动脉血管顺应性的检测方法主要有:脉搏波传导速度(pulse wave velocity, PWV)、反射波增强指数(augmentation index, AI)、大动脉弹性指数(capacitve compliance, C1)及小动脉弹性指数(oscillatory compliance, C2)、袖带内压力震荡波分析(analysis of the oscillometric cuff signal,AOCS)和动态动脉硬化指数(ambulatory arterial stiffness index, AASI)[1]。以上测试方法多是通过血液脉搏波的传播特性来间接判断血管顺应性。
3.1.2 SG顺应性的测试方法
目前,还没有明确的针对SG顺应性的测试标准,仅有少量文献提到支架顺应性的测试评价方法。较为直接的测试方法是通过向SG腔内精确注射液体,同时记录SG腔内压力的增长量[33]。由于顺应性(C)可以转换表达为体积的增量(δV)/压力的增量(δP),从而可以确定SG试样的刚度。通过线性化体积与压力比的曲线获得顺应性[(δV)/(δP)],因此SG的顺应性是绝对压力降的函数。另外,对SG的顺应性研究多在体外动物模型上进行,通过衡量支架植入后宿主血管顺应性的变化,间接反映支架的顺应性[15];或者将超声回声探针置入血管内,测试血管的直径变化[34];或通过有限元分析[30]、测试支架径向支撑力[35]等方法间接获得。临床动脉血管顺应性的检测方法,如脉动能量损失(pulsatile arterial energy loss, PAEL)、PWV和脉搏波反射系数(Γ)[31]等,也可用于反映SG的顺应性情况。
3.2 顺应性的研究现状
3.2.1 小口径人工血管顺应性的相关研究
若宿主血管和人工血管的顺应性不匹配,会导致血液的血流动力学状态改变[36-38],引起血栓形成,导致人工血管的移植失败。当前,针对人工血管顺应性的研究主要集中在血管材料、结构和后处理方法等三方面[7]。其中,材料弹性越大,血管的顺应性越优良(如聚氨酯、PTT长丝等);管壁越薄、孔隙率和孔径越大,也越有利于提高其顺应性。将人工血管管壁结构多层化,模拟人体血管的三层管壁结构,可有效地提高顺应性。而热处理工艺则诱使人工血管内部材料分子重排,导致顺应性降低。
3.2.2 裸金属支架顺应性的相关研究
裸金属支架植入后再狭窄率高达30%。这与裸金属支架与宿主血管间顺应性不匹配有关,裸金属支架的植入显著降低了宿主血管的顺应性。Hélène Vernhet等将3种支架植入小口径血管,通过研究其壁面应力变化,验证了这一理论[34, 39]。支架植入之前血管的顺应性为75.3±20.1(10-3mm/kPa),植入后支架近端血管顺应性为(94.7±42.2)10-3mm/kPa,支架处顺应性为(38.8±14.2)10-3mm/kPa(P<0.05),支架远端顺应性为(70.8±23.2)10-3mm/kPa。支架处的顺应性显著小于近端和远端的顺应性,从而说明支架的植入使血管壁的顺应性显著降低。裸金属支架的植入扰乱了血液系统原有的血流动力学特征和血管壁面应力分布[40-41],引起内膜增生和血栓[42-43],目前还没有一种可与正常血管相比拟、顺应性相匹配的理想裸金属支架[44-45]。由于裸金属支架和SG的金属支架部分材料与结构相似,所以裸金属支架的研究对SG的金属支架部分的开发和研究具有指导意义。
为了验证与宿主血管顺应性相匹配的裸金属支架是否能够降低远期并发症的产生,改善临床结果,研究者们对顺应性优良的裸金属支架分别进行了体外、体内和软件模拟的研究。Berry等[40]研究了一种能够平滑支架与宿主血管之间顺应性转变的裸金属支架(CMS)(见图1),采用有限元评价了CMS在体内外的血流动力学和壁面应力结果,以及在支架、血管结合处的机械性能(顺应性和应力)。他们将CMS支架移植到猪模型上,直接测量其在体的各血流动力学参数和壁面应力的变化,包括血流、压力、直径和支架处动脉7天后的组织学切片。有限元结果显示,CMS支架植入后,支架段和非支架段顺应性不匹配的情况有所好转,其血管周向应力比别的支架显著降低。体内实验结果显示,CMS顺应性较匹配,对血流和压力波传输影响很小,支架附近只有少量的血栓和炎性细胞集聚。因此,合理的支架设计可以实现支架与血管间顺应性相匹配,减少应力和血流动力学的紊乱。顺应性匹配程度高的支架以及适当的刚度和直径,可以优化血流并抑制局部狭窄的发生,证明顺应性较优的支架头端对于血流的改善和抗血栓有所帮助[35]。
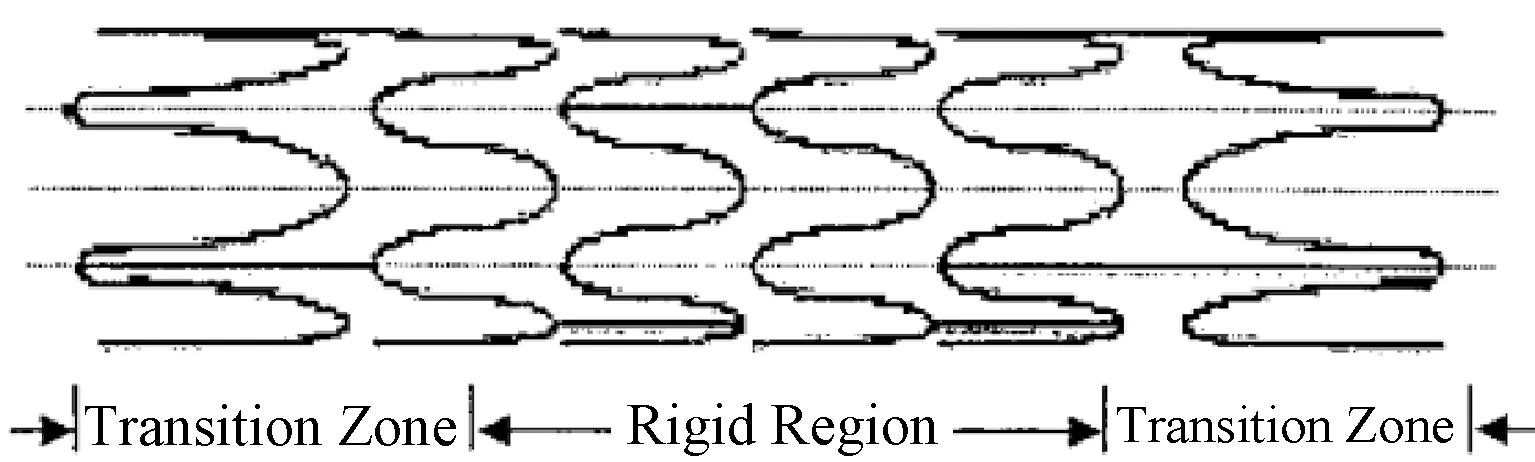
图1 CMS结构[40]Fig.1 The structural schematic of CMS[40]
物质的结构决定性质,裸金属支架的结构同样对宿主血管的顺应性有所影响。Stefan等[46]研究、对比了6种不同结构设计的颈动脉支架与宿主血管间的径向力、柔顺性和顺应性,分别是Precise、Acculink、Protégé、Xact、Wallstent和Cristallo Ideale(见图2)。通过平行板装备测试径向力,柔顺性(扭转和弯折)在体温温度的水中测试。实验结果表明,尽管这几种支架的尺寸相似,但是由于支架结构设计不同,其性能各有差异。开放式单元的支架结构与宿主血管间的柔顺性和顺应性匹配度最好,闭合式单元的支架结构与宿主血管间的柔顺性和顺应性最差,而混合型支架设计(Cristallo Ideale)可以兼具开放式单元的良好的顺应性和闭合单元结构对颗粒的阻挡性。

图2 6种支架[46]。(a) Precise;(b) Acculink;(c) Protégé;(d) Xact;(e) Wallstent;(f)Cristallo IdealeFig.2 Six stents[46].(a) Precise; (b) Acculink; (c) Protégé; (d) Xact; (e) Wallstent; (f)Cristallo Ideale
综上所述,现有研究指出合理的支架结构设计能够降低其与宿主血管顺应性的不匹配,减少血管应力和血流动力学的紊乱,改善临床结果,但何为最合理的支架结构仍是未知,支架本身的结构、材料等细节的描述较为笼统,鲜有研究针对支架本身的结构做更细致的探讨,难以指导支架结构设计。因此,有必要对裸金属支架的结构与顺应性间的关系进行更细致深入的讨论。
3.2.3 SG顺应性的相关研究
3.2.3.1 SG顺应性的研究现状
目前,针对SG顺应性的研究数量较为有限。为了研究SG植入后对宿主血管的影响,通常将SG植入体外动脉瘤模型中,研究动脉瘤模型的顺应性、血流动力学参数等其他性能参数的变化。Morris等将ZenithTM移植到体外腹主动脉瘤模型中,经研究发现其支架近端的动态响应能力远不如没有SG的腹主动脉瘤模型,动脉瘤模型及顺应性测试位点见图3[15]。ZenithTM的引入使原血管的顺应性减少了54%,脉搏波速相应增加了43%,结果表明SG会使血管壁的刚度增大。基于笔者的研究,更具顺应性的SG近端可能能使腹主动脉瘤的临床结果有所改善。Morris等在随后对4种支架的研究中,得出了相同的结论[31]。
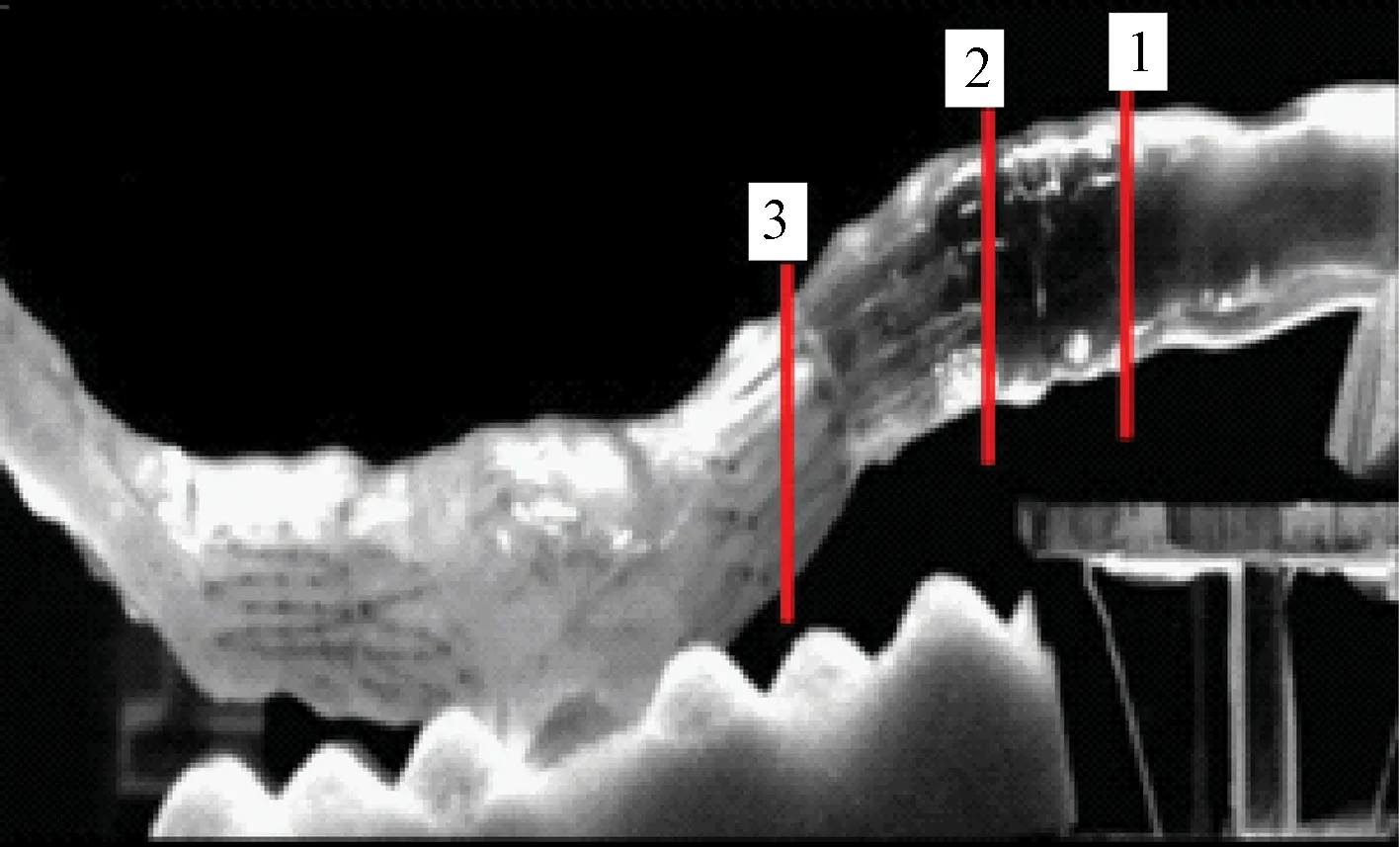
图3 腹主动脉瘤模型及ZenithTM支架上顺应性测试点(1,2,3)[15]Fig.3 AAA model and positions (1, 2, 3)along the ZenithTM stent-graft in which the compliances were recorded[15]
Bosman等[33]研究了支架顺应性对瘤腔内压力的影响及其程度。在动态试验中,将一橡胶动脉瘤置入体外循环模型中,选用3种不同织物制成无支架血管、3种用于腔内隔绝术的商用SG和1个用作对照的橡胶管,分别对动脉瘤进行隔离,并分别对收缩压、舒张压下的瘤内压和平均瘤内压进行测量。通过测试体积的变化,获得每个SG和橡胶动脉瘤的顺应性,以及瘤体内压力的变化。所用的SG顺应性为0.005 4~0.011 5 mL/mmHg,而无支架的覆膜具有较高的顺应性0.006 1~0.020 0 mL/mmHg。结果表明,随着系统压力增大,瘤体内的压力仅有略微增大(小于5 mmHg),有支架比没有支架的血管压力传导小,但两者没有显著性差异(P>0.05)。体外研究表明,SG管壁类型与压力传导无相关性,有支架和无支架血管对压力传导也无显著性差异。动脉瘤壁的顺应性比SG和橡胶管的顺应性高,因此可以解释为何动脉瘤内的压力变化非常有限,即瘤壁顺应性影响瘤体内压力。
SG植入人体内所受的力学作用环境复杂,在此环境下SG的顺应性是否随时间推移有所变化,同样也是需要考虑的重要因素。Desai等[47]在模拟体内生理环境的条件下,测试了主动脉无缝合线SG与POSS(polyhedral oligomeric silsesquioxane,多面体低聚倍半硅氧烷)和PCU(ploy(carbonate-urea) urethane, 聚(碳酸酯脲)聚氨酯)复合型SG的耐疲劳性能。在37℃的蒸馏水中,分别对4个主动脉支架施加动态载荷,测试动态顺应性。在平均压力段为60~120 mmHg时,疲劳实验的SG总体顺应性为(3.48±1.27)%/100 mmHg,与未疲劳的SG的总体顺应性(3.26±0.65)%/100 mmHg(P=0.47)没有显著差异。这种新型支架强度高,经过模拟10年加速试验后没有发生结构分离,因此可以发展具有耐久性而顺应性更优良的SG。
SG的植入会使宿主血管的性能有所改变,但是不同的材料种类、支架结构可能会产生不同的影响。Kleinstreuer等[30]通过有限元分析的方法,分别对两种镍钛合金(NITI-1和NITI-2)和两种覆膜织物(ePTFE和PET)用于AAA治疗的钻石型SG在循环压力下的机械性能和疲劳情况进行了研究,同时也表征了其各自的顺应性。NITI与PET复合的SG比与ePTFE复合的SG顺应性低。覆膜为ePTFE的SG顺应性为1.7~2.0%/100 mmHg,而PET覆膜的SG顺应性值为0.1~0.2%/100 mmHg。因此,ePTFE覆膜的SG较柔软,可与不规则的瘤径或动脉瘤相匹配,而PET覆膜的SG较刚硬,有助于减小瘤体压力。
即使商用SG在植入后同样存在降低宿主血管顺应性的问题,还是要选择顺应性最匹配的SG,这样能够减少植入后远期相关并发症的产生[31]。材料和结构两方面是影响SG顺应性的重要因素,但是相关文献中对SG的细节描述较为有限,具体何种材料种类和结构的SG最有利于与宿主血管的顺应性相匹配尚无确切结论。
3.2.3.2 针对SG顺应性的改进方法
优化SG的顺应性可从材料种类和结构两方面入手,美敦力发布全新SG系统Captivia,金属支架的正弦结构设计增加了柔顺性,同时有效地避免了支架弯折[48-49]。Heijmen RH将Captivia系统植入100位病人体内,对病人的移植后效果进行平均周期为(68.9±34.9)天的随访。结果显示,Captivia支架100 %体内移植成功,30天死亡率为4.0%,2位病人发生A型动脉夹层,4位病人发生中风,1位病人发生瘫痪,11位病人发生Ⅰ、Ⅱ型内漏,没有病人发生Ⅲ、Ⅳ型内漏。从以上临床结果可知,这种血管支架有潜力治疗多种胸主动脉病况。
Singh等模仿毛毛虫的体形骨骼结构设计了新型的SG,平衡SG的结构刚度和顺应性,突破SG的机械性能限制[27]。此模型随后被制成了可实验用的SG试样。新型SG采用高性能聚合物长丝织制出片段针织结构,研究人员对其进行顺应性、滑移强度等体外生物力学性能评价。实验结果显示,其各项性能均优于ZenithTMFlex SG和机织涤纶人工血管。新型SG结构上的分节提高了其机械性能,当对其施加应力时,它的结构可以三维立体扩张;其机械性能与主动脉的正交弹性性能相吻合,同时这种分段结构可以为以后的主动脉修复提供设计参考。分节结构还使顺应性有显著提高,血流动力学尤为重要的血管(如主动脉、冠状动脉)尤为适用[50]。
在优化新支架设计参数时需要考虑诸多变量,包括支架高度、支架尖端个数、支架直径的不匹配程度、闭合式或开放式SG结构等,这些因素分别对SG的径向支撑力和顺应性等性能产生影响。目前,现有的针对SG顺应性的研究较少,而关于提高其顺应性的研究更是十分有限。
4 结论与展望
由于SG与宿主血管间顺应性的不匹配,相对较刚性的SG的植入会对宿主在血管顺应性、管壁应力和血流动力学特性等方面产生显著的不良影响,从而导致远期临床并发症的产生。目前,针对SG与宿主血管顺应性不匹配这一问题进行研究的报道仍十分有限,但现有的研究均证实了与宿主血管顺应性匹配良好的SG有助于术后临床并发症发病率的降低,改善临床结果,故对SG顺应性进行研究是十分重要的。作为SG性能的又一新关注点,顺应性是一个充满未知但极有价值的研究方向。
SG的顺应性与其所用材料属性和结构特征有关,但现有文献报道的大多是同时对几种材料或结构不同的SG进行对比研究,得出性能最优的某一种或几种SG。以往所研究的SG材料和结构参数有限,对顺应性优良的SG的具体结构参数信息报道并不详尽,开发者难以根据现有信息设计并开发出综合性能优良的新型SG产品。SG的材料和结构与其性能,尤其是顺应性间的对应关系,仍有待系统性地细致研究。因此,在未来的研究中,对SG的材料种类和结构类型、参数等与顺应性间的相关关系进行探索,探明顺应性优良的SG的材料和结构特征,为开发新一代综合性能优异的SG奠定理论基础,为减少SG植入术后远期临床并发症提供可能。
[1] 赵志芳,李光华. 影响动脉血管顺应性的因素及机制[J]. 当代医学, 2011, 17(32): 13-14.
[2] Lucereau B, Koffhi F, Heim F, et al. Relation between tensile tests and compliance in polyester textile vascular prostheses[J]. Ann Vasc Surg, 2015, 29(6):1300-1306.
[3] Nezarati RM, Eifert MB, Dempsey DK, et al. Electrospun vascular grafts with improved compliance matching to native vessels[J]. J Biomed Mater Res B, 2015, 103(2):313-323.
[4] Khoffi F, Mathieu D, Dieval F, et al. Compliance properties of collagen-coated polyethylene terephthalate vascular prostheses[J]. J Appl Biomater Func, 2014, 12(3):163-171.
[5] Catto V, Fare S, Cattaneo I, et al. Small diameter electrospun silk fibroin vascular grafts: Mechanical properties, in vitro biodegradability, and in vivo biocompatibility[J]. Mat Sci Eng C-Mater, 2015, 54:101-111.
[6] 王璐,丁辛. 人造血管的生物力学性能表征[J]. 纺织学报, 2003, 24(1): 7-9.
[7] 关颖,关国平,林婧,等. 小口径人工血管顺应性的影响因素和改善方法[J]. 材料导报, 2014, 28(19): 125-129.
[8] Mensel B, Kuhn JP, Hoene A, et al. Endovascular repair of arterial iliac vessel wall lesions with a self-expandable nitinol stent graft system[J]. PLoS One, 2014, 9(8):e103980.
[9] Aziz A, Sicard GA. Surgical management of abdominal aortic aneurysms: a lost art?[J].Prog Cardiovasc Dis, 2013, 56(1):13-18.
[10] Wang Siwen, Wang Jinsong, Lin Peiliang, et al. Short-term curative effect of endovascular stent-graft treatment for aortic diseases in China: a systematic review[J]. PLoS One, 2013, 8(8):e71012.
[11] Buckley CJ, Buckley SD. Limitations of current EVAR endografts and potential solutions for their deficiencies[J]. Semin Vasc Surg, 2012, 25(3):136-137.
[12] Mehta M, Sternbach Y, Taggert JB, et al. Long-term outcomes of secondary procedures after endovascular aneurysm repair[J]. J Vasc Surg, 2010, 52(6):1442-1449.
[13] Rodrigues A, Figueiredo L, Bordado J. Abrasion behaviour of polymeric textiles for endovascular stent-grafts[J]. Tribol Int, 2013, 63:265-274.
[14] Demanget N, Duprey A, Badel P, et al. Finite element analysis of the mechanical performances of 8 marketed aortic stent-grafts[J]. J Endovasc Ther, 2013, 20(4):523-535.
[15] Morris L, Stefanov F, McGloughlin T. Stent graft performance in the treatment of abdominal aortic aneurysms: the influence of compliance and geometry[J]. J Biomech, 2013, 46(2):383-395.
[16] Harris PL, Vallabhaneni SR, Desgranges P,et al. Incidence and risk factors of late rupture, conversion, and death after endovascular repair of infrarenal aortic aneurysms: The EUROSTAR experience[J]. J Vasc Surg, 2000, 32(4):739-749.
[17] Becker GJ, Kovacs M, Mathison MN, et al. Risk stratification and outcomes of transluminal endografting for abdominal aortic aneurysm: 7-year experience and long-term follow-up[J]. J Vasc Interv Radiol, 2001, 12(9):1033-1046.
[18] Hinchliffe RJ, Ivancev K. Endovascular aneurysm repair: current and future status[J]. Cardiovasc Interv Radiol, 2008, 31(3):451-459.
[19] Laturnus J, Oliveira N, Basto Goncalves F, et al. Towards individualized follow-up protocols after endovascular aortic aneurysm repair[J]. J Cardiovasc Surg, 2016, 57(2):242-247.
[20] Zhou SSN, How V, Vallabhaneni SR. Comparison of the fixation strength of standard and fenestrated stent-grafts for endovascular abdominal aortic aneurysm repair[J]. J Endovasc Ther, 2007, 14(2):168-175.
[21] Roos H, Ghaffari M, Falkenberg M, et al. Displacement forces in iliac landing zones and stent graft interconnections in endovascular aortic repair: an experimental study[J]. Eur J Vasc Endovasc Surg, 2014, 47(3):262-267.
[22] Heikkinen MA, Alsac JM, Arko FR, et al. The importance of iliac fixation in prevention of stent graft migration[J]. J Vasc Surg, 2006, 43(6):1130-1137.
[23] Resch T, Malina M, Lindblad B,et al. The impact of stent design on proximal stent-graft fixation in the abdominal aorta: an experimental study [J]. Eur J Vasc Endovasc Surg, 2000, 20(2):190-195.
[24] Sun Z. Transrenal fixation of aortic stent-grafts Current status and future directions[J]. J Endovasc Ther, 2004, 11(5):539-549.
[25] Malina M, Lindblad B, Ivancev K, et al.. Endovascular AAA exclusion will stents with hooks and barbs prevent stent-graft migration[J]. J Endovasc Ther, 1998, 5(4):310-317.
[26] Weidman JM, Desai M, Iftekhar A, et al. Engineering goals for future thoracic endografts-how can we make them more effective?[J].Prog Cardiovasc Dis, 2013, 56(1):92-102.
[27] Singh C, Wang X. A biomimetic approach for designing stent-graft structures: Caterpillar cuticle as design model[J]. J Mech Behav Biomed Mater, 2014, 30:16-29.
[28] Vlachopoulos C, Aznaouridis K, Stefanadis C. Prediction of cardiovascular events and all-cause mortality with arterial stiffness: a systematic review and meta-analysis[J]. J Am Coll Cardiol, 2010, 55:1318-1327.
[29] Santos IC, Rodrigues A, Figueiredo L, et al. Mechanical properties of stent-graft materials[J]. P I Mech Eng L-J Mat, 2012, 226(4):330-341.
[30] Kleinstreuer C, Li Z, Basciano CA, et al. Computational mechanics of nitinol stent grafts[J]. J Biomech, 2008, 41(11):2370-2378.
[31] Morris L, Stefanov F, Hynes N, et al. An experimental evaluation of device/arterial wall compliance mismatch for four stent-graft devices and a multi-layer flow modulator device for the treatment of abdominal aortic aneurysms[J]. Eur J Vasc Endovasc, 2016, 51(1):44-55.
[32] Cardiovascular implants-tubular vascular prostheses:BS ISO 7198[S].1998.
[33] Bosman WMPF, Hinnen JW, Rixen DJ, et al. Effect of stent-graft compliance on endotension after EVAR [J]. J Endovasc Ther, 2009, 16(1): 105-113.
[34] Hélène Vernhet RD. Changes in wall mechanics after endovascular stenting in the rabbit aorta comparison of three stent designs[J]. Am J Roentgenol, 2001, 176(3):803-807.
[35] Rolland PH, Mekkaoui C, Vidal V, et al. Compliance matching stent placement in the carotid artery of the swine promotes optimal blood flow and attenuates restenosis[J]. Eur J Vasc Endovasc Surg, 2004, 28(4):431-438.
[36] Weston MW, Rhee K, Tarbell JM. Compliance and diameter mismatch affect the wall shear rate distribution near an end-to-end anastomosis[J]. Journal of Biomech, 1996, 29(2):187-198.
[37] Ballyk PD, Walsh C, Butany J, et al. Compliance mismatch may promote graft-artery intimal hyperplasia by altering suture-line stresses[J].J Biomech, 1998, 31(3):229-237.
[38] Inoguchi H, Kwon IK, Inoue E,et al. Mechanical responses of a compliant electrospun poly(L-lactide-co-epsilon-caprolactone) small-diameter vascular graft[J]. Biomaterials, 2006, 27(8):1470-1478.
[39] Vernhet H, Juan JM, Demaria R, et al. Acute changes in aortic wall mechanical properties after stent placement in rabbits[J]. J Vasc Interv Radiol. 2000, 11(5):634-638.
[40] Berry JL, Manoach E, Mekkaoui C,et al. Hemodynamics and wall mechanics of a compliance matching stent: In vitro and in vivo analysis[J]. J Vasc Interv Radiol, 2002, 13(1):97-105.
[41] Rachev A, Manoach E, Berry J, et al. A model of stress-induced geometrical remodeling of vessel segments adjacent to stents and artery/graft anastomoses[J]. J Theor Biol, 2000, 206(3):429-443.
[42] Farhatnia Y, Pang JH, Darbyshire A, et al. Next generation covered stents made from nanocomposite materials: a complete assessment of uniformity, integrity and biomechanical properties[J]. Nanomed-Nanotechnol, 2016, 12(1):1-12.
[43] Yazdani SK, Moore JE, Berry JL, et al. DPIV measurements of flow disturbances in stented artery models: adverse affects of compliance mismatch[J]. J Biomech Eng, 2004, 126(5):559-566.
[44] 刘修健,蔺嫦燕. 冠脉分叉病变及支架后再狭窄的血流动力学研究进展[J]. 中国生物医学工程学报, 2012, 31(3):446-450.
[45] Martin H, Grabow N, Stiehm M, et al. Finite Element Analysis of Compliance of Stent-Vesselsystems[J]. Biomed Tech (Berl), 2013.
[46] Mueller-Huelsbeck S, Schafer PJ, Charalambous N, et al. Comparison of carotid stents: an in-vitro experiment focusing on stent design[J]. J Endovasc Ther, 2009, 16(2): 168-177.
[47] Desai M, Bakhshi R, Zhou X, et al. A sutureless aortic stent-graft based on a nitinol scaffold bonded to a compliant nanocomposite polymer is durable for 10 years in a simulated in vitro model[J]. J Endovasc Ther, 2012, 19(3):415-427.
[48] Heijmen RH, Thompson MM, Fattori R, et al. Valiant thoracic stent-graft deployed with the new captivia delivery system: procedural and 30-day results of the valiant captivia registry[J]. J Endovasc Ther, 2012, 19(2):213-225.
[49] Mlynski A, Marzelle J, Desgranges P, et al. Two cases of misaligned deployment of valiant captivia thoracic stent graft[J]. J Vasc Surg, 2012, 56(5):1419-1421.
[50] Singh C, Wang X. A biomechanically optimized knitted stent using a bio-inspired design approach[J]. Text Res J, 2015, 86(4):380-392.
Research Progress on Compliance Property of Endovascular Stent Graft
Guan Ying1Guan Guoping1,2Lin Jing1,2Wang Lu1, 2#*
1(DonghuaUniversity,CollegeofTextiles,Shanghai201620,China)2(KeyLaboratoryofTextileScience&Technology,MinistryofEducation, 201620,China)
Compliance mismatch between small diameter vascular graft and host artery is the main factor caused low long-term patency rate. There are literatures proving that compliance mismatch between endovascular stent graft and host artery is the main reason caused the long-term complications, such as SG displacement, endoleaks and blood turbulence. However there is only limited number of studies in this area at present. This article reviewed the methods of evaluating compliance of SG, including calculating via pressure range and corresponding SG volume change or reflecting indirectly by pulse wave velocity and aneurysm pressure. Researches on SG compliance mainly include verifying effects of SG implantation on host artery, effects of different SG structures on host artery, and how compliance changing over time. Achieving compliant SG by optimizing SG structure is reviewed briefly.
endovascular surgery; stent graft; compliance; vascular prosthesis; bare metal stent
10.3969/j.issn.0258-8021. 2016. 05.013
2016-03-29, 录用日期:2016-06-18
国家自然科学基金(81371648);教育部纺织生物医用材料与技术创新引智基地111计划(B07024);东华大学博士研究生创新基金(CUSF-DH-D-2015007)
R318
A
0258-8021(2016) 05-0605-07
# 中国生物医学工程学会高级会员(Senior member, Chinese Society of Biomedical Engineering)
*通信作者(Corresponding author), E-mail: wanglu@dhu.edu.cn
