注射不同液体对微波消融温度场的离体实验研究
2016-02-16聂晓慧
董 彤 田 甄 聂晓慧 南 群
(北京工业大学生命科学与生物工程学院,北京 100124)
注射不同液体对微波消融温度场的离体实验研究
董 彤 田 甄 聂晓慧 南 群#*
(北京工业大学生命科学与生物工程学院,北京 100124)
研究不同注射液体、注射量对于微波消融温度场的影响。在加热功率60 W、加热时间10 min的情况下,利用新型注射型微波天线进行消融离体肝脏的实验研究,并且于加热过程中分别注射生理盐水和无水乙醇液体,注射量依次为0、10、20 mL。根据测温针采集的温度数据,利用Matlab计算消融区域的范围(高于60℃区域)。通过对离体肝脏的消融面积、体积、横径和纵径的测量和统计,发现注射两种液体均可有效增大消融范围,与无液体注射相比面积增大率的范围在29.1%~72.0%之间,体积增加率在45.2%~141.8%之间;当注射液体体积由10 mL增加到20 mL时,生理盐水组的面积增加率为8.8%,无水乙醇组的面积增加率为28.8%。因此,联合液体注射可以扩大微波消融范围,并且随着注射体积的增加,消融范围扩大;微波联合无水乙醇的注射效果要略好于生理盐水。
微波消融;生理盐水;无水乙醇;离体牛肝;消融范围
引言
肝细胞肝癌(hepatocellular carcinoma,HCC)位居全球恶性肿瘤发病率第5位,死因第3位,被称为是“癌中之王”[1]。我国是肝癌大国,新发病逐年攀升,并且其发病率与死亡率几乎相同[2]。在我国,肝癌现已成为继肺癌之后的第2位杀手[3]。目前对于肝癌的治疗,最有效的方法是进行肝移植或者肝切除手术。然而,由于受身体健康状况、肝硬化程度、肿瘤大小、数目和部位等各种条件限制,真正适合手术切除的仅占所有患者的25%左右[4]。
微波消融( microwave ablation, MWA )具有痛苦小、操作简便、可反复施行、疗效确切等优点,为肝癌的局部治疗提供了一种新途径[5]。MWA是借助医学影像技术的引导对肿瘤靶区进行定位,将微波输入局部,当局部温度迅速升高达有效治疗温度54℃或60℃以上时细胞即刻发生凝固坏死,达到原位灭活肿瘤的一种治疗手段[6]。随着微波消融术在医学领域的发展,其安全有效性已经在临床上得到了一定的证实,但是仍存在一定的局限性和弊端。从目前的临床数据上来看,更多消融过程是应用于单针的天线。然而,由于微波本身的物理特性以及肝脏的供血特点,单针天线一般适用于体积较小且数量单一的肿瘤,对于体积较大、非单一以及存在特殊位置的肿瘤可以采取分时或者多针加热的手段,实现不规则肿瘤的消融[7]。微波消融肿瘤的完全坏死率会随着肿瘤体积的增大而降低,因此如何增加单针天线消融范围从而扩大适应症是目前的主要研究方向之一[8]。
研究表明,射频消融治疗体积较大的肿瘤时,采用注射液体(盐水、乙酸、乙醇)的方法来扩大消融区的范围。由于盐水、乙酸、乙醇等可以改变组织的电导率,可防止电极表面的组织产生血凝及组织炭化等使阻抗明显增高的现象,减少能量的损失,因此可导致热量的增加,从而显著扩大消融区域的范围[9]。
虽然微波与射频的致热原理存在差异,但注射型微波消融,不仅增加了组织中的含水量,增加了热量的吸收,同时也提高了微波能量转化为热量的效率,从而为扩大消融区域的范围提供了技术保证。因此,为验证不同注射液体和注射量对于微波消融区域范围的影响提供一定的技术支持。
范伯强等通过联合注射无水乙醇对兔肝肿瘤进行了微波消融的治疗[10],从而证明了其方法的安全有效性。然而,尽管联合消融在这个肿瘤模型上取得较好的结果,但其研究仍有一些局限性:肿瘤规模较小,不能模拟大肿瘤的临床效果,且消融功率较小,消融时间较短,对临床的参考价值较低。本实验采用了生理盐水跟无水乙醇两种液体来进行微波消融离体实验的研究,并提高了消融功率和消融时间,在相同条件下对比两种液体对消融范围和温度场的影响,以验证扩大消融区域的理论,从而为临床医疗提供研究基础。
1 实验方法
1.1 实验器材
本实验采用MTC-3微波发射仪,该仪器是由南京庆海微波电子研究所设计并制造,同时此系统配有低损耗的同轴电缆传输线。表1为该微波仪的工作条件和一些主要的性能参数。

表1 微波仪的工作条件和主要性能参数
天线采用裂隙发射,裂隙宽1.5 mm,距前端13 mm。为了防止微波天线 ( 直径为1.9 mm,长150 mm)与组织黏接,表面附有涂层。在其裂隙后沿20mm处有一出水孔,当按压注射器后,液体可从注射管流入天线内部的液体管道,并从出水孔流出,进入消融区域。当注射液体流入消融区域后,可使其中心温度降低,减少碳化,热量随着液体的渗透向周围扩散,从而达到扩大消融范围的效果。图1为微波天线及注射器。
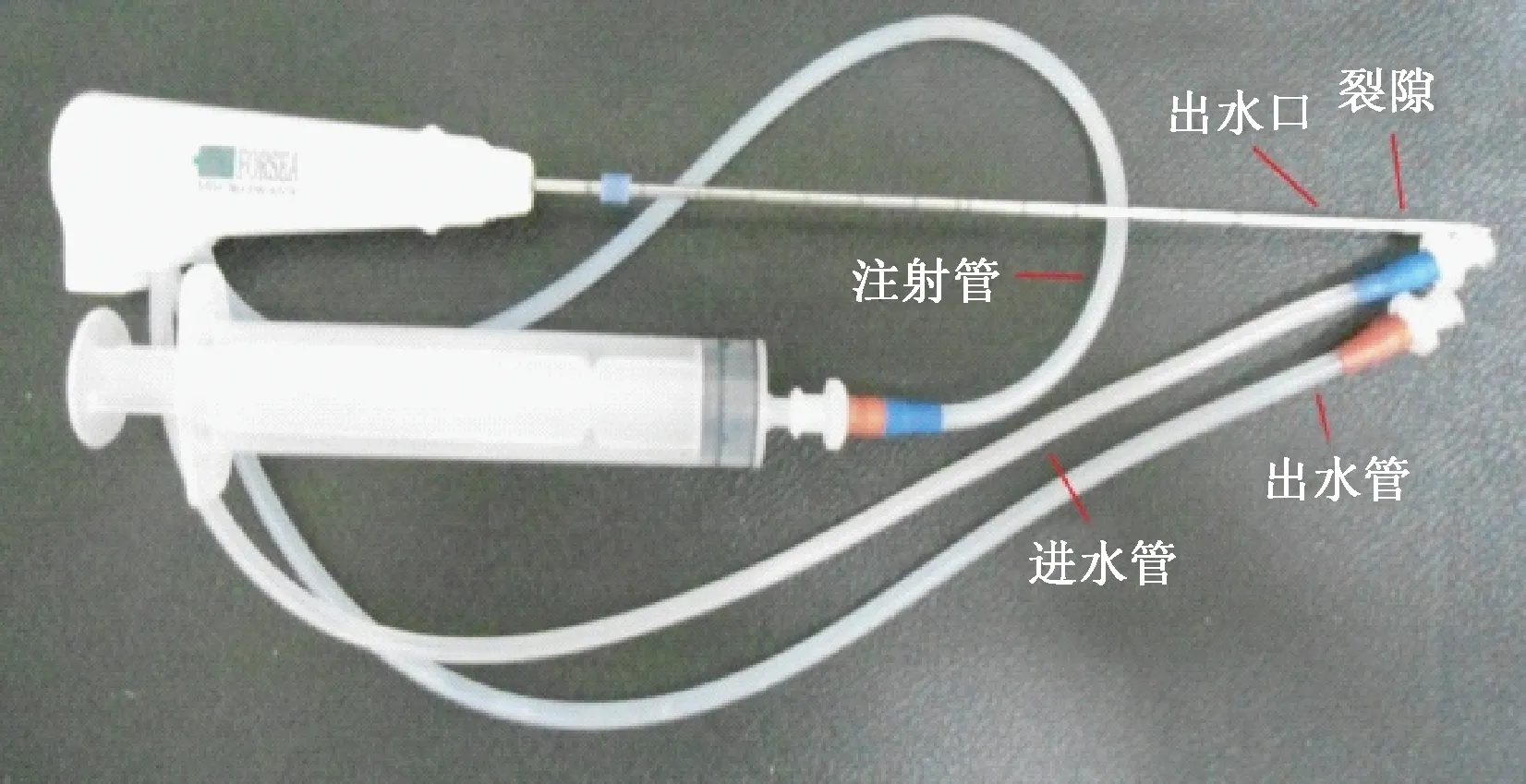
图1 微波天线及注射器Fig. 1 Microwave antenna and syringes
实验中使用的数据采集仪是安捷伦公司(Agilent)所生产的34972A多点数据采集仪。Agilent34972A拥有6位半分辨率(22bit)、0.004%的基本直流电压精度以及极低的读数噪声, 250通道/s扫描速率,利用Agilent Bench Link Data Logger软件设置测试参数,采集并归档测量数据,以及对输入的测量数据执行实时显示和分析。
实验中采用的循环水泵为兰格BT09-100,水泵上有旋钮可以调节转速,控制实验所需水流速度,上方的数字代表十位,下方的数字代表个位,本实验要求将转速调至40 r/min。通过水循环装置防止天线温度过高导致组织炭化的现象,为微波消融实验提供基础技术支持。图2为循环水泵结构。
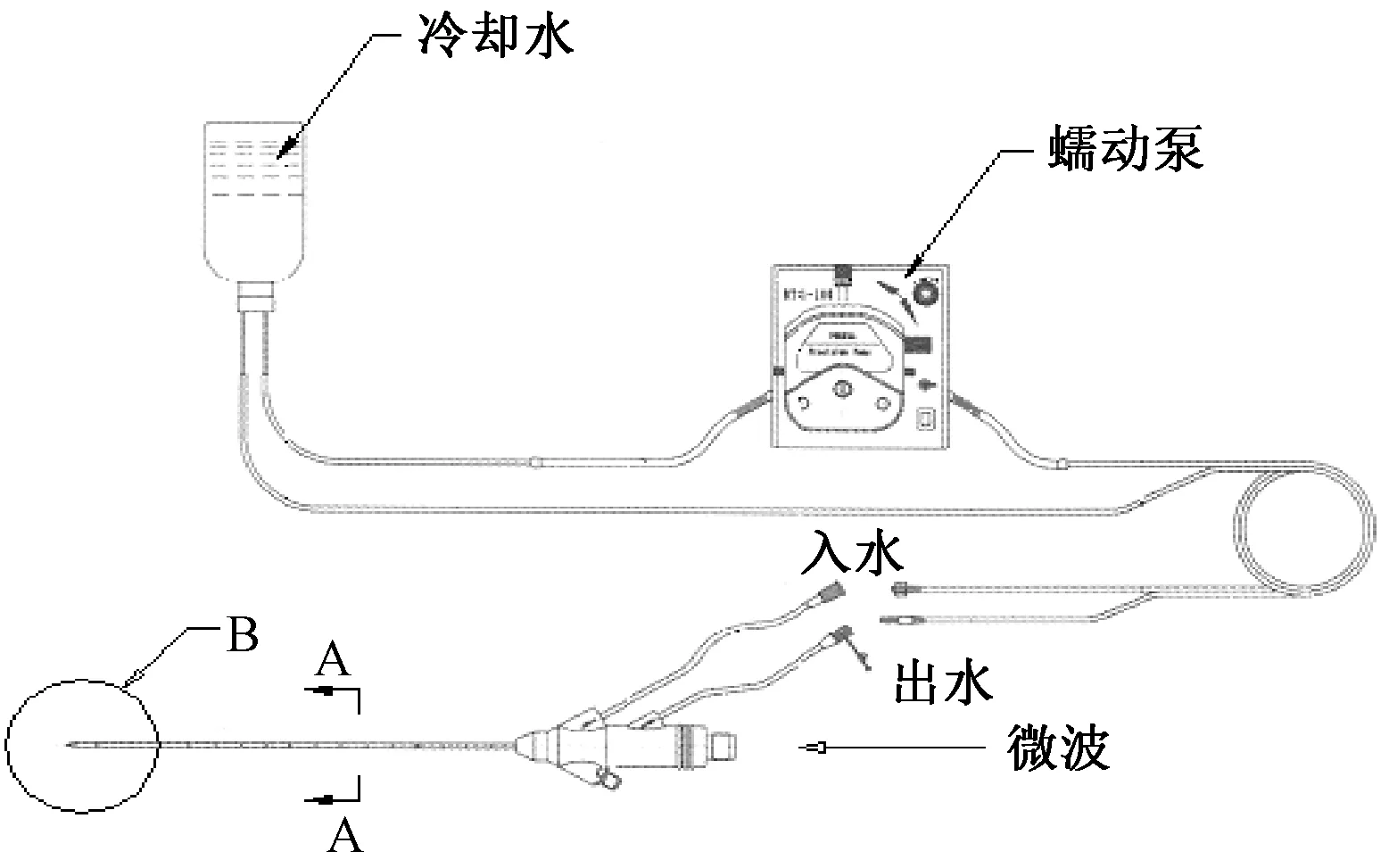
图2 循环水泵结构Fig.2 The water circulation structure
1.2 测温点的排布
为了固定天线和测温针,在放置牛肝的装置上部分别标注了r轴与z轴的位置,其中r轴垂直于微波天线,z轴与微波天线平行,在r轴正方向即以天线位置为中心的牛肝右半部分布测温针。由于测温针采集的主要为60℃左右的温度,根据消融区域的特点,采取内疏外紧的排布方案,即最靠近天线的区域布置少量的测温针,60℃边界附近布置较多的测温针,从而得到准确的60℃等温线图。
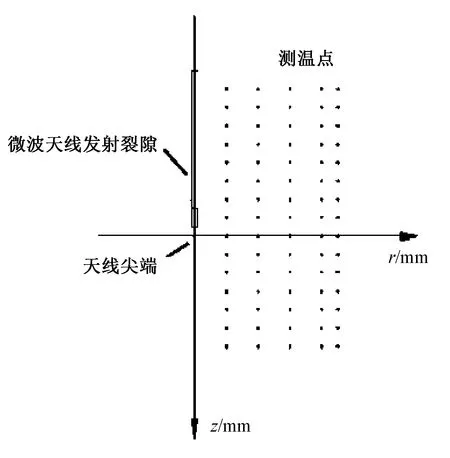
图3 测温针排布Fig. 3 temperature measuring needle configuration
水平方向r垂直于天线的方向,水平布置6个数据采集点,第1个采集点在天线所在位置,采集点间隔10 mm,为了得到更为准确的等温线图,在边缘处将采集点间隔改为5 mm,于是得到r=0,±10,±20,±30,±40,±45 mm 的测温点。
竖直方向z平行于天线方向,竖直方向上每间隔5 mm布置一个测温点,而将第一列只留下两个关键位置的测温点,分别是天线尖端和天线裂隙,两点间距大约在15 mm。
1.3 实验过程
实验过程主要包括8个步骤。
步骤1:在离体肝脏复温到37℃后,将肝脏放入消融装置中,同时将微波天线和测温针插入肝脏体内,并连接微波消融仪器和水冷装置。
步骤2:校准微波发射仪,将功率调至60 W,设定加热时间为10 min,用注射器抽取10 mL(20 mL)生理盐水(无水乙醇),并与微波天线相连。
步骤3:开启采集器,在点击开始采集数据的同时开启微波发射仪,开始对离体牛肝进行微波消融实验。
步骤4:当消融时间持续5 min时,需将微波天线连接的注射器内的液体(生理盐水或无水乙醇)匀速缓慢地推送,液体会顺着微波天线内部的结构流入离体牛肝的消融区域,注射时间维持在15~30 s。
步骤5:微波消融结束后,停止采集数据,关闭微波发射仪,将采集的数据导出到文件并保存。
步骤6:将消融后的肝组织沿着微波天线插入的位置横向切开,测量并记录其消融区域的长径和短径。
步骤7:为提高消融结果的准确性,需对离体牛肝进行多次相同条件的消融实验,因此需重复上述方法5次。
步骤8:采用Matlab软件进行后期的数据处理,通过采集的数据得到时间与温度的关系曲线,并生成60℃等温线,并计算消融区域的长径、短径、面积和体积。
1.4 统计学分析
对不同组间注射液体的种类、体积、消融区域大小、体积大小以及类圆率纵横比进行了单因素方差分析以及单样本t检验,发现实验组与无注射的对照组存在显著性差异,P<0.05,具有统计学意义;而实验组组间差异较小。
2 实验结果
2.1 离体实验结果
在微波加热过程中,测温针采集到的数据为各个测温点的电压值,通过相应的公式将电压值转换为温度值,得到各测量点温度的数据,最终用Matlab软件作图得到不同z坐标下的温度与时间的关系曲线,生成等温线图进而得出消融截面面积、长宽值和体积等。消融实物如图4所示。
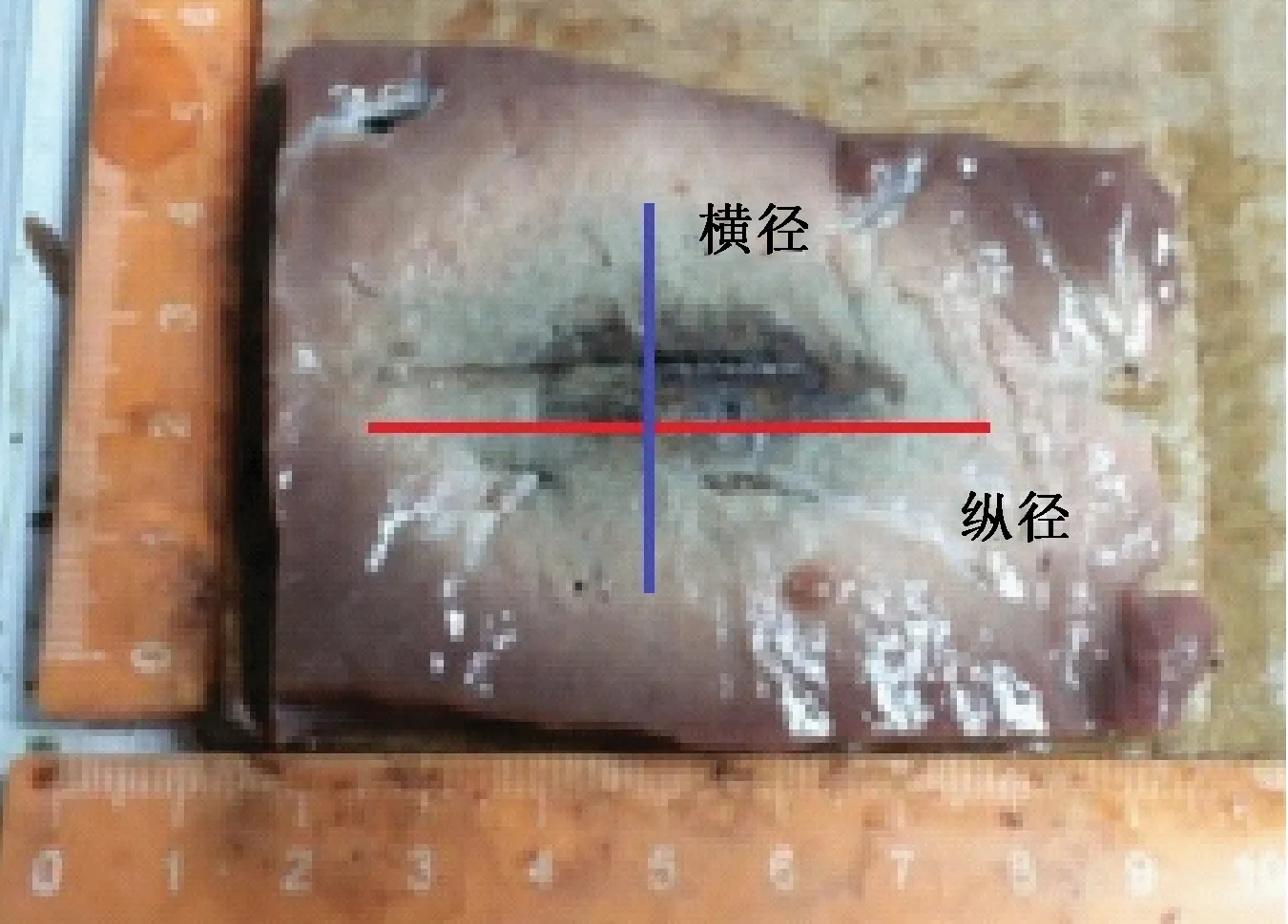
图4 消融实物Fig.4 ablation physical figure
单一条件变量,每一组实验分别重复做5次,去掉离群数据后,将余下的几组数据取平均值,用Matlab进行数据处理后,得到如表2所示的具体实验数据。当注射液体为0 mL时,即无任何液体注射时,实验数据如表2第一行所示;当注射液体为生理盐水和无水乙醇时,消融结果对比无注射液体时有较为明显的差异。实验数据表明,注射后比无注射条件下的消融范围有显著增加,且消融范围的纵横比也逐渐趋近于1,达到了扩大消融面积且消融范围更接近于球体的目的。
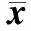
表2 不同条件下的具体实验数据(±s)
注:a表示与无注射组相比,P<0.05;b表示与无注射组相比,P<0.05;c表示与无注射组相比,P<0.05。
Note:aCompared with no injection group,P<0.05;bcompared with no injection group,P<0.05;ccompared with no injection group,P<0.05.
2.2 实验结果对比
虽然消融面积和体积能够较为直观地体现消融效果,然而对于每次实验结果的面积计算由于每次使用的牛肝存在大小差异、含水量的区别,所以造成计算出的数据都有可能存在一些偏差,与理论上的结果不完全一致。为了更直观地从消融面积上来讨论消融效果,将每组结果产生的60℃等温线做了单一变量的消融区域重叠,以便得到结论。
2.2.1 注射液体与无注射对比结果
当无任何液体注射时的面积平均是19.58 cm2,在注射生理盐水和无水乙醇后,消融区域的面积均扩大,面积增加率在29.1%~72.0%之间;无注射时体积平均为57.35 cm3,在消融过程中注射液体可导致体积增大,其增加率在45.2%~141.8%之间。因此,联合注射液体确实能够起到增加消融范围的效果。
2.2.2 注射体积对比结果
当注射液体体积增加时,注射生理盐水和注射无水乙醇均可导致消融范围的增加,并且均随着注射体积的增加,消融区域的范围也增大。注射体积由10 mL增加到20 mL,生理盐水组的面积增加率约为8.8%,无水乙醇组的面积增加率约为28.8%,说明增加注射液体体积也可以起到消融范围增加的效果。如图5所示,通过消融区域最大横截面的等温线叠加比较,可以直观地看出,当注射体积增加时,消融区域扩大;而微波消融区域具有对称性,其消融体积为类椭球形具有轴对称结构。因此,根据消融区域最大横截面积的不断扩大,可导致其消融体积的不断增加,证明消融范围有所增大。
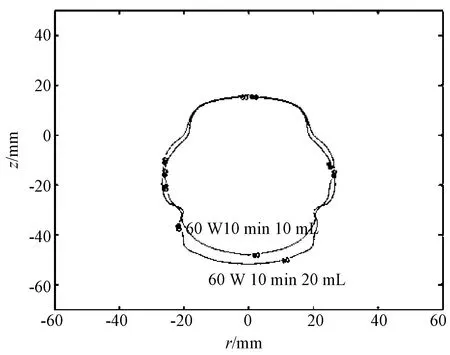
图5 注射液体体积增加时的等温线叠加比较Fig. 5 The isothermal comparisonof different injection liquid volume
2.2.3 相同条件下两种液体的对比结果
在相同条件下,注射无水乙醇产生的消融范围比注射生理盐水后的有所增加,在注射体积为10 mL的时候面积增加率为3.4%,注射体积为20 mL时面积增加率为22.4%。如图6的等温线叠加比较所示,单一变量注射液体,可以比较清晰地看出注射无水乙醇时的消融区域略大于注射生理盐水时的消融区域。
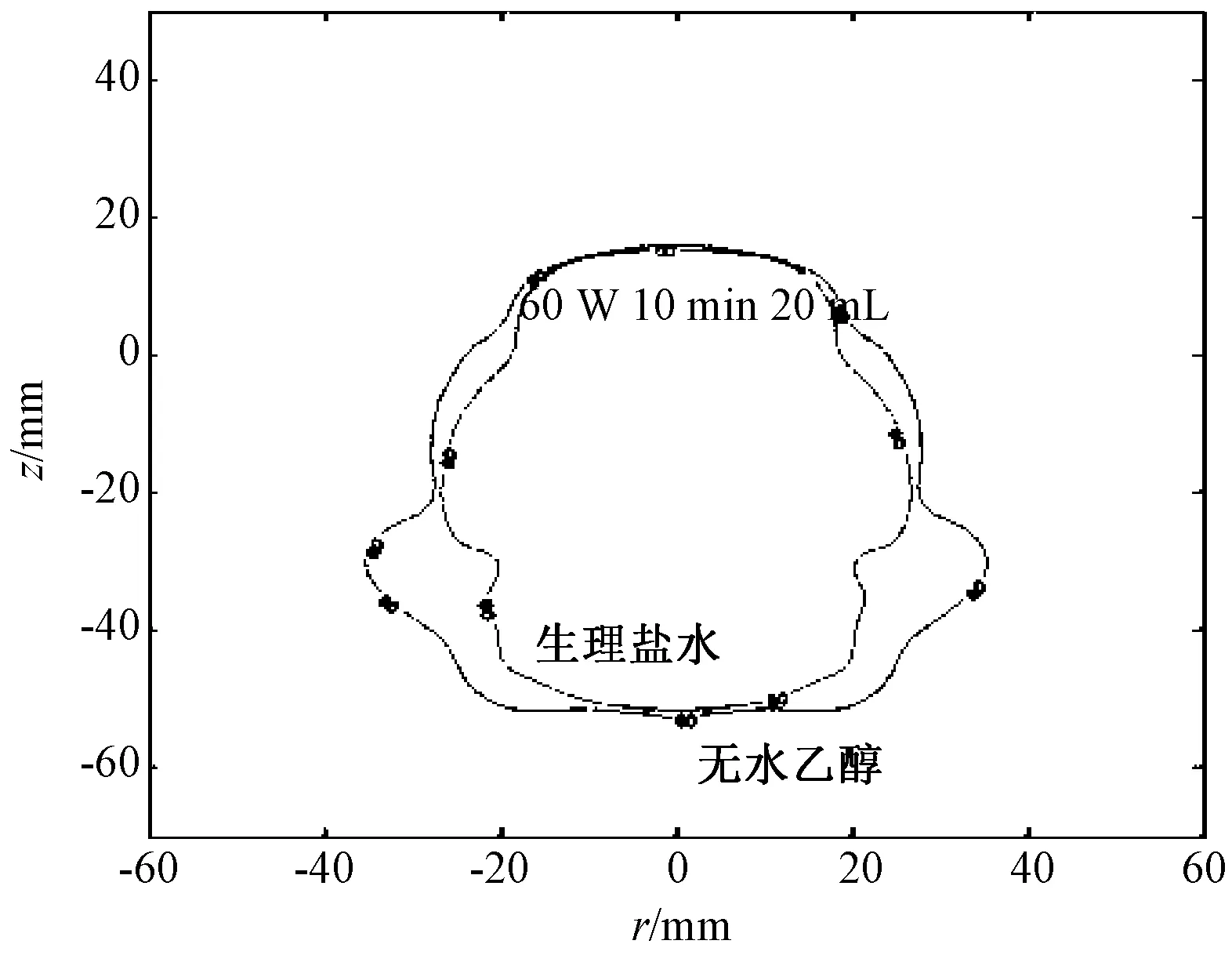
图6 不同注射液体时的等温线叠加比较Fig. 6 The isothermal comparisonof different injection liquid
3 讨论
本研究对扩大肝脏肿瘤消融区域的新方法,即注射液体联合微波消融进行了离体实验研究,并对比了注射生理盐水与无水乙醇所得的消融效果以及温度场变化情况。
实验数据表明,与无液体注射相比消融区域面积增大率的范围在29.1%~72.0%之间,体积增加率在45.2%~141.8%之间;当注射液体体积由10 mL增加到20 mL,生理盐水组的面积增加率为8.8%,无水乙醇组的面积增加率为28.8%。
从上述实验结果来看,注射两种液体均可有效增大消融范围,而联合无水乙醇的注射效果要略好于生理盐水。这是由于乙醇的渗透性很强,热的乙醇快速向周围弥散,使中央产生的高温可快速向周围扩散;在微波加热时,向周围弥散的乙醇可对组织产生再次破坏作用[10],所以随着乙醇注入体积的增加,最高温度升高,消融面积增大。而对于生理盐水,注射后增加局部组织内水分含量,局部组织内水分增加减缓了天线周围碳化过程[11],使微波能量向周围扩散得更多,而生理盐水的增加消耗了一部分热量,消融的能量向四周弥散,导致天线周围的最高温度出现小幅度的降低。盐水注入得越多,热量被分走得越多,所以会造成最高温度随着注射体积增加而降低的状况。但随着加热时间的增长,天线加热补偿的热量开始大于对于生理盐水的渗透作用而带来的热能损耗,而且中央组织脱水使能量逐渐集中而不易于散热[12],最终形成的消融区域范围扩大;微波加热后的热盐水易于向周围扩散,其本身就有一个热损伤作用。而通过联合注射液体进行消融,加强了肝细胞的坏死程度,距离微波消融部位较近区域的肝细胞广泛固缩变性,灶性坏死,说明流失的热量对肝细胞的影响明显。通过对比不注射液体与注射液体时的消融范围,可以看出其热损伤的程度大大提高,而单纯注射液体所形成的细胞坏死很难造成细胞凝固变性[13],所以细胞的坏死是消融主导造成,而不是全来自于液体占位。
但本次实验也存在一定的缺陷:由于时间和设备的原因,无法针对注射液体体积和消融范围的增长率关系做出线性相关分析来确定最佳注射量;此次得到的实验结果还需要和理论计算值做比较;由于牛肝与人肝脏之间、离体与活体之间存在较大差异,所以实验数据仅供临床参考。这些问题都还需要后期的补充实验和更多的理论学习来进行深入的研究。
4 结论
由生理盐水和无水乙醇联合微波消融都可以扩大消融范围,相对之前的单针微波消融的情况,消融面积及体积增加,并且纵横比增加,逐渐接近于1,消融形状趋向球形,更适合临床上肿瘤的治疗。注射液体体积增加,消融范围增大。
通过对比实验数据以及等温线重叠图直观对比,研究认为联合无水乙醇的注射效果要略好于生理盐水。总的来说,注射液体对扩大消融是有利的,但最佳注射用量还需要进一步研究。
[1] 范卫君. 射频, 微波, 冷冻消融治疗肿瘤的临床应用及优势对比[J]. 实用医学杂志, 2013, 29(21): 3447-3448.
[2] Chen Jianguo, Zhang Siwei.Liver cancer epidemic in China:Past, present and future[J]. Semin Cancer Biol,2011,21(1):59-69.
[3] Cui Jun, Dang Baowei, Liang Ping, et al. Construction and clinical significance of a predictive system for prognosis of hepatocellular carcinoma[J].World J Gastroenterol, 2005,11(20):3027-3033.
[4] Brace CL. Microwave tissue ablation: biophysics, technology, and applications[J].Critical Reviews in Biomedical Engineering, 2010, 38(1) : 65-78.
[5] 梁萍, 董宝玮. 肝癌微波消融治疗合理选择与评价[J]. 中国实用外科杂志, 2009, 28(8): 615-618.
[6] 张娴,张本华.微波消融术应用于原发性肝癌的研究进展[J]. 泰山医学院学报,2013, 34 (3):236-240.
[7] Lu Yulin, Nan Qun, Li Liang, et al. Numerical study on thermal field of microwave ablation With Water-cooled antenna [J]. Int J Hyperthermia, 2009,25 (2):108-115.
[8] Garbay JR, Mathieu MC, Lamuraglia M, et al. Radiofrequency thermal ablation of breast cancer local recurrence: A phase II clinical trial[J]. Annals of Surgical Oncology,2008, 15(11): 3222-3226.
[9] 李晓峰. 高功率水冷微波消融肝肿瘤的实验及临床研究[D]. 苏州:苏州大学, 2012.
[10] 范伯强,袁涛,平国强,等.超声引导下微波消融联合乙醇注射治疗兔肝VX2瘤[J].江苏医药,2012,38(12):1382-1385.
[11] 范伯强. 液体注射增强微波消融效果的实验研究[D]. 南京:南京医科大学, 2012.
[12] Liang Ping, Wang Yang, Yu Xiaoling et al. Malignant liver tumors: treatment with percutaneous microwave ablation—complications among cohort of 1136 patients [J]. Radiology, 2009, 251(3): 933-940.
[13] 姜凯,陈继业.活体猪肝射频消融河流效应对相应流域肝细胞的影响:病理学初步研究[J]. 解放军医学杂志,2013 ,38(5):347-350.
Experimental Study on Temperature Field of Microwave Ablation with Injecting Different Liquidsinvitro
Dong Tong Tian Zhen Nie Xiaohui Nan Qun#*
(BeijingUniversityofTechnologyCollegeofLifeScienceandBiotechnology,Beijng100124,China)
microwave ablation; saline; anhydrous ethanol;ex-vivo bovine liver; ablation range
10.3969/j.issn.0258-8021. 2016. 05.016
2016-01-07, 录用日期:2016-03-08
北京市自然科学基金(3162006);国家自然科学基金(31070754);北京市属高等学校高层次人才引进与培养计划项目
R318
D
0258-8021(2016) 05-0621-05
# 中国生物医学工程学会高级会员(Senior member, Chinese Society of Biomedical Engineering)
*通信作者(Corresponding author), E-mail: nanqun@bjut.edu.cn
