乳腺癌DCE-MRI影像特征与分子分型的关联性研究
2016-02-16王世健邵国良王晓稼厉力华
王世健 范 明 张 娟 邵国良 王晓稼 厉力华
1(杭州电子科技大学生命信息与仪器工程学院,杭州 310018)2(浙江省肿瘤医院放射科,杭州 310022)3(浙江省肿瘤医院肿瘤内科(乳腺),杭州 310022)
乳腺癌DCE-MRI影像特征与分子分型的关联性研究
王世健1范 明1张 娟2邵国良2王晓稼3厉力华1
1(杭州电子科技大学生命信息与仪器工程学院,杭州 310018)2(浙江省肿瘤医院放射科,杭州 310022)3(浙江省肿瘤医院肿瘤内科(乳腺),杭州 310022)
探讨DCE-MRI影像特征与乳腺癌分子分型之间的关联性。回顾性分析60例术前、化疗前行免疫组化病理检查及DCE-MRI检查的乳腺癌恶性患者。根据免疫组化结果,将患者分为4种分子分型。利用计算机,半自动提取DCE-MRI中包括统计特征、形态特征、纹理特征以及动态增强特征的65维影像特征。利用单变量逻辑回归和多变量逻辑回归方法,评估影像特征和分子分型之间的关联性,并建立多元回归模型,最后研究显著影像特征的分布情况。其中,MRI病灶统计特征与luminal A显著相关,病灶和背景的动态增强特征与luminal B、HER2、basal like显著相关(单变量逻辑回归矫正后P<0.05)。多变量逻辑回归结果显示,luminal A型、HER2型、basal like型都存在与其显著相关的影像特征,回归方程的P值分别为0.004 73、0.002 77、0.011 7。实验结果说明,DCE-MRI特征可作为潜在的乳腺癌分子分型的影像学标记。
乳腺癌;DCE-MRI;分子分型;影像特征;逻辑回归
引言
乳腺癌是女性最常见的恶性肿瘤之一,其发病率在全球主要国家均呈现上升趋势,成为女性健康的头号杀手。近年来,欧美发达国家乳腺癌发病率较高,每年乳腺癌新增病例约20万人,但死亡率却呈下降趋势,主要原因之一就是对广大妇女开展乳腺癌普查。相反,我国乳腺癌发病率相对于欧美国家要低,但发病增长率以每年3%~4%的速度急剧增长,同时死亡率也逐年增加[1]。在没有完全搞清楚引发乳腺癌原因的情况下,乳腺癌的准确诊断及合理治疗是降低病死率的关键。目前在医学上,乳腺癌在基因水平上被分为4种分子分型,分别为管腔上皮A型(luminal A型)、管腔上皮B型(luminal B型)、HER2过表达型(HER2型)和基底细胞样型(basal like型)4种分型[2]。这些分型根据种族、绝经情况、年龄等因素,不均匀地分布在乳腺癌女性患者中[3]。不同分子分型的乳腺癌患者在疾病表达、对治疗的反应以及生存结果上存在明显的差异[4-5]。luminalA型是临床上最常见的亚型,多为早期乳腺癌,复发率较低,对内分泌治疗敏感,而对化疗欠敏感;luminal B型多见于高龄乳腺癌患者,组织学分级较luminal A型高,且多数伴有HER2基因扩增,对内分泌治疗敏感,但不如luminal A型;HER2过表达型原发性肿瘤较大,复发转移较早,淋巴结转移较多,病理分期晚且浸润性强,治疗策略主要为化疗及靶向治疗,对化疗反应性较好,但预后不理想,可能出现耐药现象;Basal like型的病理分级高、浸润性强,年轻患者较多,有家族史的患者较多,并且预后较差,治疗时多采取联合化疗方案,另外该型肿瘤具有独特的转移机制,较少发生淋巴结转移,但发生转移后生存期较短[6]。总的来说,luminal A型预后最好,luminal B型稍好于HER2过表达型,但是差于luminal A型,Basal like型一般对化疗有较好的反应性,但预后最差。有研究做过统计,luminalA型、luminal B型、HER2过表达型、basal like型的5年存活率分别为81.9%、72.8%、67.1%、62.4%[7]。分子分型为临床乳腺癌的放化疗、内分泌治疗及靶向治疗提供一定依据,也对乳腺癌的临床诊治及预后评估做出贡献,因此对乳腺癌进行分子分型的判断具有极其重要的意义。
不同的乳腺癌分子分型在影像学检查中有不同的表现[8],因此推测影像学检查能反映分子分型,成为一种判断分子分型的替代方式。目前,用于诊断乳腺疾病的影像学方法主要包括乳腺钼靶成像、乳腺超声、乳腺核磁共振(magnetic resonance imaging, MRI)及正电子发射断层扫描(positron emission tomography, PET)技术等。其中,钼靶成像对于钙化点、肿块等病症的检出率较高,但其诊断结果受乳房密度的个体差异影响较大,不适于年轻女性的检查;超声成像无放射性损害,虽能很好地检测囊肿,但假阳性率高[9];而PET技术作为一种新的检查方法,费用昂贵,临床使用有限,其对于病灶的诊断能力有待通过更多的病例研究证实。对比以上3种影像学检查方法,磁共振成像(MRI)属多参数、多方位成像,可提供丰富的影像学信息,具有无电离辐射、安全可靠、软组织分辨率高等优点,是用于肿瘤特征提取和精确尺寸测量的最敏感成像方式[10]。动态增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging, DCE-MRI)技术,能反映对比剂在瘤体内的动态分布过程,因此可以从血液动力学角度了解瘤体的功能信息,如血供状况、血管通透性、细胞构成、间质压力、细胞外间隙大小等,已成为乳腺癌临床诊断的重要依据[11]。理论上DCE-MRI强化过程特征与乳腺癌的微血管特点具有相关性,进而可能在活体上评价其血管生成情况,了解其生物学特性,为乳腺癌治疗方案的制订提供依据[12]。许多研究者通过提取乳腺DCE-MRI中的影像特征来预测肿瘤的良恶性,本课题组在之前的研究中也在病灶区域和背景实质区域通过提取纹理特征和动态增强特征来预测乳腺肿块的良恶性,并取得了比较好的结果[13]。
将影像学特征关联到基因表达特征,从而替代基因芯片进行癌症的辅助诊疗,这门新兴的研究领域被称为“影像基因组学”,这个概念由Gevaert等提出[14]。此类研究在国外是一个热点,虽处于起步阶段,但也有了一些意义重大的发现。Mazurowski等发现了乳腺MRI动态增强率与luminal B型分子分型的关系,病灶区域动态增强率与背景区域动态增强率的比值越大,越有可能是luminal B型分子分型[2]。Zhang等利用单变量回归模型和多变量回归模型分别进行研究,发现了动态增强达到峰值时的时间与luminal A以及luminal B型分子亚型都存在着一定的联系[15]。Sutton等利用逐步多重线性回归法,发现了图像峰度与乳腺癌复发评分(recurrence score, RS)之间有一定的关联性,并构造出了RS与影像特征之间的最佳拟合线性回归模型[16]。同样地,本研究的目标就是从MRI影像中提取特征,定量地去研究影像特征和基因表达特征之间的关系,分子分型就是基因信息的外在表达特征,因此本研究可以等价于研究影像特征与分子分型的关系。由于绝大部分被初诊为患有乳腺癌的患者都做过MRI影像检查,若能通过计算机半自动提取MRI中的影像特征,并进行乳腺癌分子分型的可靠判断,将会为治疗提供有效的预后信息,同时还增加了影像诊断的准确性和效用性。本研究相比前人的研究,使用了3种逻辑回归方式进行综合分析,并提取了更多的MRI影像特征进行实验,如病灶区域的统计特征、纹理特征、形态特征以及动态增强特征,背景区域的纹理特征、动态增强特征以及左右两侧乳房的不对称性特征。结果表明,在这些影像特征中,存在部分特征与分子分型显著相关,这为后续建立从影像信息到基因信息的预测模型提供了可能性。
1 资料与方法
1.1 病人数据
本次研究所用数据皆来自浙江省肿瘤医院,包括从2011年1—7月的116例乳腺癌病例。去除掉没有进行病理检查、病理资料缺失和MRI图像序列不完整的病例,共剩76例。在剩下的病例中又通过时间先后进行筛选和排查,舍去在影像采集和病理检查前做过乳房相关手术以及化疗的16例,最后剩60例有效病例。对可研究的有效病例进行分析统计,发现所有病例均为女性,且都是乳腺癌恶性病例,年龄范围在32~64岁,中位年龄48.8岁;绝经前35例,绝经后25例。病理诊断结果分布为导管内癌4例。黏液癌2例、髓样癌2例、低分化腺癌1例,其余51例为浸润性导管癌。
1.2 影像数据
所有的DCE-MRI图像均来源自浙江省肿瘤医院放射科,利用西门子公司1.5T的MRI扫描设备(MAGNETOM Espree-Pink 1.5T)及专用乳腺相控阵线圈进行采集。在检查过程中,患者取俯卧位,双手平放在身体两侧,双侧乳房充分暴露,自然垂入乳房相控阵线圈。平扫采用轴位、矢状位常规FSE序列T1WI及脂肪抑制FSE序列T2WI,动态增强扫描采用轴位。采用3D VIBRANT(three-dimensional volume imaged breast assessment)T1加权序列进行动态增强扫描(重复时间TR为4.4 ms,回波时间TE为1.6 ms,翻转角FA为12°,重构层厚为1.2 mm)。根据浙江省肿瘤医院的参数设定,一次乳腺动态增强核磁共振检查的扫描时间往往会持续15~18 min。动态增强扫描采用20 G的医用套管针在前臂静脉建立通道,设定3个时间相位的扫描序列,总的动态扫描时间约为2 min 25 s。动态增强的首个序列为蒙片平扫,于该序列结束时将顺磁性对比剂Gd-DTPA按照0.2 mmol/kg的剂量,用高压注射器以4 mL/s的流率经静脉注入。在分别经过1 min 20 s与2 min 25 s后,后续的两次增强平扫序列会依次采集。由于三平扫序列采用相同的扫描参数,所以每个序列的影像集规格都是相同的,都是88张等间距断层截面图,重构层厚为1.2 mm,分辨率为512像素×512像素。因此,把数据存为四维矩阵,以方便后续的研究。
1.3 图像预处理
在影像特征提取前,需要对MRI原始影像进行预处理。在图像噪声处理方面进行了自适应维纳滤波降噪,在时限序列配准上采用组织边缘信息刚性配准方式[17],同时对研究区域进行分割与划分。一方面,在资深医师标注的病灶区域指导下,对MRI图像进行空间FCM粗分割,提取病灶粗轮廓;在此基础上,结合病灶三维信息进行MRF精分割,得到较为精准的病灶区域[18]。另一方面,使用基于人体解剖学结构的分割方法,从原始图像中分割出乳房区域[17],分割流程主要包括基于Canny边缘算子的身体轮廓检测、基于霍夫变换的双乳间皮肤检测和基于最小二乘法的多项式胸腔轮廓拟合。对分割出的乳房区域进行正常侧与异常侧的划分,进而得到病灶区域,正常侧背景实质区域,异常侧背景实质区域3个待研究区域[17]。本研究图像预处理的方法延续了课题组的前期工作,具体细节详见之前的相关成果[17]。
1.4 影像特征提取
本研究共提取了65维特征,病灶区域的影像特征主要有4类:第1类是统计特征,包括最大值、均值、方差、偏度;第2类是形态特征,包括病灶体积、径向长度均值、径向长度方差、粗糙度、紧致度;第3类是纹理特征,包括对比度、能量、同质性、相关性;第4类是动态增强特征,其中动态特征主要包括任意两个序列之间体素动态增强率的均值、方差、最大值,以及每两个序列之间病灶整体均值的比值。背景实质区域的特征主要有2类:第1类是纹理特征,包括对比度、能量、相关性、同质性;第2类是动态增强特征,包括在背景实质区域正常侧和异常测[19]任意两个序列之间体素动态增强率的均值、方差、最大值以及两侧区域之间这三类值的差值。动态增强率数据集定义如下:
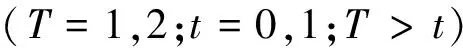
(1)


1.5 分子分型统计
从最初的乳腺活检或手术的病理报告中可以获取雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体(HER2)等的表达情况,从而确定分子分型。免疫组化染色采用SP法,整个免疫组化过程严格按照试剂盒说明书步骤进行。结果的判定通过病理专业医师读片,确定乳腺癌免疫组织标记物的染色情况,从而得出ER、PR、HER2的阴阳性结果。ER及PR的判定标准参考《ASCO/CAP乳腺癌激素受体IHC检测指南》,均定义检测标本中有大于1%的肿瘤细胞核着色就确定为阳性。HER2判读标准参考《乳腺癌HER2检测指南》,当表达情况为(+++)时认定为阳,(++)时需进一步做FISH检测判断阴阳性,表达情况为(-)或(+)都判定为阴性。ER、PR、HER2可以作为判断乳腺癌分子分型的依据,判断规则如下:ER和/或 PR阳性,HER2阴性,为管腔上皮A型(luminal A型); ER 和/或 PR阳性, HER2 阳性,为管腔上皮B型(luminal B型); ER和PR 阴性, HER2阳性,判定为HER2过表达型; ER、PR、HER2 阴性,为基底细胞样型(Basal like型)。需要补充的是,ER和/或PR为阳性、HER2为阴性的样本中,有部分因为Ki-67的高表达也被判定为管腔上皮B型[2]。对病人数据进行分类统计,统计结果如表1所示,其中luminalA型、luminalB型、HER2过表达型以及Basallike型病人分别为34例、8例、7例和11例。对年龄进行方差分析,P值为0.141,说明年龄分布不受分子分型组别的影响;对绝经情况、肿瘤类型进行卡方检验,P值分别为0.356和0.885,说明绝经情况和肿瘤类型的分布也不受分子分型组别的影响。
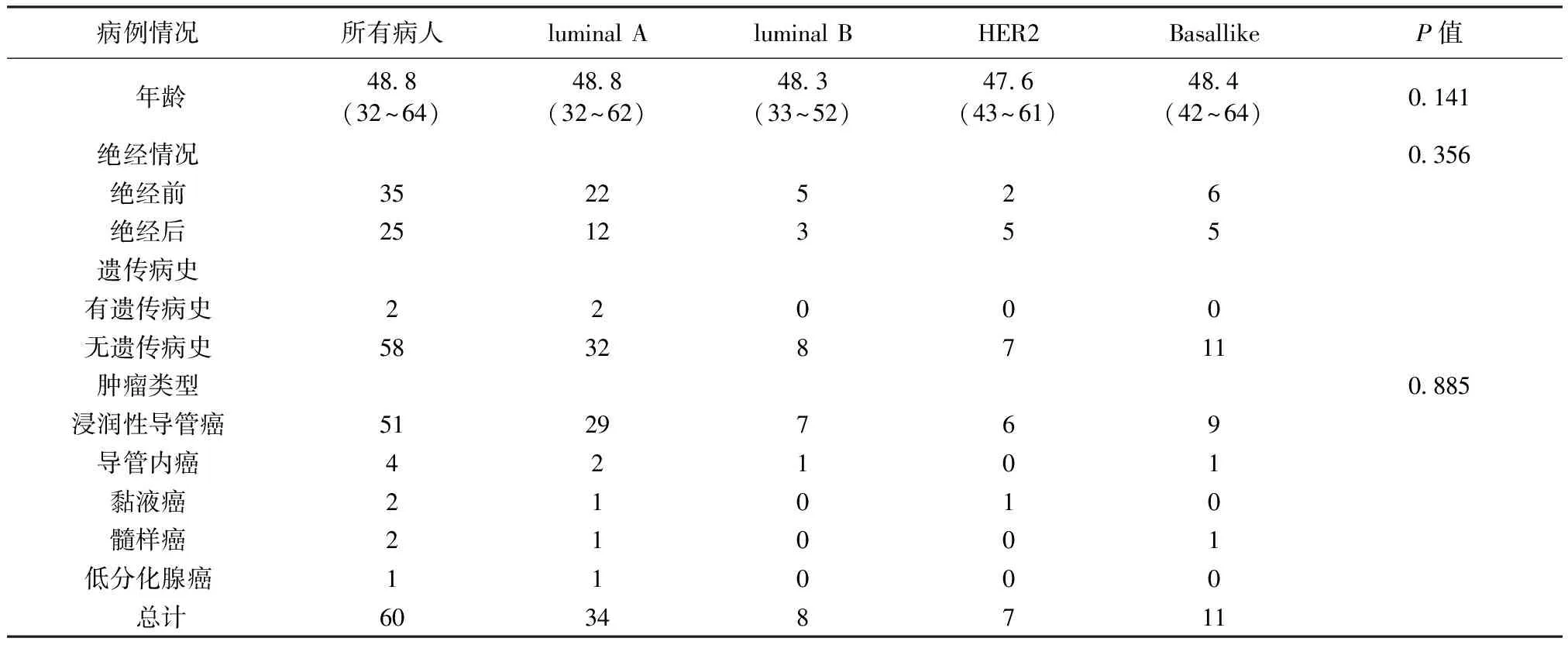
表1 样本分子分型特征统计
1.6 统计学分析
为了研究影像特征与分子分型之间的关系,考虑采用逻辑回归分析的方法寻找显著特征。将影像特征以及年龄、绝经情况作为自变量,每个病例分子分型取0或1(该分型为1,非该分型为0)作为因变量,进行回归分析,寻找显著的影像特征。
1.6.1 单变量逻辑回归分析
把单个影像特征作为自变量、分子分型作为因变量进行单变量逻辑回归分析,利用P值去评价每个影像特征的显著性。对于单变量逻辑回归分析后得到的显著性影像特征,再进行似然比检验和FDR矫正。步骤如下:首先,把年龄和绝经情况两个变量作为自变量、分子分型作为因变量进行逻辑回归分析;在此基础上,加入单个影像特征,与年龄、绝经情况一起作为自变量进行逻辑回归分析[2];然后,把前两步得到的回归模型做似然比检验,得到P值;最后,对P值进行FDR矫正。之所以进行似然比检验,一方面为了验证影像特征比年龄和绝经情况更能体现回归结果,另一方面也作为对单变量逻辑回归结果的修正。
1.6.2 多变量逻辑回归分析
在单变量逻辑回归分析中,并没有考虑多个影像特征的共同影响,因此需要再进行多变量的逻辑回归分析。由于特征可能存在冗余,回归分析容易出现多重共线性的现象,所以删除相似度较高特征中的一个,使最终两两特征之间的相关关系小于0.5。具体方法如下:首先,计算出各个特征两两之间的皮尔逊相关系数,形成一个上三角矩阵;其次,寻找目前矩阵中最大的相关系数,该相关系数对应两个特征,分别统计这两个特征与其他剩余特征相关系数大于0.5的特征个数,删去个数较多的那个特征;重复这一步骤,直到所有特征两两之间相关系数小于0.5。之所以采用这种删除方式,是为了在保证剩余特征尽可能多的情况下消除共线性。当两两相关系数都小于0.5后,进行多变量逻辑回归,在每次回归后判断整体方程是否显著,若不显著则删去最不显著的特征(P值最大),继续做多元逻辑回归,直到整体方程显著。当整体方程显著后,选取与显著特征相关系数较大的特征进行回溯替代,观察整体方程是否显著以及代入的特征是否显著,从而避免在消除共线性的过程中丢失显著特征。
2 结果
2.1 单变量逻辑回归分析结果
在单变量逻辑回归分析中,每个分子分型都有影像特征与其显著相关:luminal A型主要为统计特征中的偏度和形态特征中的紧致度显著,luminal B型主要为病灶区域动态增强特征和背景区域异常侧动态增强特征显著,HER2型主要为背景区域异常侧的动态增强特征以及两侧的不对称性特征显著,Basal-like型主要为统计特征中的病灶区域灰度最大值和背景区域正常侧动态增强显著。具体的显著特征如表2所示,其中第3列数据表示仅通过单变量逻辑回归获得的结果,第4列数据表示似然比检验(矫正后)获得的结果。特征入选标准为似然比检验结果中显著性指标P值的FDR校验值小于0.1,另外对于FDR校验值小于0.05的特征进行了加粗显示(见表2中的加黑数字)。
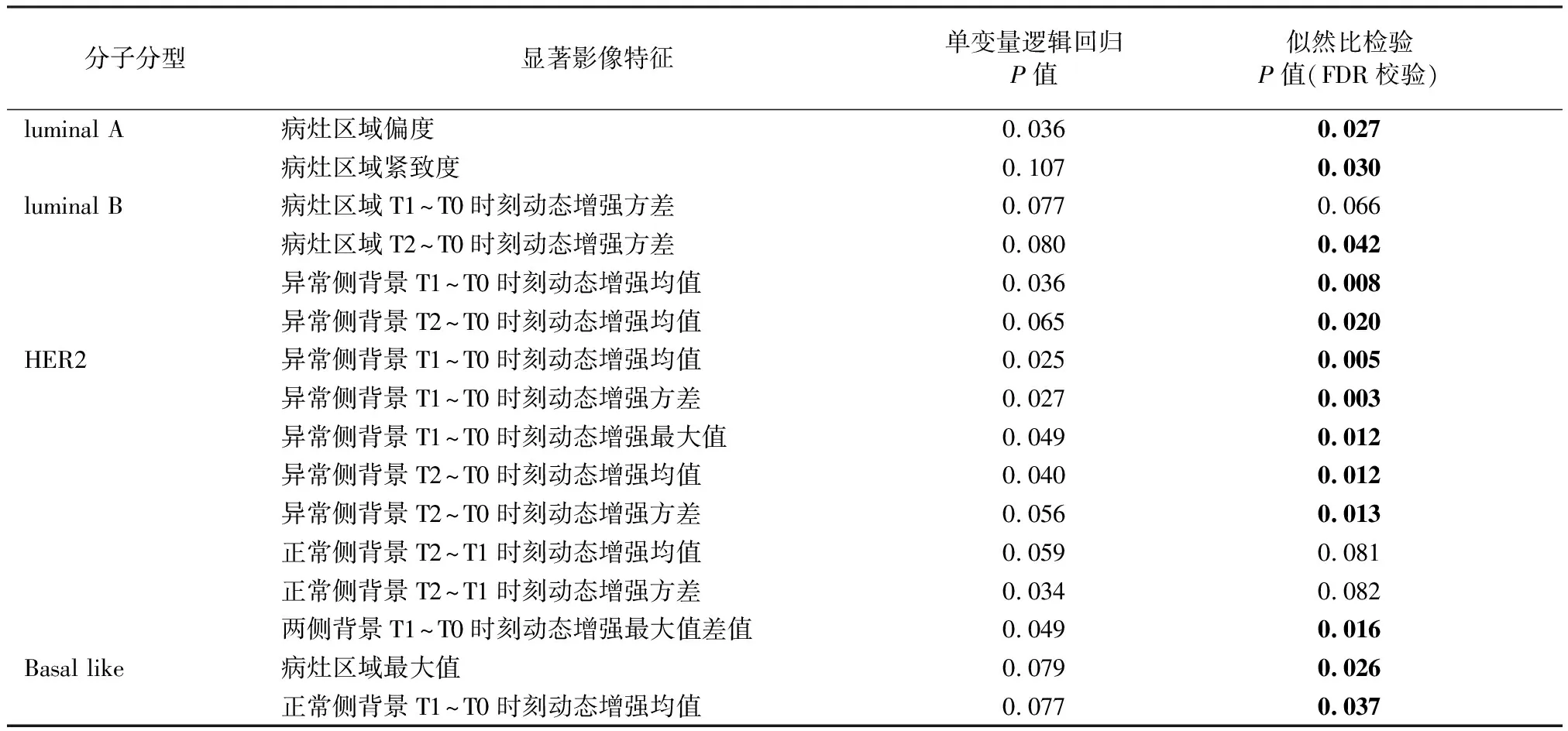
表2 单变量回归分析
2.2 多变量逻辑回归分析结果
在多变量逻辑回归分析中,除了luminal B型外,luminal A型、HER2型、Basal like型等3种分子分型都能找到显著特征使得整体方程显著,P值分别为0.005、0.003、0.012。其中,luminal A型主要为统计特征中的偏度和形态特征中的紧致度显著,HER2型主要为病灶区域动态增强特征、背景区域异常侧动态增强特征以及两侧的不对称性特征显著,Basallike型主要为背景区域动态增强特征显著(包括正常侧、异常侧以及两侧差值),具体的显著特征如表3所示。

表3 多变量回归分析
根据回归结果,可以得出最佳拟合模型(由公式编辑器得出),有
(2)
式中,skewness表示病灶区域偏度,kurtosis表示病灶区域峰度,age表示患者年龄,radial_length表示病灶最大径向长度均值,compactness表示病灶区域紧致度,max表示病灶区域灰度最大值。
式(2)为Logistic方程,Yi表示每一种分子分型的是该类型的可能性(介于0~1之间),Xi为Logistic方程中的线性部分,它的值可以由影像特征、年龄、绝经情况等特征线性表示。式(3)~(5)分别表示luminalA、HER2、Basallike等3种分子亚型线性部分的拟合模型。
2.3 4种显著影像特征的分布
在对各个分子分型进行逻辑回归分析后发现,无论在单变量回归还是多变量回归结果中,luminal A型的病灶区域偏度与紧致度、HER2型异常侧T1~T0时刻动态增强均值特征、Basal like型正常侧T1~T0时刻动态增强均值特征都具有较高的显著性,因此进一步地去研究这4个特征的分布情况。
为了研究特征的分布情况,本研究选取了上述4个显著特征做了箱线图分析,如图1所示。其中,(a)和(b)分别表示在luminal A型分子分型中病灶区域偏度特征和紧致度特征的分布情况。从图1(a)可以发现,luminal A型相比其他分子分型在偏度特征上更具有负偏离性;从图1(b)可以发现,luminal A型相比其他分子分型在紧致度上平均数值更大。图1(c)表示在HER2型与其他分子分型中异常侧T1~T0时刻动态增强均值的分布情况,可以发现HER2型异常侧T1~T0时刻动态增强均值明显大于其他类型的值。图1(d)表示在Basal like型与其他分子分型中正常侧T1~T0时刻动态增强均值的分布情况,可以发现Basal like型正常侧T1~T0时刻动态增强均值相比其他类型分布更加集中。
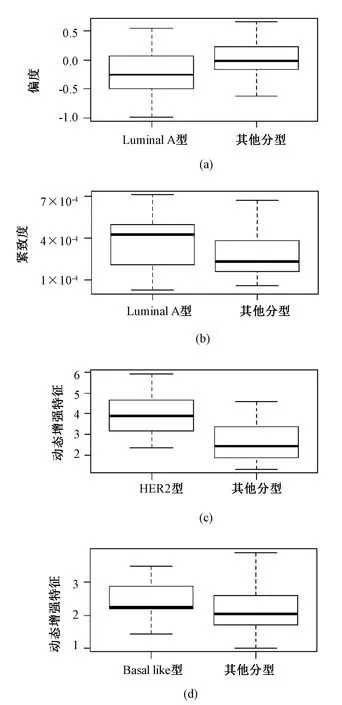
图1 4种显著影像特征的分布情况。(a)偏度;(b)紧致度;(c)异常侧背景T1~T0时刻动态增强均值;(d)正常侧背景T1~T0时刻动态增强均值Fig.1 Distributions of four significant MRI features. (a)Skewness; (b)Compactness; (c) The average of dynamic enhancement at T1~T0 time phase in abnormal side; (d) The average of dynamic enhancement at T1~T0 time phase in normal side
3 讨论
上述实验结果证明,乳腺癌MRI影像特征与分子分型存在一定的统计关联,尤其是luminal A型与MRI影像中的偏度特征、紧致度特征有较强的相关性。通过统计模型构建回归方程,利用DCE-MR影像特征来预测乳腺癌肿瘤的3种分子亚型,即luminal A型、HER2过表达型和Basal like型。虽然这只是早期的研究,但是具有一定的重要意义。本研究采用影像基因组学(radiogenomics)方法,为非侵入、无创的核磁共振影像检查来代替侵入性、费时费力的免疫组化检测提供了依据,从而可以利用影像特征来分析预测病人的预后、治疗等情况。
此外,本研究中的影像特征是通过计算机半自动提取的,而放射科医生在无计算机支持下是无法获得这些影像特征的。区别于放射科医生传统的读片方法(即定性分析肿瘤特征,如毛刺情况、边界情况等),影像特征可以计算提取定量的计算特征,如肿瘤灰度分布特点、肿瘤纹理特征等。这种定量特征提取的方法可以发现更多肿瘤的特征,具有很大优势。所以,采用半自动的计算机图像分割与特征提取方式,可以在基本不增加诊断时间的情况下进行更细致的MRI影像分析,这将十分有助于乳腺癌的前期诊断和后续治疗。
虽然乳腺癌分子分型与影像特征的关联性研究是一个相对较新的探索领域,但从结果看也是得到了一些生物学理论的支持。例如,luminal A型在所有分子分型中预后最好,且对内分泌治疗和放射治疗有较大的敏感性[20],而在笔者的实验中luminal A型对应的显著影像特征也反映了这一特点。偏度反映了像素的不平衡性,是病灶异质性的一种体现,而紧致度反映了病灶边界的光滑圆润程度。研究发现,luminal A型相对其他分子分型有较低的偏度和较高的紧致度,即病灶有较低的病灶异质性以及不规则性,这与生物学理论基础以及临床经验相吻合。另外,实验表明HER2型异常侧背景区域的动态增强率高于其他分子分型,也一定程度上体现了HER2型代谢速率较快、预后较差的临床特点[21]。从另一角度分析来看,Mazurowski等发现了病灶区域动态增强率与背景区域动态增强率的比值越大越有可能是luminal B型分子分型[2],Sutton等发现了图像峰度与乳腺癌RS(recurrence score)之间有一定的关联性[16],这些特征都与笔者研究所获得的结果有一定相似性和类比性。
本研究具有一定的局限性,原因是样本量太少,有效病例只有60例,且主要分布在luminal A型(34例),这不利于对其他分子分型的研究。虽然本研究的样本数量较少,但也得到了部分显著性结果,期望在后续研究中补充更多样本,以得到更加准确可信的结果。发现MRI影像和分子分型的关联性,并不意味着影像特征可以很容易地取代基因测序或免疫组化病理检查,但这是一个良好的开端。相信在后续的研究中,通过大量的患者信息可以发现更多的与分子分型相关的影像特征,甚至能够通过计算机提取影像特征,并建立准确的分子分型分类预测模型。除此之外,基于计算机的病灶分割依赖于放射科医生对肿瘤的标注,其标注范围可能会因为人与人的差别或同一个人在不同时间的行为差别而不同,这一潜在问题的解决也应该是未来的一个研究方向。最后,乳腺癌的癌症分期对于影像学表型和分子分型可能有一定的影响,这也是后续研究中应当考虑的因素。
[1] 张承杰. MRI乳腺病灶分割研究[D]. 杭州:杭州电子科技大学,2013.
[2] Goldhirsch A, Wood WC, Coates AS, et al. Strategies for subtypes—dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011[J]. Ann Oncol,2011,22(8):1736-1747.
[3] Mazurowski MA, Zhang J, Grimm J, et al. Radiogenomic analysis of breast cancer: luminal B molecular subtype is associated with enhancement dynamics at MR imaging[J]. Radiology,2014,273(2):365-372.
[4] 王娇,温健,涂巍,等. ER和PR及HER-2表达与乳腺癌分子分型及临床特征和预后的关系[J]. 中国现代普通外科进展,2014,17(2):99-103.
[5] Schnitt SJ. Will molecular classification replace traditional breast pathology?[J]. International Journal of Surgical Pathology,010,18(Suppl3):162S-166S.
[6] 赵燕,徐卫云. 乳腺癌分子分型及临床意义的研究进展[J]. 中国现代普通外科进展,2014,17(11):921-924.
[7] Spitale A, Mazzola P, Soldini D, et al. Breast cancer classification according to immunohistochemical markers: clinicopathologic features and short-term survival analysis in a population-based study from the South of Switzerland[J]. Annals of Oncology,2009,20(4):628-635.
[8] 张峰,罗立民,鲍旭东. 常用影像方法在乳腺癌辅助诊断中的性能对比[J]. 中国生物医学工程学报,2012,31(2):276-284.
[9] 王荣福. 乳腺癌影像诊断技术应用进展[J]. 中国医学影像技术,2009(05):905-907.
[10] 刘全良,马捷,龚静山,等. 乳腺癌MRI动态增强扫描非肿块样强化特点与ER PR及C-erbB-2因子表达的相关性研究[J]. 河北医学,2015(2):185-189.
[11] Teifke A, Behr O, Schmidt M, et al. Dynamic MR imaging of breast lesions: correlation with microvessel distribution pattern and histologic characteristics of prognosis[J]. Radiology,2006,239(2):351-360.
[12] 汤光宇. 动态增强MRI对乳腺癌生物学行为评价[D]. 上海:第二军医大学,2008.
[13] 杨骞. 基于DCE-MRI影像的乳腺癌早期诊断研究[D]. 杭州:杭州电子科技大学,2013.
[14] Segal E, Sirlin CB, Ooi C, et al. Decoding global gene expression programs in liver cancer by noninvasive imaging[J]. Nature Biotechnology,2007,25(6):675-680.
[15] Grimm LJ, Zhang J, Mazurowski MA. Computational approach to radiogenomics of breast cancer: luminal A and luminal B molecular subtypes are associated with imaging features on routine breast MRI extracted using computer vision algorithms[J]. Journal of Magnetic Resonance Imaging,2015,42(4):902-907.
[16] Sutton EJ, Oh JH, Dashevsky BZ, et al. Breast cancer subtype intertumor heterogeneity: MRI-based features predict results of a genomic assay[J]. Journal of Magnetic Resonance Imaging,2015,42(5):1398-1406.
[17] Yang Q, Li L, Zhang J, et al. Computer-Aided Diagnosis of Breast DCE-MRI Images Using Bilateral Asymmetry of Contrast Enhancement Between Two Breasts[J]. Journal of Digital Imaging,2014,27(1):152-160.
[18] 张承杰,厉力华. 基于空间FCM与MRF方法的乳腺MRI序列三维病灶分割研究[J]. 中国生物医学工程学报,2014,33(2):202-211.
[19] Qian Y, Lihua L, Juan Z, et al. A computerized global MR image feature analysis scheme to assist diagnosis of breast cancer: a preliminary assessment.[J]. European Journal of Radiology,2014,7(7):1086-1091.
[20] Lam SW, Jimenez CR, Boven E. Breast cancer classification by proteomic technologies: Current state of knowledge[J]. Cancer Treatment Reviews, 2014, 40(1): 129-138.
[21] Kyndi M, Sorensen FB, Knudsen H, et al. Estrogen receptor, proges-terone receptor, HER-2, and response to postmastectomy radiother-apy in high-risk breast cancer: the Danish Breast Cancer CooperativeGroup [J]. J Clin Oncol 2008,26(9):1419-1426.
Association between DCE-MRI Features and Molecular Subtypes in Breast Cancer
Wang Shijian1Fan Ming1Zhang Juan2Shao Guoliang2Wang Xiaojia3Li Lihua1*
1(CollegeofLifeInformationScienceandInstrumentEngineering,HangzhouDianziUniversity,Hangzhou310018,China)2(DepartmentofRadiology,ZhejiangCancerHospital,Hangzhou310010,China)3(DepartmentofMedicalOncology(Breast),ZhejiangCancerHospital,Hangzhou310010,China)
In this work, we investigated the correlation between DCE-MRI features and molecular subtypes in breast cancer. Sixty cases of malignant breast cancer patients with DCE-MRI examination before chemotherapy were retrospectively analyzed. The molecular subtype was confirmed according to the immunohistochemistry results. Firstly, 65-dimensional imaging features including statistical characteristics, morphology, textural and dynamic enhancement were extracted from DCE-MRI with computer semi-automatic methods. Then, the correlations of imaging features and molecular subtype were assessed using statistical analyses, including univariate logistic regression and multivariate logistic regression. At the same time, a multiple regression model was established based on above results. Finally, the distribution of significant image features was analyzed. The results of experiments showed that statistical characteristics of lesions were significantly correlated with luminal A, dynamic enhancement of lesions and background were significantly related to luminal B, HER2 and basal like subtype, in whichPvalues were all lower than 0.05 using univariate logistic regression-adjusted method. Multi-variable logistic regression analysis showed that imaging features were significantly associated with molecular subtypes withPvalue equaled to 0.004 73 for luminal A, 0.002 77 for HER2 and 0.011 7 for basal like. The results suggested DCE-MR imaging features as important candidate marker to divide breast cancer into molecular subtypes.
breast cancer; DCE-MRI; molecular subtype; image feature; logistic regression
10.3969/j.issn.0258-8021. 2016. 05.004
2015-10-08, 录用日期:2016-05-12
国家自然科学基金(61271063,61401131);浙江省自然科学基金(LZ15F010001)
R318
A
0258-8021(2016) 05-0533-08
*通信作者(Corresponding author), E-mail: lilh@hdu.edu.cn
