兔脂肪干细胞与软骨细胞微球共培养成软骨分化最适诱导比例的实验研究
2016-02-16赵明璨
赵明璨 杨 午 刘 畅,2*
1(吉林大学口腔医学院,长春 130021)2(广州医科大学附属口腔医院,广州口腔病研究所,口腔医学重点实验室, 广州 510140)
兔脂肪干细胞与软骨细胞微球共培养成软骨分化最适诱导比例的实验研究
赵明璨1杨 午1刘 畅1,2*
1(吉林大学口腔医学院,长春 130021)2(广州医科大学附属口腔医院,广州口腔病研究所,口腔医学重点实验室, 广州 510140)
通过间接共培养ADSC与软骨细胞微球,得出使ADSC发生软骨向分化的最佳比例。体外分离培养新西兰大白兔ADSC和软骨细胞,制成微球分置于Tranwell上下室,实验分为阳性对照组,阴性对照组,生长因子对照组及不同比例(0.5∶1; 1∶1; 1∶2; 1∶3; 1∶5;1∶7)的ADSC和软骨细胞共培养组,培养28天后分别行组织形态学观察,GAG、COL-Ⅱ和COL-Ⅹ的定性定量检测。阿利新蓝-核固红染色及Ⅱ型胶原免疫组化染色显示比例为0.5∶1和1∶1的阳性较弱,而Ⅹ型胶原在生长因子对照组的表达最为强烈。DMMB法显示总GAG含量在共培养组较阴性对照组均有所增加(P<0.05),且增加量与软骨细胞的比例呈正相关,但是在ADSC:AC比例达到1∶5之后有所下降。OHP检测总胶原蛋白的变化同上,且1∶5组中沉积的胶原量比阴性对照组高出7.3倍。能够使ADSCs最大程度的表达软骨特异性细胞外基质,同时使COL-Ⅹ等软骨肥大标志无明显上调的ADSC与软骨细胞的比例为1∶5,共培养诱导较生长因子能够抑制ADSC软骨向分化后的肥大问题。
脂肪干细胞;软骨细胞;共培养;生长因子
引言
软骨一旦损伤便无法自行修复,但组织工程的兴起为解决这一难题提供了新的方法。脂肪干细胞(adipose-derived stem cell,ADSC)因来源丰富、取材方便等优点而成为软骨组织工程理想的种子细胞[1],然而并没有一种公认高效的诱导方法[2]。传统诱导用到大量的生长因子,如转化生长因子β家族(transforming growth factor-βs,TGF-βs)、骨形态发生蛋白家族(bone morphogenetic proteins,BMPs)等,费用高、半衰期短,而且避免不了在ADSC发生向稳定软骨分化的同时发生早期肥大[3-5]。已知正常关节软骨微环境可以诱导ADSC向软骨细胞分化[6],因此近年来利用ADSC和软骨细胞共培养的方法诱导ADSC向软骨分化的研究越来越多[7-8],但共培养的机制及两种细胞的最佳比例有待进一步探讨。
1 材料和方法
1.1 材料
健康新西兰大白兔,体重约250 g(吉林大学动物中心;Transwells插入装置(美国 Corning);L-DMEM 培养基、H-DMEM、DMEM-F12 (美国 Hyclone);胰蛋白酶、I型胶原酶、Ⅱ型胶原酶、透明质酸酶、青/链霉素、两性霉素B、PicoGreen dsDNA定量试剂盒(美国Invitrogen);氯胺T、P-DMBA、4-羟基脯氨酸(美国 Sigma);胰岛素、ITS、DMB、木瓜蛋白酶消化液(美国 Gibco);阿利新蓝、TGF-β3、 BMP-6 (美国 Cyagen);兔二步法免疫组化检测试剂盒、DAB染色液(迈新 福州);硫酸软骨素(美国Calbiochem)。
1.2 方法
1.2.1 脂肪干细胞的分离与培养
2~4周龄健康新西兰大白兔,取皮下脂肪用0.1%的I型胶原酶消化60 min;过滤,离心(1 000 r/min),10%FBS的L-DMEM重悬细胞,接种,培养于37℃、5%CO2的孵箱;24 h后半量换液,之后3天换液一次。待细胞达90%融合时传代,0.25%胰蛋白酶(含0.02%EDTA)消化,以5×105cells/cm2的密度接种于培养瓶,细胞传至第3代备用。
1.2.2 脂肪干细胞的鉴定
取第3代ADSC,以每孔2×104个细胞接种到24孔培养板上,常规培养液培养,待细胞达90%融合时,分别换为成脂诱导培养基(H-DMEM,10%FBS,1×10-6M 地塞米松,10 μg/mL胰岛素,50 μg/L-抗坏血栓,0.5 mM的IBMX,0.2 mM吲哚美辛,青/链霉素各100 U/mL)及成骨诱导培养基(H-DMEM,10%FBS,1×10-8M地塞米松,L-抗坏血栓50 μg/mL,β-磷酸甘油钠10 mM,青/链霉素100 U/mL),行成脂及成骨诱导。3周后分别行油红O染色及茜素红-Tris-HCl染色,倒置显微镜观察拍照。
1.2.3 软骨细胞的分离与培养
2~4周龄健康新西兰大白兔无菌处死,取关节软骨切成1 mm×1 mm小块,0.2%Ⅱ型胶原酶消化16 h;过滤后1 200 r/min离心5 min;10%FBS的DMEM/F12重悬细胞获得关节软骨细胞(ACs),在37℃、5%CO2的标准孵箱培养,2 d换液一次;待细胞达90%融合时传代,以1~5×105cells/cm2的密度接种于培养瓶,待细胞铺满瓶底后备用。
1.2.4 脂肪干细胞和软骨细胞微球的制作
取第3代ADSC和第1代AC,消化后移入15 mL离心管内,调整细胞数为5×l05个,1 200 r/min离心5 min制成pellets。加入基础培养基(L-DMEM,10%FBS,100 U/ mL青/链霉素),置于37℃、5%CO2的培养箱内培养3 d,使细胞团聚集,依照此法制成8个ADSC微球和19个软骨细胞微球。同时,制成一个细胞数为2.5×105个的AC球,方法同上。
1.2.5 实验模型的建立及分组
将ADSC和AC微球分置于Tranwell上下层。实验共分为9组(n=3):#1为单纯AC球,用普通培养基(H-DMEM,1% ITS,50 μg/mL L-抗坏血栓,40 μg/mL L-脯氨酸,青/链霉素100 U/ mL,2.5 μg/mL两性霉素B)培养;#2为单纯上层ADSC球的阴性对照组(普通培养基);#3为单纯ADSC球,用诱导培养基(普通培养基+1×10-7M 地塞米松+10 ng/mL TGF- β3+10 ng/mL BMP-6)培养,为生长因子对照组。组4到组9(#4~#9)为实验组,将ADSC球和AC球以不同比例(0.5∶1; 1∶1; 1∶2; 1∶3;1∶5;1∶7)共培养(普通培养基)。将以上9组分置于24孔板,置于37℃、5%CO2的培养箱中培养,2 d换液一次。培养28 d后,取出ADSC微球检测。
1.3 观测指标
1.3.1 大体观察
观察诱导后各组ADSC微球的大小、形状、色泽、质地的变化,比较各组间标本湿重的差异。
1.3.2 组织学观察
取各组诱导后的ADSC微球,固定后包埋切片。
1)HE染色观察微球结构,包括组织的连续性、密度及软骨陷窝形成情况。
2)阿利新蓝-核固红双染色,观察软骨特异性细胞外基质GAG的表达情况。
3)采用免疫组化染色法,观察诱导后ADSC微球Ⅱ型胶原的表达:切片脱蜡脱水,4 mg/mL透明质酸酶(pH值为5.5)消化60 min(37℃),内源性过氧化物酶室温下处理10 min,滴加浓度为1∶80的Ⅱ型胶原一抗,4℃过夜,约20 h后用酶标羊抗小鼠/兔IgG聚合物孵育10 min;DAB显色,苏木素复染,自来水返蓝,梯度酒精脱水,二甲苯透明,中性树胶封片;倒置相差,显微镜观察。
4)采用免疫组化染色法,鉴定诱导后ADSC微球Ⅹ型胶原的表达:切片脱蜡脱水, 0.25%的胰酶(含1 mM EDTA)消化3 min(37℃),内源性过氧化物酶处理10 min,滴加浓度为1∶200的Ⅹ型胶原一抗,4℃过夜,用酶标羊抗小鼠/兔IgG聚合物孵育10 min,显色、复染、脱水、透明、封片、观察。
1.3.3 DMB染色法定量检测GAG
培养28 d后取出细胞微球,木瓜蛋白酶消化16 h(65℃);用PicoGreen dsDNA定量试剂盒检测微球的DNA浓度,用做DMB检测值的标准化;在96孔板中加入40 μL梯度浓度(0~35 μg/mL)的C-4-S标准液和样品液,每孔加入125 μL DMB染液,酶标仪测量595 nm处的吸光度值(OD),绘制浓度标准曲线,计算样品所含GAG浓度。
1.3.4 OHP法定量检测总胶原
培养28d后取出细胞微球,木瓜蛋白酶消化细胞微球(65℃;16 h),用PicoGreen dsDNA定量试剂盒做OHP检测值的标准化;分别将标准液、样品50 μL及12N HCl(37%)50 μL加入2 mL耐高温离心管中,高压蒸汽灭菌锅中(120℃,15~20 kg/cm2)水解30 min;96孔板中加入50 μL梯度浓度的OHP标准液和样品液及50 μL 的氯胺-T溶液混匀,室温静置15 min后加入p-DMBA显色液,37℃反应30 min;使用酶标仪测量550 nm处的吸光度值(OD),绘制浓度标准曲线,计算样品所含羟基脯氨酸浓度,并以7.46∶1的比例将其转化为II型胶原浓度[9]。
1.4 统计学分析
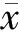
2 结果
2.1 脂肪干细胞多向分化潜能鉴定结果
ADSC经成脂诱导5 d后细胞逐渐变圆,增殖停止,细胞内出现小脂滴样空泡,随后空泡逐渐增多并互相融合。油红0染色脂滴为红色(见图1(a));ADSC经成骨诱导后细胞增大变为多角形,2周左右可见折光度高的晶莹似钙基质结节物质出现,细胞呈重叠融合生长态势。诱导 21 d后,茜素红-Tris-Hcl染色将沉积明显的钙结节染成深粉红色(见图1(b))。

图1 脂肪干细胞多向分化潜能鉴定结果。(a)成脂诱导油红0染色(100×);(b)成骨诱导茜素红染色(100×)Fig.1 The Result of multilineage differentiation of ADSC. (a)Osteogenic measured by oil red o staining;(b) Adipogenic measured by alizarin red staining.
2.2 各组微球大体观察及湿重
体外共培养4周后,各组细胞微球均聚集成类圆形组织块(见图2)。#1为半透明的光滑结构,体积较大,色乳白,质地稍韧有弹性;#2微球团块呈淡黄色不透明状态,质地较软无弹性。#3与共培养组(#4 ~ #9)为白色稍有硬度的低弹团块,组间肉眼差异较小,但从ADSC:AC为1∶3的实验组开始,ADSC微球的韧度较低,细胞比例组的微球韧度有明显增加。为了验证大体结果,称量各ADSC细胞微球湿重,通过测量进一步量化结果(见图3)。

图2 各组细胞微球大体观察Fig.2 The gross view of each pellets

图3 各组细胞微球湿重测量Fig.3 The wet weight of each pellets
2.3 组织学观察
2.3.1 HE染色
图4为培养28 d后各组HE染色结果,结果显示软骨细胞阳性对照组(见图4(a))有大量软骨陷窝形成;高软骨比例的共培养组(1∶3,1∶5,1∶7)可见零星软骨陷窝(见图4(g)~(f))。ADSC阴性对照组(见图4(b))未见软骨陷窝形成。同时,除了软骨细胞阳性对照组,所有实验组和对照组的ADSC微球周围一圈都有不同程度的空泡,而在微球中央部空泡则很少发生,在生长因子阳性对照组最多(见图4(c))。

图4 培养28 d后各组HE染色结果 (200×)。(a)~(i) #1~#9Fig.4 The result of HE staining after 28 days of culture 200×. (a)~(i) #1~#9
2.3.2 阿利新蓝-核固红染色
图5为培养28 d后各组阿利新蓝-核固红染色结果,除了ADSC阴性对照组(见图5(b)),各实验组及对照组阿利新蓝染色均为阳性;低软骨细胞比例共培养组(0.5∶1与1∶1)与高软骨细胞比例共培养组(1∶5,1∶7)和阳性对照组相比,蓝色着色较浅;相比高软骨细胞比例共培养组(1∶3,1∶5,1∶7)和生长因子阳性对照组(见图5(c)),蓝色的深浅差异不大。
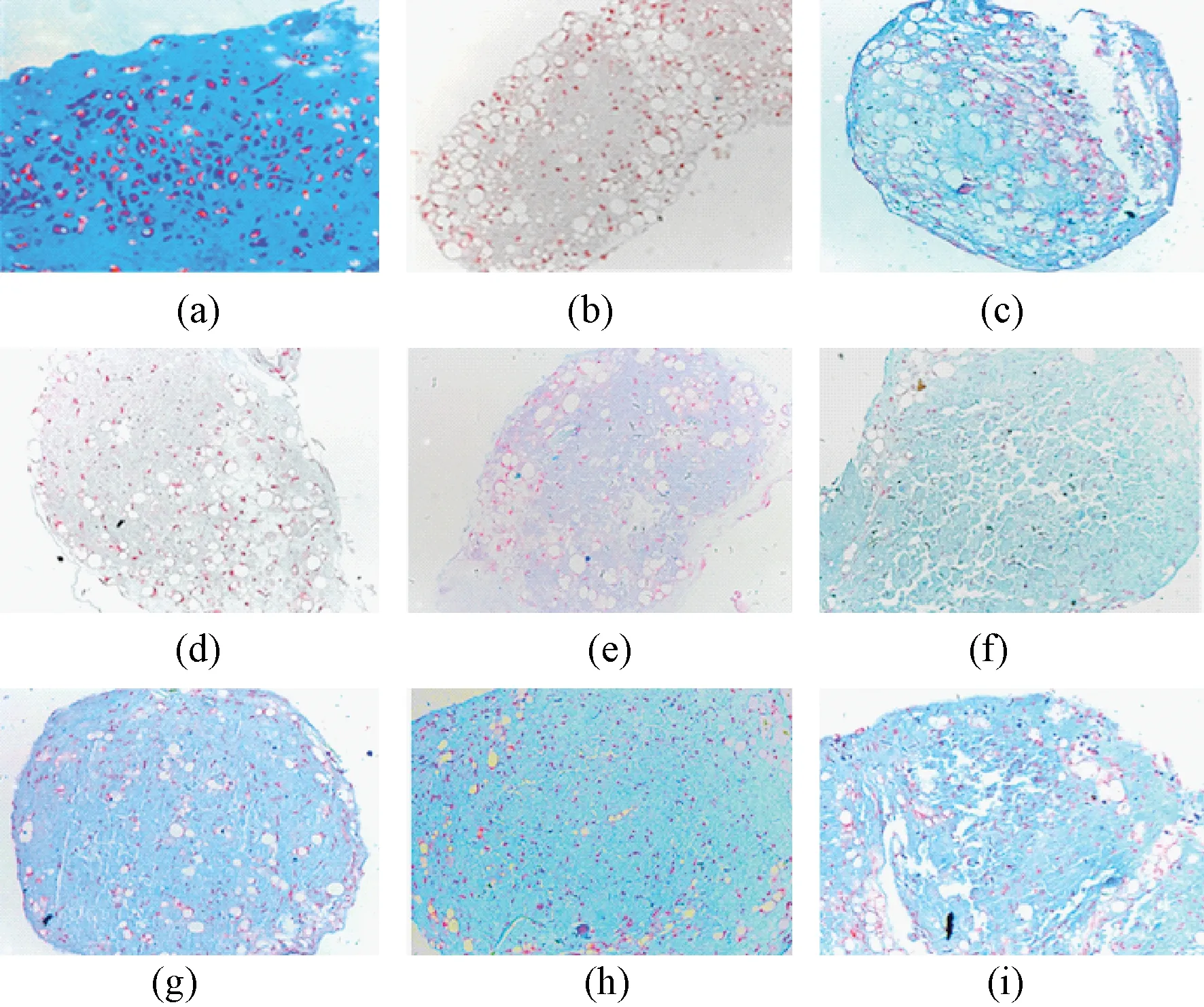
图5 培养28 d后各组阿利新蓝-核固红染色结果(200×)。(a)~(i) #1~#9Fig.5 The result of toluidine blue- nuclear fast red staining after 28 days of culture 200×. (a)~(i) #1~#9
2.3.3 II型胶原免疫组化染色
图6为培养28 d后各组II型胶原免疫组化染色结果,除了ADSC阴性对照组(见图6(b))外,其余各组均可见到棕黄色沉淀;ADSC-AC 比为1∶5(见图6(h)),达到了生长因子阳性对照组(见图6(c))的着色水平;低软骨细胞比例组(见图6(d)、(e))与高浓度软骨细胞共培养组(见图6(g)、(f))相比,Ⅱ型胶原着色较浅。

图6 培养28 d后各组Ⅱ型胶原免疫组化染色结果 (200×)。(a)~(i) #1~#9Fig.6 The result of immunofluorescence staining of collagen type Ⅱ after 28 days of culture 200×. (a)~(i) #1~#9
2.3.4 Ⅹ型胶原免疫组化染色
图7为培养28 d后各组Ⅹ型胶原免疫组化染色结果,结果显示各共培养组(见图7(d)~(i))及生长因子阳性对照组(见图7(c))均可见到棕黄色区域。其中,以生长因子阳性对照组的颜色最深,共培养各组Ⅹ型胶原免疫组化着色均较浅。

图7 培养28 d后各组Ⅹ型胶原免疫组化染色结果 (200×)。(a)~(i) #1~#9 Fig.7 The result of immunofluorescence staining of collagen typeⅩafter 28 days of culture 200×. (a)~(i) #1~#9
2.4 GAG定量
经过28 d共培养,ADSC微球分泌大量的GAG,与阴性对照组形成鲜明对比(P<0.05)。然而,ADSC-AC比为1∶5和1∶7组中,GAG的沉积量比1∶1组高出将近140%。实验结果还表明,共培养时相对较高的软骨细胞比例组(1∶3,1∶5和1∶7)GAG的沉积量甚至达到了生长因子对照组的水平,但组间无显著统计学差异(P>0.05)(见图8)。

图8 各组细胞微球GAG定量结果Fig.8 The GAG quantitative result of each pellets
2.5 总胶原定量
共培养28 d后,软骨细胞比例从1∶1到1∶7的各共培养组ADSC微球的总胶原量较ADSC阴性对照组(#2)均有所增加,1∶5组中沉积的胶原量最高,比阴性对照组高出7.3倍,且总胶原量占到微球湿重的1.58%。用湿重标准化该测量值发现,在1∶3组、1∶5组、1∶7共培养组和生长因子阳性对照组,ADSC微球单位质量产生胶原量无显著差异(P>0.05),但均较其余共培养组高(见图9)。

图9 各组细胞微球总胶原定量结果Fig.9 The total collagen quantitative result ofeach pellets
3 讨论
由疾病等原因引起关节软骨损伤的修复一直是医学界面临的难题。以种子细胞为依托的组织工程的出现为软骨再生提供了新的方法,其中骨髓间充质干细胞(bone mesenchymal stem cell,BMSC)和ADSC的研究最为广泛。虽然有研究[10]认为,在TGF-β3与BMP-2存在时,BMSC较ADSC有更强的成软骨潜能,但对于相对缺血、缺氧的关节软骨微环境而言,ADSC更能耐受缺氧及无血清等引起的凋亡,同时来源广泛及含量丰富等优势,使ADSC的研究更具临床价值。
三维的立体环境对构建组织工程软骨非常重要[11]。Yoon等认为,ADSC三维培养较单层培养成软骨能力增强的原因可能是3D微环境增加了细胞间的交流,同时轻度缺氧激活了p-p38、AKT和 HIF-1a信号通路,从而增强了SOX-9表达[12]。本OHP结果显示ADSC微球分泌大量的GAG和胶原,与阴性对照组形成对比(P<0.05)。实验中还发现,所有实验组(AC阳性对照组除外)的微球周围均有不同程度的空泡,而在微球中心则很少发生这种情况。这也许是微球中心缺氧微环境有利于诱导,而周围暴露于正常氧环境,使得诱导后的ADSC肥大进而凋亡。笔者的猜想来自于Ville等的结论[13]。
关于MSCs与软骨细胞共培养在体外构建软骨组织的研究已经很多[14-17],有单层混合共培养[14]、细胞离心微球共培养[15]和三维支架共培养[16]。因为这些研究中两种细胞群有直接的细胞接触,所以难以区分检测到的软骨特异性信号的起源。此外,以往大多数共培养实验依赖TGF-β以确保MSC的软骨向分化[15-16],因此对单纯软骨细胞能否驱动MSCs的分化并不明确。而最近的一项研究表明,在没有外源性诱导因子的情况下,来源于骨关节炎患者的ACs可以单独诱导MSCs发生软骨向分化[17],笔者的实验也证明了这点。建立MSCs与软骨细胞的最佳比例,是构建高质量组织工程的关键。在共培养时,不同的细胞来源以及实验条件都可能导致不同的最佳比率[18]。将人类髓核(NPs)细胞与人BMSCs直接共培养时,发现两者比例为3∶1时软骨特异性标志物表达最多,而进行间接共培养时比例不同则无差异。Fischer等共培养ACs与BMSCs时发现,当两者比例为2∶1时,COL-Ⅱ的基因比例最高[15]。Yang等发现,在没有细胞直接接触的情况下,当ACs/MSCs为63∶1时,共培养的MSCs在细胞形态、行为和表型最接近AC[19]。在本研究中发现,微球Transwell间接共培养ADSC与AC时,发生软骨向分化的最佳比例为1∶5。而随着AC比例的增加,软骨特异性细胞外基质并未接着升高,可能是因为比例为5∶1时,AC分泌的可溶性因子的量已经达到了可以触发ADSC发生有效软骨向分化的剂量。在这种情况下,继续增加AC的比例显得意义不大,而且较大的细胞量还可能影响营养物质的供给。
作为软骨细胞最特异的表面标志,GAG及Ⅱ型胶原的表达水平反映了ADSC发生软骨向分化的情况,而随着未成熟的软骨细胞分化成肥大软骨细胞并分泌Ⅹ型胶原,也意味着软骨内成骨的开始[20]。传统应用ADSC作为种子细胞时,经常添加生长因子诱导其软骨向分化。然而,最完美的生长因子及作用机制、甚至有效剂量都还处于探索阶段。最大的问题是,这种培养模式在使软骨特异性细胞外基质表达上调的同时,也上调了X型胶原等软骨肥大的标志,使形成的新生软骨短时间就发生钙化、微骨化、纤维化以及微血管浸润,不能形成稳定的透明软骨[21]。研究[22]证实,将软骨细胞与MSC共培养,可以抑制诱导后干细胞的早期肥大问题[23]。本实验设置了生长因子对照组(10ng/ml TGF-β3+10ng/ml BMP-6),想观察所谓最好的成软骨诱导剂[3]与最适比例的共培养组相比,成软骨效能有何差异。实验结果表明,AC-ADSC 比为5∶1时,单位质量所产生的GAG及总胶原的含量上甚至达到了生长因子诱导组的水平(P>0.05),但是在Ⅹ型胶原表达方面却明显降低,笔者对Ⅹ型胶原基因的PCR检测结果也证实了这点(数据没有显示)。研究证实,共培养使ADSC发生软骨向分化的同时,还能抑制诱导后干细胞的早期肥大问题,是一种更为高效简捷的诱导方法。
4 结论
结果显示,能够使ADSC最大程度地表达软骨特异性细胞外基质,同时使COL-Ⅹ等软骨肥大标志无明显上调的ADSC与AC的比例为1∶5,同时证实共培养诱导较生长因子能够抑制ADSC软骨向分化后的肥大问题。然而,实验仅检测了诱导后ADSC的数据,没有对AC微球的变化进行分析,这是一个不完善的地方。同时,更高比例的软骨细胞(AC-ADSC=7∶1)共培养时软骨特异性细胞外基质没有继续增加的具体原因还有待进一步探索,也许在通过更全面的定性和定量检测共培养液中生长因子种类和含量后可以给出一些答案,但是实际上的可操作性也是有限的,这涉及到进一步的mRNA的内容,探讨共培养的更深层次的分子机制是下一步的研究内容。
(致谢 感谢吉林大学第一医院转化所王平教授对实验操作所做的指导,感谢吉林大学口腔医院孙宏晨教授对实验设计的指正。)
[1] Gimble JM, Bunnell BA, Chiu ES, et al. Concise review: adipose-derived stromal vascular fraction cells and stem cells: let′s not get lost in translation[J]. Stem Cells, 2011, 29(5):749-754.
[2] 赵明璨,刘畅.脂肪干细胞在软骨组织工程中的研究进展[J].中国生物医学工程学报, 2014, 33(4): 475-481.
[3] Sukarto A, Yu C, Flynn LE, et al. Co-delivery of adipose-derived stem cells and growth factor-loaded microspheres in RGD-grafted N-methacrylate glycol chitosan gels for focal chondral repair [J]. Biomacromolecules, 2012, 13(8): 2490-2502.
[4] Hildner F, Peterbauer A, Wolbank S, et al. FGF-2 abolishes the chondrogenic effect of combined BMP-6 and TGF-beta in human adipose derived stem cells[J]. Journal of Biomedical Materials Research, 2010, 94(3): 978-987.
[5] Freyria AM, Mallein GF. Chondrocytes or adult stem cells for cartilage repair: the indisputable role of growth factors [J]. Injury, 2012, 43(3):259-265.
[6] Hamid AA, Idrus RB, Saim AB, et al. Characterization of human adi-pose-derived stem cells and expression of chondrogenic genes during induction of cartilage differentiation [J]. Clinics, 2012, 67(2):99-106.
[7] Acharya C, Adesida A, Zajac P, et al. Enhanced chondrocyte proliferation and mesenchymal stromal cells chondrogenesis in coculture pellets mediate improved cartilage formation [J]. Cell Physiol, 2012, 227(1):88-97.
[8] Wu L, Prins HJ, Helder MN, et al. Trophic effects of mesenchymal stem cells in chondrocyte co-cultures are independent of culture conditions andcell sources[J].Tissue Eng, 2012, 18 (15-16): 1542-1551.
[9] Estest BT, Diekman BO, Gimble GM, et al, Isolation of adipose derived stem cells and their induction to a chondrogenic phenotype[J].Nat Protoc, 2010, 5(7): 1294-1311.
[10] Ronzière MC, Perrier E, Mallein GF,et al. Chondrogenic potential of bone marrow- and adipose tissue-derived adult human mesenchymal stem cells [J]. Bio-medical Materials and Eengineering, 2010, 20(3):145-158.
[11] Wu SC, Chang JK, Wang CK, et al. Enhancement of chondrogenesis of human adipose derived stem cells in a hyaluronan-enriched microenvironment[J]. Biomaterials, 2010, 31(4):631-640.
[12] Yoon HH, Bhang SH, Shin JY, et al. Enhanced cartilage formation via three-dimensional cell engineering of human adipose-derived stem cells [J]. Tissue Eng,2012,18(19-20):1949-1956.
[13] Ville VM, Rebecca LD, Sarah W, et al. The effect of hypoxia on the chondrogenic differentiation of cocultured articular chondrocytes and mesenchymal stem cells in scaffolds [J]. Biomaterials, 2013, 34(3): 4266-4273.
[14] Chen WH, Lai MT, Wu TH, et al. In vitro stage-specific chondrogenic of mesenchymal stem cells committed to chondrocytes [J]. Arthritis Rheum, 2009, 60(7): 450-459.
[15] Fischer J, Dickhut A, Rickert M, et al. Human articular chondrocytes secrete parathyroid hormone-related protein and mesenchymal stem cells in coculture during chondrogenesis[J]. Arthritis Rheum, 2010,62 (9):2696-2706.
[16] Bian L, Zhai DY, Mauck R,et al. Coculture of human mesenchymal stem cells and articular chondrocytes reduces hypertrophy and enhances functional properties of engineered cartilage[J]. Tissue Eng Part A, 2011,17 (8):1137-1145.
[17] Aung A, Gupta G, Majid G, et al. Osteoarthritic chondrocyte-secreted morphogens induce chondrogenic differentiation of human mesenchymal stem cells [J]. Arthritis Rheum, 2011, 63 (6):148-158.
[18] Richardson SM, Walker RV, Parker S, et al. Intervertebral disc cell-mediated mesenchymal stem cell differentiation [J]. Stem Cells, 2006, 24 (3):707-716.
[19] Yang YH, Lee AJ, Barabino GA, et al.Coculture-driven mesenchy stem cell-differentiated articular chondrocyte-like cells support neocartilage development [J]. Stem Cells Transl Med, 2012, 1 (11):843-854.
[20] Shen G. The role of type X collagen in facilitating and regulating endochondral ossification of articular cartilage [J]. Orthod Craniofac Res, 2005, 8(1):11-17.
[21] Pelttari K, Winter A, Steck E, et al. Premature induction of hypertrophy during in vitro chondrogenesis of human mesenchymal stem cells correlates with calcification and vascular invasion after ectopic transplantation in SCID mice[J]. Arthritis Rheum, 2006,54(3):3254-3266.
[22] Meretoja VV, Dahlin RL, Kasper FK, et al.Enhanced chondrogenesis in co-cultures with articular chondrocytes and mesenchymal stem cells [J]. Biomaterials, 2012, 33(27):6362-6369.
[23] Hwang NS, Im GI, Wu PB, et al. Chondrogenic priming adipose-mesenchymal stem cells for cartilage tissue regeneration [J]. Pharm Res, 2011, 28(6): 1395-1405.
An Experimental Study on Optimal Ratio of Chondrogenesis in Pellet Co-Culture of Adipose-Derived Stem Cells and Chondrocytes Differentiation in Rabbits
Zhao Mingcan1Yang Wu1Liu Chang1,2*
1(SchoolofStomatology,JilinUniversity,Changchun130021,China)2(LaboratoryofOralMedicine,GuangzhouInstituteofOralDisease,StomatologyHospitalofGuangzhouMedicalUniversity,Guangzhou510140,China)
The aim of this work was to figure out the optimal ratio of adipose-derived stem cells (ADSCs) to articular chondrocyte (AC) (ADSCs/AC)in the chondrogenesis effect through indirectly co-culture pellets of ADSCs and AC. Isolate and cultivate ADSC and chondrocytes to form pellets that were placed into upper and lower layers of tranwell system. Experiments included positive control group, negative control group, growth factor control groupand ADSC and chondrocytes pellets in different ratios (0.5∶1; 1∶1; 1∶2; 1∶3; 1∶5; 1∶7) groups. After 28 days of culture,histological morphology, protein level of GAG, COL-II and COL-X were examined. Results: Toluidine blue staining and collagen typeII displayed 0.5∶1 and 1∶1 groups showed weak positive staining. The collagen X in the growth factor group showed the most strong positive staining; DMMB showed that the total GAG content in co-culture groups increased when compared with that of the control group (P<0.05),while decreased whenthe ratio of ADSC/AC reached 1∶5. Results obtained from OHP measurements howed the variation tendency of total collagen was similar to the change tendency of GAG. Conclusions: The optimal ratio that made adipose derived stem cells expressed the maximum cartilage specific extracellular matrix was 1∶5. The co-culture inhibited the hypertrophic problem when compared with growth factor induction.
adipose-derived stem cell;chondrocyte;co-culture;growth factor
10.3969/j.issn.0258-8021. 2016. 05.009
2015-11-06, 录用日期:2016-07-05
吉林省科技发展计划项目(20140204022SF);广东省教育厅省级高等教育“创新强校工程”专项资金(B16036087);长春市重大科技攻关项目 (13KG45)
R318
A
0258-8021(2016) 05-0570-07
*通信作者(Corresponding author), E-mail: lcwztt@gmail.com
