骨髓间充质干细胞复合海螵蛸支架的部分生物学安全性评估
2016-02-16顾春松易洪城
彭 雅 覃 裕 顾春松 易洪城*
1(贵州省骨科医院骨内二科,贵阳 550002)2(贵阳中医学院第二附属医院骨二科,贵阳 550002)
骨髓间充质干细胞复合海螵蛸支架的部分生物学安全性评估
彭 雅1覃 裕1顾春松2易洪城2*
1(贵州省骨科医院骨内二科,贵阳 550002)2(贵阳中医学院第二附属医院骨二科,贵阳 550002)
制作与鉴定自体兔骨髓间充质干细胞-海螵蛸复合支架,进行生物学安全性评估。采用密度梯度离心联合贴壁筛选法,体外培养兔骨髓间充质干细胞(BMSCs);采用沉淀法,构建BMSCs-海螵蛸复合支架;通过电镜扫描及MTT试验,对复合支架进行检测。选取40只新西兰兔, 分两组分别植入BMSCs-海螵蛸复合支架(试验组)或海螵蛸支架(对照组),通过肌肉植入试验评估复合支架的生物学安全性。密度梯度离心联合贴壁筛选分离培养出干细胞,其免疫细胞化学检测表面抗原CD29(+)。电镜扫描测得海螵蛸支架孔隙率为81.730%±6.770%。扫描电镜下见细胞黏附于海螵蛸支架爬行生长,分泌胞间基质。MTT检测:复合培养第1、3、5、7天之间吸光值两两比较,均有显著性差异(P<0.05),细胞呈逐渐增殖趋势;第7、8天比较无显著差异,表明第8天细胞无明显增殖。肌肉植入试验的血常规、血生化检测,复合支架组(试验组)与海螵蛸组(对照组)检测结果无显著差异,复合支架的各项指标达标。病理切片:第7天,试验组与对照组的组织炎症反应为III~IV级;第14天,二者的组织炎症反应为II~III级;第28天,二者的组织炎症反应为I~II级;第56天,二者的组织炎症反应为0~I级:均符合肌肉植入试验结果评定标准。自体BMSCs能与中药海螵蛸联合培养构建复合支架,支架上的细胞数量随培养时间延长而增多,第7天时达增殖高峰。研究表明,此复合支架的组织相容性良好,符合生物材料的应用要求。
兔骨髓间充质干细胞;海螵蛸;复合支架;生物安全性;骨组织工程
引言
骨组织工程是一门融合了工程学、细胞学、组织生物学等多方面知识的高新学科[1]。 将自体细胞或干细胞转移至生物支架材料上,经体内或体外培养扩增,形成细胞/材料三维空间复合体,植入骨缺损位置,替代、修复组织缺损,促进骨再生。就目前而言,将细胞与中医中药构建复合支架的报道并不多见。中药海螵蛸[2]为乌贼科动物多种乌贼的内壳,乌贼骨中含有丰富的矿物质及微量元素,且孔隙发达, 已被作为支架材料做过相关研究[3-5]。 骨髓来源的骨髓间充质干细胞(BMSCs),较容易向成骨方向定向诱导和分化,取材方便,增殖能力强,易于操作,同种异体BMSCs移植免疫排斥反应较弱,分离和使用也不存在伦理学问题,因此常被作为骨组织工程种子细胞的首要选择。
本试验是建立在对兔自体骨髓、海螵蛸及玻璃酸钠联合修复兔桡骨缺损研究[6-7]基础上的进一步改良,体外构建自体BMSCs-海螵蛸复合生物支架,参照《医疗器械生物学评价标准》[8],通过肌肉植入试验,对复合支架进行生物安全性评估,为下一步修复骨缺损研究打下基础。
1 材料和方法
1.1 材料
试验试剂:DMEM 培养液(LG、F/12),Hyclone公司;胎牛血清、0.25%胰蛋白酶,Gibco 公司;兔骨髓干细胞分离液试剂盒、兔CD29抗体,天津灏洋公司。实验动物:清洁级新西兰大白兔50只,雌雄不限,体重2.5 kg左右,购于贵阳医学院实验动物中心,许可证号SCXK(黔)2013-001。实验中药材:海螵蛸,贵阳中医学院第二附属医院中药房提供。
1.2 方法
1.2.1 BMSCs制备[9]
10%水合氯醛腹腔麻醉白兔,髂后上棘处骨髓穿刺,抽骨髓4 mL,采用兔骨髓干细胞分离试剂盒提取细胞,密度梯度离心联合贴壁法培养BMSCs。取3~4代BMSCs进行实验。
1.2.2 孔隙率检测
1)横断截取海螵蛸,脱脂脱蛋白,环氧乙烷熏蒸消毒,备用。
2)采用孔隙率检测-压酒精法[10],取5个海螵蛸样品支架(φ3 mm×10 mm,已消毒烘干)进行检测:电子天平称重,5个海螵蛸支架样品总重W0;比重瓶倒满100%酒精,称重W1;将5个海螵蛸支架样品浸入100%酒精,待充分脱气,使酒精完全充盈于复合物样本微孔中,加满酒精称重W2;取出海螵蛸样品,称取剩余酒精与比重瓶的和重,记为W3。孔隙率ε可表示为
计算5次,取其平均值。
1.2.3 BMSCs-海螵蛸复合支架构建
采用沉淀法[11],构建BMSCs-海螵蛸复合支架。选P3代BMSCs,制成细胞悬液,调整密度5×105个/mL。将BMSCs接种于24孔板中海螵蛸(φ3 mm×10 mm)上,复合培养8 d,2~3 d换液一次。
1.2.4 细胞表型鉴定[12]
取P3代细胞,制作细胞爬片,采用免疫细胞化学鉴定法,检测细胞表面标志抗原CD29,用PBS溶液替代一抗样品,作为空白对照组。光学显微镜下观察细胞显色情况,摄影。
1.2.5 BMSCs-海螵蛸复合支架鉴定
1)扫描电镜鉴定。将复合支架固定后,置于扫描电镜下观察。
2)MTT检测[13]。海螵蛸支架30个(φ3 mm×3 mm,已消毒), 分别置入5个无菌96孔板内,6个/板。同上方法,调整P3 代BMSCs密度5×104/mL,接种于海螵蛸上,复合培养。分别于第1、3、5、7、8 d,取出相应培养板,采用MTT检测法,在酶联免疫检测仪上测量各孔的吸光值(检测波长调节为490 nm)。计算各时相点吸光度平均值,绘制细胞增殖曲线(横坐标为时间,纵坐标为吸光值)。
1.2.6 肌肉植入试验[14-15]
对BMSCs-海螵蛸复合支架进行安全性评估。健康新西兰兔,40只,随机分为试验组及对照组,编号记录。麻醉白兔,术区脱毛,消毒铺敷,于脊旁1.5 cm处做1~2 cm纵形切口,钝性分离肌肉组织,深度为1~2 cm,分别植入BMSCs-海螵蛸复合支架(试验组)或海螵蛸支架(对照组),缝合,一周后拆线。术后注射适量青霉素,以防止感染。于7、14、28、56 d进行检测观察,一是血常规及肝肾功能检测,二是病理切片检测。于术后第7、14、28、56 d,切取支架周围0.5~1.0 cm厚肌肉组织,行病理切片观察,结果评价见表1、2。

表1 炎性细胞反应分级

表2 肌肉植入试验结果评定参考标准
主要观察指标如下:
1)海螵蛸支架孔隙率检测;
2)免疫细胞化学检测表面抗原CD29;
3)BMSCs-海螵蛸复合支架电镜扫描;
4)复合支架MTT生长曲线;
5)安全性评估肌肉检测试验结果是否符合《医疗器械生物学评价标准》。
2 结果
2.1 海螵蛸孔隙率检测
组织工程中对支架材料的要求之一就是具有多孔性,以促进细胞的黏附、爬行、生长和分化。本试验测得海螵蛸支架孔隙率为81.730%±6.770%(见表3),较符合文献要求[16]。
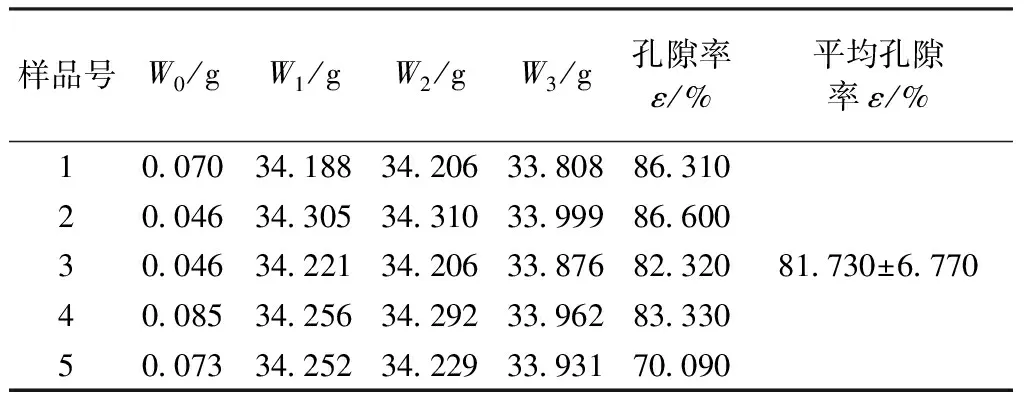
表3 海螵蛸支架的孔隙率测定值
2.2 表面抗原CD29检测
经免疫细胞化学染色,可见绝大部分细胞胞浆为棕红色或棕褐色,表明细胞表面抗原CD29呈阳性(见图1)。此结果与文献报道一致[16],说明本实验提取纯化的细胞是骨髓间充质干细胞,不是成纤维细胞或造血干细胞。

图1 BMSCs表面抗原CD29免疫细胞化学染色结果(光学显微镜100×)Fig.1 Immunoctochemistry Detection-Surface antigen CD29. Optical microscope (100×)
2.3 复合支架结构观察
如图2所示,BMSCs与海螵蛸支架复合培养第5天,经扫描电镜观察,见细胞爬行于海螵蛸支架表面,胞浆突起,逐渐伸出片状伪足,形态以椭球形、多角形、梭形为主,细胞周围有细胞外基质产生,但细胞生长区域较分散,在黏附数量上效果欠佳。
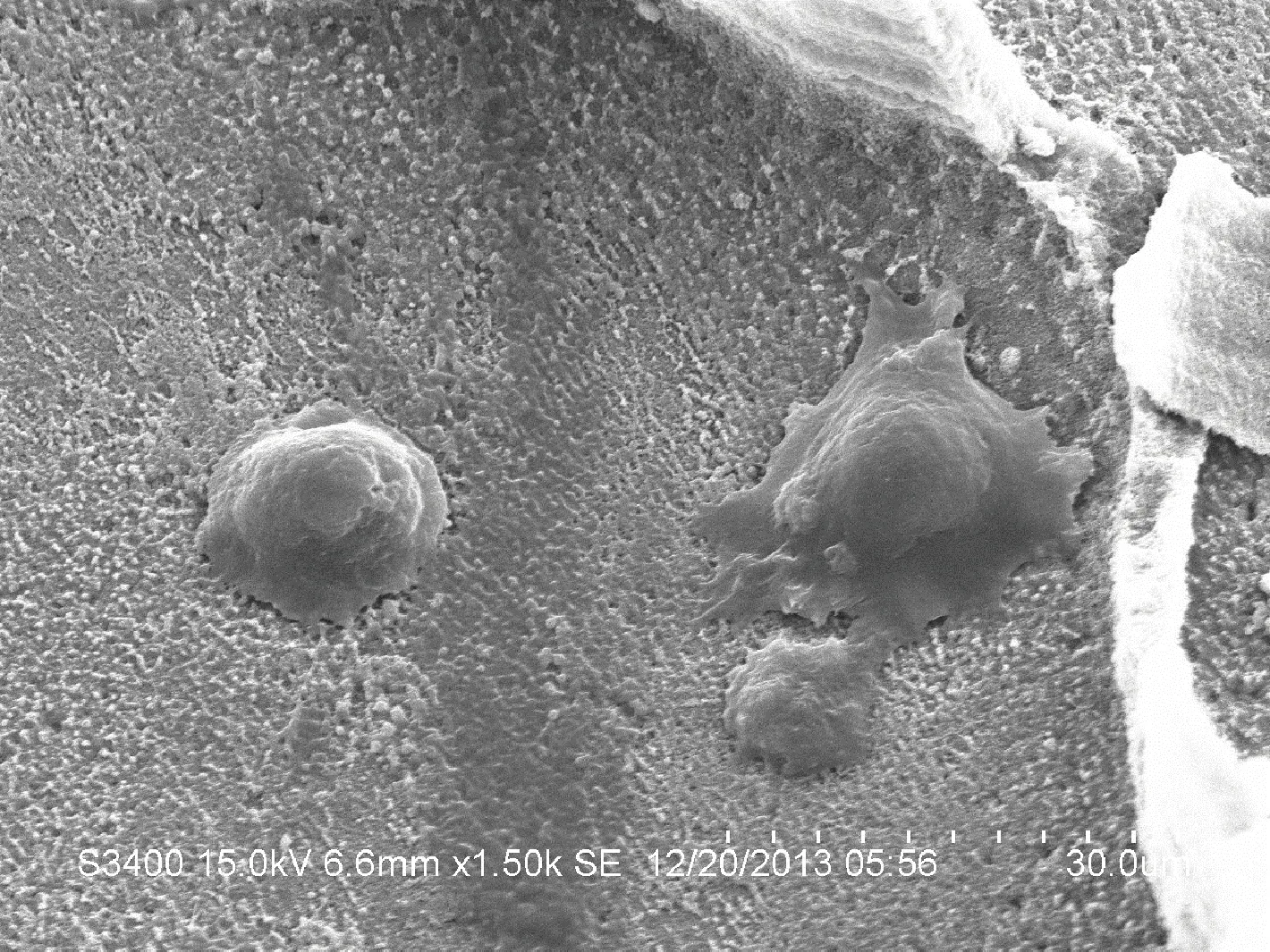
图2 复合支架扫描电镜图(1500×)Fig.2 Scanning electron microscopy test of BMSCs-cuttlebone composite scaffold(1500×)
2.4 复合支架MTT检测
第1、3、5、7 d之间吸光值两两比较,P<0.05,各组间数值存在差异,有统计学意义,细胞呈逐渐增殖趋势;第7、8 d比较,P>0.05,无统计学差异,第8 d细胞无明显增殖(见表4)。
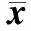
表5 骨髓间充质干细胞-海螵蛸生物支架(实验组)和海螵蛸支架(对照组)植入兔肌肉后不同时相点对血常规的影响(n=5,±S)
注:各指标内,*与对照组同时相点值相比较,P<0.05。
Note:*compared with the control group at the same phase point,P<0.05.
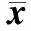
表4 各时间点上各组吸光度值及细胞相对增值率(n=6,±S)
注:*与第1 d比较,P<0.05;#与第3 d比较,P<0.05;△与第5 d比较,P<0.05。
Note:*with the day 1 comparativeP<0.05.#with the day 3 comparativeP<0.05;△with the day 5 comparativeP<0.05.
图3的细胞生长曲线显示:第1 d,细胞数量较少,但有开始增殖的趋势;第1~3 d,细胞进入对数增长期;第3~5 d,细胞仍能继续保持增殖趋势;第7 d,细胞数量达最高值;第7~8 d,细胞增殖速度减慢,开始呈下降趋势。
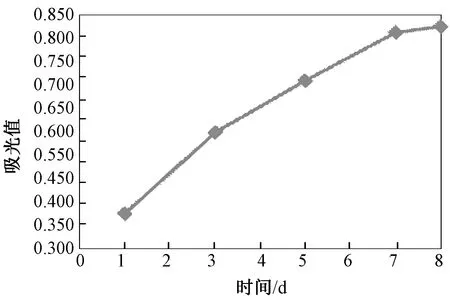
图3 细胞生长曲线Fig.3 The cell growth curve
2.5 安全性评估检测
2.5.1 肌肉植入术后血液检测结果
随着术后时间延长,到第8周时血液常规、血生化检测值基本达到正常参考值[18-19]范围,且在不同时相点两组间各指标值大部分无明显差异(见表5、6)。这说明,BMSCs-海螵蛸复合支架未对白兔肌肉组织产生明显的排斥反应及肝肾功能损害。
2.5.2 肌肉植入试验组织切片病理学检查结果
支架材料周围肌肉组织切片HE染色结果如图4所示,可看出BMSCs-海螵蛸复合支架与海螵蛸支架检测结果无明显差异。植入7 d后,炎症反应程度为Ⅲ~Ⅳ级≤Ⅳ级;植入14d,炎症反应程度为Ⅱ~Ⅲ级≤Ⅲ级;植入28d,炎症反应程度为Ⅰ~Ⅱ级≤Ⅱ级;植入56d,炎症反应程度为0~Ⅰ级≤Ⅰ级。这与文献报道[19]相仿。结果显示,骨髓间充质干细胞-海螵蛸复合支架符合肌肉植入试验结果评定标准,具有较好的组织相容性。
表6 骨髓间充质干细胞-海螵蛸复合支架(实验组)和海螵蛸支架(对照组)植入兔肌肉后不同时相点对肝功能、肾功能的影响(n=5,±s)
注:各指标内,*与对照组同时相点值相比较,P<0.05。
Note:*compared with the control group at the same phase point,P<0.05.

图4 不同植入时间病理检测(20×)。(a)第1周复合支架组;(b)第1周海螵蛸支架组;(c)第2周复合支架组;(d)第2周海螵蛸支架组;(e)第4周复合支架组;(f)第4周海螵蛸支架组;(g)第8周复合支架组;(h)第8周海螵蛸支架组Fig.4 Pathological detection of different implantation time(20×).(a)Composite scaffold group for first week;(b)Cuttlebone group for first week;(c)Composite scaffold group for second week;(d)Cuttlebone group for second week;(e)Composite scaffold group for the fourth week;(f)Cuttlebone group for the fourth week;(g)Composite scaffold group for the eighth week;(h)Cuttlebone group for the eighth week
3 讨论
骨组织工程的出现为骨缺损的修复提供了新思路,它主要分为3个基本阶段:自体或异体分离、提取、扩增靶细胞;将细胞接种于适合的支架上,形成细胞/支架复合物(CSC);将CSC植入动物试验靶部位,进行相关处理,最终修复缺损。整个过程主要包含3个主要因素:起支架作用的载体材料、引导组织构建分化的种子细胞,以及组织形成过程中在各机制系统间起联络传递作用的信号分子。
载体支架材料的选择对骨组织再生与构建至关重要,本实验选择中药海螵蛸作为支架材料主要从以下几方面考虑:
1)结合国情,创新思路,挖掘中药新用法。海螵蛸是海洋生物乌贼的内壳,性微温,味咸、涩,具有收涩、止血、固精、敛疮的作用,归于肝肾二经,“肝在体合筋,肾在体主骨”,肝血充盈能濡养筋骨,肾精充足能主骨生髓。中药海螵蛸的补益肝肾作用,对骨质的生长有推动和促进作用。
2)立足于文献,有前期实验基础。本课题组以往就曾对兔自体骨髓移植、海螵蛸及玻璃酸钠联合治疗骨缺损的作用做过相关试验研究,并取得了较好的效果。因此,综合前人实验成果,选用海螵蛸作为组织工程支架修复骨缺损,具有一定的可行性。
3)海螵蛸含有多样成分,具有较高的研究价值。海螵蛸(cuttlebone)[20]中含有碳酸钙、壳角质、黏液质、磷酸钙、氯化钠和10多种无机元素,以及17种氨基酸[21],同时还含有作为支架材料相当重要的元素——甲壳素[22]。甲壳素是源于动物的天然多糖,是一种能完全降解的生物材料,临床上也可作为可吸收手术缝合线的原料。由此可见,海螵蛸具有较良好的可吸收降解性能。
4)结构适宜,孔隙发达。海螵蛸支架内部具有相互连通的多孔隙结构,是促进新骨形成的重要条件。本实验测得,海螵蛸的孔隙率为81.730%±6.770%。根据研究报道,载体材料孔隙率需达到80%以上,才利于细胞的爬行黏附[17],才利于骨组织的形成及新生组织的爬行替代。
在生物学评估方面,BMSCs-海螵蛸复合支架的各项生物学指标均符合应用要求。肌肉植入试验显示,两组新西兰白兔的血常规、肝功能、肾功能检查在8周试验期内均逐渐达到正常参考值,且两组间的检测结果大部分未见明显差异(P>0.05)。病理学检查显示,随着时间延长,材料周围肌肉组织的炎症反应逐渐减轻,组织结构逐步恢复正常,符合肌肉植入试验结果评定标准,显示BMSCs-海螵蛸复合支架具有良好的组织相容性,符合生物组织工程支架应用标准。
4 结论
综合上述实验及检测,可以得出以下结论:自体BMSCs能与中药海螵蛸联合培养构建复合支架,且此复合物组织相容性良好,符合生物材料应用要求,在骨组织工程修复骨缺损方面具有较大的研究价值和广阔的应用前景。
[1] Bran GM, Sterr-Straeter, Hrmann K, et al.Apoptosis in bone for tissue engineering [J]. Arch Med Res,2008, 39(5) : 467-485.
[2] 肖培根.新编中药志[M].北京:化学工业出版社,2006.
[3] 刘艺,张安桢,王和鸣,等.海螵蛸接骨的动物实验研究[J].福建中医药,1988,19(3):49.
[4] 刘永刚,赵富花,何进来.海螵蛸的研究概况[J].时珍国医国药,2005,16(1):72-73.
[5] 周蔚,吴海涛,李采,等.海螵蛸作为组织工程支架材料的实验研究[J].复旦学报:医学版,2007,34(3):438-441.
[6] 易洪城,唐良华,张雪鹏.自体骨髓移植、海螵蛸与玻璃酸钠联合治疗骨缺损的试验研究[J].中国中西医结合杂志,2011,31(8):1122-1126.
[7] 张雪鹏.经皮自体骨髓移植、海螵蛸与玻璃酸钠联合治疗骨缺损的动物实验研究[D].贵阳:贵阳中医学院,2006.
[8] 由少华.解读GB/T16886《医疗器械生物学评价》系列标准[J].中国医疗器械信息,2005,11(1):15-19.
[9] 彭雅,顾春松,易洪城. 全骨髓贴壁培养兔骨髓间充质干细胞的初步研究[J].黔南民族医专学报,2013,26(3):157-161.
[10] 宋世锋,彭磊,王臻. 三维多孔复合人工骨的制备及性能检测[J].中国矫形外科杂志,2009,17(12):928-930.
[11] 裴国献,魏宽海,金丹.组织工程学实验技术[M].北京:人民军医出版社,2006:190-191.
[12] 林春博,杨渊源,陈维平.低渗结合自然沉降法分离兔骨髓间充质干细胞及其鉴定[J].中国组织工程研究与临床康复,2011,15(1):12-16.
[13] 尹航,王晓东,张亚,等. 兔骨髓间充质干细胞复合两种材料体外生物相容性的比较[J].中国矫形外科杂志,2006,14(20):1571-1573.
[14] ISO 10993—6:2007.Biological evaluation of medical devices: part 6:Tests for local effects after implantation[S]. 1994.
[15] GB/T16886—6.医疗器械生物学评价标准:第6部分:植入后局部反应实验[S]. 北京:中国标准出版社,1997.
[16] 俞猛.骨组织工程支架材料修复骨缺损的特性[J].中国组织工程研究与临床康复,2010,14(47):8869-8872.
[17] 李爽,朱家源,朱斌,等.大鼠骨髓间充质干细胞的体外分离培养及其生长特性和表型[J].中华实验外科杂志,2007,24(12):1601.
[18] 施新猷.现代医学试验动物学[M].北京:人民军医出版社,2000: 60;113.
[19] 张玲.新西兰雄兔部分血液生化指标正常值测定[J].实验动物科学与管理,2001,18(4):41-43.
[20] 周蔚,吴海涛,李采.海螵蛸作为组织工程支架材料的实验研究[J].复旦学报:医学版,2007,34(3):438-441.
[21] 中国药用动物志协作组.中国药用动物志:第一册[M].天津:天津科学技术出版社,1979:44.
[22] 赵忠杰,江佩芬,李昂. 海螵蛸中碳酸钙、微量元素和氨基酸的测定[J]. 中国中药杂志,1990,15(1):41-43.
Safety Assessment of Bone Marrow Mesenchymal Stem Cells-Cuttlebone Composite Scaffold
Peng Ya1Qin Yu1Gu Chunsong2Yi Hongcheng2
1(GuizhouProvinceOsteologicalHospital,Guiyang550002,China)2(TheSecondAffiliatedHospitalofTraditionalChineseMedicine,Guiyang550002,China)
This study is aimed to conduct fabrication and safety evaluation for the rabbit BMSCs-Cuttlebone composite scaffold. BMSCs were separated by density gradient centrifugation and adherence screening method. The BMSCs-Cuttlebone scaffold was cultivated by precipitation method. The composite scaffold was examined by SEM observation and cell viability assay (MTT test). The biological safety of the composite scaffold was evaluated through muscle implantation test. A total of 40 New Zealand rabbit were randomly divided into two groups, and then BMSCs-cuttlebone scaffold (experimental group) or cuttlebone (control group) were implanted. BMSCs of CD29 positive were obtained by the method of density gradient centrifugation effectively. Scanning electron microscope observation showed that the porosity of cuttlefish bone scaffold was 81.730%±6.770%. The cells adhered on the cuttlebone bracket creeping growth and secreted extracellular matrix. Results obtained from MTT assay showed that the number of viable cells on scaffold increased over time. On the day 1, 3, 5, 7 of cultivation, the cells kept proliferating; while on the day 7 and 8, the proliferation decreased and almost stopped on the day 8. Muscle implantation test showed no significant difference existed between the composite scaffold (experimental group) and cuttlebone group (control group) in the blood routine and blood biochemical tests. In the pathological observation, on the day 7, tissue inflammation grade III-IV for both experimental group and control group; on theday 14, the tissue inflammation grade was II-III for the two groups; on the day28, the tissue inflammation was I-II for the two groups; on the day 56, the tissue inflammation was 0-I grade for the two groups; all of which were within the limit of standard. The rabbit BMSCs could be co-cultured with cuttlebone to build complex biological scaffold. The cells embedded in the scaffold kept proliferation for 7 days. The composite scaffold exhibited good biocompatibility in the muscle implantation test.
rabbit bone marrow mesenchymalstem cells;cuttlebone; composite scaffold;biologicalsafety assessment;bone tissue engineering
10.3969/j.issn.0258-8021. 2016. 05.007
2015-11-30, 录用日期:2016-07-18
贵阳市科技局2013社会发展与民生科技计划(2013103-40);贵州省教育厅自然科学研究项目(黔教育KY发(2012)040号)
R318
A
0258-8021(2016) 05-0555-07
*通信作者(Corresponding author), E-mail: yihongcheng223@sina.com
