HA-bPEI纳米颗粒携带Atoh1质粒豚鼠耳蜗转染观察
2016-02-15王方园陈志婷3邓雄威吴雁张悦杨风波杨仕明吴南
王方园陈志婷,3邓雄威吴雁张悦杨风波杨仕明吴南
1解放军总医院耳鼻咽喉研究所聋病教育部重点实验室(北京100853)
2国家纳米科学中心(北京100190)
3首都医科大学附属北京安贞医院耳鼻咽喉头颈外科(北京100029)
·基础研究·
HA-bPEI纳米颗粒携带Atoh1质粒豚鼠耳蜗转染观察
王方园1陈志婷1,3邓雄威2吴雁2张悦1杨风波1杨仕明1吴南1
1解放军总医院耳鼻咽喉研究所聋病教育部重点实验室(北京100853)
2国家纳米科学中心(北京100190)
3首都医科大学附属北京安贞医院耳鼻咽喉头颈外科(北京100029)
目的利用透明质酸(HA)修饰分支型聚乙烯亚胺(bPEI)纳米颗粒制备新型非病毒基因载体,包载Atoh1-EGFP质粒,检测其在活体豚鼠内耳的转染效率。方法质粒提取后按照COOH/N/P=4:10:1合成纳米载体基因复合物并进行表征。利用圆窗膜渗透的方法,导入实验动物耳蜗。术后7天,通过激光共聚焦扫描观察基底膜铺片和切片了解转染情况,并利用Western Blot和RT-PCR技术分别从蛋白和核酸水平验证转染结果。结果按照本研究实验方法可成功合成表面带有负电荷的纳米级别的基因载体复合物颗粒,导入实验动物耳蜗后7天取材,基底膜铺片的共聚焦显微镜观察结果显示:基底膜内外毛细胞可检测到绿色荧光蛋白显色,基底膜底转的转染效率达81.7±4.71%,中转可达33.8±9.02%。结合冰冻切片结果发现,表达的绿色荧光蛋白主要位于耳蜗底转和部分中转,顶转及内外毛细胞以外区域未见绿色荧光蛋白表达。基底膜细胞未见明显变形损伤。Western Blot和RT-PCR结果也验证了Atoh1基因在基底膜上的成功转染。结论HA修饰bPEI纳米颗粒制备基因载体可成功实现耳蜗的基因转染,且未见对基底膜细胞产生明显的毒性。合成简单、成本较低,是理想的内耳基因转染载体。
透明质酸;分支型聚乙烯亚胺;Atoh1基因;内耳基因转染
Funds by The National High-tech R$D Program of China for young Scientists(2014AA020510),National Basic Research Program of China (973 Program)(#2012CB967900),NationalMinistry ofscience and technology new drug creation majorproject (2014ZX09J14101-06C);National Natural Science Foundation of China(NSFC 81470700);Innovation and drive power engineering project of China association for science and technology(2016CXQD01)
Declaration of interest:The authors report no conflicts of interest
选择理想的基因载体一直是内耳基因治疗研究的难题[1]。理想的基因载体应该是既能靶向地进入目的细胞,又能在目的细胞内有效地释放目的基因,且不会对目的细胞产生与治疗无关的毒副作用。目前比较常见的基因载体是重组病毒载体。病毒类载体有很高的转染效率及较强的携带能力,可携带目的基因有效地进入靶细胞,但病毒类载体也有很明显的缺点,如有明显的细胞毒性及免疫原性,且易引起靶细胞基因重组,缺乏细胞类型选择性[2,3],大大限制了其进一步应用。因此,非病毒载体,包括阳离子脂质、阳离子聚合物等,由于其低成本、无免疫原性及修饰后的低毒性近年来逐渐成为耳科学及其他以再生为目的的基因治疗研究所需载体的新选择[4,5]。
既往针对耳蜗内基因转染的研究发现,仅有少量的非病毒载体可成功介导向耳蜗内的目的基因转染,但大都存在转染效率低下的问题[6-8]。本研究利用可生物降级的透明质酸(Hyaluronic acid,HA)修饰分支型聚乙烯亚胺(branched Polyetherimide,bPEI)纳米复合物颗粒,包载Atoh1-EGFP基因质粒,通过圆窗膜途径转染正常豚鼠耳蜗,观察其转染效率及可行性。
1 研究方法
1.1 试验对象及分组
采用北京维通利华实验动物技术有限公司提供的6~8周SPFⅡ级健康白色红目豚鼠6只,雌雄不限,体重200-250g,毛色健康,健康营养状况良好,耳镜下见双耳道清洁,鼓膜完整,粗测听力耳廓反应灵敏,由解放军医学院动物实验中心按照标准程序统一分笼饲养。选择右耳为术耳,对侧耳为对照组。实验开始前均进行ABR听力检测,听阈位于20-30 dB SPL。
1.2 纳米载体基因复合物制备及表征测定
Atoh1-EGFP质粒菌种由陈志婷博士(北京安贞医院)馈赠。摇菌后按照Invitrogen去内毒素质粒提取试剂盒说明书步骤提取质粒。测定质粒浓度,按照N/P=10:1将Atoh1-EGFP质粒及bPEI纳米颗粒等体积混溶于20 mM HEPES缓冲液中(PH=7.4),室温下涡旋反应20分钟,获得bPEI/Atoh1-EGFP复合物。再按照COOH/N/P=4:10:1向bPEI/Atoh1-EGFP复合物中加入HA,HA通过静电力与bPEI/DNA复合物结合,最终获得HA/bPEI/Atoh1-EGFP复合物。
将HA/bPEI/Atoh1-EGFP复合物纳米粒加入HEPES缓冲液进行稀释,至最终DNA浓度为3mg/ mL。在生理条件PH=7.4环境下利用Zetasizer粒径测定仪测试复合物粒径及Zeta电位测定。测试反复进行三次,取平均值。
取少量复合物混合液,滴在电镜观测所需的干净铜网上,过夜晾干。3%磷钨酸负染色,利用透射电子显微镜(transmission electron microscopy,TEM)观察复合物颗粒形态。
1.3 手术导入
实验对象予以水合氯醛(10%,0.45ml/100g)腹腔注射麻醉。刮除耳周毛发。实验动物呈左侧卧位,右侧耳向上,碘伏棉球消毒右侧耳周及耳廓。眼科剪以耳垂下约5mm处为切口中心横行剪开皮肤及皮下组织,钝性分离颞骨表面的肌肉组织,暴露听泡,于听泡表面打一1×1mm2小孔,显微镜下经小孔定位圆窗龛及其内的圆窗膜。将浸满纳米复合物的明胶海绵放置贴敷在圆窗龛,分层缝合组织。
1.4 基底膜冰冻切片、铺片及激光共聚焦显微镜观察
导入术后7天,实验动物麻醉(方法同前)后,迅速断头,快速分离取出听泡内耳蜗,置于4%多聚甲醛中4℃固定过夜。制备冰冻耳蜗切片前需10% EDTA脱钙1周,隔天换液一次,30%蔗糖溶液脱水48h,OCT包埋,利用冰冻切片机获得过蜗轴的耳蜗切片,层厚6μm。
制备基底膜铺片需要在倒置显微镜下,轻柔去除耳蜗表面蜗壳组织、血管纹、螺旋韧带及悬浮的前庭膜、盖膜。取出游离的基底膜。
基底膜切片及铺片DAPI染色前0.01M PBS漂洗2次,每次3分钟。加入细胞核染料DAPI,室温孵育10min,再用0.01M PBS洗2次,每次5min,将游离基底膜平铺于载玻片后甘油封片。取制备好的玻片,利用Zeiss 780共聚焦显微镜(confocal microscopy)观察EGFP表达绿色荧光蛋白的情况以了解Atoh1基因的转染情况。
1.5 Western blot检测
导入术后7天,按基底膜取材方法快速取出新鲜基底膜。放置于冷冻管中冷冻于液氮中。并在液氮环境下将耳蜗组织研碎,加入预先配制的蛋白裂解缓冲液中,轻轻晃动混匀。冰浴40min后收集蛋白提取液,4℃离心机中离心20min,(12000转/min)。吸取上清液,-80℃冷冻保存待用。
配置SDS-PAGE胶,吸取15ul样本,分别加入5ul 4×蛋白质凝胶电泳缓冲液混匀,98℃变性5min,即刻插入冰中,涡旋数秒,短暂离心。设置电泳仪,调整电压为80V,保持稳压状态,共运行约40min,使样品通过浓缩胶。观察染料进入胶面情况,当染料开始进入分离胶,再次调整电压,至120V,继续电泳约60min,直至染料分离,结束电泳。凝胶转膜及封闭,将Atoh1抗体按照说明书推荐浓度1:50封闭液稀释,进行抗体孵育及曝光,收集结果。
1.6 RT-PCR检测
实验动物处死以及基底膜取材方法同上。按照Invitrogen组织提取总RNA试剂盒的说明书提取总RNA,反转录合成cDNA,PCR扩增(94℃预变性5min-94℃变性30s-57℃退火30s,30个循环-72℃延伸 30s-72℃延伸 5min)。引物:F:5’-GGTA⁃AAAGAGTTGGGGGACC-3’; R: 5’ -TGGA⁃CAGCTTCTTGTCGTTG-3’.产物电泳测定结果。
1.7 统计学方法
每个基底膜标本的底、中、顶转上分别选取3个视野计算转染效率,视野下每100个细胞中计数成功转染细胞个数,计算均值及标准差,结果以平均值±标准差形式表示。
2 结果
2.1 纳米复合物表征结果
本研究利用HA进行修饰后,纳米基因载体复合物粒径约为220±9 nm,为纳米级别复合物。其Zeta电位测量结果显示为-25.2±1.9 mV,表面为负电荷。利用透射电镜对纳米复合物的形态进行观察发现,纳米复合物颗粒呈球形颗粒(图1),其粒径大小在100nm-600nm之间,这粒径仪测得的粒径大小一致。

图1 复合物透射电镜下形态学观察Fig.1 Morphology of Nanoparticle
2.2 纳米基因载体复合物介导Atoh1基因转染耳蜗情况
基底膜外毛细胞内EGFP绿色荧光蛋白表达可自底转一直到中顶转,除顶转外,余区域基底膜外毛细胞区域均可见绿色荧光蛋白表达,且在部分区域,外毛细胞的静纤毛也出现了绿色荧光蛋白的表达,通过计数统计可见目的基因在基底膜底转外毛细胞的转染效率达81.7±4.71%,中转可达33.8±9.02%。但内毛细胞内的绿色荧光蛋白仍只表达在中转以下,转染效率仅为8.9±1.85%(图2)。基底膜各区域细胞形态尚佳,核完整,未见明显损伤或死亡。
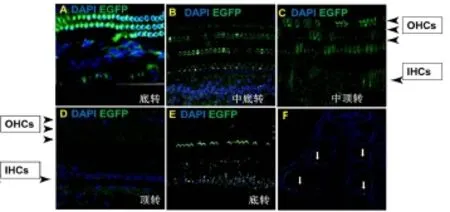
图2 外毛细胞内EGFP绿色荧光蛋白表达可自底转一直到中顶转,中转一下的内毛细胞区域也可见EGFP的表达(A-C),除顶转外(D),余区域基底膜均可见绿色荧光蛋白表达。在部分区域(E),外毛细胞的静纤毛也出现了绿色荧光蛋白的表达。冰冻切片(F)箭头为EGFP表达区域Fig.2 The expression of EGFP in OHCs can be detected from the basal turn to the middle-top turn of Basilar membrane,some EGFP were also observed in IHCs(A-C),except for the apical turn(D).In some regions(E),the expression of EGFP was also observed in the stereocilia of OHCs.The arrow in F was the EGFP.
2.3 Western blot及反转录PCR结果
实验动物分别取4只耳蜗提取总蛋白和总RNA,进行Western blot及反转录PCR分析,分别从蛋白及核酸水平验证了Atoh1基因的成功表达(图3)。
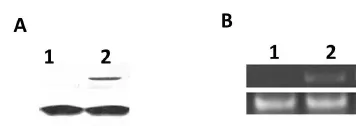
图3 Western blot(A)及反转录PCR(B)结果:1为导入组,2为阴性对照。Fig.3 Western blot(A)and RT-PCR(B)results:Nanoparticles treatment(lane1);Negative control(lane2)
3 讨论
耳蜗是人体感知听觉的器官,深埋于颅骨,是一个相对封闭的结构,且耳蜗存在血迷路屏障,类似于血脑屏障,可有效减少外部器官有害物质的侵袭,但也降低了全身用药的有效性。耳蜗内感知听觉的关键细胞--毛细胞深藏于耳蜗内部,周围是特殊的内/外淋巴液环境,这就导致即使是局部的给药也很难达到毛细胞。因此,选择合适的基因转染途径是成功实现耳蜗转染的关键之一。
关于利用非病毒载体转染耳蜗的研究发现,已有研究者利用阳离子脂质体完成了目的基因向耳蜗的转染,在转染后14天可以发现目的基因表达在感觉神经上皮细胞及其周围组织[9]。但脂质体可能影响细胞的生理活性,如可能抑制线粒体内膜或蛋白激酶C及ATP酶的活性,导致细胞毒性,因此限制了其被进一步的研究[10-12]。此外,还有多种人工合成的聚合物也可以作为基因载体实现内耳基因递送,如聚乳酸/乙醇酸、PLGA及PAMAM等,但都存在转染效率不高的问题[13-15]。本研究小组前期,曾成功利用阳离子聚合物PAMAM衍生物将目的基因转染入内耳,但PAMAM衍生物合成过程复杂,制备过程可控性较差,合成产物稳定性不佳,因此未能进一步应用研究[16]。
在PEI作为纳米载体向内耳进行基因转染的研究中,曾有利用lPEI作为载体成功将目的基因转染入内耳的研究[17],但结合其他专业的研究结果显示,与bPEI相比,lPEI的毒性较低但转染效率也不高[18-20]。此外,粒径大小也是纳米载体的重要物理参数,粒径大小与其生物膜的通透性密切相关。粒径大小与分子量有一定关系,但并非分子量越小、粒径越小越好。既往文献表明,不同分子量的PEI转染效率也有很大不同,分子量越低,其粒径小,透过细胞能力强,但较低的分子量携带DNA的能力也低,因此转染效率低。其中分子量为25 kDa的分支型PEI转染效率最高。分支型PEI内存在丰富的质子缓冲能力及质子化区域,具备很强的结合DNA及压缩DNA能力。因此为了在提高转染效率的前提下,降低毒性,我们选择了25kDa的bPEI作为制备基因载体的原料。本研究合成的复合物粒径可达220±9 nm,达纳米级别。HA修饰后的PEI/DNA复合体Ze⁃ta电位测量结果显示为-25.2±1.9 mV,因HA携带负电荷,说明HA可通过静电结合力结合修饰PEI/DNA复合物,可覆盖在PEI/DNA复合物表面,中和PEI表面的正电荷,首先可以尽可能避免其与细胞膜上带负电荷的蛋白非特异性结合,在细胞膜表面形成大量的纳米孔,导致细胞毒性[21-23]。
此外,既往关于利用PEI作为基因载体的研究发现,利用PEI-PEG作为基因载体可成功将X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP)基因转染如哺乳动物耳蜗内螺旋神经节细胞、血管纹、Corti器等结构,且能实现听力的保护作用[6]。但PEG为生物不可降解物质,因增加了载体分解产物在耳蜗内聚积,导致毒性。因此,选择可被生物降解的修饰配体也是耳蜗转导的关键之一。2012年Shibata SB等利用可生物降解的材料----透明质酸修饰腺相关病毒载体携带绿色荧光蛋白基因进行内耳转染,发现HA修饰可有效提高病毒载体携带的EGFP基因的转染效率[7]。本研究利用HA修饰bPEI制备纳米基因载体,即可实现耳蜗毛细胞的高效转染,也能尽可能降低转染过程中的阳离子聚合物的细胞毒性及转染后载体材料分子沉积导致的组织细胞毒性。为耳蜗基因转染提供了新的载体选择。
1 Pack DW,Hoffman AS,Pun S,et al.Design and development of polymers for gene delivery[J].Nat Rev Drug Discov,2005,4(7): 581-593.
2 史珣贝,吴南,郭维维,等.腺相关病毒在耳聋基因治疗上的应用[J].中华耳科学杂志,2016,14(1):37-42.
Shi XB,Wu N,Guo WW,et al.Application of adeno-associated vi⁃rus gene vectors in hereditary non-syndromic sensorineural hearing loss[J].Chinese Journal of Otology,2016,14(1):37-42.
3 Harris JD,Lemoine NR.Strategies for targeted gene therapy[J]. Trends Genet,1996,12(10):400-405.
4 Read ML,Singh S,Ahmed Z,et al.A versatile reducible polyca⁃tion-based system for efficient delivery of a broad range of nucleic acids[J].Nucleic Acids Res,2005,33(9):e86.
5 Yu H,Russ V,Wagner E.Influence of the molecular weight of biore⁃ducible oligoethylenimine conjugates on the polyplex transfectionproperties[J].AAPS J,2009,11(3):445-455.
6 Chen GG,Mao M,Qiu LZ,et al.Gene transfection mediated by poly⁃ethyleneimine-polyethylene glycol nanocarrier prevents cisplat⁃in-induced spiral ganglion cell damage[J].Neural Regen Res, 2015,10(3):425–431.
7 Shibata SB,Cortez SR,Wiler JA,et al.Hyaluronic acid enhances gene delivery into the cochlea[J].Hum.Gene Ther,2012,23:302–310.
8 陈志婷,杨仕明.纳米载体在内耳应用的研究现状[J].中华耳科学杂志,2014,12(1):151-154.
Chen ZT,Yang SM.Application of nano carriers in inner ear[J].Chi⁃nese Journal of Otology,2014,12(1):151-154.
9 Wareing M,Mhatre AN,Pettis R,et al.Cationic liposome mediated transgene expression in the guinea pig cochlea[J].Hear Res,1999, 128:61–69.
10 Felgner PL,Gadek TR,Holm M,et al.Lipofection:a highly effi⁃cient,lipid-mediated DNA-transfection procedure[J].Proc Natl Acad Sci USA,1987,84:7413–7417.
11 Bottega R,Epand RM.Inhibition of protein kinase C by cationic am⁃phiphiles[J].Biochemistry,1992,31:9025–9030.
12 Datiles MJ,Johnson EA,McCarty RE.Inhibition of the ATPase ac⁃tivity of the catalytic portion of ATP synthases by cationic amphiphi⁃les[J].Biochim Biophys Acta,2008,1777:362–368.
13 Jiang M,Zhang YQ,He GX and Sun H:Protective effect of NT-3 gene mediated by hydroxyapatite nanoparticle on the cochlea of guinea pigs injured by excitotoxicity[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2007,32:563–567.
14 Tamura T,Kita T,Nakagawa T,et al:Drug delivery to the cochlea using PLGA nanoparticles[J].Laryngoscope,2005,115:2000–2005.
15 Wang H,Shi HB,Yin SK.Polyamidoamine dendrimers as gene de⁃livery carriers in the inner ear:How to improve transfection efficien⁃cy[J].Exp Ther Med,2011,2(5):777–781.
16 Wu N,Li M,Chen ZT,et al.In Vivo Delivery of Atoh1 Gene to Rat Cochlea Using a Dendrimer-Based Nanocarrier[J].J Biomed Nano⁃technol,2013,9(10):1736-1745.
17 Tan BT,Foong KH,Lee MM,et al.Polyethylenimine-mediated co⁃chlear gene transfer in guinea pigs[J].Arch Otolaryngol Head Neck Surg,2008,134(8):884-891.
18 Wiseman JW,Goddard CA,McLelland D,et al.A comparison of lin⁃ear and branched polyethylenimine(PEI)with DCChol/DOPE lipo⁃somes for gene delivery to epithelial cells in vitro and in vivo[J]. Gene Ther,2003,10(19):1654-1662.
19 Kwon YJ.Before and after endosomal escape:roles of stimuli-con⁃verting siRNA/polymer interactions in determining gene silencing ef⁃ficiency[J].Acc Chem Res,2012,45(7):1077-1088.
20 Kafil V,Omidi Y.Cytotoxic impacts of linear and branched polyeth⁃ylenimine nanostructures in a431 cells[J].Bioimpacts,2011,1(1): 23-30.
21 Yu H,Zou Y,Wang Y,et al.Overcoming endosomal barrier by am⁃photericin B-loaded dual pH-responsive PDMA-b-PDPA micelle⁃plexes for siRNA delivery[J].ACS Nano,2011,5(11):9246-9255.
22 Hong S,Leroueil PR,Janus EK,et al.Interaction of polycationic poly⁃mers with supported lipid bilayers and cells:nanoscale hole forma⁃tion and enhanced membrane permeability[J].Bioconjug Chem, 2006,17(3):728-734.
23 Hong S,Bielinska AU,Mecke A,et al.Interaction of poly(amido⁃amine)dendrimers with supported lipid bilayers and cells:hole for⁃mation and the relation to transport[J].Bioconjug Chem,2004,15(4): 774-782.
In vivo transduction of Atoh1 gene into cochlear cells mediated by HA-PEI nanoparticle vectors
WANG Fangyuan1,CHEN Zhiting1,3,DENG Xiongwei2,WU Yan2,ZHANG Yue1,YANG Fengbo1,YANG Shiming1,WU Nan1
1 Department of Otolaryngology Head and neck surgery,Key Laboratory of Deafness,Ministry of Education,Chinese PLA General Hospital,Beijing,100853
2 The National Center for Nanoscience and Technology,Beijing 100190
3 Department of Otolaryngology Head and neck surgery,Beijing An Zhen Hospital,Beijing 100029
ObjectiveTo test in vivo transfection efficiency of Atoh1-EGFP plasmids using hyaluronic acid modified branched polyethylenimine nanoparticles as a novel non-viral gene vector.MethodsPlasmids were extracted following kit instructions.The gene-vector nanoparticles were synthesized(COOH/N/P=4:10:1)and then characterized before being transduced into the inner ear through intact round window membrane.At 7 days after transduction operation,transfection efficiency was evaluated by examination of both basilar membrane surface preparation and frozen sections under a confocal microscope.Transfection results were finally verified by Western blot and RT-PCR at protein and nucleic acid levels respectively.ResultsWe successfully synthesized a non-viral gene vector which loaded Atoh1 gene well and had a negatively-charged surface to reduce possible cytotoxicity.At 7 days after transfection,confocal microscope observation of basilar membrane showed EGFP in OHCs and IHCs.OHC transfection efficiency was 81.7±4.71%in the basal turn and 33.8±9.02%in the middle turn.Frozen section results revealed expression of EGFP mainly in the basal turn and only part of the middle turn of the cochlea.No signs of EGFP transduction were seen in either the top of the cochlea or in cells other than hair cells.Furthermore,Basilar membrane cells showed no obvious damage after operation.Both Western Blot and RT-PCR results verified successful transfection of the Atoh1 gene on the basilar membrane.Conclusion The Atoh1 gene can be successfully transduced into the inner ear by the HA modified bPEI nanoparticles and there is no obvious cytotoxicity to cochlear cells.The new nanoparticles are easy to produce at a low cost,which makes it an ideal non-viral vector for inner ear gene transfection.
Hyaluronic acid;branched Polyetherimide;Atoh1 gene;inner ear gene delivery
R764.35
A
1672-2922(2016)06-803-5
2016-12-10审核人:翟所强)
10.3969/j.issn.1672-2922.2016.06.020
国家863青年科学家项目(2014AA020510);国家973计划重大科学研究计划干细胞项目(2012CB967900);国家科技部新药创制重大专项(2014ZX09J14101-06C);国家自然科学基金项目(NSFC 81470700);中国科协创新驱动助力工程(2016CXQD01)
王方园,医学博士,主治医师,研究方向:毛细胞再生、听觉植入
吴南,Email:maxpanda1979@126.com
