小型猪听性脑干反应分析及脉冲噪声暴露后的变化
2016-02-15陈志婷王方园冀飞杨仕明吴南
陈志婷王方园冀飞杨仕明吴南
1首都医科大学附属北京安贞医院耳鼻咽喉头颈外科(北京100029)
2解放军总医院耳鼻咽喉头颈外科聋病教育部重点实验室(北京100853)
·噪声性聋专辑·
小型猪听性脑干反应分析及脉冲噪声暴露后的变化
陈志婷1,2王方园2冀飞2杨仕明2吴南2
1首都医科大学附属北京安贞医院耳鼻咽喉头颈外科(北京100029)
2解放军总医院耳鼻咽喉头颈外科聋病教育部重点实验室(北京100853)
目的了解健康小型猪的听性脑干反应特征,以及脉冲噪声暴露后其听性脑干反应的变化特点。方法健康小型猪分别给予30、50、80及100次脉冲噪声暴露,并于噪声暴露前以及暴露后即刻、1、2、4、8周进行听性脑干反应测定,了解其听性脑干反应特征及变化情况。结果健康小型猪的听性脑干反应波形包括五个典型的波峰,与其他物种一致。短声刺激下其阈值平均为25±5 dB SPL。高强度脉冲噪声暴露后,其听性脑干反应阈值显著提高。50次以上暴露即可导致无法引出可识别的听性脑干反应波形。其纯音听性脑干反应阈值在4、8、16、20kHz和32kHz频率也于暴露后增高。暴露后即刻,各实验组阈值均大于90 dB SPL。暴露后1周,各实验组动物ABR阈值都有不同程度的恢复,但暴露后1周内恢复较快,第2至第8周时,听阈位移趋势基本稳定。噪声暴露后1至8周,ABR阈值在4kHz,8kHz,16kHz、20kHz和32kHz频率恢复趋势与短声刺激一致,各频率ABR阈值比较差异无统计意义。随着时间的延长,在不同频率区间内,虽然存在听阈的阈移,但是ABR波形分化较差。讨论小型猪ABR波形与啮齿类及人类相似,但小型猪ABR对脉冲噪声的敏感性较啮齿类动物更强,且恢复期更短。此外,由于小型猪与人类在基因、解剖及病理生理学上都具有较高的相似性,因此可能是听觉研究方面理想的大型哺乳动物模型。
小型猪;听性脑干反应;脉冲噪声
Funds by The National High-tech R$D Program of China for young Scientists(2014AA020510),National Basic Research Program of China (973 Program)(#2012CB967900),NationalMinistry ofscience and technology new drug creation majorproject (2014ZX09J14101-06C);National Natural Science Foundation of China(NSFC 81470700);Innovation and drive power engineering project of China association for science and technology(2016CXQD01)
Declaration of interest:The authors report no conflicts of interest.
选择合适的动物模型一直是听力学研究的核心问题之一。既往研究常用的听力研究动物模型主要为小型啮齿类动物,如大鼠、小鼠、豚鼠等。这些动物繁殖能力强、遗传背景单纯、体型较小,实验成本低。但其内耳体积小,且其内耳在出生后仍需要一定时间才能发育成熟。此外,此类动物的耳科解剖结构与人类相差甚远,限制了其在耳科研究领域的进一步应用。因此,有关毛细胞再生、人工听力重建、早期听力挽救等方面的听觉基础研究仍然需要一种与人类内耳发育及基因表型更为接近的大型哺乳动物作为新的模型平台[1,2]。目前,应用小型猪作为听觉研究动物模型在耳科领域的研究仍处于初始阶段,本研究利用听性脑干反应检测对小型猪的听力特征进行探索,建立脉冲噪声性听觉损伤小型猪模型,为小型猪听觉模型的进一步应用提供基础。
1 材料和方法
1.1 实验动物及分组
遗传背景明确的贵州小型猪25只,由中国农业大学提供,雌雄不限,月龄2月龄,体重约为5.0±1.0 kg,身体状态良好,粗测听力正常。实验动物饲养于解放军总医院动物实验中心按照统一饲养标准饲养,恒温恒湿,环境噪声维持<40dB SPL。
实验动物随机分为5组,每组5只,分别设定为爆震次数30次(组一)、50次(组二)、80次(组三)和100次(组四),另有一组为空白对照组(组五)。
1.2 小型猪听性脑干反应(auditory brainstem re⁃sponse,ABR)测定
实验动物麻醉:前颈部肌肉注射速眠新II注射液(0.1ml/kg,最大剂量<1.0ml),1分钟后,再给予3%戊巴比妥钠(1ml/kg)。完全麻醉后观察,呼吸平稳,心跳及体表温度正常后,给予棉被保温处理,观察并清理其双侧外耳道耵聍。
听性脑干反应测定使用银针电极,记录电极安置于小型猪的颅顶双耳前缘连线中点处,参考电极置入测试耳垂下,地极插入对侧耳垂下。在隔声屏蔽室内,采用Madson2250听功能测试仪,引入EGG放大器,放大后的信号由TDT信号处理仪处理。以短声(Click)和短纯音(Tone burst)4 kHz,8 kHz,16 kHz,20 kHz,32 kHz做为刺激音。TDH 49P耳机距小型猪测约1 cm,并确保未与其毛发接触。声刺激持续时程为10 ms,带通滤波宽度为300-3000Hz。短声刺激为12.1次/秒,持续时间0.1 ms;短纯音刺激持续时间为4ms,上升和下降时间0.5 ms,平均叠加次数1024次。最大刺激声强度为90 dB SPL,短声和短音从90 dB SPL逐渐降低,每次降低幅值为10 dB SPL,直至无法引出可以重复的ABR波形,然后以5dB幅度提高刺激强度,以能分辨出可重复的ABR波形的最低刺激强度确定阈值,并重复3次,其中有2次引出确定波形即为有[3]。
1.3 脉冲电火花噪声暴露
选择双耳听阈正常的小型猪(ABR阈值约为25-35 dB SPL),麻醉(方法同测听前)状态下使其卧于特制的平板上,头部正中位,将脉冲电火花爆震仪置于小型猪鼻面部正中,声源距小型猪鼻根部1cm处,使其与双侧外耳廓平行,给声仪器与双耳呈等腰三角形,确保双耳均衡接受噪声(见图1-A)。连续给予不同次数的脉冲噪声(30,50,80,100次),压力峰值为145.0 dB SPL,脉宽0.25ms,间隔时间10秒。为确保每次暴露强度的稳定,在每次噪声暴露前都对脉冲电火花声源仪器进行校准。
1.4 统计学方法
2 结果
2.1 噪声暴露前小型猪听性脑干反应阈值
健康小型猪ABR结果显示其波形包括五个典型的波峰,分别用I–V表示,这与其他物种数据一致(见图1-B)。短声(click)刺激音下,其ABR阈值平均为25±5 dB SPL;短纯音刺激音条件下(tone burst 4 kHz,8 kHz,16 kHz,20 kHz和32 kHz),ABR阈值的均数和标准差如图1-C所示,随着刺激音频率的增高,小型猪ABR阈值增大。
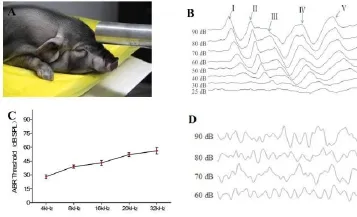
图1 小型猪听性脑干反应(ABR)阈值Fig.1 Click-ABR threshold of miniature pigs(A)应用脉冲电火花爆震仪对小型猪造模;(B)健康小型猪ABR波形特征;(C)健康小型猪不同刺激音频率下ABR阈值;(D)噪声暴露后即刻小型猪ABR波形(A)miniature pigs models of noise-induced hearing loss using a pulse electric spark detonation meter(B)characteristics of ABR waves in healthy miniature pigs;(C)ABR thresholds of healthy miniature pigs under different stimulus frequencies;(D)ABR waves of the miniature pigs immediately after noise exposure
2.2 不同剂量噪声暴露后小型猪听性脑干反应测定不同剂量的高强度脉冲噪声暴露后,健康小型猪ABR阈值明显提高,且在低频和高频区域损伤程度不同。在噪声暴露后即刻,50次、80次及100次组在刺激音最大输出时(90 dB SPL)的click刺激下均也无法引出可识别、可重复的ABR波形,或者阈值大于90 dB SPL(图1-D)。结果显示,不同剂量高强度脉冲噪声暴露前各组动物ABR阈值无显著差异(F= 0.373,P=0.774);在噪声暴露后即刻较暴露前,各组均存在显著差异(各组噪声前后ABR阈值比较的统计量t及P值见表2)。进一步分析(SNK-q检验)不同剂量高强度噪声暴露后即刻各组动物ABR阈值,结果显示,50次、80次及100次组ABR阈值较30次组高,50次、80次及100次组间无差异(表3)。在纯音刺激条件下,随着噪声暴露次数进一步增加,在4kHz,8kHz,16kHz、20kHz和32kHz频率,小型猪的ABR阈值也随之增高。
2.3 噪声暴露前后不同时间小型猪听性脑干反应测定
为了解脉冲噪声暴露后小型猪听性脑干反应的变化特点,我们分别于噪声暴露后多个时间点跟踪测试小型猪ABR阈值(噪声暴露后l周、2周、4周以及8周),结果显示在强噪声暴露一周后,各实验组动物click-ABR阈值都有不同程度的恢复(表1),100次组为85.00±7.91dB SPL,80次组ABR为76.00±9.62 dB SPL,50次组为64.00±4.18 dB SPL。噪声暴露后第4周,100次组与80次组别ABR阈值进一步恢复,至第8周时,ABR阈值位移趋势基本稳定(图2)。噪声暴露后1周至8周,tone burst ABR阈值在4kHz,8kHz,16kHz、20kHz和32kHz频率范围内恢复程度趋势与短声刺激一致,各频率ABR阈值比较差异无统计学意义(F=0.163,P=0.228,图3),其中,20kHz和32kHz在不同时间点,给予最大刺激声均未引出ABR波形。同时,随着观察时间的延长,在不同频率区间内,虽然存在ABR阈值的阈移,但是ABR波形分化较差,阈移判定仍以波形较明显的V波为主。
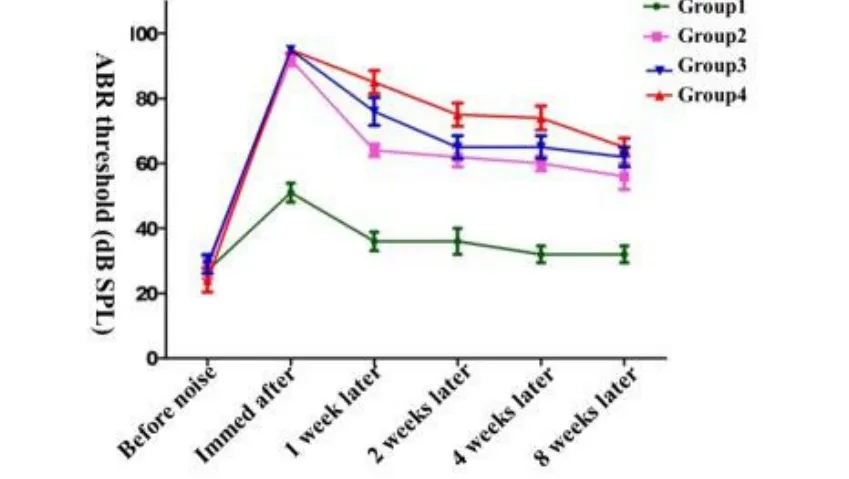
图2 不同剂量强度噪声暴露前后各组动物click-ABR阈值趋势Fig.2 trends of click-ABR threshold before and after exposure in different groups
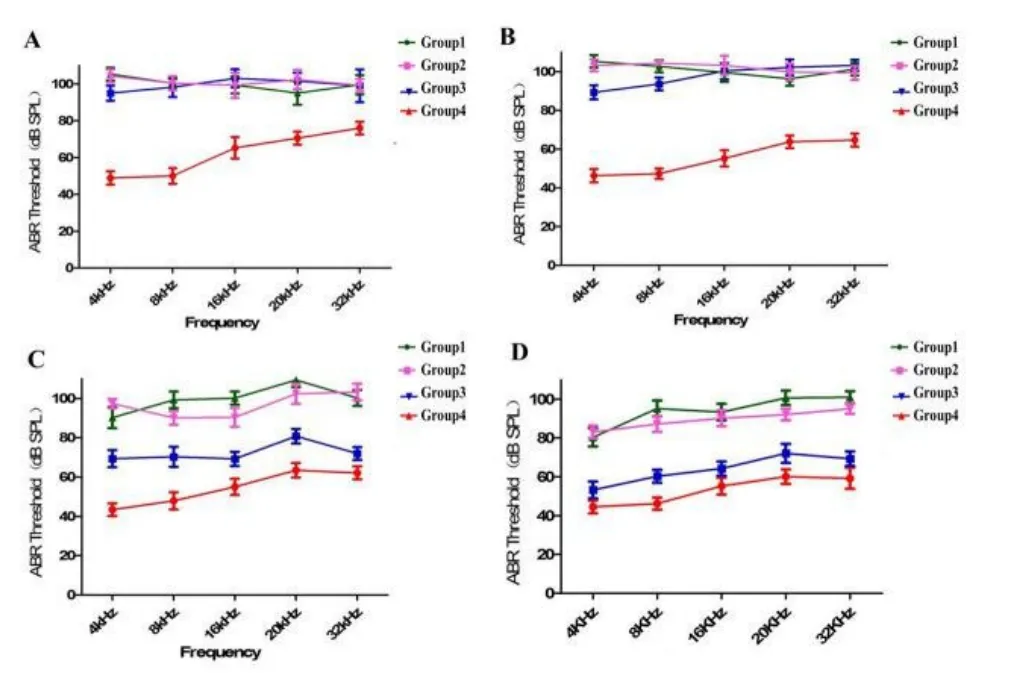
图3 不同剂量强度噪声暴露后各组动物不同频率ABR阈值趋势。A:爆震即刻;B:爆震后1周;C:爆震后2周;D:爆震后8周Fig.3 Different frequenciesABR threshold of differentgroupsA:immediately after noise;B:1 week later;C:2 weeks later;D:8 weeks later
3 讨论
由于小型猪与人类在基因、解剖及病理生理学上都具有较高的相似性,研究发现其可作为多种人类疾病的动物模型,并已显示出优越性[4,5],因此,在生物医学科学研究领域正逐渐被人们所关注并加以研究,如心血管消化系统、皮肤结构、骨骼发育、营养需要、矿物质代谢等领域[6]。本研究对小型猪的听性脑干反应进行测定,分析其特征及其脉冲噪声暴露后的变化特点,以评估其作为听觉研究动物模型的可行性。
听性脑干反应是1-10ms潜伏期内出现的一系列反应波,人体检查常用短声来诱发ABR,它的能量集中在3-4kHz,可以粗略反映耳蜗此频率的功能[7]。同时,由于听性脑干反应各波来源于听觉通路上的不同位置,根据波形的判断,大概可以了解从耳蜗Ⅰ型传入纤维突触末梢至听觉中枢的听觉通路的情况。在人体上可以ABR检测记录到波I-Ⅶ,其中波I、Ⅲ及V波最明显,且出现率较高[7]。在本实验中,小型猪的ABR一般记录到I-V波,I波和V波较为明显,可以作为判断阈值的指标。
为了更全面了解小型猪的听性脑干反应情况围较宽,单用短声刺激不能反映整个耳蜗的功能,因此我们采用短声和频率特异性较好的短纯音(4kHz、8 kHz、12 kHz、16 kHz、20 kHz、32 kHz)结合的方式检测,并根据该频率最终无法引出可重复的可辨别的波形时的输出声压级做为该频率的ABR阈值,进而绘制出各频率的ABR阈值图。本研究的结果显示,高剂量的脉冲噪声(给予噪声次数≥50次)暴露后即刻,给予最大刺激强度无法引出ABR波形,各频率ABR阈值均≥90 dB SPL,阈移达到60 dB SPL以上。连续观察噪声暴露后小型猪的听性脑干反应阈值变化情况,结果显示在不同频率的ABR损伤情况在1周后开始恢复,且恢复程度最大,但直至噪声暴露后8周,ABR损伤的阈移也不能完全恢复。
而既往关于啮齿类动物的研究发现[8],豚鼠给予400次压力峰值为160 dB SPL脉冲噪声暴露后,其各频率ABR阈值较暴露前显著升高,且平均阈移大于40 dB。而暴露次数分别为50次及100次的豚鼠在噪声暴露前后各频率反应阈变化无统计学意义。与本研究中小型猪的ABR测定结果相比较发现,虽然豚鼠接受的脉冲噪声压力峰值更强、暴露次数更多,其ABR阈值损伤程度却小于小型猪的阈值。其他关于脉冲噪声后啮齿类动物的ABR变化研究也显示了类似的现象[9,10]。说明,相对于啮齿类的动物来说,小型猪对脉冲噪声更敏感,即使较低的强度和剂量,也能导致明显的ABR阈移。
表1 噪声暴露前后各组动物ABR阈值(±s,n=5,dB SPL)Table 1 ABR thresholds of miniature pigs before and after noise exposure(±s,n=5,dB SPL)
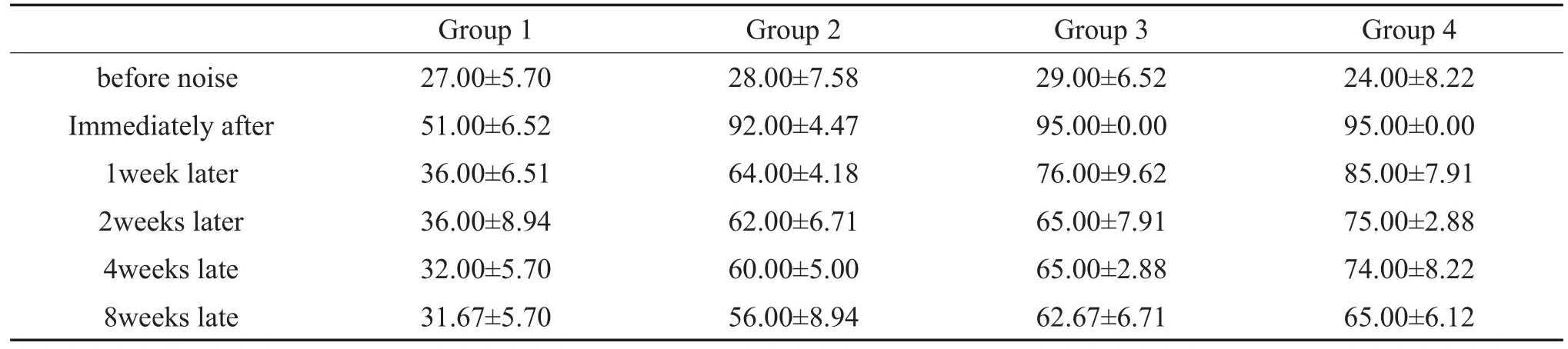
表1 噪声暴露前后各组动物ABR阈值(±s,n=5,dB SPL)Table 1 ABR thresholds of miniature pigs before and after noise exposure(±s,n=5,dB SPL)
before noise Immediately after 1week later 2weeks later 4weeks late 8weeks late Group 1 27.00±5.70 51.00±6.52 36.00±6.51 36.00±8.94 32.00±5.70 31.67±5.70 Group 2 28.00±7.58 92.00±4.47 64.00±4.18 62.00±6.71 60.00±5.00 56.00±8.94 Group 3 29.00±6.52 95.00±0.00 76.00±9.62 65.00±7.91 65.00±2.88 62.67±6.71 Group 4 24.00±8.22 95.00±0.00 85.00±7.91 75.00±2.88 74.00±8.22 65.00±6.12
表2 噪声暴露前及暴露后即刻各组动物ABR阈值比较(±s,n=5,dB SPL,t检验)Table 2 Statistical analysisABR thresholds of miniature pigs before and immediately after noise exposure(±s,n=5,dB SPL,t-test)
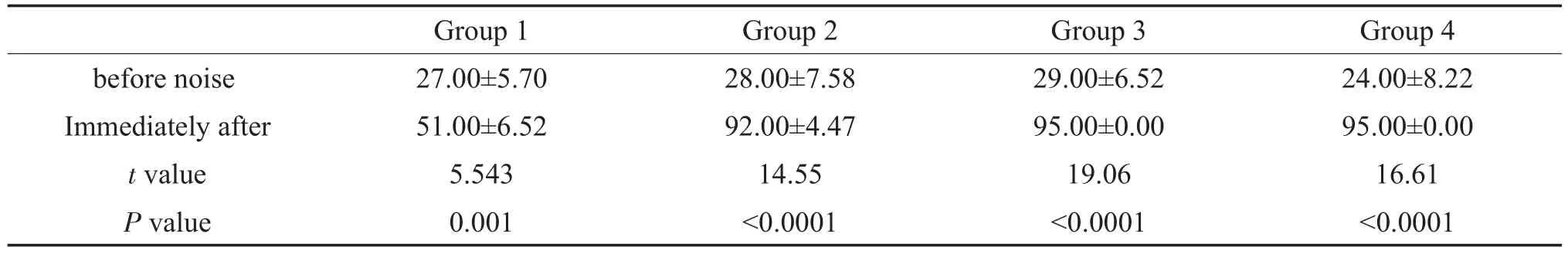
表2 噪声暴露前及暴露后即刻各组动物ABR阈值比较(±s,n=5,dB SPL,t检验)Table 2 Statistical analysisABR thresholds of miniature pigs before and immediately after noise exposure(±s,n=5,dB SPL,t-test)
before noise Immediately after t value P value Group 1 27.00±5.70 51.00±6.52 5.543 0.001 Group 2 28.00±7.58 92.00±4.47 14.55<0.0001 Group 3 29.00±6.52 95.00±0.00 19.06<0.0001 Group 4 24.00±8.22 95.00±0.00 16.61<0.0001

表3 噪声暴露后即刻各组动物ABR阈值比较(SNK-q检验)Table 3 Statistical analysisABR thresholds of miniature pigs immediately after noise exposure(SNK-q test)
Duan等[8]的研究仍发现噪声暴露后,豚鼠在12.5、16、31.5、40 kHz的ABR阈值在暴露后随着时间的延长可逐渐恢复,并在暴露后2周趋于稳定,但与暴露前比较仍有显著差异。脉冲噪声暴露后小型猪的ABR阈值损伤也能随着时间延长逐渐恢复,噪声暴露后1周内恢复程度最佳,此后从暴露后2周至暴露后8周的阈值恢复都不明显。与啮齿类动物相比,其暂时性阈移的恢复过程更短。但从永久性阈移的程度上看,前者的永久性阈移可达30-60 dB SPL,比相同强度暴露后的啮齿类动物更大。
与啮齿类动物相比较,应用小型猪作为噪声性聋动物模型的优势在于听力学资料稳定,同质性较强,易于进行听力学数据的评估,同时,从形态解剖观察,小型猪中耳听骨链、内耳等结构与人类相似[11-13],因此是重要的临床前研究大中型实验动物的优质选择。本研究对健康小型猪的ABR特征及脉冲噪声暴露后的ABR变化特点进行了初步的探索,为小型猪作为中大型听觉研究动物模型提供基础。此外,本研究发现小型猪对于强噪声较啮齿类动物更敏感,且恢复期更短,相关机制需要进一步的研究。
1 舒卫宁,赵立东,杨仕明等.内耳毛细胞再生的前体细胞及其发育调控基因[J].中国听力语言康复科学杂志.2010,4(1):21-24.
Shu WN,Zhao LD,Yang SM,et al.Progenitor cells of inner hair cells and their development regulation genes[J].Chinese Scientific Journal of Hearing and Speech Rehabilitation.2010,4(1):21-24.
2 Zhao LD,Guo WW,Lin C,et al.Effects of DAPT and Atoh1 over ex⁃pression on hair cell production and hair bundle orientation in cul⁃ tured Organ of Corti from neonatal rats[J].PloS one.2011,6: e23729.
3 Guo WW,Yi HJ,Ren LL,et al.The Morphology and Electrophysiolo⁃gy of the Cochlea of the Miniature Pig[J].The Anatomical Record, 2015,298(3):494-500.
4 张贺王承利王洋等.小型猪动物模型在医学领域中的研究应用[J].中国畜牧兽医.2012,39(7):263-266.
Zhang H,Wang CL,Wang Y,et al.Research and Application of Miniature Pigs Models on Medical Domain[J].China Animal Hus⁃bandry&Veterinary Medicine.2012,39(7):263-266.
5 Chen L,Guo W,Ren L,A de novo silencer causes elimination of MITF-M expression and profound hearing loss in pigs.BMC Bi⁃ol.2016;14:52.
6 詹纯列,徐本法,白朝晖.小型猪及医学实验应用概述[J].华南国防医学杂志.2001,15(2),24-28.
Zhan CL,Xu BF,Bai ZH.Review of miniature pigs and its medical laboratory applications[J].Mil Med J S Chin,2001,15(2),24-28.
7 姜泗长,顾瑞.临床听力学[M].北京医科大学、中国协和医科大学联合出版社.1999.21(2),37.
Jiang SC,Gu R.Clinical audiology[M].Beijing Medical University and Peking Union Medical College press.1999.21(2),37.
8 Duan M,Laurell G,Qiu J,et al.Susceptibility to impulse noise trauma in differentspecies:Guinea pig,rat and mouse[J].Acta Oto⁃laryngol,2008,128(3):277-283.
9 Wang L,Jiang W,Jiang P,et al.Inner ear damage in guinea pigs ex⁃posed to stable and impulse noise[J].Chin MedJ,1998,111(4): 354-357.
10 廖华,郜元坤,华清泉等.脉冲噪声暴露后大鼠频率特异性听性脑干反应变化特点及意义.听力学及言语疾病杂志.2011,19(1): 56-58.
Liao H,Gao YK,Hua QQ,et al.Effect of Impulse Noise on the Fre⁃quency-Specific Auditory Brainstem Response in Rat[J].Journal of Audiology and Speech Pathology,2011,19(1):56-58.
11 Guo WW,Yi HJ,Yan Z,et al.The morphological and functional de⁃velopment of the stria vascularis in Miniature Pigs.Reprod Fertil Dev,2015(Epub ahead of print)
12 杨仕明.小型猪动物模型在耳科学领域的应用.中华耳科学杂志.2016,14(1):1-5.
Yang SM.The miniature pigs as an animal model in otological re⁃search.Chinese Journal of Otology,2016,14(1):1-5.
13 侯赟,郭维维,杨仕明等.小型猪内耳发育形态学观察.中华耳科学杂志.2012,10(4):485-488.
Hou Y,Guo WW,Yang SM,et al.Developmental of inner ear in miniature pigs.Chinese Journal of Otology,2012,10(4):485-488.
Characteristics of auditory brainstem responses in miniature pigs and changes after impulse noise exposure
CHEN Zhiting1,2,WANG Fangyuan2,JI Fei2,YANG Shiming2,WU Nan2
1 Department of Otolaryngology Head and neck surgery,Beijing An Zhen Hospital,Beijing 100029
2 Department of Otolaryngology Head and neck surgery,Key Laboratory of Deafness,Ministry of Education,Chinese PLA General Hospital,Beijing,100853
ObjectiveTo investigate the characteristics of auditory brainstem responses(ABRs)in healthy miniature pigs and their changes after impulse noise exposure.MethodsHealthy miniature pigs were exposed to impulse noise at 30, 50,80 or 100 pulses separately,and auditory brainstem responses were tested before and immediately,at 1,2,4 and 8 weeks after exposure.Auditory brainstem response characteristics and changes after noise exposure were recorded.ResultsABR waves in healthy miniature pigs showed five typical peaks,consistent with those in other species.The mean threshold of click-ABRs was 25±5 dB SPL.After high intensity impulse noise exposure,the ABR threshold was significantly increased. No identifiable ABR waves could be detected immediately after exposure to more than 50 pulses at the maximum system output.Tone burst ABR thresholds at 4,8,16,20 and 32 kHz also increased to higher than 90 dB SPL immediately after noise exposure.At 1 week after exposure,various degrees of thresholds recovery were observed,constituting most recovery after noise exposure.From the second to the eighth week,threshold recovery was plateaued.Recovery of tone burst ABR thresholds at 4,8,16,20 and 32 kHz were consistent with that of click ABR,with no statistically significant differencesamong the frequencies.Furthermore,ABR waves showed poor differentiation as the time went on,despite recovery in threshold.ConclusionsABR waves in miniature pigs are similar to those of rodents and humans,but are more sensitive to impulsive noise exposure than in rodents,albeit with shorter recovery period.In addition,because of the high similarities in genetics,anatomy and pathophysiology between miniature pigs and humans,miniature pigs are an ideal large mammal model for auditory research.
Miniature pig,auditory brainstem response,impulse noise
R764
A
1672-2922(2016)06-735-5
2016-12-10)
10.3969/j.issn.1672-2922.2016.06.008
国家863青年科学家项目(2014AA020510);国家973计划重大科学研究计划干细胞项目(2012CB967900);国家科技部新药创制重大专项(2014ZX09J14101-06C);国家自然科学基金项目(NSFC 81470700);中国科协创新驱动助力工程(2016CXQD01)
陈志婷,博士,主治医师,研究方向:毛细胞再生、听觉植入
吴南,Email:maxpanda1979@126.com
