托品烷生物碱生物合成与代谢工程研究进展*
2016-02-14范雨芳廖志华
强 玮,范雨芳,廖志华**
(1. 西南大学生命科学学院 重庆 400715;2. 西南大学西藏农牧学院药用植物联合研发中心 重庆 400715)
托品烷生物碱生物合成与代谢工程研究进展*
强 玮1,2,范雨芳1,2,廖志华1,2**
(1. 西南大学生命科学学院 重庆 400715;2. 西南大学西藏农牧学院药用植物联合研发中心 重庆 400715)
托品烷生物碱是医药史上最古老的一类药物,常用的有莨菪碱(或其外消旋体阿托品)和东莨菪碱,它们都具有显著的抗胆碱活性,在现代临床上应用相当广泛。目前,市场上托品烷生物碱的供应完全依赖植物提取,但药源植物中生物碱含量往往较低,培育高含量托品烷生物碱的药源植物成为领域内共同追求的目标,利用生物技术提高发根或植株中托品烷生物碱含量成为次生代谢领域的研究热点。近10年来,托品烷生物碱的生物合成分子生物学研究取得了重要进展,代谢工程也获得了大量研究成果,本文对这两方面的研究进展进行综述,并对存在的关键问题和未来研究方向进行分析和展望。
托品烷类生物碱 生物合成 代谢工程
托品烷生物碱(Tropane Alkaloids,TAs)是少数茄科植物体内存在的一类天然次生代谢产物,因其具有显著的药理学活性,被人们作为传统药物使用了近3 000年[1]。现代临床使用的是莨菪碱或其外消旋体阿托品、东莨菪碱和药效稍低的山莨菪碱,它们均为作用于副交感神经系统的抗胆碱药物,主要用于镇痛、麻醉、抗晕动药、治疗帕金森症、改善微循环、戒毒脱瘾、治疗农药中毒等;以上3种TAs原料药中,东莨菪碱药效更强,副作用更弱,价格也更昂贵[2]。目前,全球TAs供应完全依赖植物提取,这些药用植物资源包括茄科Atropa、Datura、Hyoscyamus、Duboisia和Anisodus属的少数物种。澳洲毒茄杂交种(Duboisia hybrid)和颠茄(Atropa belladonna)是最重要的两种TAs资源植物[3],其中颠茄被中国药典收录。在大多数植物中TAs含量尤其是东莨菪碱含量极低,如颠茄中东莨菪碱含量仅为干重的0.01%-0.08%,不能满足市场需求,所以,利用代谢工程技术提高资源植物中TAs含量是相关产业长期追求的目标[2,4]。近年来,在TAs代谢途径基因克隆和转基因提高TAs合成能力等方面积累了大量的研究成果。同时,梳理TAs生物合成分子生物学开展20多年来的研究脉络也很有必要。因此,本研究对以上内容进行了综述和展望。
1 托品烷生物碱生物合成途径和相关基因
1991年,第一个TAs合成途径基因H6H在Hyoscyamus niger中被克隆[5];2014年,颠茄[6]的转录组数据公开发表,同时支路途径基因AbArAT4被首次克隆和鉴定;2015年, Anisodus acutangulus[7]的转录组也相继发表。迄今为止,托品烷生物碱生物合成的分子生物学已开展了26年,部分生物合成途径已基本清晰(图1)。
1.1 前体腐胺的来源
腐胺可以被催化生成亚精胺和精胺,三者统称为多胺,它们在植物的生长发育和抵抗环境胁迫中起着重要的作用[8]。在少数茄科植物中,腐胺也是尼古丁和TAs的合成前体。植物中存在两条腐胺来源途径:①以鸟氨酸为前体,通过鸟氨酸脱羧酶(Ornithine Decarboxylase,ODC)脱羧直接获得;②以精氨酸为前体,经精氨酸脱羧酶 (Arginine Decarboxylase,ADC)、精胺亚胺基水解酶(Agmatine Iminohydrolase,AIH)和N-甲氨酰基腐胺氨基水解酶(N-carbamoylputrescine Amidohydrolase,CPA)的三步连续反应最终生成腐胺[8]。不同植物中这两条途径对下游次生代谢产物合成的贡献也不同。烟草中,鸟氨酸途径为尼古丁的合成提供了绝大部分腐胺原料,精氨酸途径的作用十分有限[9,10];而在Datura属植物的TAs合成中,精氨酸途径主要参与了TAs的合成,鸟氨酸的作用其次[11],在Datura inoxia中超表达ADC基因能够比超表达ODC基因合成更多的莨菪碱[12](表1)。所以,次生代谢物合成依赖何种腐胺生源途径是物种特异的。
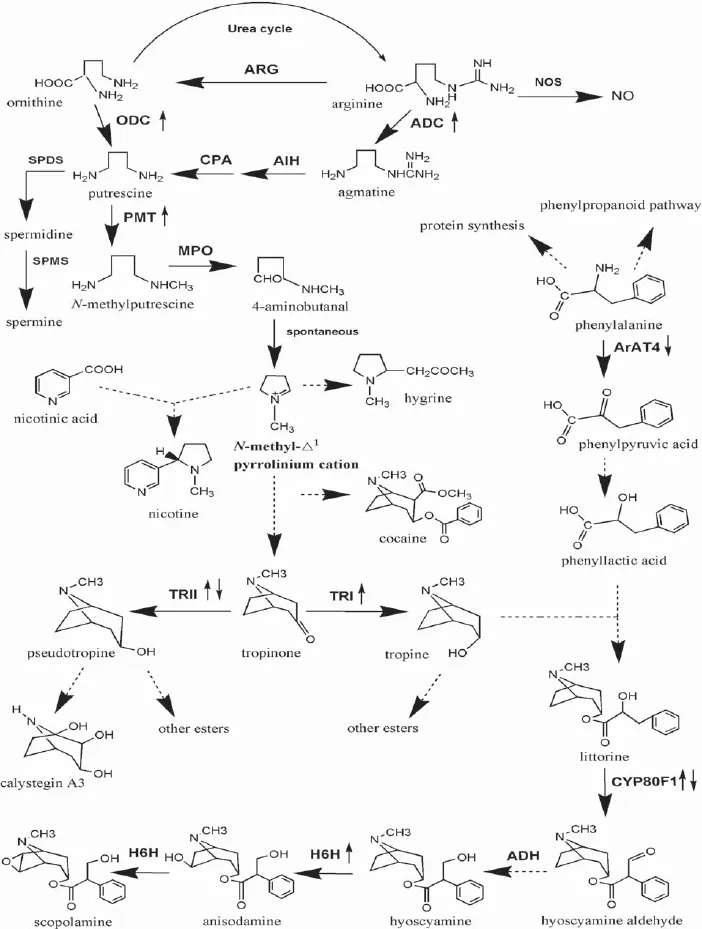
图1 茄科植物中托品烷生物碱生物合成途径
目前,在TAs资源植物中,ODC基因和ADC基因均仅在D. stramonium被克隆,烟草中也有ADC基因报道。DsODC编码431个氨基酸,具备老鼠ODC中保守的活性氨基酸残基,缺乏哺乳动物ODC中保守的一段C端延伸链,Southern blotting显示DsODC不止一个拷贝[13]。植物ODC蛋白一般认为定位于胞质,也有定位于细胞核的报道[14]。DsADC基因在水稻中超表达能显著提高耐旱能力[15]。烟草的NtADC基因编码721个氨基酸,其5’UTR包含一段编码8个氨基酸的上游ORF(uORF),该 uORF与DsuORF序列100%保守,表明DsADC和NtADC基因在翻译水平可能受到复杂的调控。NtADC在光合型细胞中定位于叶绿体,在根中定位于细胞核[16]。
1.2 PMT:托品烷生物碱合成的起点
N-甲 基-腐 胺 转 移 酶(Putrescine N-methyltransferase,PMT)以S-腺苷甲硫氨酸为辅助底物,催化腐胺的甲基化生成N-甲基-腐胺。PMT能够将初生代谢产物(腐胺)引入次生代谢(尼古丁、TAs和非TAs)合成,被认为是TAs生物合成的起点[17]。放射性标记前体饲喂D. stramonium发根实验表明PMT是一个限速酶[18],在Datura metel和Hyoscyamus muticus中超表达PMT基因都能显著提高TAs的合成[19],但是在颠茄中超表达PMT基因,TAs含量无变化[20]。所以,PMT在TAs合成中是否是限速酶与物种相关。
PMT基因首次于1994在烟草中克隆[21],随后根据cDNA文库杂交筛选,分别在颠茄和H. niger中克隆到了PMT基因[22]。目前,已有9个TAs资源植物的PMT基因被克隆,包括:A. belladonna,H. niger, Anisodus tanguticus[23],A. acutangulus[24],Anisodus luridus[25],D. stramonium,D. metel,D. inoxia[26]和Scopolia parviflora[27]。PMT基因通常包含1-2个家族成员,其中一条特异性地在根中表达。颠茄中存在两条PMT基因AbPMT1和AbPMT2,分别编码336和340个氨基酸;它们均不受茉莉酸甲酯(Methyl Jasmonate,MeJA)的诱导[22];AbPMT1只在根中表达,且表达量远高于AbPMT2,而AbPMT2在各个部位均有表达。H. niger和D. stramonium中仅存在一条PMT基因,都特异性地在根中表达,且都受MeJA的强烈诱导[22,28]。参与TAs合成的PMT基因一般在根中柱鞘细胞中特异性表达[22]。
1.3 托品酮:第一个具备托品烷环的中间体
N-甲基-腐胺在N-甲基腐胺氧化酶(N-methylputrescine Oxidase,MPO)的催化下生成4-氨基-正丁醛。4-氨基-正丁醛能自发地环化生成活性的N-甲基-△1-吡咯啉正离子。N-甲基-△1-吡咯啉正离子在各种代谢物生物合成中起着中心的作用,它与丙酮酸缩合可以形成另一种TAs古豆碱[28];与烟酸发生缩合生成尼古丁[1];还可以经若干步代谢反应生成一种可用作麻醉剂的生物碱可卡因[29];在合成莨菪碱的植物中,则经过一系列未知的反应生成TAs途径特有的二环结构前体托品酮。
1.4 TRs:调控代谢流走向的分支点
托品酮还原酶 (Tropinone Reductase,TR)包括TRI和TRII两种类型。它们都以托品酮为底物,依赖还原性辅酶II为氢供体,分别立体特异性地还原托品酮C3位的羰基生成托品和假托品,构成了TAs生物合成的一个分支点[30]。托品和假托品在植物体内不能相互转化,它们分别是莨菪碱和norTAs打碗花精的合成前体,因此,两种TRs的酶活就成了调控代谢流走向和下游TAs含量的一个重要因素[31]。在颠茄和A. acutangulus中超表达TRI都能提高TAs含量,证明TRI是一个可行的TAs代谢工程靶标基因[32,33]。两种TRs对底物托品酮获得的难易度也是影响TAs含量的另一个因素。TRII和TAs上下游其它合成酶PMT、H6H均定位在根中柱鞘细胞,而
TRI主要定位在内皮层细胞,这意味着TRI不能直接获得底物,托品酮和其产物托品必须往返于两种不同的细胞来合成莨菪碱[34]。
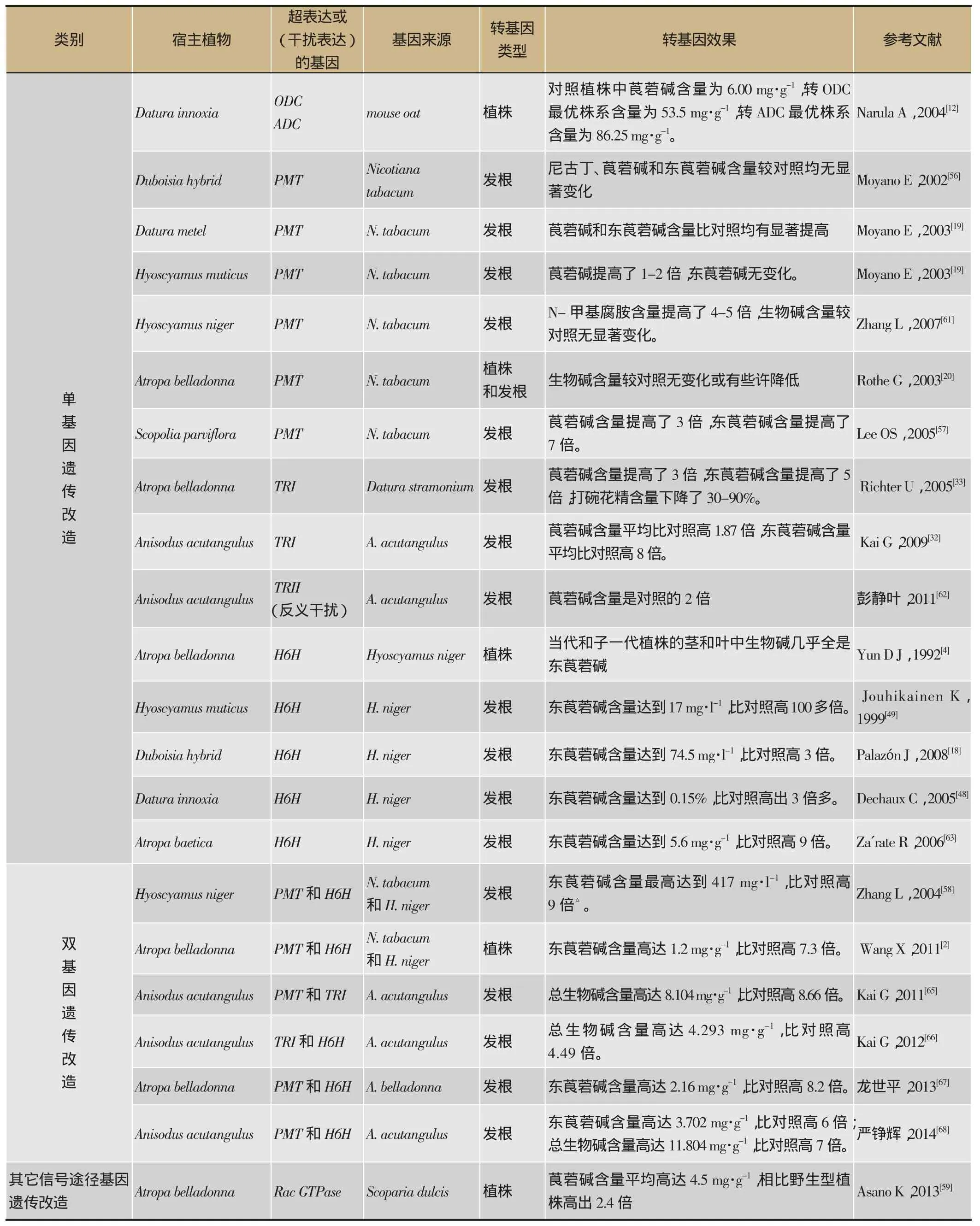
表1 托品烷类生物碱代谢工程研究
TRs首次于1993年在D. stramonium中克隆[35]。DsTRI和DsTRII基因组具有相同的组织结构,编码的氨基酸序列一致性高达64%,但是两者酶活力表现和底物特异性不同[31]。蛋白晶体结构表明两者都是同源二聚体,具有几乎相同的高级结构,但是托品酮在底物结合中心的定向完全相反,造成了两种还原产物的立体异构[36]。TRs的立体特异性是由底物结合部位少数几个氨基酸决定的,对其定点突变可以反转TRI和TRII之间的立体特异性[37]。目前,已从7个TAs资源植物中获得了该基因,包 括:D. stramonium[35],H. niger[31],A. luridus[25],A. acutangulus[32],Hyoscyamus senecionis[38],Withania coagulans[39]和Withania. somnifera[40]。与常见草本资源植物中TRI的根特异性表达不同,近期在后4种植物中发现TRI在地上部位也有表达,且已证实W. somnifera的叶能够独立地合成托品。本实验室最近从Datura arborea中克隆到一条TRI,发现也在各部位均有表达,且活性高于DsTRI[41]。
1.5 前体苯乳酸来源的支路途径
对于莨菪碱的另一合成前体,存在过托品酸和苯乳酸两种假说。直至1994年,Robins[42]利用同位素示踪实验确切地证明了苯丙酮酸和苯乳酸才是莨菪碱的合成前体,而非托品酸,莨菪碱的托品酸结构是在苯乳酸的酯化后通过分子重排形成。2014年,基于对颠茄各组织转录组数据的发掘,成功克隆了参与苯丙氨酸转氨反应生成苯丙酮酸的AbArAT4(Aromatic Amino Acid Aminotransferase,ArAT)基因。AbArAT4特异地在颠茄根中表达,与其它TAs合成途径基因表达部位一致[6];AbArAT4在进化关系上明显区别于其它植物芳香族氨基酸转氨酶,形成独立的一个分支;AbArAT4缺乏质体转运肽,预测定位于胞质。在近源物种土豆和番茄中,缺乏AbArAT4的直系同源基因,这与该基因在颠茄中参与次生代谢合成的功能有关。AbArAT4对底物苯丙氨酸和氨基受体4-羟基苯丙酮酸具有最高的催化效率,而其它芳香族氨基酸转氨酶更偏好于2-酮戊二酸、丙酮酸和草酰乙酸等氨基受体。在颠茄中沉默AbArAT4基因导致莨菪碱和东莨菪碱含量的显著下降,托品的大量积累,证明该基因参与了TAs的合成[6]。目前,ArAT基因在其它TAs资源植物中还未见报道。
1.6 海螺碱分子内重排生成莨菪碱
托品与苯乳酸通过酯化缩合生成海螺碱,由海螺碱到莨菪碱的合成涉及到分子同分异构化的过程,也即分子重排反应。该反应的机制有过长达十多年的争议:一派学者认为一种类似于依赖维生素B12的异构酶参与了该反应[43];另一派学者则提供了一个细胞色素P450催化的氧化产物中间体莨菪醛假说,莨菪醛需再经过一个未知的醇脱氢酶还原生成莨菪碱[44],双方均提供了相关的实验证据。直到2006年,Covello[45]基于cDNA文库筛选从H. niger中克隆到了第二种假说中的细胞色素P450酶基因CYP80F1(又叫littorine mutase/monooxygenase),确认CYP80F1参与了海螺碱的氧化生成莨菪醛,但是参与下一步反应的醇脱氢酶仍然未知。HnCYP80F1基因特异性地在莨菪根中表达,沉默HnCYP80F1基因导致莨菪碱含量大幅下降,海螺碱显著积累,然而超表达HnCYP80F1基因对莨菪碱含量并无影响,表明在H. niger中HnCYP80F1并不是TAs合成的限速酶。目前,基于同源克隆,已分别从A. luridus和颠茄中克隆到了该基因:AlCYP80F1基因表达受ASA和UV-B的强烈诱导[25];AbCYP80F1基因表达仅限制在根组织,与颠茄中TAs合成部位一致[46]。
1.7 H6H:东莨菪碱合成的最后一个限速酶
莨 菪 碱 6β-羟 化 酶(Hyoscyamine 6 betahydroxylase,H6H)是一种双功能酶,属于依赖α-酮戊二酸/铁离子的双加氧酶家族,它催化莨菪碱C6位的羟基化生成山莨菪碱(Anisodamine)和山莨菪碱的C6、C7环氧化两步连续反应生成东莨菪碱(scopolamine)。体外重组蛋白的酶活测试表明H6H的羟化活性要远高于环氧化活性[47]。H6H是东莨菪碱生物合成的最后一个限速酶,在多种TAs资源植物中超表达H6H无一例外的都提高了东莨菪碱的产量[4,48,49]。H6H基因首次于1991在H. niger中被克隆[5],这也是TAs生物合成分子生物学的开端。到目前为止,已在茄科6个属(Atropa、Hyoscyamus、Anisodus、Datura、Brugmansia和Scopolia)的12个物种中得到了该基因[50],但是只有4个H6Hs酶蛋白进行了酶活力测定,其中颠茄的H6H酶活性偏低,正好可以解释该物种中东莨菪碱含量显著低于其它物种[51]。在H. niger[52]、颠茄[53]和D. metal[54]中,H6H蛋白明确定位于根中柱鞘细胞。但是,近期在A. Acutangulus[55]、H. Senecionis[38]和D. arborea[50]中发现,H6H在根茎叶中均组成性地表达,尤其是DaH6H在老叶中表达量是须根的5倍,这一现象有待深入的研究。
2 托品烷生物碱代谢工程
TAs代谢工程随着合成途径基因的克隆稳步开展(表1)。第一例TAs代谢工程起始于1992年,Yun等[4]在颠茄中超表达HnH6H基因,发现转基因当代和子一代植株的茎叶中几乎全是东莨菪碱,表明H6H是很有效的遗传改造靶标基因。早期的TAs代谢工程聚焦于对H6H和PMT的单基因遗传改造,后来发现代谢流控制点酶TRI也是有效的靶标基因。超表达H6H基因无一例外地均提高了东莨菪碱的含量,而PMT在不同的物种中的作用则不尽相同:在D. metel, H. muticus和S. parviflora中超表达PMT基因均能提高TAs含量[56,57],而在Duboisia hybrid和颠茄中则没有效果[20,56],说明相同的合成途径在不同物种中具有不同的调控方式。
次生代谢物生物合成途径往往是复杂的多步酶促反应,超表达单个限速酶基因可能会限制下游的反应,后续的多步反应也会使效果逐渐减弱,最佳的策略应该是同时超量表达多个限速酶基因,形成推拉效应,使代谢流最大可能地流向目标产物。2004年,Zhang首次在H. niger发根中同时超表达两个关键酶基因PMT和H6H,使东莨菪碱含量达到了417 mg·L-1[58],证明了该策略的优越性。之后,该策略先后在颠茄和A. acutangulus中进行了多次有成效的尝试,尤其是双基因转化商业资源颠茄植株的获得,使东莨菪碱含量提高了7.3倍[2],为培育高产优质药源提供了原材料,具有极大的生产价值。
TAs的生物合成会受到其它信号途径的调节,遗传改造相关的信号途径可能会间接地影响TAs的积累。2013年Asano团队基于野甘草Scoparia dulcis中外源MeJA刺激胞外Ca2+内流产生胞内Ca2+级联信号,进而促进野甘草酸Scopadulcic acid合成的信号模型,将该模型中重要的成员Rac GTPase基因在颠茄中超表达,使转基因植株中莨菪碱含量比野生植株提高了2.4倍[59],创造了一种新的TAs代谢工程策略。
3 问题与展望
TAs生物合成的分子生物学和代谢工程研究开展了26年,取得了丰富的成果,但是仍然存在一些问题亟需解决。首先,TAs生物合成途径仍然没有完全打通,相关反应步骤尚不清楚,涉及到的酶基因尚未克隆。这些盲区包括1-甲基-△-吡咯啉正离子如何形成托品酮、托品和苯乳酸如何缩合生成海螺碱和苯丙酮酸如何还原生成苯乳酸,其中是否存在限速步骤也值得研究。合成途径的不完善对TAs合成生物学的开展也是很大的限制。其次,虽然TAs合成途径在所有资源植物中都相同,但是其调控方式可能因物种而异,典型的例子是PMT基因在不同物种中超表达效果不一。所以在D. stramonium和H. niger等模式植物中的研究成果很可能不能直接应用于商业药源植物颠茄,相关的研究必须要在颠茄本物种中取得突破。最后,目前对TAs生物合成的调控机制和转运机制还一无所知,相关的转录调控因子和转运蛋白也未见报道。值得期望的是,相关研究工作正在有序地、积极地开展。基于转录组数据鉴定支路合成途径基因AbArAT的突破,为TAs研究提供了新思路、新经验和大量基础数据,是近年来的重大成果。目前,陆续已有H. niger,颠茄和A. acutangulus共3个物种进行了转录组测序,我们实验室也首次获得了H. niger的MeJA诱导组数据(正在发表),深度发掘这些基础数据库,相信很快能在上述问题上取得更多的突破。
1 Oksman-Caldentey K M. Tropane and nicotine alkaloid biosynthesisnovel approaches towards biotechnological production of plant-derived pharmaceuticals. Curr Pharm Biotechnol, 2007, 8(4):203-210.
2 Wang X R, Chen M, Yang C X, et al. Enhancing the scopolamine production in transgenic plants of Atropa belladonna by overexpressing pmt and h6h genes. Physiol Plant, 2011, 143(4):309-315.
3 Oksman-Caldentey K M. Commentary on Verpoorte's review -Engineering the plant cell factory for secondary metabolite production. Transgenic Res, 2000, 9(4):323-343.
4 Yun D J, Hashimoto T, Yamada Y. Metabolic Engineering of Medicinal-Plants - Transgenic Atropa-Belladonna with an Improved Alkaloid Composition. Proc Natl Acad Sci U S A, 1992, 89(24):11799-11803.
5 Matsuda J, Okabe S, Hashimoto T, et al. Molecular-Cloning of Hyoscyamine 6-Beta-Hydroxylase, a 2-Oxoglutarate-Dependent Dioxygenase, from Cultured Roots of Hyoscyamus-Niger. J Biol Chem, 1991, 266(15):9460-9464.
6 Bedewitz M A, Gongora-Castillo E, Uebler J B, et al. A Root-Expressed L-Phenylalanine:4-Hydroxyphenylpyruvate Aminotransferase Is Required for Tropane Alkaloid Biosynthesis in Atropa belladonna. Plant Cell, 2014, 26(9):3745-3762.
7 Cui L J, Huang F F, Zhang D S, et al. Transcriptome exploration for further understanding of the tropane alkaloids biosynthesis in Anisodus acutangulus. Mol Genet Genomics, 2015, 290(4):1367-1377.
8 Gill S, Tuteja N. Polyamines and abiotic stress tolerance in plants. Plant Signal Behav, 2010, 5(1):26-33.
9 Deboer K D, Dalton H L, Edward F J, et al. RNAi-mediated downregulation of ornithine decarboxylase (ODC) leads to reduced nicotine and increased anatabine levels in transgenic Nicotiana tabacum L.. Phytochemistry, 2011, 72(4-5):344-355.
10 Chintapakorn Y, Hamill J D. Antisense-mediated reduction in ADC activity causes minor alterations in the alkaloid profile of cultured hairy roots and regenerated transgenic plants of Nicotiana tabacum. Phytochemistry, 2007, 68(19):2465-2479.
11 Robins R J, Parr a J, Bent E G, et al. Studies on the Biosynthesis of Tropane Alkaloids in Datura-Stramonium L Transformed Root Cultures .1. The Kinetics of Alkaloid Production and the Influence of Feeding Intermediate Metabolites. Planta, 1991, 183(2):185-195.
12 Narula A, Kumar S V, Pande D, et al. Agrobacterium-mediated Transfer of Arginine Decarboxylase and Ornithine Decarboxylase Genes to Datura innoxia Enhances Shoot Regeneration and Hyoscyamine Biosynthesis. J Plant Biochem Biot, 2004, 13(2):127-130.
13 Michael a J, Furze J M, Rhodes M J C, et al. Molecular cloning and functional identification of a plant ornithine decarboxylase cDNA. Biochem J, 1996, 314(1):241-248.
14 Nölke G, Schneider B, Agdour S, et al. Modulation of polyamine biosynthesis in transformed tobacco plants by targeting ornithine decarboxylase to an atypical subcellular compartment. Open Biot J, 2008, 2(1):183-189.
15 Capell T, Bassie L, Christou P. Modulation of the polyamine biosynthetic pathway in transgenic rice confers tolerance to drought stress. Proc Natl Acad Sci U S A, 2004, 101(26):9909-9914.
16 Bortolotti C, Cordeiro A, Alcazar R, et al. Localization of arginine decarboxylase in tobacco plants. Physiol Plant, 2004, 120(1):84-92.
17 Biastoff S, Brandt W, Drager B. Putrescine N-methyltransferase - The start for alkaloids. Phytochemistry, 2009, 70(15-16):1708-1718.
18 Palazon J, Navarro-Ocana A, Hernandez-Vazquez L, et al. Application of metabolic engineering to the production of scopolamine. Molecules, 2008, 13(8):1722-1742.
19 Moyano E, Jouhikainen K, Tammela P, et al. Effect of pmt gene overexpression on tropane alkaloid production in transformed root cultures of Datura metel and Hyoscyamus muticus. J Exp Bot, 2003, 54(381):203-211.
20 Rothe G, Hachiya A, Yamada Y, et al. Alkaloids in plants and root cultures of Atropa belladonna overexpressing putrescine N-methyltransferase. J Exp Bot, 2003, 54(390):2065-2070.
21 Hibi N, Higashiguchi S, Hashimoto T, et al. Gene expression in tobacco low-nicotine mutants. Plant Cell, 1994, 6(5):723-735.
22 Suzuki K, Yamada Y, Hashimoto T. Expression of Atropa belladonna putrescine N-methyltransferase gene in root pericycle. Plant Cell Physiol, 1999, 40(3):289-297.
23 Liu T, Zhu P, Cheng K D, et al. Molecular cloning and expression of putrescine N-methyltransferase from the hairy roots of Anisodus tanguticus. Planta Med, 2005, 71(10):987-989.
24 Kai G Y, Zhang Y, Chen J F, et al. Molecular characterization and expression analysis of two distinct putrescine N-methyltransferases from roots of Anisodus acutangulus. Physiol Plant, 2009, 135(2):121-129.
25 Qin B F, Ma L L, Wang Y X, et al. Effects of acetylsalicylic acid and UV-B on gene expression and tropane alkaloid biosynthesis in hairy root cultures of Anisodus luridus. Plant Cell Tissue and Organ Cult, 2014, 117(3):483-490.
26 Teuber M, Azemi M E, Namjoyan F, et al. Putrescine N-methyltransferases - a structure-function analysis. Plant Mol Biol, 2007, 63(6):787-801.
27 Kang Y M, Park D J, Min J Y, et al. Enhanced production of tropane alkaloids in transgenic Scopolia parviflora hairy root cultures overexpressing putrescine N-methyl transferase (PMT) and hyoscyamine-6 beta-hydroxylase (H6H). In Vitro Cell Dev PL, 2011, 47(4):516-524.
28 Deng F. Effects of glyphosate, chlorsulfuron, and methyl jasmonate on growth and alkaloid biosynthesis of jimsonweed (Datura stramonium L.). Pesticide Biochemistry and Phys, 2005, 82(1):16-26.
29 Jirschitzka J, Schmidt G W, Reichelt M, et al. Plant tropane alkaloid biosynthesis evolved independently in the Solanaceae and Erythroxylaceae. Proc Natl Acad Sci U S A, 2012, 109(26):10304-10309.
30 Drager B. Tropinone reductases, enzymes at the branch point of tropane alkaloid metabolism. Phytochemistry, 2006, 67(4):327-337.
31 Nakajima K, Oshita Y, Kaya M, et al. Structures and expression patterns of two tropinone reductase genes from Hyoscyamus niger. Biosci Biotechnol Biochem, 1999, 63(10):1756-1764.
32 Kai G Y, Li L, Jiang Y X, et al. Molecular cloning and characterization of two tropinone reductases in Anisodus acutangulus and enhancement of tropane alkaloid production in AaTRI-transformed hairy roots. Biotechnol Appl Biochem, 2009, 54(3):177-186.
33 Richter U, Rothe G, Fabian a K, et al. Overexpression of tropinone reductases alters alkaloid composition in Atropa belladonna root cultures. J Exp Bot, 2005, 56(412):645-652.
34 Nakajima K, Hashimoto T. Two tropinone reductases, that catalyzeopposite stereospecific reductions in tropane alkaloid biosynthesis, are localized in plant root with different cell-specific patterns. Plant Cell Physiol, 1999, 40(11):1099-1107.
35 Nakajima K, Hashimoto T, Yamada Y. Two tropinone reductases with different stereospecificities are short-chain dehydrogenases evolved from a common ancestor. Proc Natl Acad Sci U S A, 1993, 90(20):9591-9595.
36 Nakajima K, Yamashita A, Akama H, et al. Crystal structures of two tropinone reductases: Different reaction stereospecificities in the same protein fold. Proc Natl Acad Sci U S A, 1998, 95(9):4876-4881.
37 Nakajima K, Kato H, Oda J, et al. Site-directed mutagenesis of putative substrate-binding residues reveals a mechanism controlling the different stereospecificities of two tropinone reductases. J Biol Chem, 1999, 274(23):16563-16568.
38 Dehghan E, Ahmadi F S, Ravandi E G, et al. An atypical pattern of accumulation of scopolamine and other tropane alkaloids and expression of alkaloid pathway genes in Hyoscyamus senecionis. Plant Physiol Biochem, 2013, 70:188-194.
39 Kushwaha a K, Sangwan N S, Tripathi S, et al. Molecular cloning and catalytic characterization of a recombinant tropine biosynthetic tropinone reductase from Withania coagulans leaf. Gene, 2013, 516(2):238-247.
40 Kushwaha A K, Sangwan N S, Trivedi P K, et al. Tropine Forming Tropinone Reductase Gene from Withania somnifera (Ashwagandha):Biochemical Characteristics of the Recombinant Enzyme and Novel Physiological Overtones of Tissue-Wide Gene Expression Patterns. Plos One, 2013, 8(9):e74777.
41 Qiang W, Xia K, Zhang Q Z, et al. Functional characterisation of a tropine-forming reductase gene from Brugmansia arborea, a woody plant species producing tropane alkaloids. Phytochemistry, 2016, 127:12-22.
42 Robins R J, Woolley J G, Ansarin M, et al. Phenyllactic acid but not tropic acid is an intermediate in the biosynthesis of tropane alkaloids in Datura and Brugmansia transformed root cultures. Planta, 1994, 194(1):86-94.
43 Ollagnier S, Kervio E, Retey J. The role and source of 5’-deoxyadenosyl radical in a carbon skeletonrearrangement catalyzed by a plant enzyme. FEDS Lett, 1998, 437(3):309-312.
44 Robins R J, Bachmann P, Woolley J G. Biosynthesis of Hyoscyamine Involves an Intramolecular Rearrangement of Littorine. J Chem Soc Perkin Trans 1, 1994, 25(28):615-619.
45 Li R, Reed D W, Liu E W, et al. Functional genomic analysis of alkaloid biosynthesis in Hyoscyamus niger reveals a cytochrome P450 involved in littorine rearrangement. Chem Biol, 2006, 13(5):513-520.
46 Qiang W, Wang Y X, Zhang Q Z, et al. Expression pattern of genes involved in tropane alkaloids biosynthesis and tropane alkaloids accumulation in Atropa belladonna. Zhongguo Zhong Yao Za Zhi, 2014, 39(1):52-58.
47 Hashimoto T, Matsuda J, Yamada Y. Two-step epoxidatiun of hyascyamine to scopolamine is catalyzed by bifunctional hyoscyamine 6β-hydroxylase. FEDS Lett, 1993, 329(1-2):35-39.
48 Dechaux C, Boitel-Conti M. A strategy for overaccumulation of scopolamine in Datura innoxia hairy root cultures. Acta Biol Cracov Bot, 2005, 47(1):101-107.
49 Jouhikainen K, Lindgren L, Jokelainen T, et al. Enhancement of scopolamine production in Hyoscyamus muticus L. hairy root cultures by genetic engineering. Planta, 1999, 208(4):545-551.
50 强玮,侯艳玲,李笑,等. 木本曼陀罗中催化东莨菪碱生物合成关键步骤的H6H基因克隆与表达分析. 药学学报, 2015, 50(10):1346-1355.
51 Li J, Van Belkum M J, Vederas J C. Functional characterization of recombinant hyoscyamine 6 beta-hydroxylase from Atropa belladonna. Bioorg Med Chem, 2012, 20(14):4356-4363.
52 Hashimoto T, Hayashi A, Amano Y, et al. Hyoscyamine 6 betahydroxylase, an enzyme involved in tropane alkaloid biosynthesis, is localized at the pericycle of the root. J Biol Chem, 1991, 266(7):4648-4653.
53 Suzuki K, Yun D J, Chen X Y, et al. An Atropa belladonna hyoscyamine 6 beta-hydroxylase gene is differentially expressed in the root pericycle and anthers. Plant Mol Biol, 1999, 40(1):141-152.
54 Pramod K K, Singh S, Jayabaskaran C. Expression of hyoscyamine 6 beta-hydroxylase in the root pericycle cells and accumulation of its product scopolamine in leaf and stem tissues of Datura metel L.. Plant Sci, 2010, 178(2):202-206.
55 Kai G, Chen J, Li L, et al. Molecular cloning and characterization of a new cDNA encoding hyoscyamine 6beta-hydroxylase from roots of Anisodus acutangulus. J Biochem Mol Biol, 2007, 40(5):715-722.
56 Moyano E, Fornale S, Palazon J, et al. Alkaloid production in Duboisia hybrid hairy root cultures overexpressing the pmt gene. Phytochemistry, 2002, 59(7):697-702.
57 Lee O S, Kang Y M, Jung H Y, et al. Enhanced production of tropane alkaloids in Scopolia parviflora by introducing the PMT (putrescine N-methyltransferase) gene. In Vitro Cell Dev Pl, 2005, 41(2):167-172.
58 Zhang L, Ding R X, Chai Y R, et al. Engineering tropane biosynthetic pathway in Hyoscyamus niger hairy root cultures. Proc Natl Acad Sci U S A, 2004, 101(17):6786-6791.
59 Asano K, Lee J B, Yamamura Y, et al. Enhanced accumulation of atropine in Atropa belladonna transformed by Rac GTPase gene isolated from Scoparia dulcis. Transgenic Res, 2013, 22(6):1249-1255.
60 Singh A, Nirala N K, Das S, et al. Overexpression of odc (ornithine decarboxylase) in Datura innoxia enhances the yield of scopolamine. Acta Physiologiae Plantarum, 2011, 33(6):2453-2459.
61 Zhang L, Yang B, Lu B B, et al. Tropane alkaloids production in transgenic Hyoscyamus niger hairy root cultures over-expressing Putrescine N-methyltransferase is methyl jasmonate-dependent. Planta, 2007, 225(4):887-896.
62 彭静叶, 彭梅芳. 反义托品酮还原酶Ⅱ基因对三分三的遗传转化及生物碱含量测定. 安徽农业科学, 2011, 39(12):6968-6970.
63 Zarate R, E, Jaber-Vazdekis N, Medina B, et al. Tailoring tropane alkaloid accumulation in transgenic hairy roots of Atropa baetica by over-expressing the gene encoding hyoscyamine 6 beta-hydroxylase. Biotechl Lett, 2006, 28(16):1271-1277.
64 Yang C X, Chen M, Zeng L J, et al. Improvement of tropane alkaloids production in hairy root cultures of Atropa belladonna by overexpressing pmt and h6h genes. Plant Omics, 2011, 4(1):29-33.
65 Kai G Y, Yang S, Luo X Q, et al. Co-expression of AaPMT and AaTRI effectively enhances the yields of tropane alkaloids in Anisodus acutangulus hairy roots. Bmc Biotechnol, 2011, 11:43.
66 Kai G Y, Zhang A, Guo Y Y, et al. Enhancing the production of tropane alkaloids in transgenic Anisodus acutangulus hairy root cultures by over-expressing tropinone reductase I and hyoscyamine-6 betahydroxylase. Mol Biosyst, 2012, 8(11):2883-2890.
67 龙世平, 卢衍, 王亚雄, 等. 过表达内源PMT和H6H基因对颠茄发根托品烷类生物碱合成的影响. 药学学报, 2013, 48(2):243-249.
68 严铮辉, 潘夕春, 强玮, 等. PMT和H6H双基因共转化提高三分三托品烷类生物碱质量分数. 西南大学学报(自然科学版), 2014, 36(2):21-27.
Advances in Biosynthesis and Metabolic Engineering of Tropane Alkaloids
Qiang Wei1,2, Fan Yufang1,2, Liao Zhihua1,2
(1. School of Life Sciences, Southwest University, Chongqing 400715, China; 2. SWU-TAAHC Medicinal Plant Joint R&D Centre, Agricultural and Animal Husbandry College, Tibet University, Nyingchi of Tibet, Chongqing 860000, China)
Tropane alkaloids, such as hyoscyamine (or its more stable racemate atropine) and scopolamine, are remembered as the oldest drugs in medicine with wide pharmaceutical applications clinically for their mydriatic, antispasmodic, anticholinergic, analgesic and sedative properties. Presently, the supply of tropane alkaloids are entirely rested on their isolation from plant materials, yet the low contents of tropane alkaloids in plants raise the requirement to breed new varieties of high-yield tropane alkaloids and improving the production of tropane alkaloids in hairy root cultures or plants by biotechnology has be a research focus in the field of secondary metabolism. For the past decade, there have been important progresses on biosynthesis of tropane alkaloids and their molecular biology, some new pathway genes have been identified and many achievements have also been acquired in metabolic engineering of tropane alkaloids. This review summarized the recent advances in above aspects, and the problems and orientations of future research are also discussed and proposed.
Tropane alkaloids, biosynthesis, metabolic engineering
10.11842/wst.2016.11.011
R931.6
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-10-25
修回日期:2016-10-25
* 国家自然科学基金委面上项目(31370333):WRKY类转录因子在托品烷类生物碱生物合成中的调控作用研究,负责人:廖志华;科学技术部国家“863计划”项目(2011AA100605):植物代谢产物生物反应器产品研发任务3-东莨菪碱植物代谢产物生物反应器研制,负责人:廖志华。
** 通讯作者:廖志华,教授,主要研究方向:植物合成生物学与代谢工程。
