丹参中主要活性成分生物合成的研究进展*
2016-02-14刘薇薇陈军峰陈万生
刘薇薇,陈军峰,肖 莹,张 磊,陈万生**
(1.中国人民解放军第二军医大学附属长征医院 上海 200003;2.上海中医药大学附属普陀医院上海 200233;3.中国人民解放军第二军医大学药学院药用植物学教研室 上海 200433)
丹参中主要活性成分生物合成的研究进展*
刘薇薇2,陈军峰1,肖 莹1,张 磊3,陈万生1**
(1.中国人民解放军第二军医大学附属长征医院 上海 200003;2.上海中医药大学附属普陀医院上海 200233;3.中国人民解放军第二军医大学药学院药用植物学教研室 上海 200433)
丹参酮类和丹参酚酸类化合物是丹参中两类主要的活性成分,其含量水平是丹参药效的决定因素,直接体现了药材的品质。为深入解析丹参的品质内涵以提升丹参品质,学者们开展了一系列研究以阐明丹参中活性成分的生物合成机制及累积特征。近年来,随着更高效的基因组、代谢组等研究手段的应用,丹参活性成分的生物合成研究获得了快速发展,本研究对该领域研究进展进行综述,为丹参的活性成分及其药材品质的深入研究提供理论依据。
丹参 丹参酮 丹参酚酸 生物合成
中药丹参(Salviae Miltiorrhizae Radix et Rhizoma)是唇形科植物丹参Salvia miltiorrhiza Bge.的干燥根和根茎,其有效成分具有良好的扩张血管、治疗心肌缺血、抗动脉粥样硬化、改善微循环以及抗菌消炎等活性,在中国广泛应用于心脑血管系统疾病的治疗。伴随着中国心脑血管疾病的高发态势,丹参相关的药材、制剂、保健品等实际需求也高速增长。随着丹参产业规模的不断扩大,丹参药材的品质对整个产业的影响也更加显著,涉及该产业各种产品药效、企业成本控制、种植户收入等主要环节,以及延伸的一系列土地、环境等问题。根据2015年版《中华人民共和国药典》要求,以总丹参酮(Tanshinones)含量不低于0.25%、丹参酚酸B(Salvianolic acid B)不低于0.3%作为丹参药材质量的主要评价指标[1]。因此,以丹参酮及丹参酚酸两类化合物为切入点,研究其在丹参中生物合成与累积的机制,已经成为科学阐明丹参的品质内涵、实现丹参药材品质控制的主要途径。近年来,随着高通量代谢组、基因组、转录组等研究手段广泛应用于丹参的研究,丹参活性成分生物合成的研究发展更加迅速,产生了许多突破性成果,本文对相应的成果进行综合概述,为丹参活性成分的生物合成研究提供较为完善的现状分析。
1 高通量检测技术在丹参活性成分研究中的应用
1.1 代谢组学技术在丹参活性成分合成途径中的应用
随着化合物检测技术水平的提高和技术手段的不断丰富,代谢组学技术已经成为研究中药活性成分生物合成的主要手段之一。在近期研究中,质谱分析已经成为研究丹参活性成分的主要手段。Lu W
等[2]利用HPLC-MS/MS实现了对丹参主要活性成分的快速识别及检测,包括丹参酚酸类物质及其前体共10个化合物,并成功应用于多个丹参活性成分合成途径的研究。在最近丹参相关的研究中,高通量代谢组学分析开始扮演越来越重要的角色。利用飞行时间质谱(Q-TOF)、傅立叶变换质谱(Orbitrap)等检测平台,通过分析化合物的精确分子量和质谱信息,可以快速实现单参中两类活性成分合成途径上大部分相关化合物的指认及定量(表1)。Di P等[3]对丹参酚酸进行了全途径化合物的指认和定量,并且在此基础上开展了丹酚酸合成途径的同位素示踪研究。Cui G等[4]建立了包括丹参酮类在内的39个化合物的快速指认方法,并且应用到丹参二萜合酶蛋白家族的研究中。Zhao Q等[5]建立了丹参中40种化合物的快速检测方法,同时期还利用气相色谱-质谱联用(GC-MS)技术检测萜类途径上游化合物。除了主要活性成分合成途径研究外,高通量代谢组学分析还可同时对相关的初生代谢途径进行更大范围的分析(如莽草酸途径、氨基酸合成等途径),从而整体了解丹参活性成分的生物合成。
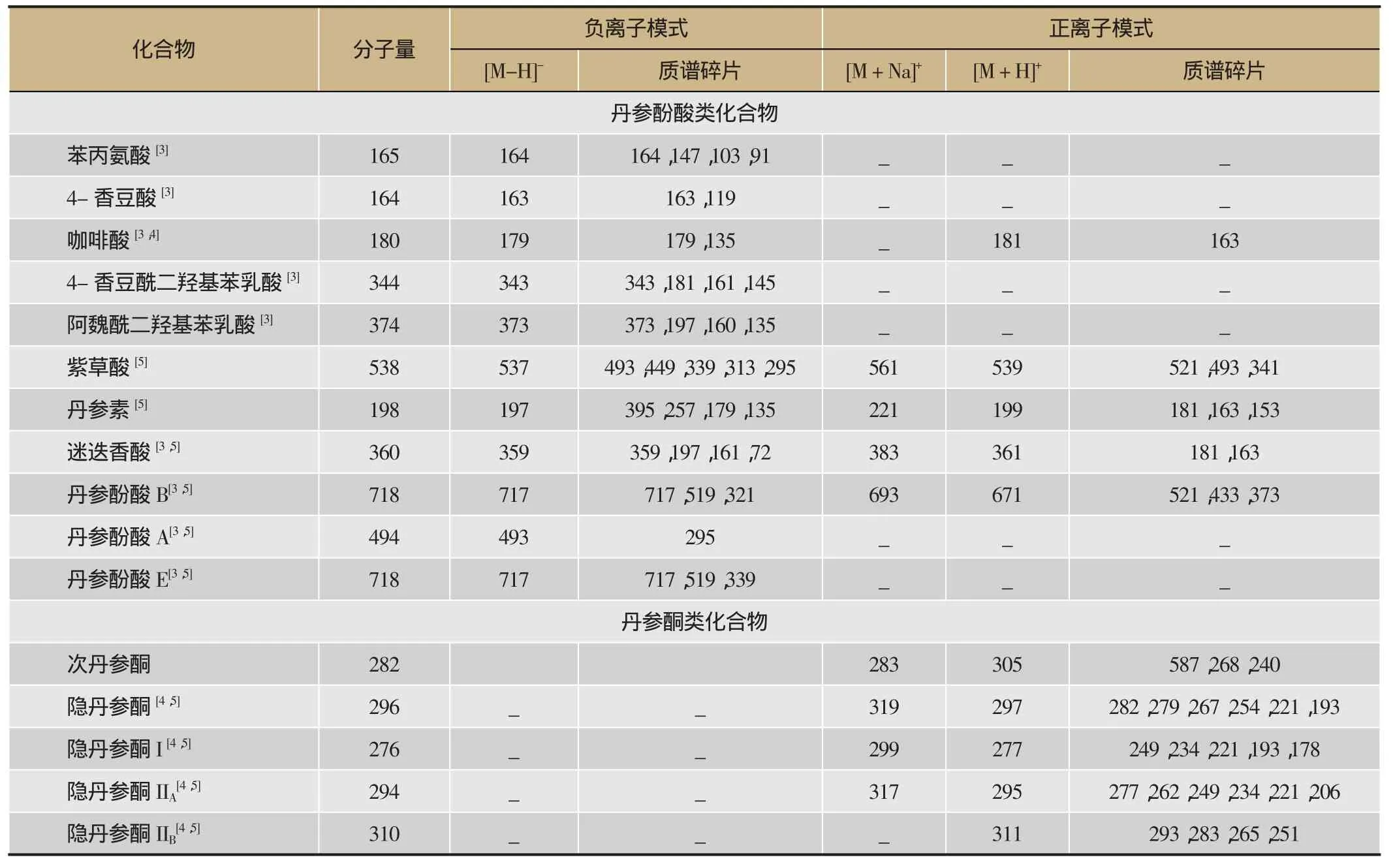
表1 丹参主要活性成分及其合成途径化合物的质谱信息
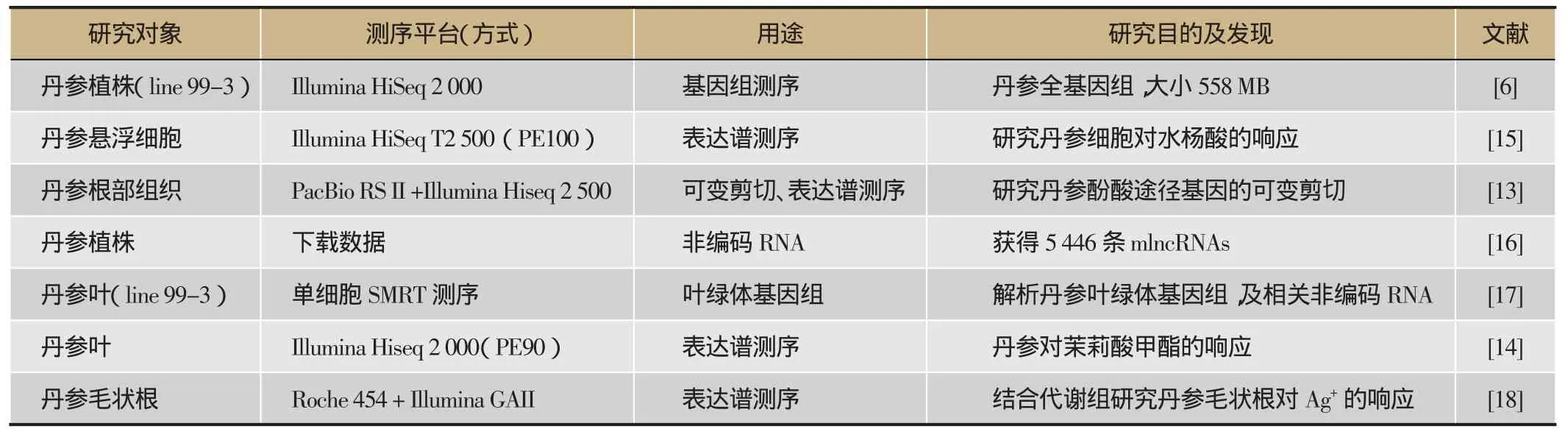
表2 高通量测序技术在丹参活性成分合成途径的应用
1.2 高通量测序在丹参活性成分代谢合成中的应用
随着高通量测序技术的飞速发展以及成本下降,基因组测序、转录组测序已经成为研究中药有效成分生物合成的最有效工具,并广泛应用于丹参活性成分合成途径的研究(表2)。陈士林、漆小泉课题组采用Illumina测序平台首次完成了丹参基因组测序及拼接工作,获得了大小为558 MB的丹参基因组,预测包含30 478个蛋白编码基因[6]。全基因组序列的获得,使我们可以获得所有可能参与到丹参活性成分合成途径的完整基因信息,包括丹参酚酸途径[7],丹参酮途径[8],以及众多转录因子家族的完整信息[9-11]。
在基因组注释的基础上,使用高通量测序进行表达谱测序(RNA sequencing),可以进一步研究与丹参活性成分生物合成相关基因的表达特征,从而准确解析活性成分的合成特征以及调控机制。研究者可以检测相关基因在不同丹参器官[12]、不同根部组织[13]和不同影响因素下的转录变化[11,14,15];同时结合不同层面的代谢组分析,解析代谢-转录变化的关联性,进而实现对丹参酮及丹参酚酸类成分在丹参中生物合成途径的深入、准确的解析。
2 丹参活性成分的生物合成途径
2.1 丹参酮的生物合成途径
丹参酮属于二萜醌类化合物,其生物合成途径起始于萜类化合物的通用途径即生成异戊二烯基焦磷酸(Isopentenyl Pyrophosphate,IPP)的甲羟戊酸途径(Mevalonic Acid Pathway,MVA)和生成二甲烯丙基焦磷酸(Dimethylallyl Pyrophosphate,DMAPP)的丙酮酸/磷酸甘油醛途径(MEP/DOXP Pathway,DXP)。两个C5化合物结合生成牻牛儿醇焦磷酸((E)-Geranyl pyrophosphate,GPP),继而依次转化为法尼基焦磷酸((E,E)-Farnesyl Pyrophosphate,FPP),牻牛儿基牻牛儿基焦磷酸((E,E,E)-geranylgeranyl pyrophosphate,GGPP)。在早期的研究中,因受限于有限的背景信息,主要针对萜类上游通用途径开展丹参酮生物合成研究。丹参中的乙酰辅酶A酰基转移酶(AACT,Accession No. EF635969)、3-羟基-3-甲基戊二酰辅酶A合成酶(HMGS,Accession No. DQ243700)、3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR,Accession No. EU680958)、脱氧-D-木酮糖-5-磷酸合成酶(DXS,Accession No. EU670744、FJ643618)、4-(5-焦磷酸胞苷)-2-C-甲基-D-赤藓醇激酶(CMK,Accession No. EF534309)、2-C-甲基赤藓醇-2,4-环焦磷酸合成酶(MCS,Accession No. JX233816)、1-羟基-2-甲基-2-(E)-丁烯基-4-焦磷酸还原酶(HDR)、牻牛儿基牻牛儿基焦磷酸环化酶(GGPPS,Accession No. FJ643617)等一系列萜类途径中的催化酶及其编码基因被依次获得。
在此基础上,基于更加丰富的丹参基因信息,黄璐琦课题组将丹参酮的合成途径进行了一系列解析(图1A)。丹参酮类化合物属醌类二萜化合物,此萜类途径分支起始于GGPP向半日花二烯/古巴基二磷酸酯(Labdadienyl/copalyl Diphosphate,CPP)的转化,进而生成次丹参酮二烯(Miltiradiene)。为了解析这两步催化步骤的机制,Gao W等[19]对丹参根部组织的cDNA文库进行筛选,分别获得了古巴基焦磷酸合酶(CPP synthases,SmCPS1,Accession No. EU003997)和类贝壳杉烯合酶(Kaurene synthaselike,SmKSL1,Accession No. EF635966)。体外酶活实验表明,SmCPS1不具有异构特异性,可以催化GGPP转化为ent-CPP和syn-CPP,该蛋白是被子植物中获得的第一个对GGPP具有特异催化活性的Class II二萜环化酶。同时,SmKSL1也是第一个从被子植物中获得的对CPP具有特异催化活性的Class I二萜合成酶。Guo等[20]对Ag+诱导的丹参毛状根进行转录组分析,筛选获得了6个根特异表达的细胞色素P450(Cytochrome P450,CYP)候选基因。通过体外活性筛选,证明CYP76AH1(Accession No. JX422213)可以催化次丹参酮二烯发生羟基化生成弥罗松酚(Ferruginol)。接下来,Guo等[21]进一步发现CYP76AH3可以催化弥罗松酚11位羟基化或7位酮基化,分别生产11-羟基弥罗松酚(11-Hydroxy ferruginol)和柳杉酚(Sugiol);随后两个产物经CYP76AK1催化20位羟基化生成10-羟甲基四氢次 丹 参 酮(10-Hydroxymethyl tetrahydromiltirone)和11,20-二羟基柳杉酚(11,20-Dihydroxy sugiol)。然而C-14和C-17如何发生环氧化,这个途径怎样继续生成次丹参酮(Miltirone)、隐丹参酮(Cyrptotanshinone)、丹参酮IIA(Tanshinone IIA)、丹参酮I(Tanshinone I)(图1A)等活性成分还需要进一步的探索。
2.2 丹参酚酸的生物合成途径
丹参酚酸类化合物的生物合成途径起始于苯丙素通用途径和酪氨酸途径。早期的研究中,丹参酚酸途径的研究主要参考彩叶草(Coleus Blumei)、紫草(Lithospermum erythrorhizon)等物种中已报道的途径。分别由苯丙氨酸(L-Phenylalanine)经脱氨、羟化、辅酶A连接三步催化,生成香豆酰辅酶A(4-Coumaroyl-CoA);酪 氨 酸(L-Tyrosine)经转氨基、还原两步催化反应生成4-羟基苯乳酸(4-Hydroxyphenyllactic acid)。 两 条 支 路 的产物经BAHD家族酰基转移酶迷迭香酸合成酶(Rosmarinic acid synthase,RAS)催化结合生产4-香豆酰基-4-羟基苯乳酸(4-coumaroyl-4'-hydroxyphenyllactic acid),进 而 被CYP98A14催化,于3'和4'位依次发生羟基化生成4-香豆酰基-3',4'-羟 基 苯 乳 酸(4-coumaroyl-3',4'-hydroxyphenyllactic acid)及4-咖啡酰基-3',4'-羟基苯乳酸(4-caffeoyl-3',4'-hydroxyphenyllactic acid)。 然而,Di P等发现[3],丹参中酚酸类成分的累积特征与其他产生酚酸化类合物的唇形科植物截然不同,这个现象提示丹参中存在着特殊的酚酸合成路径。通过13C同位素标记代谢流分析(13C metabolic flux analysis),结果显示,丹参的迷迭香酸(Rosmarinic Acid,RA)合成途径确实与植物的已知途径存在差异。主要差异发生在4-羟基苯乳酸的转化上,丹参中4-羟基苯乳酸先经过3位羟基化才与4-香豆酰辅酶A结合,该结果表明除了CYP98A14外,还有一个未知CYP蛋白存在于这个途径。除此之外,目前为止,植物细胞中RA怎样转化为丹参酚酸B(Salvianolic Acid B,SAB)还是一个未知领域。通过该研究可以推测出,丹参酚酸B由两个分别于2位、8位发生电子重排的RA分子结合而成;进一步推测可得,植物中的漆酶(Laccase)家族可能具有类似催化功能。通过不同根部组织的表达谱分析,1个漆酶编码基因SmLAC5的转录与丹参酚酸途径具有最显著的转录关联性,为进一步筛选丹参酚酸B合成催化蛋白提供了重要提示[22]。
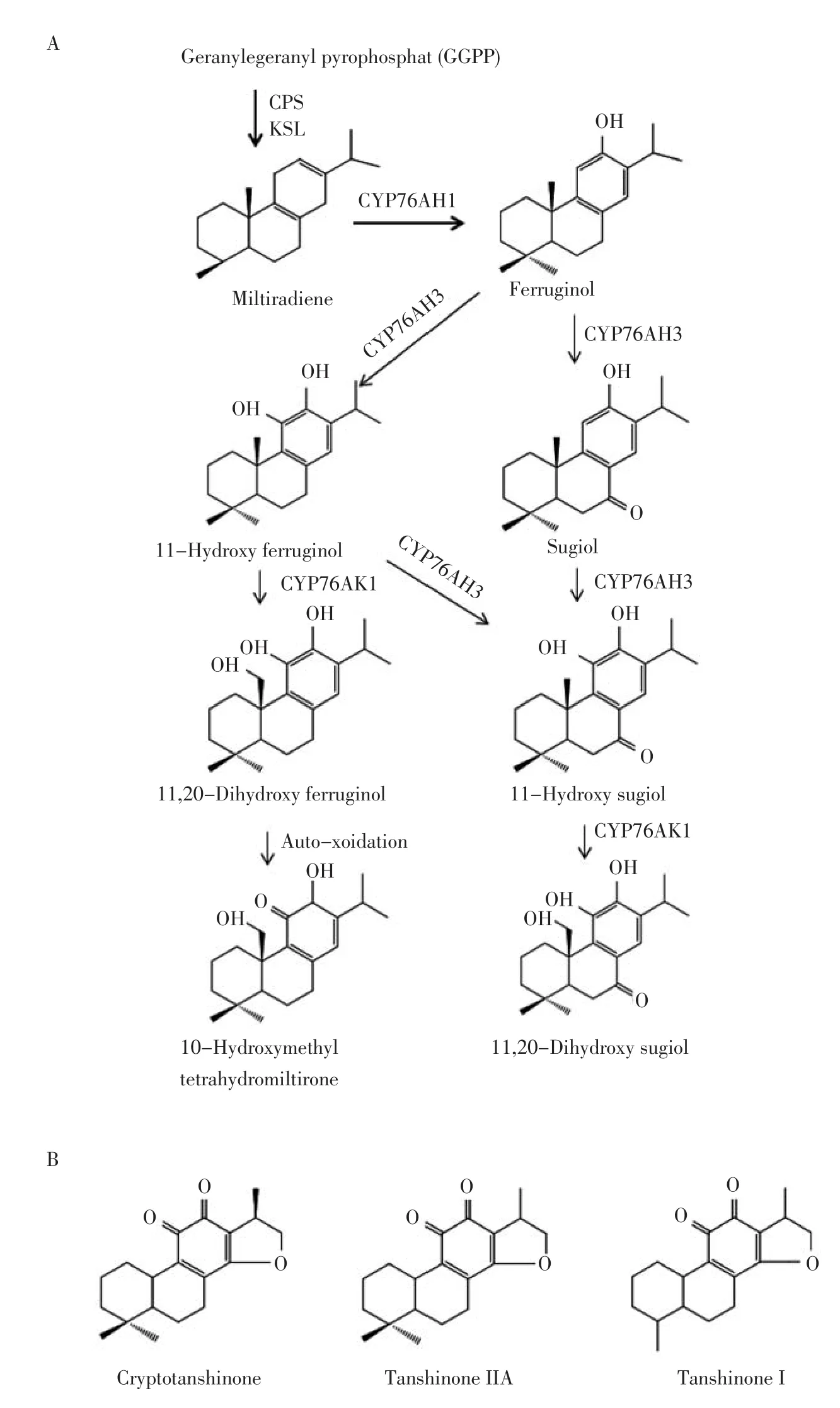
图1 丹参酮类化合物的生物合成途径
2.3 丹参活性成分合成途径的转录调控机制

图2 丹参中酚酸类成分的生物合成途径
随着丹参酮及丹参酚酸类合成途径被逐渐阐明,其调控机制的阐明成为下一个研究的热点。基于转录调控可以更有效地对合成途径实行调控,更高效地提高丹参中活性成分的合成。植物激素茉莉酸甲酯(Methyl Jasmonate,MeJA)基于植物抗逆反应机制,能够高效引起植物代谢途径的转录调控,是公认的提高植物次生代谢产物的诱导因子,可以诱导丹参酮类、酚酸类化合物的合成大幅提升[14,23,24],以此为切入点,Zhou Y等[25]对丹参中参与MeJA信号响应的关键调控因子MYC2开展了研究,确认了其对MeJA信号途径的控制作用,初步确认SmMYC2通过调控SmHCT6和 SmCYP98A14两个基因的转录水平而调控酚酸类化合物的合成。此外,JAZ蛋白作为另一类MeJA信号途径的重要开关也被证明对丹参酮、丹参酚酸类途径具有明显的调控作用[21]。除了MeJA外,Ag+[27]、水杨酸[15]等分子都被证明可以有效激活丹参两类活性成分的合成途径,为我们从多角度进一步全面阐明这些合成途径的转录调控机制提供了理想的研究体系。
3 丹参活性成分的生物合成途径的代谢调控
3.1 丹参活性成分合成途径的次生代谢工程研究
基于对途径的认知,Xiao Y等[28]开展了丹参酚酸途径的代谢工程研究,采用多种途径调控策略,将途径中的SmC4H、SmTAT、SmHPPR基因过表达激活合成途径,通过RNAi抑制SmHPPD基因以抑制代谢支路,最终发现将TAT基因和HPPR基因共表达是最有效的调控策略,可以分别将RA和丹参酚酸B的含量提高3.3倍和4.4倍。为了提高丹参酮的含量,Kai等[29]将SmGGPPS,SmHMGR,SmDXS等基因过表达,发现共表达SmGGPPS、SmHMGR可以大幅提高丹参毛状根中丹参酮类的含量达4.74倍。
基于MeJA对丹参活性成分调控的显著作用,Gu X C等[30]通过提高SmAOC(Allene oxide cyclase)基因的表达,提升丹参中内源茉莉酸水平的含量,从而实现了对丹参活性成分的高效调控。Zhang Y等[31]采用组合的遗传操作,将外源转录因子(Anthocyanin Pigment 1 Transcription Factor,AtPAP1)导入丹参中,同时通过抑制SmCCR(Cinnamoyl-CoA reductase)及 SmCOMT(Caffeic acid O-methyltransferase)基因的转录抑制丹参苯丙素网络中的其他支路,这个组合策略使丹参酚酸B的含量提高了3倍。利用玉米中的C1转录调控因子,Zhao S[32]等发现丹参中丹参酮的含量可以提高3.4倍,而同时酚酸类含量却降低了37%,这个研究实现了对合成途径的靶标性调控,对将来实现丹参品质的精确控制具有借鉴意义。
3.2 丹参活性成分的合成生物学研究
利用合成生物学策略,使用微生物细胞生产有价值的天然产物,是解决药材资源问题的另一个理想途径。Guo J等[20]将已知的丹参酮途径在酵母中重构,获得了可以合成丹参酮前体弥罗松酚的酵母细胞,经过元件优化,使其发酵产量达到了10.5 mg·L-1。而随着丹参酮合成途径的解析,必将能够实现丹参酮活性物质的高效发酵生产。对于酚酸类途径,已有报道在大肠杆菌细胞内实现了全合成,但是还没有获得较高的产率,而丹参中特异存在的酚酸途径的阐明[3],则为这项研究提供了一个潜在的高效途径以及相关的合成元件。
4 展望
鉴于丹参在中药市场上具有重要地位,其活性成分又极具代表性,目前越来越多的国内外顶级科研团队开始关注丹参的研究,随着大量科研成果的累积,丹参已经逐渐被视为药用植物中的“模式植物”[33]。对丹参研究的飞速发展将极大地从各个方面提升这一传统药材的应用。随着丹参活性成分合成机制一步步被解析,我们可以从活性成分角度出发,逐步阐明丹参药材品质的科学内涵,从而帮助我们制定更加科学准确的丹参药材质量标准、培育优质且稳定的丹参种质、形成科学的栽培种质管理体系,以及利用工业化手段生产丹参中的活性成分等。最终,通过解决丹参药材的资源和品质两大问题,逐步实现中药丹参产业的现代化。
1 国家药典委员会. 中华人民共和国药典(一部). 北京:中国医药科技出版社, 2015:76-77.
2 Lu W, Gao S, Xiao Y, et al. A liquid chromatographic–tandem mass spectrometric method for the quantitation of eight components involved in lithospermic acid B biosynthesis pathway in Salvia miltiorrhiza hairy root cultures. J Med Plants Res, 2011, 5(9):1664-1672.
3 Di P, Zhang L, Chen J, et al. 13C Tracer reveals phenolic acids biosynthesis in hairy root cultures of Salvia miltiorrhiza. ACS Chem Biol, 2013, 8(7):1537-1548.
4 Cui G, Duan L, Jin B, et al. Functional divergence of diterpene syntheses in the medicinal plant Salvia miltiorrhiza. Plant Physiol, 2015, 169(3):1607-1618.
5 Zhao Q, Song Z, Fang X, et al. Effect of genotype and environment on Salvia miltiorrhiza roots using LC/MS-based metabolomics. Molecules, 2016, 21(4):414.
6 Xu H, Song J, Luo H, et al. Analysis of the genome sequence of the medicinal plant Salvia miltiorrhiza. Mol Plant, 2016, 9(6):949-952.
7 Wang B, Sun W, Li Q, et al. Genome-wide identification of phenolic acid biosynthetic genes in Salvia miltiorrhiza. Planta, 2015, 241(3):711-725.
8 Ma Y, Yuan L, Wu B, et al. Genome-wide identification and characterization of novel genes involved in terpenoid biosynthesis in Salvia miltiorrhiza. J Exp Bot, 2012, 63(7):2809-2823.
9 Zhang X, Luo H, Xu Z, et al. Genome-wide characterisation and analysis of bHLH transcription factors related to tanshinone biosynthesis in Salvia miltiorrhiza. Sci Rep, 2015, 5:11244.
10 Li C, Lu S. Genome-wide characterization and comparative analysis of R2R3-MYB transcription factors shows the complexity of MYB-associated regulatory networks in Salvia miltiorrhiza. BMC Genomics, 2014, 15:277.
11 Xu Z, Ji A, Song J, et al. Genome-wide analysis of auxin response factor gene family members in medicinal model plant Salvia miltiorrhiza. Biol Open, 2016, 5(6):848-857.
12 Yang L, Ding G, Lin H, et al. Transcriptome analysis of medicinal plant Salvia miltiorrhiza and identification of genes related to tanshinone biosynthesis. PloS One, 2013, 8(11):e80464.
13 Xu Z, Peters R J, Weirather J, et al. Full-length transcriptome sequences and splice variants obtained by a combination of sequencing platforms applied to different root tissues of Salvia miltiorrhiza, and tanshinone biosynthesis. Plant J, 2015, 82(6):951-961.
14 Luo H, Zhu Y, Song J, et al. Transcriptional data mining of Salvia miltiorrhiza, in response to methyl jasmonate to examine the mechanism of bioactive compound biosynthesis and regulation. Physiol Plant, 2014, 152(2):241-255.
15 Zhang X, Dong J, Liu H, et al. Transcriptome sequencing in response to salicylic acid in Salvia miltiorrhiza. Plos One, 2016, 11(1):e0147849.
16 Li D, Shao F, Lu S. Identification and characterization of mRNA-like noncoding RNAs in Salvia miltiorrhiza. Planta, 2015, 241(5):1131-1143.
17 Qian J, Song J, Gao H, et al. The complete chloroplast genome sequence of the medicinal plant Salvia miltiorrhiza. PloS One, 2013, 8(2):e57607.
18 Gao W, Sun H X, Xiao H, et al. Combining metabolomics and transcriptomics to characterize tanshinone biosynthesis in Salvia miltiorrhiza. BMC Genomics, 2014, 15:73.
19 Gao W, Hillwig M L, Huang L, et al. A functional genomics approach to tanshinone biosynthesis provides stereochemical insights. Org Lett, 2009, 11(22):5170-5173.
20 Guo J, Zhou Y J, Hillwig M L, et al. CYP76AH1 catalyzes turnover of miltiradiene in tanshinones biosynthesis and enables heterologous production of ferruginol in yeasts. Proc Nat Acad Sci U S A, 2013, 110(29):12108-12113.
21 Guo J, Ma X, Cai Y, et al. Cytochrome P450 promiscuity leads to a bifurcating biosynthetic pathway for tanshinones. New Phytol, 2016, 210(2):525-534.
22 Xu Z, Luo H, Ji A, et al. Global identification of the full-length transcripts and alternative splicing related to phenolic acid biosynthetic genes in Salvia miltiorrhiza. Front Plant Sci, 2016, 7:100.
23 Xiao Y, Gao S, Di P, et al. Methyl jasmonate dramatically enhances the accumulation of phenolic acids in Salvia miltiorrhiza, hairy root cultures. Physiol Plant, 2009, 137(1):1-9.
24 Shi M, Zhou W, Zhang J, et al. Methyl jasmonate induction of tanshinone biosynthesis in Salvia miltiorrhiza hairy roots is mediated by JASMONATE ZIM-DOMAIN repressor proteins. Sci Rep, 2016, 6:20919.
25 Zhou Y, Sun W, Chen J, et al. SmMYC2a and SmMYC2b played similar but irreplaceable roles in regulating the biosynthesis of tanshinones and phenolic acids in Salvia miltiorrhiza. Sci Rep, 2016, 6:22852.
26 Ying X, Gao S H, Peng D, et al. Lithospermic acid B is more responsive to silver ions (Ag+) than rosmarinic acid in Salvia miltiorrhiza hairy root cultures. Biosci Rep, 2009, 30(1):33-40.
27 Xing B, Yang D, Guo W, et al. Ag+ as a more effective elicitor for production of tanshinones than phenolic acids in Salvia miltiorrhiza hairy roots. Molecules, 2014, 20(1):309-324.
28 Xiao Y, Zhang L, Gao S, et al. The c4h, tat, hppr and hppd genes prompted engineering of rosmarinic acid biosynthetic pathway in Salvia miltiorrhiza hairy root cultures. PloS One, 2011, 6(12):e29713.
29 Kai G, Xu H, Zhou C, et al. Metabolic engineering tanshinone biosynthetic pathway in Salvia miltiorrhiza, hairy root cultures. Metab Eng, 2011, 13(3):319-327.
30 Gu X C, Chen J F, Xiao Y, et al. Overexpression of allene oxide cyclase promoted tanshinone/phenolic acid production in Salvia miltiorrhiza. Plant Cell Reports, 2012, 31(12):2247-2259.
31 Zhang Y, Yan Y P, Wu Y C, et al. Pathway engineering for phenolic acid accumulations in Salvia miltiorrhiza, by combinational genetic manipulation. Metab Eng, 2014, 21:71-80.
32 Zhao S , Zhang J, Tan R, et al. Enhancing diterpenoid concentration in Salvia miltiorrhiza hairy roots through pathway engineering with maize C1 transcription factor. J Exp Bot, 2015, 66(22):7211-7226.
33 宋经元, 罗红梅, 李春芳,等. 丹参药用模式植物研究探讨. 药学学报, 2013(7):1099-1106.
A Research Progress on the Biosynthesis of Effective Compounds in Salvia Miltiorrhiza
Liu Weiwei2, Chen Junfeng1, Xiao Ying1, Zhang Lei3, Chen Wansheng1
(1. Changzheng Hospital, Second Military Medical University, Shanghai 200003, China; 2. Shanghai Putuo District Central Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200233, China; 3. Department of Pharmacognosy, School of Pharmacy, Second Military Medical University, Shanghai 200433, China)
Tanshinones and phenolic acids are two major classes of effective compounds in S. miltiorrhizae Radix et Rhizoma. Accumulative levels of these compounds directly determined its quality and efficacy. Presently, for the purpose of understanding the underlying the mechanism behind the biosynthesis and regulation of effective compounds in S. miltiorrhiza, a series of progresses have been pressed ahead. Benefiting from the boost and convenience of high-throughput genomic, transcriptomic, and metabolic analysis methods, remarkable achievements have been accessed in this field. In this paper, a summary for the recent progress have been made with the provision of a reference for better understanding over the quality of S. miltiorrhiza.
Salvia miltiorrhiza Bunge, tanshinones, phenolic acid, biosynthesis
10.11842/wst.2016.11.010
R931.6
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-10-27
修回日期:2016-11-02
* 国家自然科学基金委杰出青年科学基金(81325024):中药药效物质,负责人:陈万生;国家自然科学基金面上项目(81673550):丹参根系形态、结构特征与有效成分积累的关联性及形成机制研究,负责人:陈军峰;国家自然科学基金青年基金项目(31100221):四倍体菘蓝聚合蛋白酶与松脂醇还原酶的功能及特征研究,负责人:肖莹。
** 通讯作者:陈万生,本刊编委,教授,博士生导师,主要研究方向:中药药效物质和品质调控研究;张磊,副教授,主要研究方向:药用植物学。
