大鼠被动皮肤过敏反应实验条件的优化
2016-02-14陈文培张子扬周成浩郭宇琳林宝琴
陈文培,张子扬,周成浩,刘 涵,胥 彤,郭宇琳,林宝琴
(广州中医药大学中药学院,广东广州 510006)
·实验方法·
大鼠被动皮肤过敏反应实验条件的优化
陈文培,张子扬,周成浩,刘 涵,胥 彤,郭宇琳,林宝琴
(广州中医药大学中药学院,广东广州 510006)
目的通过卵白蛋白(OVA)致敏大鼠优化被动皮肤过敏反应(PCA)的实验条件。方法1 ~2月龄SD大鼠ip给予OVA(每只0.2,1.0和5.0 mg)与弗氏完全佐剂的混合乳液,隔日1次,共3次,进行致敏。分别于末次致敏后1,3,5,7,10,12,14,16和18 d用ELISA检测血清总IgE(T-IgE)水平和OVA特异性IgE(OVA-sIgE)水平。大鼠致敏后12 ~16 d制备致敏血清。大鼠皮内注射致敏血清被动皮肤致敏后,于0.5,1.5,3,6,12,24,36,48和60 h后iv给予同等剂量OVA和伊文思蓝激发,于激发后10,30和60 min测量大鼠皮肤蓝斑直径。结果OVA致敏大鼠血清T-IgE和OVA-sIgE水平分别于末次致敏后3 ~7 d和12 ~16 d达高峰;在OVA 0.2 ~5.0 mg剂量范围内,OVA-sIgE与T-IgE水平无明显关联性;OVA 1.0和5.0 mg致敏大鼠血清能诱发大鼠PCA;皮内注射致敏血清0.5 ~3 h后激发的皮肤蓝斑形态规则,范围最大;激发后30 ~60 min检测的皮肤蓝斑范围大,界线清晰,形状规则,且着色较深。结论PCA优化条件为1 ~2月龄大鼠隔日每只ip给予OVA 1.0 ~5.0 mg,共致敏3次,致敏后12 ~16 d制备致敏血清。在被动皮肤致敏0.5 ~3 h后,进行激发,30 ~60 min后检测皮肤内层蓝斑直径。
卵白蛋白;Ⅰ型过敏反应;IgE;被动皮肤过敏反应;大鼠
过敏反应又称超敏反应。根据病理机制和临床特点,过敏反应分为4型,其中Ⅰ型过敏反应由免疫球蛋白E(IgE)介导[1],其机制为过敏原刺激呼吸道和消化道黏膜固有层淋巴组织中的B细胞转变为浆细胞,浆细胞释放IgE抗体。IgE抗体与肥大细胞或嗜碱性粒细胞膜上的特异受体结合,使机体处于致敏状态。当相同过敏原再次进入机体,接触到结合了IgE的肥大细胞或嗜碱性粒细胞,则后者会“脱颗粒”释放出过敏介质如组胺和白三烯等,这些介质刺激邻近的血管或神经,从而引起血管扩张和平滑肌收缩等[2-3]。
用于评价药物引起Ⅰ型过敏反应的方法有主动全身过敏反应、主动皮肤过敏反应和被动皮肤过敏反应(passive cutaneous anaphylaxis,PCA)实验[1,4]。其中,PCA实验主要用于由IgE介导的过敏反应的研究[4],是研究药物是否会产生Ⅰ型过敏反应的较好方法。PCA的敏感动物依次为BN大鼠、豚鼠和SD大鼠,较之于BN大鼠和豚鼠,SD大鼠尽管敏感性低于前两者,但因其来源稳定、价格便宜和便于饲养等,越来越受到国内药物安全评价工作者的重视和使用。然而,本实验室和不少其他GLP实验室根据我国2010年版《最新药品注册法规及指导原则》(简称《原则》)中化学药物刺激性、过敏性和溶血性研究技术指导原则[4]进行多次PCA实验发现,即使是使用阳性药如卵白蛋白(ovalbumin,OVA)对大鼠进行PCA实验,被动皮肤致敏24或48 h激发时产生的皮肤蓝斑边界不清晰,难以定量,或有个别大鼠未出现蓝斑。这一现象不利于准确评价药物的安全性。为此,本研究以SD大鼠为实验对象,采用ip给予OVA与弗氏完全佐剂的混合乳液致敏,以期优化PCA的实验条件。
1 材料与方法
1.1药品、试剂和仪器
OVA和弗氏完全佐剂,德国Sigma公司;伊文思蓝,国药集团化学试剂有限公司;OVA-特异性IgE(specific IgE,sIgE)酶联免疫试剂盒,武汉华美生物工程有限公司;大鼠IgE ELISA试剂盒,日本Shibayagi公司。酶标仪,美国Thermo Scientific公司。
1.2动物
SPF级SD大鼠,雌雄兼用,体质量为130 ~150 g,由广州中医药大学实验动物中心提供〔动物生产许可证号:SCXK(粤)2013-0020〕,饲养于广东药科大学实验动物中心SPF级实验室〔场地设施使用许可证号:SYXK(粤)2012-0125〕。
1.3大鼠OVA致敏血清最佳致敏时间的考察
本实验共设2组,分别为正常对照组(4只大鼠)和OVA组(36只大鼠)。OVA组大鼠隔日ip给予OVA和弗氏完全佐剂混合乳液,每只5.0 mg OVA,给药体积为每只1 mL(含OVA 0.5 mL,弗氏完全佐剂0.5 mL),共致敏3次。于末次致敏后1,3,5,7,10,12,14,16和18 d分别随机取4只大鼠,用戊巴比妥钠与赛拉嗪(xylazine)联合麻醉后,颈动脉采血,分离血清。正常对照组大鼠则以生理盐水替代OVA,于末次注射后1 d采血,分离血清。严格按照ELISA试剂盒说明书操作,测定血清总IgE(total IgE,T-IgE)和OVA-sIgE水平。
1.4大鼠OVA致敏血清中T-IgE与OVA-sIgE检测
大鼠隔日ip给予OVA进行致敏,剂量为每只0.2,1.0和5.0 mg,给药体积为每只1 mL(含OVA 0.5 mL,弗氏完全佐剂0.5 mL)。分别于末次致敏后3和12 d采血,分离血清。末次致敏后3 d分离的血清用于测定T-IgE水平,末次致敏后12 d分离的血清用于测定OVA-sIgE水平。
1.5最佳OVA剂量及皮内注射致敏血清后最佳激发时间考察
大鼠分别隔日ip给予OVA,剂量为每只0.2,1.0和5.0 mg,给药体积为每只1 mL(含OVA 0.5 mL,弗氏完全佐剂0.5 mL)。末次致敏后12 d制备致敏血清。将各组大鼠的致敏血清进行组内等体积混合后,以生理盐水按1∶0,1∶4和1∶16稀释。各大鼠背部皮内注射对应致敏血清0.1 mL进行被动致敏。分别在皮肤被动致敏0.5,1.5,3,6,12,24,36,48和60 h后,静脉注射与致敏剂量相同的OVA加等体积的1%伊文思蓝染料共1 mL进行激发,激发后30 min用5倍麻醉剂量戊巴比妥钠活杀大鼠,测量皮肤内层的斑点大小,直径大>5 mm者为阳性。
1.6最佳PCA检测时间考察
大鼠隔日ip给予OVA,每只5.0 mg,给药体积为每只1 mL(含OVA 0.5 mL,弗氏完全佐剂0.5 mL)。末次致敏后12 d制备致敏血清。将各组大鼠的致敏血清进行组内等体积混合后,以生理盐水按1∶0,1∶4,1∶16和1∶32稀释,各大鼠背部皮内注射对应致敏血清0.1 mL进行被动致敏。在皮肤被动致敏30 min后,各大鼠静脉注射与致敏剂量相同的OVA加等体积的1%伊文思蓝染料共1 mL进行激发,分别在激发后10,30和60 min用5倍麻醉剂量戊巴比妥钠活杀大鼠,测量皮肤内层的蓝色斑点直径。
1.7统计学分析
实验结果数据用x±s表示,采用SPSS 20.0软件进行统计学分析,采用单因素方差分析,多组间两两比较用LSD法,P<0.05为差异具有统计学意义。
2 结果
2.1制备大鼠OVA致敏血清的最佳时间
由图1可知,与正常对照组比较,末次致敏后3 ~14 d大鼠血清T-IgE水平显著升高(P<0.01);末次致敏后3 d,血清OVA-sIgE水平显著增加(P< 0.01),12 ~16 d达到最高。因此,检测致敏血清中T-IgE水平的时间应在末次致敏后3 ~7 d。致敏血清制备的时间则根据OVA-sIgE水平,结合2010年版《原则》中化学药物刺激性、过敏性和溶血性研究技术指导原则,以末次致敏后12 ~16 d为宜。
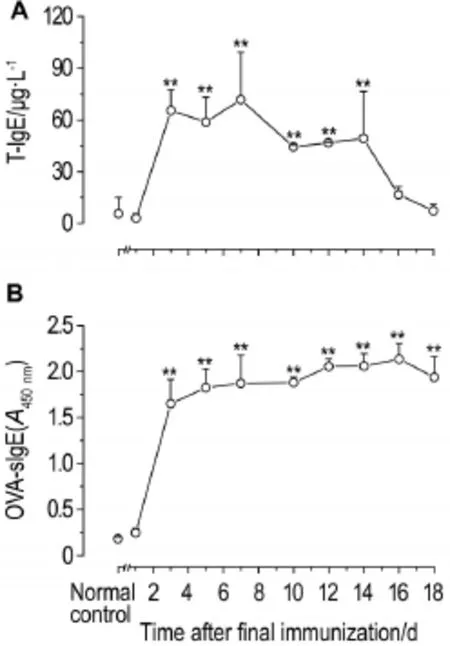
Fig.1 Total IgE(T-IgE)(A)and ovalbumin(OVA)-specific IgE(OVA-sIgE)(B)levels in serum of rats after final immunization with OVA.The rats were ip given OVA 5.0 mg per rat,once every other day,for 3 times,and then serum T-IgE and OVA-sIgE were detected at indicated time after final immunization.x±s,n=4.**P<0.01,compared with normal control group.
2.2大鼠OVA致敏血清中T-IgE与OVA-sIgE水平的关联性
由图2可知,与正常对照组比较,OVA各剂量组的T-IgE(P<0.05)和OVA-sIgE(P<0.01)水平均显著提高。在OVA每只0.2 ~5.0 mg剂量范围内,两者水平与OVA剂量均无明显相关性,两者水平无明显关联性。
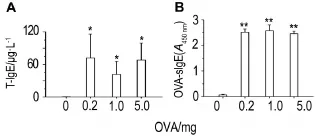
Fig.2 Levels of serum T-IgE(A)and OVA-sIgE(B)in rats after final immunization with OVA.The rats were ip given OVA 0,0.2,1.0 and 5.0 mg per rat,respectively,once every other day,for 3 times.Serum IgE was detected on the 3rdday(T-IgE)and the 12thday(OVA-sIgE)after final immuni⁃zation,respectively.x±s,n=3-4.*P<0.05,**P<0.01,compared with normal control group.
2.3最佳OVA致敏剂量及皮内注射致敏血清后最佳激发时间
由图3、表1和表2可知,正常对照组大鼠激发后背部皮肤均未出现蓝斑(图3A),PCA发生率为0。OVA每只1.0和5.0 mg剂量组0.5 ~3 h激发大鼠背部皮肤均出现直径>5 mm蓝斑,蓝斑界线清晰,形状规则,且着色较深(图3B1 ~3,图3C1 ~3),PCA发生率为100%。OVA每只1.0 mg和5.0 mg剂量组6 h激发大鼠均发生PCA,背部皮肤均出现直径>5 mm的蓝斑,蓝斑界线不清晰,形状不规则(图3B4,图3C4)。OVA每只1.0 mg剂量组12 ~24 h激发大鼠和每只5.0 mg剂量组12 ~48 h激发大鼠背部皮肤可出现直径>5 mm的蓝斑,但大部分蓝斑呈弥漫状,着色随皮内注射时间的延长而逐渐变淡(图B5 ~6,图3C5 ~8),PCA发生率未达100%。每只1.0 mg剂量组48 h激发大鼠背部皮肤均未出现直径>5 mm的蓝斑(图3B7),PCA发生率为0。每只0.2 mg剂量组激发后仅小部分大鼠背部皮肤出现直径>5 mm蓝斑(图略)。由此可见,OVA剂量为每只1.0和5.0 mg能诱发大鼠PCA反应,最佳激发时间为皮内注射致敏后0.5 ~3 h。

Fig.3 Blue spots in skin of rats stimulated by OVA 1.0 mg(B)and 5.0 mg(C)per rat.The rats were ip given OVA 1.0 and 5.0 mg per rat respectively,once every other day,for 3 times.Serum was collected on the 12thday after final immunization and diluted at the ratio of 1∶0,1∶4 and 1∶16.The rats were sensitized by different diluted serum 0.1 mL,and then stimulated by the same dose of OVA 0.5-60 h later.A:normal control;B1-B7:0.5,1.5,3,6,12,24 and 48 h stimulation;C1-C9:0.5,1.5,3,6,12,24,36,48 and 60 h stimulation.
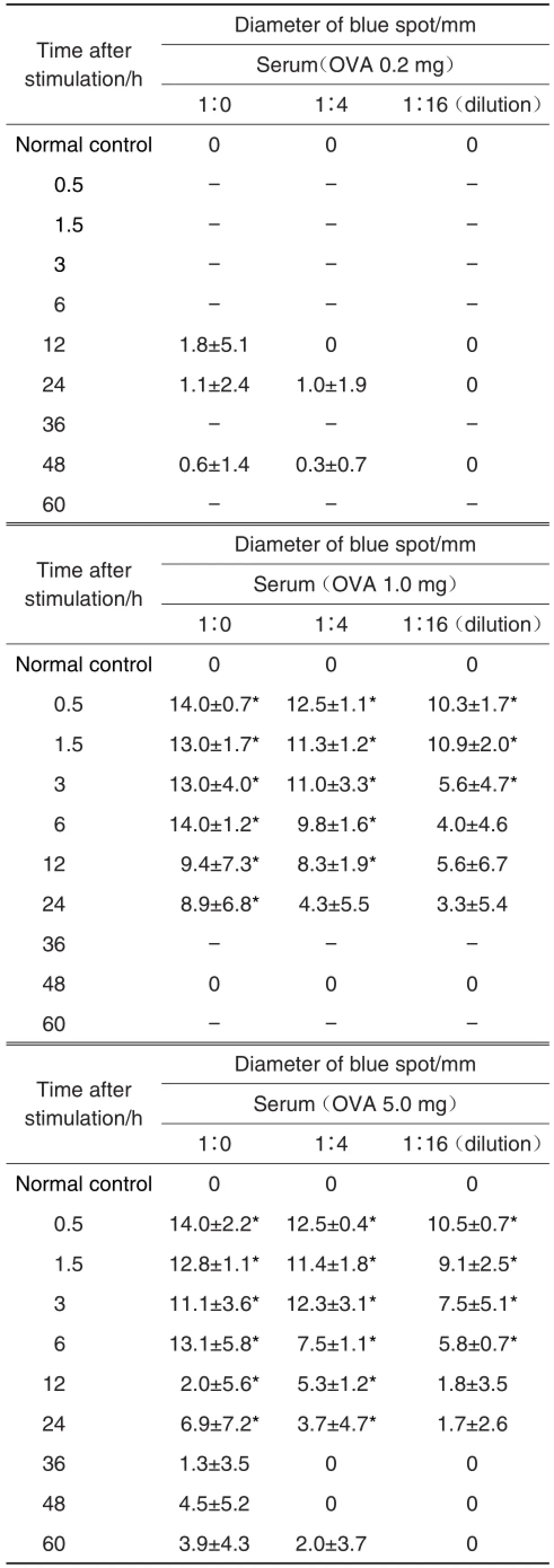
Tab.1 Diameters of skin blue spot induced by OVA stimulation in rats
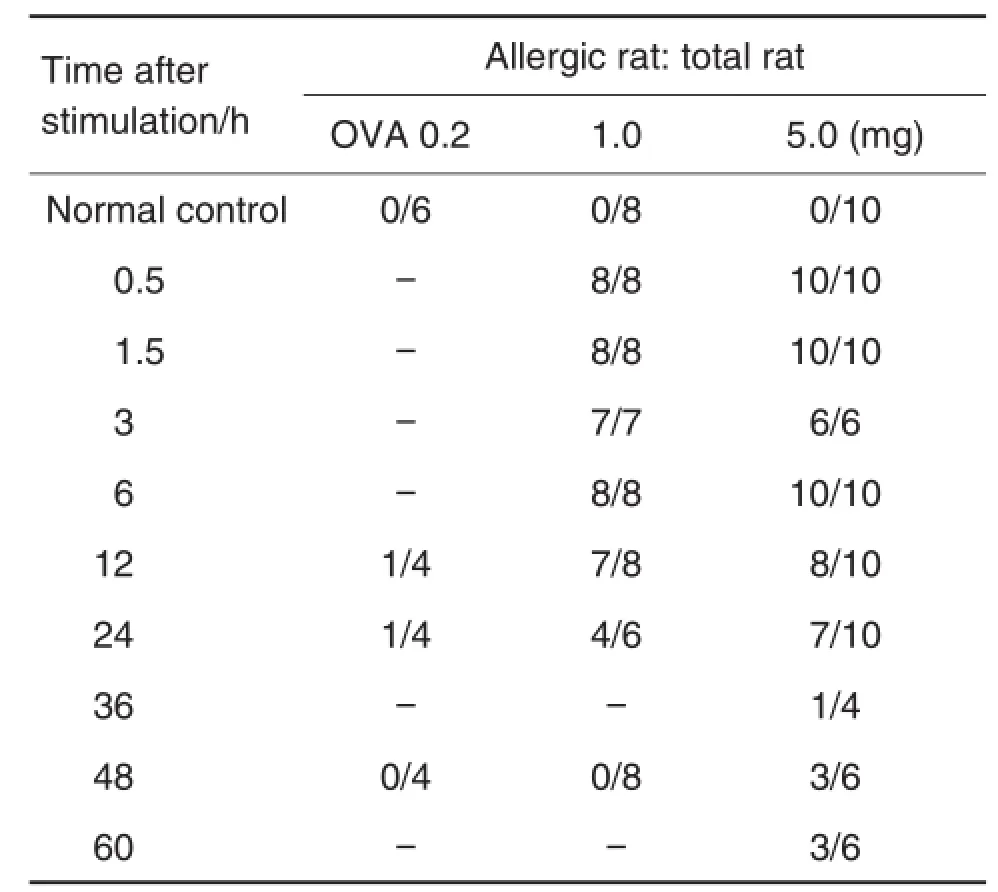
Tab.2 Positive rate of passive cutaneous anaphylaxis(PCA)induced by OVA stimulation in rats
2.4大鼠OVA激发后最佳PCA检测时间
由表3可知,OVA激发后10,30和60 min,大鼠背部皮肤均出现直径>5 mm蓝斑,蓝斑大小无明显差异。但10 min组大鼠皮肤蓝斑界线不清晰,颜色过浅;30和60 min组则蓝斑界线清晰,形状规则,着色较深。因此,宜在抗原激发后30 ~60 min进行PCA检测。
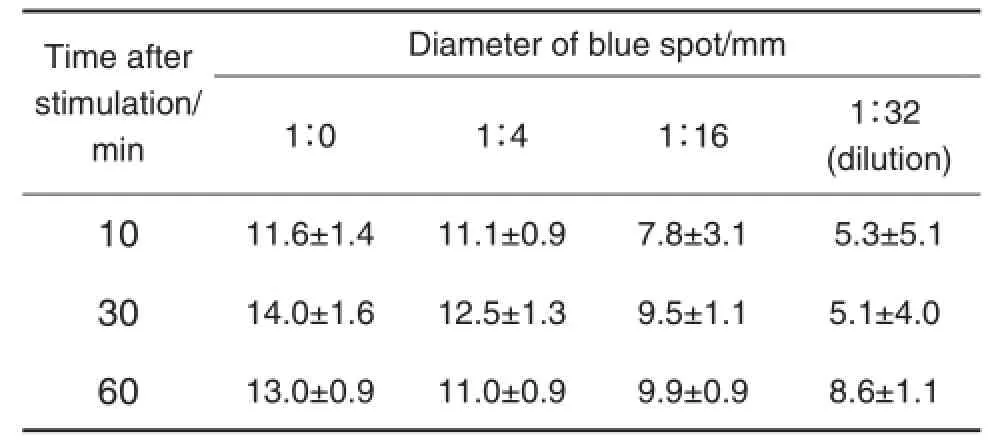
Tab.3 Diameter of blue spots in skin of rats after dif⁃ferent time of stimulation
3 讨论
一般认为,PCA的敏感动物依次是BN大鼠、豚鼠和SD大鼠。虽然BN大鼠是最易产生IgE的大鼠品系[5],但因繁殖率低,自发肿瘤率高,价格昂贵,限制了其在药物安全性评价中的应用。豚鼠的Ⅰ型过敏反应可由IgE和IgG介导[6],后者起主要作用,而这两种Ig所介导的过敏反应出现的时间和程度不一致,影响PCA结果。SD大鼠多次接触致敏原也能产生抗体[7-8],而该品系大鼠在我国最易购买,且价格相对低廉,越来越受到药物安全评价工作者的重视和使用。此外,大鼠年龄与IgE产生有一定关系,1 ~2月龄大鼠多次致敏产生的IgE水平最高,而3 ~12月龄大鼠致敏后产生IgE能力显著减小[9]。因此,本研究选用1 ~2月龄,体质量为150 ~ 170 g的SD大鼠进行研究。
OVA比牛血清白蛋白和钥孔血蓝蛋白更易产生IgE抗体[5,8]。研究发现,使用大鼠进行PCA的前提条件是加用佐剂[8,10]。常见佐剂主要有Al(OH)3、卡介苗、弗氏完全佐剂和弗氏不完全佐剂。配制方法、实验重复性和试剂来源等问题限制了Al(OH)3和卡介苗的使用。而Sigma等公司提供的市售弗氏完全佐剂质量稳定,使用方便。弗氏完全佐剂致敏大鼠后可产生体液免疫和细胞免疫反应。因此,本研究选用了OVA和弗氏完全佐剂进行研究。此外,尽管大鼠皮下注射和腹腔注射致敏可获得等效的PCA结果,但腹腔注射致敏的动物由于佐剂的慢性刺激,普遍出现腹腔内肠黏膜炎性粘连和体质量下降,个别出现睾丸红肿[8]。所以,本研究若采用皮下注射致敏途径进行研究则更为可靠。
血清IgE水平与遗传有关,受年龄、性别和种族影响[9]。本研究预实验中发现血清T-IgE水平明显受性别影响,雄性SD大鼠体内的T-IgE水平较雌性高,对OVA刺激的反应程度相近,而雌性大鼠对于OVA刺激所产生的IgE水平则存在明显的个体差异。但是,雌雄大鼠受OVA刺激后所产生的sIgE并无明显差异。
本研究结果表明,免疫后大鼠血清T-IgE水平和OVA-sIgE水平与过敏原的剂量无关,且同一剂量致敏后血清T-IgE水平和OVA-sIgE水平也无关联性,这与之前的文献报道一致[5]。这说明不能通过检测血清T-IgE水平来预测sIgE的水平。此外,研究中也发现,OVA每只0.2 mg剂量致敏产生的致敏血清中T-IgE和OVA-sIgE虽与OVA每只1.0和5.0 mg剂量无显著差异,但在蓝斑形成能力上明显不如后两者。其原因可能如下:①IgE的生成量与组胺释放量无关联性[11];②血清sIgE检测的是游离sIgE,而与过敏症状最直接相关的是与细胞结合的sIgE。也就是说,血清sIgE水平并不能反映与细胞结合的sIgE的量。
经过反复验证发现,皮内注射OVA后最佳的激发时间为0.5 ~3 h,蓝斑形状规则,颜色反差明显,范围最大。此外,过敏发生阳性率可达100%。皮内注射6 ~48 h后再用OVA致敏原激发,则蓝斑弥散,很难准确测定蓝斑范围。这与之前大量的文献报道不符。皮内局部注射后会有一定的注射损伤,这可能会导致发生局部炎症,致使血管通透性增加,产生假性蓝斑。但是,本研究以同样的操作重复多次,并未发现正常对照组大鼠出现蓝斑。这证实了皮内注射后0.5 ~3 h激发所出现的蓝斑并非假阳性结果。OVA致敏大鼠后产生的抗体有两种亚型,即IgE和IgGa。如是IgE,则最佳致敏期长,一般为24 ~48 h甚至更长;如是IgGa,则最佳致敏期短,一般为1.5 ~16 h[12]。OVA联合弗氏完全佐剂致敏大鼠产生的抗体中,IgE会与肥大细胞或嗜碱性粒细胞膜上的特异受体结合,使机体处于致敏状态。当相同过敏原再次进入机体,接触到结合了IgE的肥大细胞或嗜碱性粒细胞,则后者会“脱颗粒”释放出过敏介质如组胺和白三烯等,从而引起血管扩张、支气管平滑肌收缩等。因此,如是IgE介导的蓝斑形成,则需要在皮内致敏后24 h才能明显出现。该致敏血清致敏时间与文献报道不相符的原因可能为:①IgG也能介导肥大细胞脱颗粒,释放组胺。Woolhiser等[13]通过聚合的IgG刺激人肥大细胞可引起脱颗粒。这可能也是造成T-IgE和sIgE的水平与PCA结果不平行的原因。②佐剂的选择。Dahlbäck等通过ip给予OVA免疫SD大鼠后仅以铝和百日咳杆菌疫苗激发大鼠,发现铝和百日咳杆菌疫苗分别通过刺激sIgE和IgG2a的产生增强或沉淀过敏反应强度[14]。
综上,对PCA进行以下条件优化:对1 ~2月龄SD大鼠采用易产生抗体的给药方法如皮内或ip给予OVA与弗氏完全佐剂的混合乳液,隔日1次,共免疫3次;末次致敏后12 ~16 d制备致敏血清。激发采用大鼠背部皮肤皮内注射梯度稀释度的致敏血清0.1 mL,0.5 ~3 h后iv给予与致敏剂量相同的OVA加等体积的1%伊文思蓝染料共1 mL。激发注射0.5 ~1 h后测量皮肤的蓝色斑点,直径>5 mm者为阳性。其中,“皮内注射后最佳的激发时间为0.5 ~3 h”与现行传统方法和文献报道不同,能否作为预测新药致敏性的改进方法加以推广并应用于新药安全性评价尚待进一步验证。
[1]Lyu XY.Hypersensitivity reactions[M]∥Lyu CL,Li DJ,Li Y.Medical Immunology(医学免疫学).7th ed.Beijing:Higher Education Press,2012:181-192.
[2]Zhang HQ.Introduction ofanaphylaxis[J].Biol Teach(生物学教学),2012,37(9):61-62.
[3]Zhang B,Liang SH,Luo B,Zhou WB,He Y,Liao XB,et al.Evaluation on the applicability of the total serum IgE to certification of death from allergic shock induced by drugs in cadavers[J].Chin J Forensic Med(中国法医学杂志),2004,19(S1):1-2.
[4]Research Group of Guidance Principles for the Study of Chemical Irritation,Allergy and Hemolysis. Guidance principles for the study of chemical irritation,allergy and hemolysis[M]∥The Latest Drug Regis⁃tration Regulations and Guidelines(最新药品注册法规及指导原则).Beijing:Chinese Medical Science and Technology Press,2010:496-509.
[5]Abadie A,Prouvost-Danon A.Specific and total IgE responses to antigenic stimuli in Brown-Norway,Lewis and Sprague-Dawley rats[J].Immunology,1980,39(4):561-569.
[6]Shan XL,Zhang SC,Sun YX.Active systemic anaphylaxis induced by vaccine in guinea pig[J].Chin J Pharmacol Toxical(中国药理学与毒理学杂志),2013,27(3):518-519.
[7]Lan JK,Xu JH,Xu XY.Study on the influence factors of passive skin allergy test[J].Pharmacol Clin Chin Mater Med(中药药理与临床),2008,24(2):108-109.
[8]Wang JH,Wang RF,Gao ZY.Study on experi⁃mental factors of passive cutaneous anaphylaxis in rats[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2010,16(18):160-162.
[9]Pauwels R,B azin H, Platteau B, van der Straeten M.The effect of age on IgE production in rats[J].Immunology,1979,36(1):145-149.
[10]LiXF,JinRM,FuSG,Yao GT,Tan MH. Difference ofpassive cutaneous anaphylaxis between SD and Wistar rats[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2010,16(10):102-105.
[11]Bergstrand H,Björnsson A,Frick IM,Lundquist B,Pauwels R,Bazin H.Anti-IgE and Con A-induced histamine release from mast cells of four rat strains: correlation with totalserum IgE[J].Agents Actions,1982,12(5-6):612-618.
[12]Watanabe N,Ovary Z.Antigen and antibody detection byin vivomethods;a reevaluation of passive cutaneous anaphylactic reactions[J].J Immunol Methods,1977,14(3-4):381-390.
[13]Woolhiser MR,Brockow K,Metcalfe DD.Activation of human mast cells by aggregated IgG through FcgammaRI:additive effects ofC3a[J].Clin Immunol,2004,110(2):172-180.
[14]Bergstr H,Andersson I,Nyström I,Pauwels R,Bazin H.The non-specific enhancement of allergy[J].Allergy,1983,38(4):247-260.
Optimization of parameters of passive cutaneous anaphylaxis in rats
CHEN Wen-pei,ZHANG Zi-yang,ZHOU Cheng-hao,LIU Han,XU Tong,GUO Yu-lin,LIN Bao-qin
(School of Chinese Materia Medica,Guangzhou University of Chinese Medicine,Guangzhou 510006,China)
OBJECTIVE To optimize the parameters of passive cutaneous anaphylaxis(PCA)in rats immunized by ovalbumin(OVA).METHODS 1-2 month-old Sprague-Dawley rats were immu⁃nized by ip injection of OVA(0.2,1.0 and 5.0 mg per rat)mixed with complete Freund′s adjuvant once every other day 3 times.Serum was collected on the 12th-16thdays after final immunization.Then the rats were intracutaneously injected with sensitized serum and then stimulated by iv injection of the same dose of OVA mixed with Evans blue after a latent period of 0.5,1.5,3,6,12,24,36,48 and 60 h.Finally,the diameters of blue spots in the skin were measured at stimulation.RESULTS Serumtotal-IgE(T-IgE)and OVA-specific IgE(sIgE)levels increased significantly and reached the peak on the 3rd-7thdays and 12th-16thdays after final immunization,respectively.There was no correlation between the serum T-IgE level and OVA-sIgE level when the rats were immunized with OVA at OVA 0.2-5.0 mg per rat.The rats experienced PCA after injection of OVA 1.0 and 5.0 mg per rat.Diameters of blue spots in the skin reached the maximum value after rats were sensitized for 0.5-3 h.Moreover,the shape,color and size of blue spots were better 30-60 min after stimulation.CONCLUSION Optimized PCA is as follows:1-2 month-old rats are immunized on the 1st,3rdand 5thdays by ip injection of OVA 1.0-5.0 mg.The immunizing serum is collected at 12-16 d after final immunization.The rats are stimulated by OVA and Evans blue after a latent period of 0.5-3 h.Diameters of blue spots in rats′skin are then measured 30-60 min after stimulation.
ovalbumin;typeⅠhypersensitivity;IgE;passive cutaneous anaphylaxis;rats
LIN Bao-qin,Tel:(020)39358085,E-mail:linbqcpu@126.com
R965.2
:A
:1000-3002-(2016)07-0747-07
10.3867/j.issn.1000-3002.2016.07.007
2015-08-31接受日期:2016-06-29)
(本文编辑:齐春会)
陈文培,硕士研究生,主要从事新药研究。
林宝琴,E-mail:linbqcpu@126.com,Tel:(020)39358085
