棒曲霉素对人肝细胞L-02的毒性效应及作用机制
2016-02-14马丽卿马永成岳晓禹
苏 楠,马丽卿,马永成,岳晓禹
(1.河南牧业经济学院食品工程学院,河南郑州 450011;2.郑州大学人民医院临床药理室,河南 郑州 450003)
棒曲霉素对人肝细胞L-02的毒性效应及作用机制
苏 楠1,马丽卿1,马永成2,岳晓禹1
(1.河南牧业经济学院食品工程学院,河南郑州 450011;2.郑州大学人民医院临床药理室,河南 郑州 450003)
目的研究棒曲霉素(PAT)对人肝细胞L-02的毒性作用,并探讨其作用的分子机制。方法PAT 1.25,2.5,5,10和20 μmol·L-1分别作用于L-02细胞24和48 h,采用噻唑蓝(MTT)法检测PAT对L-02细胞增殖的抑制作用;PAT 0,5和10 μmol·L-1作用L-02细胞24 h后,Hoechst33258和JC-1染色,通过荧光显微镜进行细胞形态及线粒体膜电位(MMP)观察;利用流式细胞术对细胞凋亡、MMP及细胞内活性氧(ROS)水平进行定量分析;Western蛋白印迹法检测PAT对线粒体凋亡通路的影响。结果PAT明显抑制L-02细胞的生长,24和48 h的IC50值分别为6.61和2.78 μmol·L-1;与正常对照组低MMP比率(9.2±2.3)%相比,PAT 5和10 μmol·L-1组低MMP比率显著升高(P<0.01),分别升高至(23.4±4.5)%和(47.1±5.5)%;PAT 5和10 μmol·L-1处理后L-02细胞早期凋亡率较正常对照组(3.8±1.1)%升高(P<0.01),分别增至(29.8±4.5)%和(24.1±6.2)%;PAT引起L-02细胞内ROS增加,使用外源性谷胱甘肽预孵育细胞后,阻断了PAT诱导的ROS升高和增殖抑制的作用。结论PAT可显著影响L-02的生长,并通过线粒体途径诱导细胞凋亡,其机制与胞内ROS水平升高有关。
棒曲霉素;细胞毒性;细胞凋亡;线粒体;活性氧
棒曲霉素(patulin,PAT)属于曲霉和青霉等真菌的次级代谢产物,普遍存在于发霉的水果、蔬菜、谷物和动物饲料中,尤其在腐烂的苹果及苹果汁、苹果酒等苹果制品中,PAT的含量最高。PAT的主要接触途径是消化道,经消化道吸收进入血液循环,分布于全身各个组织器官,在细胞色素P450酶作用下其毒性有所下降,但代谢产物仍具有毒性[1-2]。体外实验表明,PAT可诱导多种菌株的基因突变、对体外培养的细胞亦有DNA损伤作用;动物实验研究也发现,PAT对胃肠、肝肾及免疫系统具有明显毒性。因此,WHO和欧盟已将果汁中的PAT检测限量定为50 μg·L-1,目前FDA以及世界多个国家也对食品中PAT含量做了严格限定[3]。
虽PAT的生物毒性已明确,但多项报道指出由于常规的巴氏消毒法不能有效减少食品中PAT的含量,市场流通的商品中PAT超标的情况仍较多见,严重威胁着人们的健康[4]。目前针对食品中PAT的检测技术研究较多[5],且应用相对成熟,但对于PAT的毒理研究不足。因此,本研究以人正常肝细胞L-02为实验模型,评估PAT的细胞毒性,探讨可能的毒性机制,为进一步了解其对人类潜在的危害提供实验依据。
1 材料与方法
1.1细胞、试剂和主要仪器
人肝细胞L-02购自中国科学院典型培养物保藏委员会细胞库;细胞培养液RPMI 1640(美国Gibco公司);胎牛血清(杭州四季青公司);PAT(P1639)、噻唑蓝(MTT,M2128)及Hoechst33258(B2883)(美国Sigma公司);FITC-AnnexinⅤ/PI双染细胞凋亡检测试剂盒(K201-25)(美国Biovision公司);细胞线粒体分离试剂盒(C3601)、JC-1荧光染料(C2005)、荧光探针2′7′-二氯二氢荧光素二乙酸酯(2′7′-dichlorodihydroflu-orescein diace⁃tate,DCFH-DA)(S0033)(碧云天生物技术研究所);鼠抗人细胞色素c单克隆抗体(sc-13156,15 ku)(美国Santa Cruz公司);GAPDH抗体(AB-PR001)(杭州贤至生物科技公司);辣根过氧化酶标记的二抗(北京中杉金桥生物技术公司);谷胱甘肽(glutathione,GSH,A600229)(上海生工生物公司)。
311型细胞培养箱(美国Thermo公司);sw-cj-1f超净工作台(苏州净化设备有限公司);FACS Calibur流式细胞仪(美国BD公司);5424R高速低温离心机(德国Eppendorf公司);80i荧光显微镜(日本Nikon公司);Powerwave XS酶标仪(美国Bio Tek公司);MiniVE电泳电转系统(美国GE公司);ME104分析天平(瑞士梅特勒托利公司)。
1.2细胞培养
使用RPMI 1640培养液(含10%胎牛血清,青霉素100 kU·L-1和链霉素100 g·L-1),于37℃,5% CO2细胞培养箱内培养L-02细胞。待细胞生长至大约70%满时,胰酶消化,传代。选用对数生长期且状态良好的细胞用于实验。
1.3MTT法检测细胞存活率
胰酶消化,离心收集细胞,使用新鲜培养基调整细胞浓度,按每孔约7000细胞接种于96孔板,边缘孔用无菌PBS填充。置培养箱过夜培养,待细胞充分贴壁,使用或不使用GSH预孵育细胞后,加入终浓度为1.25,2.5,5,10和20 μmol·L-1的PAT,每个浓度设6个复孔。PAT分别作用24和48 h后,每孔加入20 μL MTT溶液,继续孵育4 h后终止培养,移液器吸去孔内培养液,每孔加入150 μL二甲亚砜(dimethyl sulfoxide,DMSO),于摇床低速振荡10 min,使结晶物充分溶解,酶标仪测定490 nm处的吸光度(A490nm)。按照以下公式计算细胞存活率,细胞存活率(%)=处理组(A490nm)/正常对照组(A490nm)×100%。并使用GraphPad Prism软件计算IC50值。
1.4倒置荧光显微镜检测细胞形态
于6孔板中做细胞爬片,使用PAT 5和10 μmol·L-1作用细胞24 h后,使用免疫染色固定液室温固定10 min。加入适量的Hoechst33258染液进行细胞染色,室温避光30 min。倒掉染液,PBS漂洗2次,荧光显微镜观察并拍照。
1.5流式细胞术检测细胞凋亡
PAT 5和10 μmol·L-1作用细胞24 h后,按照FITC-AnnexinⅤ/PI双染细胞凋亡检测试剂盒说明书操作。先加入适量结合缓冲液,然后加入FITC标记的AnnexinⅤ和PI,室温避光孵育5 min,使用流式细胞仪分析早期凋亡的细胞。
1.6JC-1染色检测线粒体膜电位(mitochondrial membrane potential,MMP)[6]
将细胞在6孔板中制成爬片,使用PAT 5和10 μmol·L-1分别作用细胞24 h后,弃去培养基,加入JC-1染液(线粒体荧光探针,10 mg·L-1),在细胞培养箱中孵育20 min,使用荧光显微镜在488 nm激发波长下观察并拍照。同样,药物作用24 h后离心收集细胞并进行上述染色操作后,使用流式细胞仪分析细胞MMP的变化情况,结果使用FlowJo软件进行数据处理。
1.7Western蛋白印迹法检测细胞色素c
参考马永成等[7]的方法,按线粒体分离试剂盒说明书,分离线粒体,提取线粒体蛋白和细胞质蛋白。BCA法测定蛋白浓度,取60 μg总蛋白上样,经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)后,转移至硝酸纤维素膜(NC膜)上,5%脱脂奶粉室温封闭2 h,一抗室温孵育2 h或4℃孵育过夜,辣根过氧化酶标记的二抗室温下孵育2 h,充分洗膜后加增强化学发光(enhanced chemilumines⁃cence,ECL)剂,暗室中对胶片曝光,扫描并保存结果。扫描条带计算积分吸光度值(integrated absor⁃bance,IA),蛋白相对表达水平以目标蛋白IA与内标IA的比值表示。
1.8荧光探针DCFH-DA流式法检测活性氧水平
使用氧化还原敏感探针DCFH-DA检测胞内ROS的水平,细胞内的ROS可氧化无荧光的DCFH-DA生成有荧光的二氯荧光素(2′7′-dichlo⁃rodihydrofluorescein dictate,DCF),从而通过DCF的荧光强度判别细胞内ROS的水平。细胞处理后,胰酶消化离心收集细胞,PBS洗2次,使用无血清配制的10 μmol·L-1的DCFH-DA 37℃孵育30 min。再使用无血清培养基洗细胞3次,以去除未结合的游离探针,流式检测ROS的变化情况。
1.9统计学分析
实验结果数据以x±s的形式表示,采用SPSS 15.0软件进行统计分析,用t检验检测各组间的差异,P<0.05为差异有统计学意义。
2 结果
2.1棒曲霉素对L-02存活的影响
如图1所示,PAT对人肝细胞L-02生长有显著的抑制作用,且呈浓度和时间依赖性(24 h,r2=0.95,P<0.01;48 h,r2=0.99,P<0.01);由浓度-效应曲线计算24和48 h时PAT对L-02细胞的IC50值分别为6.6和2.8 μmol·L-1。
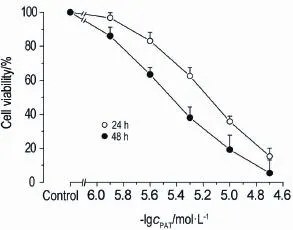
Fig.1 Effect of patulin(PAT)on viability of L-02 cells by MTT assay.x±s,n=3.
2.2棒曲霉素对L-02细胞凋亡的影响
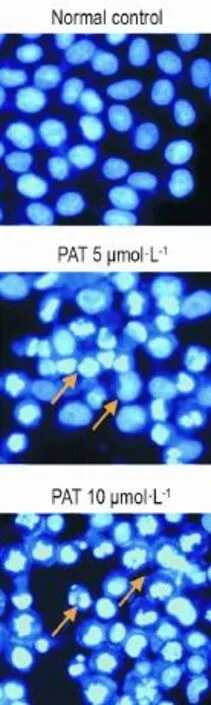
Fig.2 Effect of PAT for 24 h on apoptosis of L-02 cells by Hoechst33258 staining(×200).Arrows indicate apoptotic cells.
PAT作用L-02细胞24 h后,正常对照组细胞核大小均匀,染色质无浓缩。而PAT组细胞可见染色质浓缩,边缘化,核膜裂解,染色质碎裂成块状,形成凋亡小体等典型凋亡状态(图2);AnnexinⅤ-FITC/PI双染,流式细胞术检测发现,PAT 5和10 μmol·L-1组的早期凋亡率较正常对照组(3.8±1.1)%显著升高(P<0.01),分别增至(29.8±4.5)%和(24.1± 6.2)%;晚期凋亡率由正常对照组的(1.8±0.3)%增至(6.0±3.1)%(P<0.05)和(25.6±5.5)%(P<0.01)(图3)。上述结果表明,PAT可诱导L-02细胞凋亡。

Fig.3 Effect of PAT for 24 h on apoptosis of L-02 cells by flow cytometry.B was the semi-quantitative result of A.x±s,n=3.*P<0.05,**P<0.01,compared with normal control(0 μmol·L-1)group.
2.3棒曲霉素对L-02细胞MMP的影响
PAT作用细胞24 h后荧光显微镜观察,可见正常对照组细胞线粒体显示强的橙色荧光,提示MMP较高,细胞状态正常;在PAT 5 μmol·L-1作用下,细胞线粒体呈现了一定量的绿色荧光,提示MMP较正常对照组有所下降;当浓度升至10 μmol·L-1时,线粒体几乎完全呈现绿色荧光,提示此浓度下MMP完全丧失,细胞死亡不可逆转(图4)。
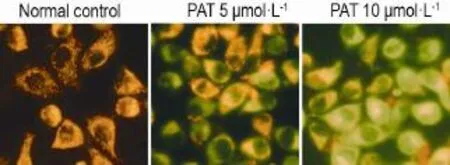
Fig.4 Effect of for 24 h PAT on mitochondrial mem⁃brane potential(MMP)of L-02 cells by JC-1 staining(×200).
流式分析结果表明(图5),PAT 5和10 μmol·L-1使L-02细胞MMP降低,低MMP的细胞比例由正常对照组的(9.2±2.3)%分别升高至(23.4±4.5)%和(47.1±5.5)%(P<0.01)。同时,Western蛋白印迹实验结果(图6)显示,L-02细胞经PAT作用24 h后,线粒体中的细胞色素c减少,而胞质中的细胞色素c则增多,进一步证明了PAT导致MMP下降,通透性增加,细胞色素c由线粒体释放到细胞质。这些结果表明,PAT诱导的凋亡过程与线粒体损伤有关。

Fig.5 Effect of PAT for 24 h on percent of low MMP cells by flow cytometry.B was the semi-quantitative result of A.x±s,n=3.**P<0.01,compared with normal control(0 μmol· L-1)group.

Fig.6 Effect of PAT on release of cytochrome c from mitochondria to cytosols in L-02 cells treated with PAT for 24 h by Western blotting.B was the semi-quantitative re⁃sults of A.x±s,n=3.**P<0.01,compared with nromal control(0 μmol·L-1)group.
2.4棒曲霉素对L-02细胞内ROS水平的影响
不同浓度PAT分别处理L-02细胞12 h后,装载DCFH-DA探针,流式细胞仪检测发现,L-02细胞内ROS水平显著增加(图7A),与正常对照组相比,PAT 5和10 μmol·L-1组ROS含量由正常对照组的(4.0±1.2)%分别增至(22.1±4.7)%和(32.0± 7.1)%(P<0.01)(图7B)。上述实验结果提示,PAT可诱导L-02细胞内ROS水平升高。
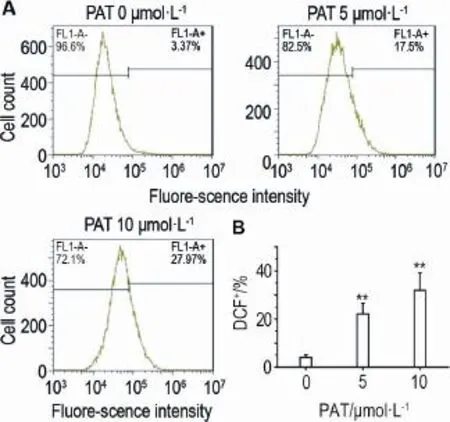
Fig.7 Effect of PAT for 12 h on intracellular levels of reactive oxygen species(ROS)in L-02 cells by flow cytometry.A:cells were treated with patulin at indicated doses for 12 h,followed by incubation with DCFH-DA 10 μmol·L-1for 30 min at 37℃;B was the semi-quantative result of A.x±s,n=3. **P<0.01,compared with normal control(0 μmol·L-1)group.
2.5抗氧化剂GSH对棒曲霉素诱导的ROS升高和增殖抑制的影响
图8结果表明,GSH完全阻断PAT 0 μmol·L-1诱导的ROS升高;此外,GSH也明显阻断了PAT作用L-02 24 h所诱导的细胞死亡,且差异具有显著性(图9)。这些结果表明,PAT通过消耗胞内GSH,导致抗氧化系统失衡,ROS积累,从而产生细胞毒性。
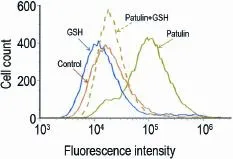
Fig.8 Effect of glutathione(GSH)on PAT induced ROS increase by flow cytometer.L-02 cells were pretreated with or without GSH 3 mmol·L-1,incubated with patulin 10 μmol·L-1for 12 h,stained with DCFH-DA and then determined by flow cytometry.

Fig.9 Effect of GSH on PAT induced L-02 proliferation decrease by MTT assay.Cells were pretreated with or without GSH 3 mmol·L-1,and then incubated with the indicated doses ofpatulin for24 h.x±s,n=3.**P<0.01,compared with corresponding patulin group.
3 讨论
本研究结果表明,PAT可明显抑制L-02的生长,呈浓度和时间依赖关系。通过荧光显微镜观察发现PAT可致L-02发生典型的凋亡形态,流式细胞术分析也证明PAT可引起L-02凋亡。表明PAT对人肝细胞具有显著毒性。
在线粒体介导的凋亡通路中,线粒体膜通透性起到“开关”的作用[8]。因此,本研究检测了PAT对MMP的影响,经过JC-1荧光染色以及Western蛋白印迹实验发现,PAT导致L-02 MMP下降,引起细胞色素c释放,最终诱导L-02凋亡。表明PAT通过线粒体损伤途径发挥了其细胞毒性。
细胞内部抗氧化系统失衡,ROS积聚,是细胞凋亡、组织衰老及损伤的起始原因。多项研究已证明PAT可与细胞内含巯基的生物大分子结合,破坏氧化还原系统,造成氧化压力,诱发细胞毒性[9-10]。其中GSH是哺乳动物细胞中巯基的主要来源,是动物细胞中关键的抗氧化剂,已证明一分子PAT可与三分子GSH发生反应,破坏其抗氧化作用[2]。本研究检测了PAT对ROS产生的影响,研究发现,PAT可显著升高L-02内部的ROS水平。外源性抗氧化剂GSH几乎可完全阻断PAT诱导的ROS水平升高及细胞死亡。因此推测,消耗胞内GSH引起ROS水平升高是PAT的主要毒性机制。总之,本研究为进一步揭示PAT的毒性机制、深入研究PAT对人体肝的影响,以及为制定PAT在食品中的限量标准提供了实验依据。
[1]Puel O,Galtier P,Oswald IP.Biosynthesis and toxicological effects of patulin[J].Toxins(Basel),2010,2(4):613-631.
[2]Mahfoud R,Maresca M,Garmy N,Fantini J.The mycotoxin patulin alters the barrier function of the intestinal epithelium:mechanism of action of the toxin and protective effects of glutathione[J].Toxicol Appl Pharmacol,2002,181(3):209-218.
[3]Boussabbeh M,Ben Salem I,Neffati F,Najjar MF,Bacha H,Abid-Essefi S.Crocin prevents patulininduced acute toxicity in cardiac tissues via the regulation of oxidative damage and apoptosis[J].J Biochem Mol Toxicol,2015,29(10):479-488.
[4]Wu TS,Liao YC,Yu FY,Chang CH,Liu BH. Mechanism of patulin-induced apoptosis in human leukemia cells(HL-60)[J].Toxicol Lett,2008,183(1-3):105-111.
[5]Liu WJ,Jia LL,Liu XL,Song HB.Research progress in determination of patulin[J].Prog Mod Biomed(现代生物医学进展),2010,10(10):1978-1979,1986.
[6]Zhao JW,He JL,Ma ZC,Liang QD,Wang YG,Tan HL.Mitochondrial toxicity effect ofRadix Aconiti LateralisPraeparata on H9c2 cardiomyocytes[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2015,29(5):816-824.
[7]Ma YC,Su N,Shi XJ,Dai MY,Zheng YC,Liu HM. Bioactivity and mechanism of jaridonin,a novel ent-kaurene diterpenoidcompound,ontumor cells growthin vitro[J].Chin Pharm J(中国药学杂志),2013,48(15):1266-1270.
[8]Ma YC,Ke Y,Zi X,Zhao W,Shi XJ,Liu HM,et al.Jaridonin,a novel diterpenoid from isodon rubescens,induces reactive oxygen species-mediated apoptosis in esophageal cancer cells[J].Curr Cancer Drug Targets,2013,13(6):611-624.
[9]Ferrer E,Juan-García A,Font G,Ruiz MJ.Reactive oxygen species induced by beauvericin,patulin and zearalenone in CHO-K1 cells[J].Toxicol In Vitro,2009,23(8):1504-1509.
[10]Liu BH,Wu TS,Yu FY,Su CC.Induction of oxidative stress response by the mycotoxin patulin in mammalian cells[J].Toxicol Sci,2007,95(2):340-347.
Toxicological effect and mechanism of patulin on human normal liver cells L-02
SU Nan1,MA Li-qing1,MA Yong-cheng2,YUE Xiao-yu1
(1.Food Science and Engineering College,Henan University of Animal Husbandry and Economy,Zhengzhou 450011,China;2.Clinical Pharmacology Laboratory,People′s Hospital,Zhengzhou University,Zhengzhou 450003,China)
OBJECTIVE To investigate the toxicological effect of patulin(PAT)on the growth of human normal liver cells L-02 and its possible mechanisms.METHODS After cells were treated with PAT 1.25,2.5,5,10 and 20 μmol·L-1for 24 or 48 h,cell viability was examined using MTT assay.L-02 cells were treated with PAT 5 and 10 μmol·L-1for 24 h,respectively.Cytomorphology and mitochondrial membrane potential(MMP)were observed under a fluorescence microscope.Apoptosis,MMP and reactive oxygen species(ROS)were analyzed by flow cytometry.Mitochondria apoptosis pathways were detected by Western blotting.RESULTS PAT exhibited a strong inhibitory effect on L-02 in a concentration-dependent and time-dependent manner.IC50of PAT treatment for 24 or 48 h was 6.61 and 2.78 μmol·L-1,respectively.MMP was decreased,while the percentage of low MMP cells increased from(9.2±2.3)%in controls to(23.4±4.5)%(PAT 5 μmol·L-1)and(47.1±5.5)%(PAT 10 μmol·L-1),respectively.Compared to untreated cells,the early apoptosis population increased from(3.8±1.1)% to(29.8±4.5)%(PAT 5 μmol·L-1)and(24.1±6.2)%(PAT 10 μmol·L-1)(P<0.01),respectively.Further⁃more,the accumulation of ROS was also observed.The effect of PAT on ROS and cell viabilities could be attenuated by glutathione.CONCLUSION PAT can significantly inhibit the growth of L-02 and induce apoptosis via ROS-dependent mitochondria pathways.
patulin;cytotoxicity;apoptosis;mitochondria;reactive oxygen species
s:MA Yong-cheng,E-mail:myc66881998@163.com;YUE Xiao-yu,E-mail:yuerain@163.com
R996.1
A
1000-3002-(2016)07-0741-06
10.3867/j.issn.1000-3002.2016.07.006
Foundation item:The project supported by National Natural Science Foundation of China(U1404332);and Program for Science&Technology Innovation Talents of Henan Province(16HASTIT017)
2016-01-07接受日期:2016-06-17)
(本文编辑:贺云霞)
国家自然科学基金(U1404332);河南省科技创新人才支持计划(16HASTIT017)
苏 楠,女,硕士,主要从事食品药品检测及毒理学研究,E-mail:catnancy@163.com
马永成,E-mail:myc66881998@163.com;岳晓禹,E-mail:yuerain@163.com
