采用ChIP-chip技术分析大鼠肺成纤维细胞转分化前后全基因组蛋白H3K4三甲基化水平的改变
2016-02-14刘素娜张红义侯建勇陈慧婷郝长付
刘素娜,姚 武,暴 磊,李 娟,张红义,侯建勇,王 迪,陈慧婷,郝长付
(郑州大学公共卫生学院,河南 郑州 450001)
采用ChIP-chip技术分析大鼠肺成纤维细胞转分化前后全基因组蛋白H3K4三甲基化水平的改变
刘素娜,姚 武,暴 磊,李 娟,张红义,侯建勇,王 迪,陈慧婷,郝长付
(郑州大学公共卫生学院,河南 郑州 450001)
目的研究经二氧化硅(SiO2)染毒的肺成纤维细胞(LF)转分化前后全基因组蛋白H3赖氨酸4(H3K4)三甲基化(met3)水平的改变。方法原代培养大鼠肺泡巨噬细胞(AM)和LF,采用transwell共培养,建立共培养模型,用100 mg·L-1游离SiO2粉尘染毒AM 24 h,收集LF细胞,免疫组织化学法对转分化后的LF进行表型鉴定。采用染色质免疫共沉淀联合芯片技术(ChIP-chip)对LF全基因组蛋白H3K4met3进行高通量筛选,采用染色质免疫共沉淀-实时荧光定量聚合酶联反应技术(ChIP-qPCR)验证芯片结果,采用定量逆转录聚合酶联反应技术(qRT-PCR)检测H3K4出现显著差异的mRNA表达水平。结果通过对经SiO2染毒前后LF全基因组蛋白H3K4met3水平的对比,共筛选出1815个基因存在H3K4显著性差异(Cy3/ Cy5比值>2.0或<0.5,NimbleScan V2.5软件),其中518个基因出现H3K4met3程度增高,1297个基因H3K4met3程度降低。随机挑选2个差异表达基因nfib和kpna3,以ChIP-qPCR和qRT-PCR方法验证,取得与CpG岛芯片一致的结果。结论经SiO2染毒的LF转分化前后全基因组蛋白H3K4met3水平存在显著改变。ChIP-chip技术有利于进一步揭示矽肺纤维化发生的分子机制,有助于发现新的蛋白标志物和基因干预靶点。
成纤维细胞;二氧化硅;肺泡巨噬细胞;染色质免疫共沉淀;组蛋白H3赖氨酸4;甲基化
目前,尘肺病仍是中国最严重的职业病,而矽肺是尘肺病中危害最严重的一种。长期吸入游离二氧化硅(SiO2)粉尘,导致肺成纤维细胞(lung fi⁃broblast,LF)转分化为肌成纤维细胞(myofibro⁃blast,MF)是矽肺发病重要的细胞基础[1]。细胞转分化是指分化完全的细胞在某些因素的刺激下,丢失其原有的表型特点而转变为其他类型细胞,是一种特定的生理或病理过程[2]。
LF在正常静息状态下不具有过度增殖和分泌能力,发生活化、功能改变是细胞转分化的结果[3]。MF的一个关键的生物学标志是α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达[4]。在肺纤维化发生时,Ⅰ型胶原(collagenⅠ,ColⅠ)和ColⅢ蛋白的含量增加,成为反映细胞外基质蛋白成分变化的主要指标[5]。因此,α-SMA,ColⅠ和ColⅢ的表达增多是LF转化为MF,发生纤维化的标志。LF在肺泡巨噬细胞(alveolar macrophage,AM)分泌的多种细胞因子,尤其是成骨细胞转化因子β1的诱导下转分化为MF,其α-SMA及胶原蛋白的表达上调,且凋亡受到抑制,这一过程已得到研究者的共识[6-7]。以往对这一过程的研究,主要从遗传学角度进行,如张海英等[3]从遗传学角度探讨了LF转分化的基因表达变化,证实了游离SiO2刺激LF过程中,大量基因和蛋白改变,但以往传统遗传学研究尚不能解释其确切机制。随着表观遗传学研究的不断深入,发现表观遗传学改变可能早于传统遗传学,且由于其改变的可逆性越来越受到关注。Sanders等[8]应用组蛋白修饰抑制剂,考察了大鼠LF的组蛋白修饰机制,并考察了Thy-1细胞表面抗原启动子区高甲基化在肺纤维化中的调控机制[9],发现表观遗传学机制在其中起到关键的调控作用,应用抑制剂干预可改变表观遗传学的调控效果。研究提示,表观遗传学调控在LF转分化中可能发挥着重要作用,但相关报道仍较缺乏,因此有必要进一步研究LF转分化过程中的表观遗传学机制。
组蛋白的共价修饰是表观遗传机制的重要内容。许多研究提示组蛋白修饰可改变染色体结构、调控组蛋白与DNA及组蛋白与组蛋白间的相互作用,从而调控基因表达[10-11]。组蛋白修饰包括乙酰化、甲基化、磷酸化和ADP核糖基化等,这些类似于组蛋白的编码子,调控染色体的功能[12]。在组蛋白共价修饰过程中研究较多的是赖氨酸甲基化,其修饰的位点有多个,如组蛋白H3赖氨酸4(his⁃tone H3 lysine 4,H3K4)、H3K9、H3K20和H3K27等。本研究采用染色质免疫共沉淀-实时荧光定量聚合酶联反应(chromatin co-immunoprecipitation linked to microarrays,ChIP-chip)技术检测了染毒组和正常组的LF全基因组蛋白H3K4三甲基化(trimethylation,met3)水平,通过比较两组细胞内相同基因位点组蛋白H3K4met3水平的差异,进行基因筛选,采用ChIP-chip和定量逆转录聚合酶联反应技术(quantitational real-time polymerase chain reaction,qRT-PCR)验证芯片结果,为进一步揭示矽肺纤维化发生的分子机制,以及发现新的蛋白标志物和基因干预靶点提供参考。
1 材料与方法
1.1实验动物
SPF级成年雄性Spraque-Dawley(SD)大鼠10只,体质量160 ~200g,购自河南省实验动物中心,许可证号为SCXK(豫)2010-0002。大鼠在温度21 ~25°C、湿度50% ~70%的屏障系统内进行常规饲养,所饲养饮用水、饲料及垫料均经消毒灭菌处理。
1.2试剂和主要仪器
游离SiO2粉尘标准品(粒径为1 ~5 μm)购自美国Sigma公司;胎牛血清,购自杭州四季青公司;DMEM培养液购自中国Solarbio公司;Trizol试剂购于上海英俊生物技术有限公司;逆转录试剂盒和RT-PCR试剂盒均购于大连宝生物生物技术有限公司;PCR引物由上海生工公司合成;抗α-SMA,ColⅠ和ColⅢ抗体均购自武汉博士德生物技术有限公司;兔抗小鼠辣根过氧化酶标记二抗购自北京中杉金桥生物技术有限公司;抗α-SMA,ColⅠ和ColⅢ抗体ELISA试剂盒购自美国BD公司;抗组蛋白H3K4met3抗体标记磁珠购于美国Santa公司;DNA纯化试剂盒购自德国Qiagen公司;NimbleGen启动子芯片和Cy3/Cy5 DNA双标试剂盒购自美国Roche公司。GenePix 4000B芯片扫描仪(美国Axon公司);ABI 7100 Real time PCR仪(美国ABI应用生物系统公司);酶标仪(美国BioTek仪器有限公司)。
1.3LF的分离和纯化
选用成熟SPF级雄性SD大鼠,脱颈椎活杀后在75%乙醇中浸泡5 min,无菌环境下解剖取出大鼠肺脏,用胰蛋白酶消化法消化适量肺组织,分离LF细胞,制成单细胞悬液,用0.4%锥虫蓝(台盼蓝)染色并计数活细胞含量。补加新鲜的含10%血清的DMEM培养液,置于37℃,5%CO2培养箱中培养。将传至4 ~8代的LF细胞用于实验。
1.4大鼠AM的提取和纯化
肺泡灌洗法提取大鼠AM。进行气管插管术后,用注射器向插管内注入PBS溶液5 mL,轻轻按摩胸腔,使细胞充分混入。反复抽推注射器5次,5 min后抽出肺内液体,将其离心(250×g,4℃)10 min,收集下层细胞,用PBS溶液洗1次,用DMEM培养基悬起细胞,调整细胞浓度约5×108L-1。将细胞悬液置入培养瓶,37℃培养2 h后,吸弃上清,再加入新鲜的DMEM培养基,即得纯化的AM,调整细胞浓度将其立即转入上室transwell中(下室LF已生长至80% ~90%),培养24 h后进行SiO2剌激处理。
1.5CCK8法检测AM存活
调整AM细胞浓度至1×109L-1,接种到96孔板中,每孔100 μL。培养2 h后吸弃培养液,更换新鲜的含20%胎牛血清的DMEM培养液。培养24 h后,实验组分别加SiO220,40,60,80,100,120和140 mg·L-1,同时设空白对照孔,每个浓度均设6个复孔,转移到培养箱中继续培养24 h,每孔加入CCK8溶液10 μL,继续培养4 h。振荡混匀后,用酶联免疫检测仪在492 nm波长下检测各孔的吸光度(absorbance,A)值,按以下公式计算细胞的存活率。细胞存活率(%)=实验组平均A值/正常对照组平均A值×100%。
1.6矽肺纤维化体外细胞模型的建立
transwell(孔径0.4 μm)只允许细胞因子通过,细胞和SiO2均不能通过,利用transwell建立大鼠LF和AM体外共培养模型来模拟体内矽肺环境,研究SiO2作用下AM对LF转分化的影响。取4 ~8代的LF,调整细胞浓度至约2×108L-1,接种于6孔板内。细胞生长至80% ~90%融合状态时,在transwell内接种约3×105个AM,悬挂于6孔板的孔内。分2组:空白组,在transwell内加入无游离SiO2的培养基每孔2 mL;处理组在transwell内加入100 mg·L-1游离SiO2粉尘悬液每孔2 mL,将此两组细胞置于37℃,5%CO2培养箱中培养24 h。
1.7免疫组织化学法鉴定LF的转分化
免疫组学法检测共培养模型中的LF内LF转分化标志物:α-SMA,ColⅠ和ColⅢ蛋白的表达。细胞棕染为检测蛋白阳性表达。利用Nikon NISElements AR4.0软件对检测结果进行光密度分析。实验步骤按免疫组化检测试剂盒说明书进行操作。
1.8ELISA法检测细胞共培养上清液中 α-SMA,ColⅠ和ColⅢ蛋白的表达
LF向MF转分化的过程中,细胞中α-SMA,ColⅠ和ColⅢ蛋白表达增高,同时一部分α-SMA,ColⅠ和ColⅢ蛋白分泌到培养上清中。收集transwell所建立的大鼠LF和AM共培养模型的上清液,采用双抗体夹心ABC-ELISA法检测上清液中α-SMA,ColⅠ和ColⅢ蛋白对LF转分化进行进一步鉴定。ELISA试剂盒室温放置平衡20 min待用,96孔反应板中每孔分别加入100 μL标本(样品或标准品),37℃孵育90 min,吸出液体,洗板3次;加50 μL的HRP标记二抗,37℃孵育60 min,吸出液体,洗板3次;加入50 μL的显色液,37℃孵育15 min,每孔加入50 μL的终止液。全自动酶标仪检测450 nm波长下的A值,绘制标准曲线,计算各样品目的蛋白的浓度。每个样品平行测定6次。
1.9ChIP-chip法测定 LF全基因组蛋白H3K4met3水平
ChIP-chip步骤基本参照以前文献中的描述进行[13],并作了一些修改,即在37℃,1%甲醛处理LF 10 min,使组蛋白和DNA发生交联,随后甘氨酸0.125 mol·L-1在37℃下处理5 min终止交联反应。PBS溶液清洗细胞后,用300 μL溶解缓冲液(0.1%SDS,0.5%TritonX-100,Tris-HCl 20 mmol·L-1pH 8.1,NaCl 150 mmol·L-1,蛋白酶抑制剂)重悬细胞,并在冰上孵育30 min,超声处理细胞悬液,用稀释缓冲液(1%SDS,NaHCO30.1 mol·L-1)进行溶解,同时设置内参组(不经免疫共沉淀的DNA片段)和阴性对照组(不经Cy3和Cy5荧光基团标记的DNA片段),各组溶解液分别加入抗组蛋白H3K4met3抗体,置于4℃孵育过夜,加入50 μL磁珠(蛋白质A/G)于4°C过夜,磁珠经洗涤后加热65℃过夜解交联。用酚氯仿抽提DNA,进行DNA扩增,用DNA纯化试剂盒对扩增的DNA进行纯化。分别用Cy3和Cy5荧光基团标记ChIP DNA(经免疫共沉淀的DNA片段)和input DNA,得到用于芯片杂交的荧光探针;将其与含有大鼠15 398个探针的CpG岛芯片进行杂交,使用GenePix 4000B芯片扫描仪(Axon Instruments,Foster City,CA)进行扫描。用NimbleScan v2.5软件读取芯片原始信号值,过滤背景噪声,提取基因表达的荧光信号强度值,并计算所有基因的Cy3/ Cy5比值,用Log2比值(log2 Cy5/Cy3)将芯片数据进行均一化处理,剔除两组差异中的假阳性基因,最后两组细胞之间Cy3/Cy5的差异:①Cy3/Cy5值>2.0或<0.5的显著差异基因确定为H3K4met3差异候选基因,Cy3/Cy5>2的基因表达水平升高,Cy3/Cy5<0.5的基因表达水平降低;②t检验法分析两组结果,筛选出的H3K4met3差异候选基因,利用Signalmap软件将在对应的H3K4met3靶点图谱中不存在的基因舍弃。
1.10ChIP-qPCR法和qRT-PCR法对CpG岛芯片所测定为H3K4met3基因的验证
ChIP操作步骤与1.9项下ChIP-chip免疫共沉淀DNA操作相同。用Trizol试剂分别提取两组细胞总RNA,将提取的总RNA进行琼脂糖凝胶电泳检测。按照逆转录试剂盒说明将细胞总mRNA逆转成cDNA。采用PCR仪对ChIP DNA、内参组、阴性对照组和逆转录细胞cDNA进行扩增。任意挑选两个经CpG岛芯片测定为H3K4met3的基因,扩增引物序列用Primer5.0软件设计,引物序列见表1。测定标准曲线和熔解曲线,确保扩增的准确性和专一性,用Ct值表示样品中模板的相对含量,采用2-△△Ct法进行分析。实时定量PCR扩增条件为:预变性95℃4 min,变性94℃15 s,退火60℃20 s,延伸72℃20 s,40个循环。
1.11统计学分析
实验结果数据均用x±s表示。应用SPSS 17.0统计软件进行单因素方差分析(one-way ANOVA),采用t检验进行组间两两比较,以P<0.05表示差异有统计学意义。
2 结果
2.1SiO2对大鼠AM存活的影响
SiO2对大鼠AM的生长具有明显的抑制作用,且呈浓度依赖性(r=0.996)(图1)。SiO220,40和60 mg·L-1染毒AM 24 h,细胞存活率与正常对照组(0 mg·L-1)无明显差异;80,100,120和140 mg·L-1组细胞存活率均低于正常对照组(P<0.05)。SiO2100 mg·L-1引起>30%的AM死亡,此浓度既确保了对AM的细胞毒性,又保证了共培养体系中AM的存活率。基于以上实验结果,确定SiO2100 mg·L-1为以下实验染毒浓度。

Tab.1 PCR primers and annealing temperatures used for mRNA analysis ofnfib,kpna3andGAPDH
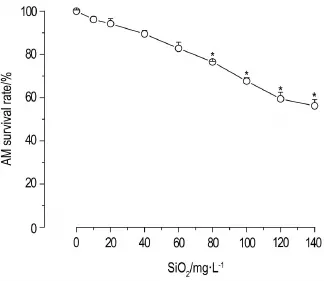
Fig.1 Effect of free SiO2on viability of alveolar macrophages(AM).The cell viability was examined by CCK8 assay when the rat AM were incubated with SiO2for 24 h.x±s,n=6.*P<0.05,compared with normal control(SiO20 mg·L-1)group.
2.2SiO2对LF中 α-SMA,ColⅠ和ColⅢ蛋白的表达量的影响
免疫组化检测结果如图2所示,与正常对照组细胞相比,SiO2100 mg·L-1组LF细胞中α-SMA,ColⅠ和ColⅢ的蛋白水平增高(P<0.05)。

Fig.2 Effect of free SiO2on expression of collagenⅠ(ColⅠ),ColⅢand α-smooth muscle actin( α-SMA)in lungfibroblasts(LF)by immunohistochemistry(×100).The staining intensity of ColⅠ,ColⅢ and α-SMA was quantified by densitometric analysis.LF were cocultured with AM treated by SiO2100 mg·L-1for 24 h.x±s,n=6.*P<0.05,compared with normal control(SiO20 mg·L-1)group.
2.3SiO2对LF和AM细胞共培养上清中 α-SMA,ColⅠ和ColⅢ蛋白的表达水平的影响
ELISA检测结果见表2,与正常对照组相比,SiO2100 mg·L-1组细胞共培养上清中α-SMA,ColⅠ和ColⅢ的蛋白表达水平升高(P<0.01)。

Tab.2 Effect of free SiO2on protein expression levels of ColⅠ,ColⅢand α-SMA in co-culture supernatant by ELISA
2.4CpG岛芯片数据分析
超声波处理细胞后,通过琼脂糖凝胶电泳判断超声效果,确定基因组DNA片段在200 ~1000 bp范围内。正常对照组与SiO2100 mg·L-1染毒组之间对全基因组蛋白H3K4差异进行分析,共筛选出1815个基因存在H3K4显著性差异(Cy3/Cy5比值>2.0或<0.5,NimbleScan V2.5软件),其中518个基因H3K4met3水平增高,1297个基因H3K4met3水平降低。部分H3K4met3改变基因见表3。
2.5ChIP-qPCR和Q-PCR验证结果
为证实CpG岛芯片结果准确性,随机挑选CpG岛芯片测定的H3K4met3阳性基因nfib和kpna3,分别运用ChIP-qPCR和QRT-PCR对免疫沉淀的cDNA和细胞mRNA进行基因分析。ChIP-qPCR和QRT-PCR结果与芯片分析结果相一致(图3)。
2.6差异基因分析
运用Cytoscape软件对差异基因进行了聚类和相互作用分析,最终确定52个基因为下一步重点研究对象,其中H3K4met3上调基因22个,H3K4met3下调基因30个(图4)。鉴定出的52个差异基因涉及细胞周期调控基因、离子通道蛋白、核转录蛋白、细胞信号转导蛋白、组蛋白和锌指蛋白。这些基因可能在LF转分化的过程中起关键作用。
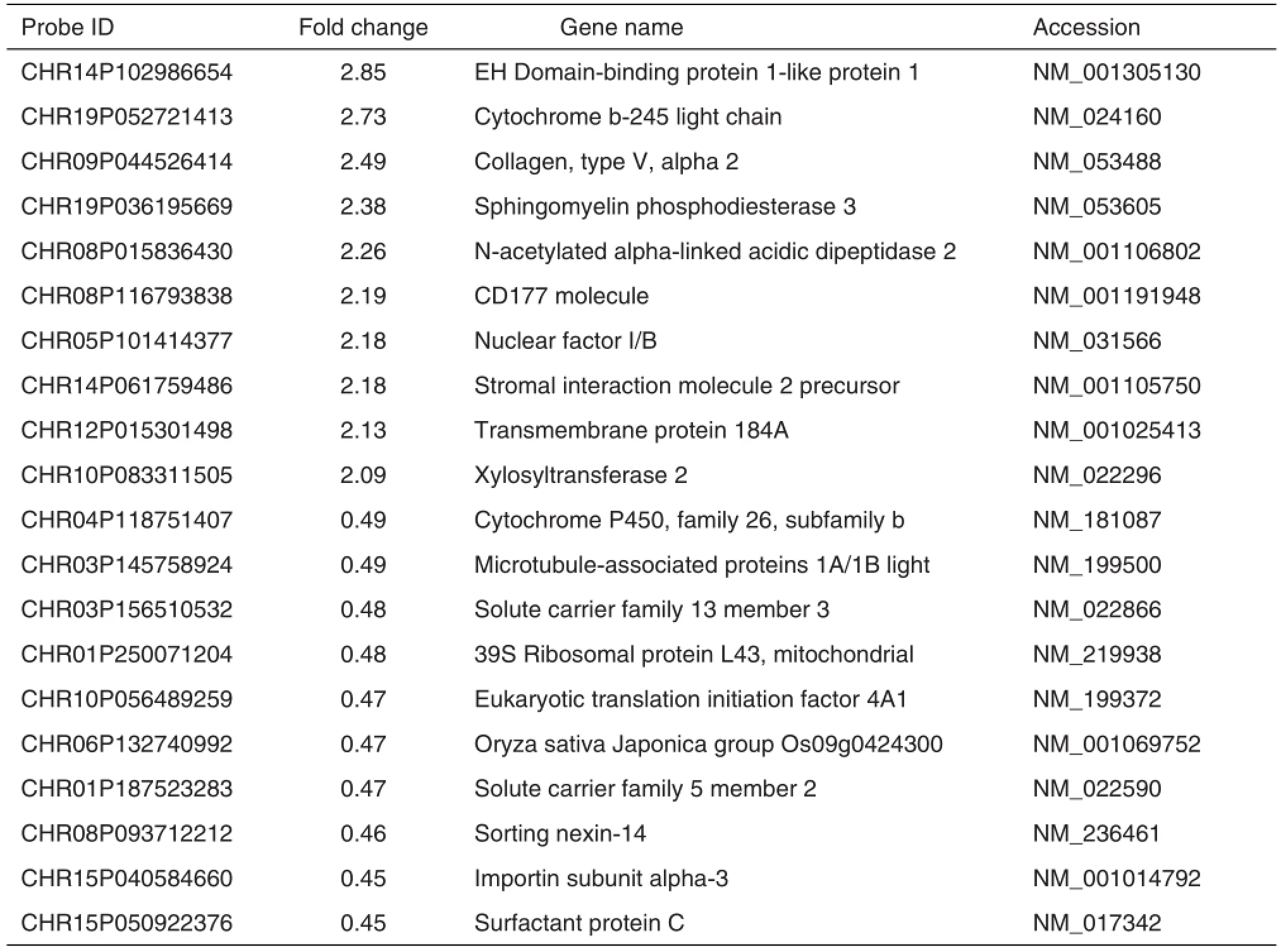
Tab.3 Enrichment of H3K4 trimethylation(H3K4met3)genes identified in ChIP-chip with LF co-cultured with AM treated by SiO2100 mg·L-1for 24 h

Fig.3 Trimethylation positive genenfibandkpnasdetected by CpG island microarrays were verified via ChIP-qPCR(B)and qRT-PCR(C).A:H3K4met3 level ofnfibandkpna3in ChIP-chip by Signalmap.B:expressions ofnfibandkpna3cDNA were measured by ChIP-qPCR.C:expressions ofnfibandkpna3mRNA were measured by qRT-PCR.LF were cocul⁃tured with AM treated by SiO2100 mg·L-1for 24 h.

Fig.4 ChIP-chip analysis of multiple histone marks at promoters of repressed genes.See Fig.3 for cell treatment. A:expression profile of dynamically changed H3K4met3 genes over a period of 24 h after SiO2100 mg·L-1stimulation by using Cyto⁃scape software.52 genes,the expression of which changed significantly relative to the normal control group,are shown.Red,green and black denote increased,decreased and no change in gene expression.B:part network of interactions of the transcription factor target genes.Molecules are represented as nodes,and the biological relationship between two nodes is represented as a line.Red repre⁃sents regulatory genes of H3K4met3 genes and yellow represents H3K4met3 genes.
3 讨论
本研究结果显示,SiO2对大鼠AM的生长具有明显的抑制作用且呈浓度依赖性。SiO2100 mg·L-1染毒AM 24 h,引起>30%AM死亡,此浓度既确保了对AM的细胞毒性,又保证了共培养体系中AM存活率,基于以上实验结果,确定SiO2100 mg·L-1为共培养模型的AM染毒浓度。在本实验建立的细胞共培养模型中,SiO2100 mg·L-1处理组LF的α-SMA、ColⅠ和ColⅢ的表达量明显高于正常对照组,且随游离SiO2浓度增高,LF的α-SMA、ColⅠ和ColⅢ的表达量也逐渐增多。处理组α-SMA、ColⅠ和ColⅢ的表达明显升高,说明在SiO2100 mg·L-1作用24 h后LF已转化为MF。
组蛋白共价修饰调控染色质重塑与转录的发生[14]。组蛋白甲基化是表观遗传的一种主要修饰形式,组蛋白甲基化修饰具有类似密码作用,能调控基因的表达[15-16]。研究发现,组蛋白H3K4甲基化可激活基因转录[17],并且这种组蛋白修饰主要发生在转录起始部位附近。染色质免疫沉淀技术是一种在体内研究DNA和蛋白质相互作用的方法。近年来此技术经过不断的发展和完善,可与DNA芯片和分子克隆技术相结合,衍生出染色质ChIP-chip等技术,用于在基因组水平上对特定反式作用因子的顺式作用元件进行高通量筛选。本研究鉴定出的H3K4met3的显著差异基因涉及细胞周期调控基因、离子通道蛋白、核转录蛋白、细胞信号转导蛋白、组蛋白、锌指蛋白等。并应用ChIP-qPCR和qRT-PCR对芯片结果进行了验证,最终证实该法所得数据的正确性。
本研究共筛选出1815个基因存在h3k4显著性差异。通过对ChIP-cDNA和细胞mRNA进行荧光定量分析发现,nfib和kpna3基因的组蛋白H3K4met3水平与其cDNA和mRNA的表达直接相关且具有一致性,又一次验证了之前研究证实的H3K4met3是基因激活的标志。通过基因的聚类和相互作用进一步对数据进行了分析和比较,最终共确定52个H3K4met3显著变化基因,其中H3K4met3上调基因22个,下调基因30个。免疫组化实验结果显示SiO2染毒促进了LF向MF的转化,说明H3K4met3阳性基因可能在LF转分化的过程中起关键作用。下一步将验证在动物实验和人群中对筛选芯片检测的阳性基因中的关键基因。
综上所述,本研究检测分析了在LF转分化过程中相关基因的组蛋白H3K4met3水平,提示组蛋白H3K4met3修饰可加快LF向MF的转化进程,它们可能参与肺组织纤维化的发生。所以,相关基因的组蛋白H3K4met3可为治疗矽肺提供一个新的研究方向,并成为新的干预靶点。
[1]Phan SH.The myofibroblast in pulmonary fibrosis[J].Chest,2002,122(5 Suppl):286S-289S.
[2]Eberhard D,Tosh D.Transdifferentiation and metaplasia as a paradigm for understanding devel⁃opment and disease[J].Cell Mol Life Sci,2008,65(1):33-40.
[3]Usuki J,Matsuda K,Azuma A,Kudoh S,Gemma A. Sequential analysis of myofibroblast differentiation and transforming growth factor-β1/Smad pathway activation in murine pulmonary fibrosis[J].J Nippon Med Sch,2012,79(1):46-59.
[4]Gong LK,Ren J.Modulation of pulmonary fibrosis by renin-angiotensin system[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2005,19(5):396-400.
[5]Schones DE,Cui K,Cuddapah S,Roh TY,Barski A,Wang Z,et al.Dynamic regulation of nucleosome positioning in the human genome[J].Cell,2008,132(5):887-898.
[6]Cutroneo KR,White SL,Phan SH,Ehrlich HP. Therapies forbleomycin induced lung fibrosis through regulation of TGF-beta1 induced collagen gene expression[J].J Cell Physiol,2007,211(3):585-589.
[7]Zhao L,Xiao K,Wang H,Wang Z,Sun L,Zhang F,et al.Thalidomide has a therapeutic effect on interstitial lung fibrosis:evidence fromin vitroandin vivostudies[J].Clin Exp Immunol,2009,157(2):310-315.
[8]Sanders YY,Tollefsbol TO,Varisco BM,Hagood JS. Epigenetic regulation of Thy-1 by histone deacetylase inhibitor in rat lung fibroblasts[J].Am J Respir Cell Mol Biol,2011,45(1):16-23.
[9]Sanders YY,Pardo A,Selman M,Nuovo GJ,Tollefsbol TO,Siegal GP,et al.Thy-1 promoter hypermethylation:a novel epigenetic pathogenic mechanism in pulmonary fibrosis[J].Am J Respir Cell Mol Biol,2008,39(5):610-618.
[10] Wolffe AP,Hayes JJ.Chromatin disruption and modification[J].Nucleic Acids Res,1999,27(3):711-720.
[11]Shi YB,Matsuura K,Fujimoto K,Wen L,Fu L.Thyroid hormone receptor actions on transcription in amphibia:the roles of histone modification and chromatin disruption[J].Cell Biosci,2012,2(1):42.
[12]Turner BM.Cellular memory and the histone code[J].Cell,2002,111(3):285-291.
[13]Singh P,Szabó PE.Chromatin immunoprecipitation to characterize the epigenetic profiles of imprinted domains[J].Methods Mol Biol,2012,925:159-172.
[14]Mahgoub M, Monteggia LM.A role for histone deacetylases in the cellular and behavioral mecha⁃nisms underlying learning and memory[J].Learn Mem,2014,21(10):564-568.
[15]Estève PO,Chin HG,Benner J,Feehery GR,Samaranayake M,Horwitz GA,et al.Regulation of DNMT1 stability through SET7-mediated lysine methylation in mammalian cells[J].Proc Natl Acad Sci USA,2009,106(13):5076-5081.
[16]Chen Y,Jie W,Yan W,Zhou K,Xiao Y.Lysinespecific histone demethylase 1(LSD1):A potential molecular target for tumor therapy[J].Crit Rev Eukaryot Gene Expr,2012,22(1):53-59.
[17]Shindo N.Histone modification:a new era of targeting epigenetics[J].Rinsho Ketsueki,2009,50(4):282-288.
Genome-wide analysis of histone H3 lysine 4 trimethylation by ChIP-chip in rat lung fibroblast transdifferentiation
LIU Su-na,YAO Wu,BAO Lei,LI Juan,ZHANG Hong-yi,HOU Jian-yong,WANG Di,CHEN Hui-ting,HAO Chang-fu
(College of Public Health,Zhengzhou University,Zhengzhou 450001,China)
OBJECTIVE To analyze trimethylation of genome-wide histone H3 lysine 4(H3K4met3)induced by silicon dioxide(SiO2)through chromatin immunoprecipitation linked to microarrays(ChIP-chip)in lung fibroblast(LF)of rats.METHODS A primary co-culture model of rat alveolar macrophages(AM)and LFin vitro.AM were exposed to 100 mg·L-1free SiO2for 24 h,before LF were collected and the phenotype of LF was determined after transdifferentiation by immunohistochemistry.ChIP-chip was used to profile the variations of trimethylation in H3K4 of lung fibroblasts in CpG island regions.ChIP-qPCR was used to validate the microarray results.The mRNA expression ofnfibandkpna3was analyzed by qRT-PCR.RESULTS Totally 1815(518 increased and 1297 decreased)genes of H3K4met3 displayed significant differences in SiO2100 mg·L-1group compared with control group(Cy3/ Cy5 value>2.0 or<0.5,NimbleScan V2.5 software).The results of ChIP-qPCR were quite consistent with those of microarray.CONCLUSION There are significant differences in methylation of genomewide H3K4 between SiO2100 mg·L-1group and control group.These novel candidate genes may become potential biomarkers or new interfered targets.
fibroblast;silicon dioxide;alveolar macrophages;chromatin co-immunoprecipitation;histone H3 lysine 4;methylation
HAO Chang-fu,E-mail:haochangfu@126.com,Tel:(0371)67781241
R965.2
A
1000-3002-(2016)07-0728-08
10.3867/j.issn.1000-3002.2016.07.004
Foundation item:The project supported by National Natural Science Foundation of China(81102109);and National Natural Science Foundation of China(81472954)
2015-12-15接受日期:2016-06-12)
(本文编辑:沈海南)
国家自然科学基金(81102109);国家自然科学基金(81472954)
刘素娜,女,博士研究生,主要从事职业性肺病的研究,E-mail:liusuna2009@126.com
郝长付,E-mail:haochangfu@126.com,Tel:(0371)67781241
