氨磷汀对人巨核细胞白血病Dami细胞增殖及分化的影响
2016-02-14汪海涛卢学春杨红旗罗龙龙李素霞乔春霞郎晓玲吴晓雄朱宏丽
汪海涛,杨 波,卢学春,胡 博,杨红旗,罗龙龙,林 洁,李素霞,范 辉,乔春霞,王 巍,郎晓玲,耿 晶,黎 燕,吴晓雄,吕 明,朱宏丽
(1.中国人民解放军总医院老年血液科,北京 100853;2.军事医学科学院基础医学研究所免疫学研究室,北京 100850;3.中国人民解放军总医院第一附属医院血液科,北京 100048;4.北京大学肿瘤医院胸外科,北京 100142)
氨磷汀对人巨核细胞白血病Dami细胞增殖及分化的影响
汪海涛1,2,3,杨 波1,卢学春1,胡 博2,4,杨红旗1,罗龙龙2,林 洁1,李素霞1,范 辉1,乔春霞2,王 巍2,郎晓玲2,耿 晶2,黎 燕2,吴晓雄3,吕 明2,朱宏丽1
(1.中国人民解放军总医院老年血液科,北京 100853;2.军事医学科学院基础医学研究所免疫学研究室,北京 100850;3.中国人民解放军总医院第一附属医院血液科,北京 100048;4.北京大学肿瘤医院胸外科,北京 100142)
目的探讨氨磷汀(依硫磷酸,Amf)对人巨核细胞白血病Dami细胞分化的影响。方法Amf 0.01 ~5.0 mmol·L-1分别处理Dami细胞12 d,每天光镜下观察细胞形态,计数Dami细胞数量,绘制增殖曲线;第12天,计数直径>20 μm细胞数量,透射电镜观察Dami细胞血小板分界膜系统的形成,流式细胞仪检测细胞DNA倍体化及细胞表面抗原CD33,CD34和CD41a的变化。结果Amf 0.1 ~1.0 mmol·L-1促进Dami细胞分化;Amf>1.0 mmol·L-1时抑制Dami细胞增殖,Amf 1.0 mmol·L-1作用12 d后光镜下观察到细胞体积增大,直径>20 μm细胞比例增加24.6%(P<0.01);透射电镜观察可见细胞出现血小板分界膜系统;流式细胞仪发现,髓系细胞分化抗原CD33表达减少13.6%;巨核细胞相关分化抗原CD41a表达增加11.9%(P< 0.05);DNA倍体分析发现,实验组4N和8N细胞分别增至31.56%和8.83%(P<0.01),并出现16N的超多倍体细胞(3.43%)。结论Amf>1.0 mmol·L-1时抑制Dami细胞增殖,0.1 ~1.0 mmol·L-1时诱导Dami细胞向成熟巨核细胞分化。
氨磷汀;Dami细胞;细胞分化;CD41a;DNA倍体化
氨磷汀(依硫磷酸,amifostine,Amf),化学名2-(3-氨基丙胺基)-乙硫醇磷酸酯,于20世纪60年代由美国Walter Reed陆军研究所研发,用于核辐射损伤的防护。作为一种前体药物,Amf只有在细胞膜碱性磷酸酶作用下脱去磷酸基,生成游离硫醇后才有活性[1]。目前,Amf也用于减轻放化疗过程中肾、骨髓、黏膜、耳及神经系统毒性[2-4]。
临床研究发现,Amf对血细胞减少性疾病,如骨髓增生异常综合征(myelodysplastic syndrome,MDS)和免疫性血小板减少症(immune thrombocytopenia,ITP)有一定疗效,2种均有巨核细胞的病态造血或分化成熟障碍,Amf治疗后患者血小板有不同水平的升高[5-8]。这种作用并不能用Amf经典的碱性磷酸酶途径解释,我们设想Amf可能通过促进巨核细胞的分化成熟,从而对MDS和ITP等存在巨核细胞分化障碍的疾病起到治疗作用。
为了验证Amf对Dami细胞的分化作用,本研究先用不同浓度Amf诱导Dami细胞,得到Amf促进Dami细胞分化的合适浓度,然后从细胞形态学,分化抗原和DNA倍体化3个方面验证了Amf对Dami细胞分化的作用。
1 材料与方法
1.1药物、细胞、试剂和仪器
Amf,纯度>99%,大连卓悦美罗药业有限公司,4℃避光保存,每次使用时配制成液体。Dami细胞来源于美国ATCC公司,由军事医学科学院基础医学研究所免疫学研究室冻存。RPMI 1640培养基,美国Hyclone公司;5%戊二醛,美国Sigma公司;小鼠抗人CD41a-PE抗体(批号:340931)和碘化丙啶(propidium iodide,PI)(批号:P4170),美国Santa Cruz公司;小鼠抗人CD33-PC5(批号:53199)、小鼠抗人CD34-PE抗体(批号:3569),美国CST公司。3111型CO2培养箱,美国Thermo公司;CK40型倒置荧光显微镜,日本Olympus公司;5417R型高速离心机,德国Eppendorf公司;流式细胞仪,美国BD公司。
1.2细胞培养及增殖检测
Dami细胞在含10%加热灭活的胎牛血清和双抗的RPMI 1640培养基中呈悬浮生长,37℃,含5%CO2饱和湿度条件下培养。将细胞浓度调整为5×108L-1,于6孔板中培养,分别调整Amf浓度为0.01,0.1,1.0和5.0 mmol·L-1,每2 d传代1次,每天计Dami细胞数,连续12 d,绘制增殖曲线。
1.3光学显微镜观察细胞形态
Amf 1.0 mmol·L-1诱导Dami细胞0,4,8和12 d,于倒置显微镜下观察,随机取3个视野,记录细胞直径>20 μm的细胞数量,并照相记录。
1.4透射电镜观察细胞血小板分界膜系统形成
血小板分界膜系统由巨核细胞膜深度凹陷形成,是分割形成血小板的前提条件,也是巨核细胞成熟的标志。在Amf 1.0 mmol·L-1诱导Dami细胞第12天,取2×106细胞,5%戊二醛固定,磷酸盐缓冲液100 mmol·L-1(pH=7.2)洗1遍,四氧化锇固定后溶于环氧树脂胶,切片后进行醋酸铀和柠檬酸铅染色,透射电镜观察。
1.5流式细胞仪检测细胞CD33,CD34和CD41a的表达
在Amf 1.0 mmol·L-1诱导的第12天,收集约1× 106细胞于EP管,4℃预冷的PBS洗1遍,分别加入100 μL小鼠抗人CD41a/CD33/CD34抗体,枪尖吹匀,37℃避光孵育30 min;PBS洗3遍,流式细胞仪检测。
其次,政策的系统性和配套性增强。任何一个政策都不是孤立存在的,纵观四十年来养老服务政策的出台,发现养老服务政策的系统性越来越强,通常是围绕一个主题的政策会有一系列的《意见》《通知》作为支撑和配套,形成一个文件群,以文件的形式将宏观导向、发展思路、具体规定和实际做法制度化,既保证了政策的连贯性和延续性,也推动了宏观政策的具体实施和落地见效,增强了政策制度的针对性、协调性、系统性。
1.6流式细胞仪检测细胞DNA倍体化
在Amf 1.0 mmol·L-1诱导的第0,4,8和12天分别收集2×106细胞,-20℃预冷的PBS洗1遍,加入75%乙醇2 mL,-20℃固定24 h;PBS洗1遍,加RNA酶1 g·L-1100 μL,37℃避光30 min,加入PI染液0.1 g·L-1100 μL,室温避光5 min,流式细胞仪检测,Cell quest pro软件分析细胞倍体化。
1.7统计学分析
使用SPSS13.0软件包分析,计量资料用x±s表示,两组之间均数比较采用t检验,等级资料用Wilcoxon检验,P<0.05认为差异有统计学意义。
2 结果
2.1氨磷汀对Dami细胞增殖的影响
增殖曲线结果显示(图1),和正常对照组相比,Amf浓度<0.01 mmol·L-1时,Dami细胞增殖不受影响;而>1.0 mmol·L-1时,Dami细胞增殖受到抑制(P<0.05)。
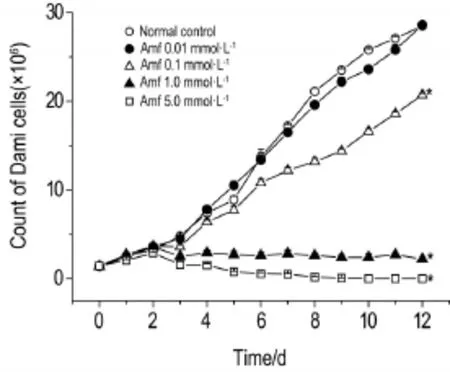
Fig.1 Effect of amifostine(Amf)on proliferation of Dami cells determined by cell counting.x±s,n=3.*P< 0.05,compared with normal control group.
2.2氨磷汀对Dami细胞形态的影响
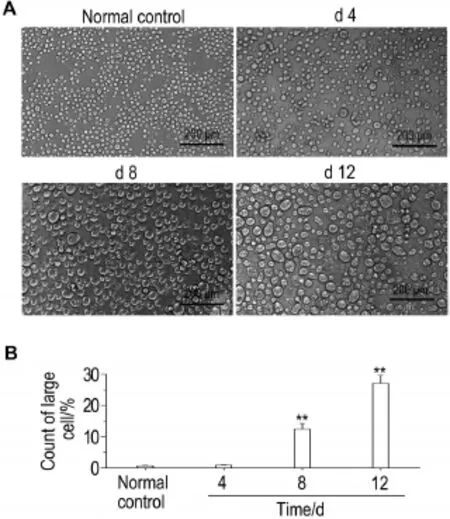
Fig.2 Effect of Amf 1.0 mmol·L-1on morphology of Dami cells(A)and proportion of Dami cells with diameter>20 μm(B).See Fig.1 for the treatment.x±s,n=3. **P<0.01,compared with normal control group.
Dami细胞向巨核细胞分化过程中,细胞体积逐渐增大,并>20 μm[9]。显微镜下随机选取3个视野,计数直径>20 μm细胞的比例(图2),和正常对照组相比,Amf 1.0 mmol·L-1诱导12 d后,直径>20 μm的Dami细胞比例由0.2%增加至24.8%(P<0.01)。后续实验选用Amf 1.0 mmol·L-1诱导Dami细胞分化。
2.3氨磷汀对血小板分界膜系统形成的影响
透射电镜观察血小板分界膜系统(图3),结果显示,与正常对照细胞相比,在Amf 1.0 mmol·L-1处理第12天,电镜观察见Dami细胞胞体明显增大,直径可达约100 μm,细胞边缘不规则,呈海绵状。提示Amf能促进Dami细胞向成熟巨核细胞分化。
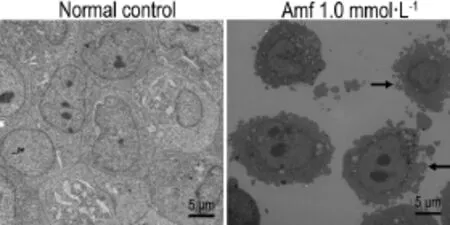
Fig.3 Effect of Amf 1.0 mmol·L-1for 12 d on platelet demarcation membrane system in Dami cells by transmission electron microscopy.Arrows indicate the platelet demarcation membrane system.
2.4氨磷汀对Dami细胞CD33,CD34和CD41a表达的影响
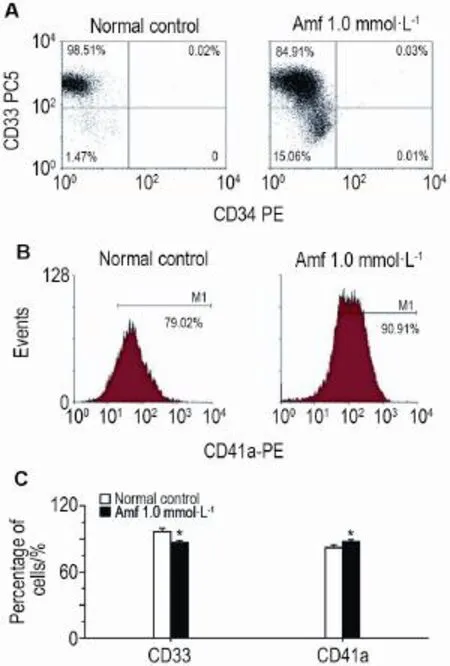
Fig.4 Effect of Amf 1.0 mmol·L-1for 12 d on expression of CD33(A),CD34(A)and CD41a(B)on Dami cell surface by flow cytometric analysis.C was the semi-quantitative result of A and B.x±s,n=3.*P<0.05,compared with normal control group.
流式细胞仪检测结果(图4)显示,两组Dami细胞表面CD34表达均很弱,<0.1%,未作比较。与正常对照细胞相比,Amf 1.0 mmol·L-1诱导第12天,Dami细胞表面髓系抗原CD33的表达减少13.6%(P< 0.05),而巨核细胞成熟相关抗原CD41a的表达增加11.9%(P<0.05)。
2.5氨磷汀对Dami细胞DNA倍体化的影响
细胞DNA倍体分布检测结果(图5)表明,在Amf 1.0 mmol·L-1诱导的第0天(正常对照组)以2N和4N为主,分别占62.46%和15.63%,而8N和16N细胞的比例分别占0.21%和0.02%。随着时间延长(第4,8和12天),多倍体细胞逐渐增加;在诱导第12天,与正常对照组相比,4N和8N细胞比例分别增加至31.56%和8.83%,并出现16N细胞,占3.43%(P<0.01)。

Fig.5 Effect of Amf 1.0 mmol·L-1for indicated number of days on DNA ploidy in Dami cells.B was the semiquantitative result of A.x±s,n=3.*P<0.05,**P<0.01,compared with normal control(0 d)group.
3 讨论
本研究单独应用Amf诱导Dami细胞,发现Amf具有促进Dami细胞分化的作用。有关Amf促进巨核细胞分化作用最早由Kashiwakura等[10]报道,他们用Amf联合血小板生成素(thrombopoietin,TPO)在体外诱导胎盘及脐带血CD34+细胞向巨核细胞分化,发现和TPO组相比,巨核系祖细胞数量分别增加70倍和83倍。但他们采用Amf联合TPO诱导细胞分化,不能直接说明Amf具有促进细胞分化的作用。
本研究Dami细胞直径约在10 ~15 μm,处于原始巨核细胞阶段,在Amf处理第4天,开始出现4N细胞,同时细胞体积增大至>20 μm。在处理第12天,直径>20 μm细胞比例达24.8%,倍体在>4N细胞占43.8%,且透射电镜观察到血小板分界膜系统出现,说明Amf具有诱导Dami细胞向成熟巨核细胞分化的作用。成熟巨核细胞由造血干细胞经巨核/红系祖细胞、巨核系祖细胞、原始巨核细胞、幼巨核细胞和颗粒型巨核细胞等阶段分化而来。巨核细胞的成熟过程伴随着细胞体积及染色体倍体的增加。据报道,原始巨核细胞染色体倍体为2N,平均直径约在20 μm,而幼稚巨核细胞阶段开始出现多倍体,最多达8N,细胞直径增大至约30 μm;成熟巨核细胞(颗粒型或产板型)倍体通常>32N,细胞体积巨大,>40 μm,且出现血小板分界膜系统[9,11]。本研究Dami细胞经过Amf 1.0 mmol·L-1处理12 d后,细胞体积增大,倍体增加,并出现血小板分界膜系统,与文献[9,11]报道相符。
人红系和巨核系有着共同的祖细胞,即巨/红系祖细胞,表型为Lin-CD34+CD33+D38+IL3Rα-CD45RA-[12],当分化为成熟巨核细胞时,细胞表面CD33和CD34的表达降低,而CD41a,CD42b,CD45和CDw32等表达升高[11,13]。其中,CD41a是巨核细胞分化成熟的特征性分子标志,在巨核细胞分化过程中始终表达,其表达强度和巨核细胞分化成熟程度相关[14]。本研究分别在Amf诱导的第0,4,8和12天,通过流式细胞仪检测Dami细胞表面CD41a表达水平,发现随着Amf处理时间延长,Dami细胞表面CD41a表达强度逐渐增加,而CD33表达强度逐渐降低,符合巨核细胞的分化规律。
本研究结果表明,Amf具有诱导Dami细胞分化的作用,但Amf促进Dami细胞分化的分子机制尚不清楚。下一步将通过基因芯片技术检测Amf处理前后Dami细胞基因表达谱差异,进一步研究Amf诱导Dami细胞分化的机制,为临床应用Amf治疗血小板生成障碍性疾病提供理论依据。
[1]Purdie JW,Inhaber ER,Schneider H,Labelle JL. Interaction of cultured mammalian cells with WR-2721 and its thiol,WR-1065:implications for mechanisms of radioprotection[J].Int J Radiat Biol Relat Stud Phys Chem Med,1983,43(5):517-527.
[2]Capizzi RL,Scheffler BJ,Schein PS.Amifostinemediated protection of normal bone marrow from cytotoxic chemotherapy[J].Cancer,1993,72(11 Suppl):3495-3501.
[3]Gurney JG,Bass JK,Onar-Thomas A,Huang J,Chintagumpala M,Bouffet E,et al.Evaluation of amifostine for protection against cisplatin-induced serious hearing loss in children treated for averagerisk or high-risk medulloblastoma[J].Neuro Oncol,2014,16(6):848-855.
[4]Kanter M,Topcu-Tarladacalisir Y,Uzal C.Role of amifostine on acute and late radiation nephrotoxicity:a histopathological study[J].In Vivo,2011,25(1):77-85.
[5]Grossi A,Fabbri A,Santini V,Leoni F,Nozzoli C,Longo G,et al.Amifostine in the treatment of lowrisk myelodysplastic syndromes[J].Haematologica,2000,85(4):367-371.
[6]List AF,Brasfield F,Heaton R,Glinsmann-Gibson B,Crook L,Taetle R,et al.Stimulation of hematopoi⁃esis by amifostine in patients with myelodysplastic syndrome[J].Blood,1997,90(9):3364-3369.
[7]Schanz J,Jung H,Wörmann B,Gassmann W,Petersen T,Hinke A,et al.Amifostine has the potential to induce haematologic responses and decelerate disease progression in individual patients with low-and intermediate-1-risk myelodysplastic syndromes[J].Leuk Res,2009,33(9):1183-1188.
[8]Fan H,Zhu HL,Li SX,Lu XC,Zhai B,Guo B,et al.Efficacy of amifostine in treating patients with idiopathic thrombocytopenia purpura[J].Cell Biochem Biophys,2011,59(1):7-12.
[9]Kaushansky K,Lichtman M,Beutler E,Kipps T,Seligsohn U,Prchal J,et al,Williams Hematology[M].8th ed.New York:McGraw-Hill Medical,2010:1721.
[10]Kashiwakura I,Murakami M,Inanami O,Hayase Y,Takahashi TA,Kuwabara M,et al.Effects of amifostine on the proliferation and differentiation of megakaryocytic progenitor cells[J].Eur J Pharmacol,2002,437(1-2):19-25.
[11]Tomer,A.Human marrow megakaryocyte differentiation:multiparameter correlative analysis identifiesvon Willebrandfactor as a sensitive and distinctive marker for early(2N and 4N)megakaryocytes[J].Blood,2004,104(9):2722-2727.
[12]Yu M,Cantor AB.Megakaryopoiesis and thrombo⁃poiesis:an updateon cytokinesand lineage surface markers[J].Methods Mol Biol,2012,788:291-303.
[13]Qiao X,Loudovaris M,Unverzagt K,Walker DE, Smith SL,Martinson J,et al.Immunocytochemistry and flow cytometry evaluation of human megakary⁃ocytes in fresh samples and cultures of CD34+cells[J].Cytometry,1996,23(3):250-259.
[14]Mostafa SS,Papoutsakis ET,Miller WM.Oxygen tension modulatesthe expression ofcytokine receptors,transcription factors,and lineage-specific markers in cultured human megakaryocytes[J].Exp Hematol,2001,29(7):873-883.
Effect of amifostine on proliferation and differentiation of human megakaryocyte Dami cells
WANG Hai-tao1,2,3,YANG Bo1,LU Xue-chun1,HU Bo2,4,YANG Hong-qi1,LUO Long-long2,LIN Jie1,LI Su-xia1,FAN Hui1,QIAO Chun-xia2,WANG Wei2,LANG Xiao-ling2,GENG Jing2,LI Yan2,WU Xiao-xiong3,LYU Ming2,ZHU Hong-li1
(1.Department of Geriatric Hematology,Chinese PLA General Hospital,Beijing 100853,China;2.Laboratory of Immunology,Institute of Basic Medical Sciences,Academy of Military Medical Sciences,Beijing 100850,China;3.Department of Hematology,the First Affiliated Hospital of Chinese PLA General Hospital,Beijing 100048,China;4.Department of Thoracic Surgery,Peking University Cancer Hospital&Institute,Beijing 100142,China)
OBJECTIVE To investigate the effect of amifostine(Amf)on the differentiation of human megakaryocyte cell line-Dami.METHODS Dami cells were treated with Amf 0.01-5.0 mmol·L-1for 12 d. Dami cells were counted every day for the growth curve:only cells with a diameter>20 μm.The platelet demarcation membrane system was observed by transmission electron microscopy.The expression of CD33,CD34,CD41a and DNA ploidy was detected by flow cytometry.RESULTS Amf 0.1-1.0 mmol·L-1promoted the differentiation of Dami cells,but inhibited their proliferation at a concentration>1.0 mmol·L-1. When these cells were treated with Amf 1.0 mmol·L-1for 12 d,the platelet demarcation membrane system was observed,the percentage of cells with a diameter>20 μm was increased by 24.6%(P< 0.01),the expression of CD41a was increased by 11.9%,while the expression of CD33 was decreased by 13.6%(P<0.05).Polyploidy cells(16N)were observed,and 4N,8N and 16N cells were increased to 31.56%,8.83%and 3.43%,respectively(P<0.05).CONCLUSION Amf 0.1-1.0 mmol·L-1can promote the differentiation of Dami cells,but inhibit their proliferation at a high concentration(>1.0 mmol·L-1).
amifostine;Dami cells;cell differentiation;CD41a;DNA ploidy
s:ZHU Hong-li,E-mail:bjzhl202_cn@sina.com,Tel:(010)66876267;LYU Ming,E-mail:lm62033@ 163.com,Tel:(010)66931325;
R979.6,R973
A
1000-3002-(2016)07-0723-05
10.3867/j.issn.1000-3002.2016.07.003
Foundation item:The project supported by National Natural Science Foundation of China(81273597);Innovation and Nursery Foundation of Chinese PLA General Hospital(15KMM28);and Military Health Care Foundation(13BJ247)
2016-04-12接受日期:2016-06-22)
(本文编辑:贺云霞)
国家自然科学基金项目(81273597);解放军总医院科技创新苗圃基金(15KMM28);全军保健基金(13BJ247)
汪海涛,男,硕士,主要从事血液病的基础与临床研究,E-mail:ws_ht@126.com;朱宏丽,女,主任医师,主要从事老年血液病的基础与临床研究。
朱宏丽,E-mail:bjzhl202_cn@sina.com,Tel:(010)66876267;吕 明,Tel:(010)66931325,E-mail:lm62033@163.com
