受体型酪氨酸激酶RON及其在恶性肿瘤发生发展中的作用研究进展
2016-02-14虞碧霞陈俊丰
马 琪,虞碧霞,陈俊丰,程 跃
(宁波市第一医院1.泌尿系疾病转化医学研究实验室,2.泌尿肾病中心,浙江宁波 315010)
受体型酪氨酸激酶RON及其在恶性肿瘤发生发展中的作用研究进展
马 琪1,虞碧霞1,陈俊丰1,程 跃2
(宁波市第一医院1.泌尿系疾病转化医学研究实验室,2.泌尿肾病中心,浙江宁波 315010)
巨噬细胞刺激蛋白受体(RON)隶属于原癌基因met家族。目前发现,RON在多种肿瘤存在异常表达。它通过配体结合、受体的过表达和原癌基因变异体的产生,以及激酶区的点突变获得激活,并通过促丝裂原活化蛋白激酶和磷酸肌醇3激酶等信号通路向下游传递,调节细胞增殖、凋亡、迁移与浸润。了解RON在肿瘤发生发展中的作用及其机制以及相关致癌信号途径,能为基于RON的肿瘤靶向治疗提供更多参考。
酪氨酸激酶;RON;肿瘤;靶向治疗
受体酪氨酸激酶家族中,RON是一组具有独特生物学功能的原癌基因。巨噬细胞刺激蛋白受体(Recepteur d′origine Nantais,RON)在肿瘤细胞的形成、侵袭性生长和恶性表型中发挥重要作用。了解RON在肿瘤发生发展中的作用及其机制和多重致癌信号途径,能为基于RON的肿瘤靶向治疗提供更多参考。
1 RON的基因表达和分子结构
1993年,从人皮肤角化细胞中克隆得到编码酪氨酸激酶受体RON蛋白的cDNA,其分子克隆揭示,RON是酪氨酸激酶受体蛋白c-met原癌基因家族中的一员。RON基因由20个外显子和19个内含子组成,定位于人第3对染色体的长臂p21区域内(3p21)[1]。成熟的RON蛋白是由2个蛋白亚单位组成的单体,分子质量约185 ku。α-亚单位的分子质量约40 ku,位于细胞膜外;β-亚单位的分子质量约145 ku,由胞外、跨膜和胞内3部分组成[2]。
RON的胞外区含有一些重要的功能域,其中包括1个信号蛋白域(sema域,semaphoring domain)、1个丝蛋白、信号蛋白和整合素域(PSI,域plexin,semaphor-and integrin domain及4个连续的免疫球蛋白样免疫球蛋白丛蛋白转录IPT域)〔immunoglobulin-like immunoglobulin plexin tran⁃scription(IPT)domains〕[2-3]。Sema域的主要功能是结合巨噬细胞刺激蛋白(macrophage stimulat⁃ing protein,MSP),从而通过配体依赖途径引起受体分子形成同源二聚体[2-3]。另外,RON可与和其他受体如肝细胞生长因子受体和表皮生长因子受体(epidermal growth factor receptor,EGFR)等结合形成异源二聚体[2,4]。而IPT域的主要功能则是调节RON的活性,通过mRNA的异常剪切过程引起IPT域起始段的插入或缺失,这些插入或缺失与RON的激活密切相关[5]。因此,胞外域在调节RON的活性方面至关重要。
2 RON的激活机制
RON是由二聚体化被激活的。RON被激活的4种途径是特异的配体结合、受体的过表达、原癌基因变异体的产生和激酶区的点突变[2,6-7]。RON能发生自身磷酸化,并与下游信号蛋白发生交互作用,最终导致细胞增殖,上皮细胞获取纤维间充质细胞表型,细胞迁移侵袭能力增强,并产生药物抗性[7]。
2.1配体诱导的激活
MSP结合RON是激活RON的经典模式。MSP是已知的RON的唯一配体,它能诱导RON的二聚体化导致信号激活。MSP是肝细胞生长因子家族的一个蛋白,合成的MSP以无活性的前体形式在血液中循环。MSP前体被水解后产生生物活性,获得受体结合能力,成为具有双链结构的成熟MSP。成熟MSP分子拥有2个受体结合位点,其中高亲和力结合位点位于β链上,α链上则隐藏了1个低亲和力结合位点[8]。晶体结构分析显示MSP的β链与RON的sema、PSI及第1个IPT域区(SPI1)按1∶1比例形成复合结构;MSP的αβ链也能与SPI1按1∶1比例结合,且具有与MSPβ-SPI1类似的亲和力。然而,MSP的αβ-SPI1除了能形成1∶1复合结构外,尚能形成亲和力弱的2∶2复合结构。提示MSP β主要与RON结合,而MSP α则主要调节RON的二聚体化[6]。RON与MSP结合后,迅速通过二聚化导致自身激酶域的磷酸化,从而使催化效率极大提高,并且磷酸化的RON亦能发生构象变化,表现在RON的C端产生能结合多种信号蛋白的多功能锚定位点[9](图1)。
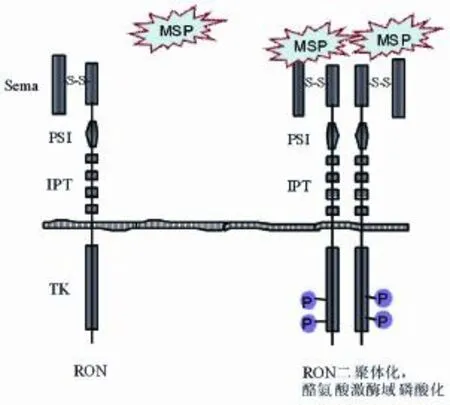
图1 巨噬细胞刺激蛋白(MSP)刺激酪氨酸激酶受体RON活化。MSP是RON的唯一配体。RON与MSP结合后,导致RON的二聚体化和酪氨酸激酶区的磷酸化,RON被激活,并进一步向下游传导信号。Sema:RON蛋白N端的一个功能域;PSI:RON蛋白中的1个具有类似导向蛋白、丛状蛋白和整合素样结构的功能域;IPT:RON蛋白中的4个具有免疫球蛋白样结构的功能域;TK:RON蛋白的酪氨酸激酶区;S:连接RONα链与β链之间的二硫键;P:RON蛋白的酪氨酸磷酸化位点。
2.2异构体介导的激活
RON的另一个激活机制是RON异构体的产生。RON的一些异构体会持续激活、致瘤;而另一些异构体则会由于多部位缺陷而失活。目前至少已确定了9个RON异构体,其中包括RONΔ170,RONΔ165,RONΔ165.e11p,RONΔ160,RONE5/6in,RONΔ155,RON110,RONΔ85和 RONΔ55。 RON异构体的产生机制主要是由于mRNA的剪切替换,蛋白酶解以及选择性转录[10]。RON异构体的激活机制在很大程度上是未知的,可能与氨基酸或RON蛋白特殊域的缺失引起的构象变化有关[6]。至于RONΔ160,它的产生由一段109个氨基酸序列的缺失造成,这一段氨基酸序列由外显子5和6在RON胞外的第一个IPT域编码。缺失导致了细胞外的半胱氨酸残基序列不平衡,然后导致RON蛋白发生自发二聚体化和持续激活[11]。因此,RON的异构体是RON激活的一个机制,它在细胞病理和肿瘤形成上具有重要作用(图2)。

图2 RON异构体介导的激活。RONΔ160是RON的致癌性异构体,在结肠癌、乳腺癌等多种肿瘤表达。RONΔ160在转录过程中发生了第5和6外显子的异常剪切。因此,表达后基因序列对应的第一IPT域是缺失的。第一IPT域缺失后,无需MSP的刺激,RONΔ160发生自发的二聚体化和酪氨酸激酶域的磷酸化,并向下游持续传递信号。RONΔ160:RON原型蛋白缺少了第5和6外显子的异构体。
2.3过表达诱导的激活
在多种肿瘤中存在RON的过表达,RON的过表达与患者的预后相关[2,6-7]。过表达的原因很复杂,RON蛋白的稳定增长和抗内吞作用、细胞内蛋白的水解和降解作用、以及肿瘤细胞内蛋白酶体降解途径的减少等可能是导致RON过表达的原因[12]。此外,RON基因的畸变也会导致RON的过表达。在胃食管腺癌中,RON基因的拷贝数是增加的,这提示基因拷贝数的增加可能也是RON过表达的机制之一[13]。最后,通过晶体包装分析RON和RON之间的交互作用,证实了RON的sema域能够形成同源二聚体[6,8]。在肿瘤细胞中,RON在细胞表面或胞质中的异常积累形成了RON的高密度的环境。这种高密度环境足以引起RON同源二聚体的形成和RON的活化。
2.4点突变介导的激活
进行海绵城市建设的主要是在影响较低的基础之上建立城市水利系统,主要包含河流、湖泊、地下水系统,建立一个完整的整体。随着经济的不断发展与进步,城市化进程不断加快,城市的面积也在不断的扩大,资源开发利用不断增加,使得整个环境工程质量有所下降。在我国国内较为严重的就是水环境的问题,水资源短缺、水污染严重、分布不均等等,使得农村牧区用水的安全性无法得到保证。洪水、内涝灾害时常发生。海绵城市理念主要是对水资源短缺以及水污染源严重的问题,提出了雨水对于城市生态建设工作的管理方向。与此同时通过对城市污水的回收再利用,实现对生态系统的保护。
RON激活的第4种方式是由某些实验性的突变所致。例如,RON氨基酸序列中Asp1232和Met1254是其激酶域的两个关键残基。用点突变技术使Asp1232替换为Val1232或Met1254替换为Thr1254,足以使RON持续激活并产生致瘤性。此外,在RON激酶域Thr1254替换Met1254能引起RON构象的重排,导致Tyr1238的磷酸化并激活RON[14]。
3 RON的下游信号传导和生物学作用
RON的信号传导主要是通过RAS蛋白-丝裂原活化蛋白激酶(mitogen activated protein ki⁃nase,MAPK)和磷酸肌醇3激酶-丝/苏氨酸蛋白激酶(phosphoinositide 3 kinase-serine/threonine protein kinase,PI3K-AKT)途径进行。在RON信号介导的肿瘤发生中,RAS-MAPK和PI3K-AKT通路被激活,发生细胞上皮间充质转化(epithelial to mesenchymal transition,EMT)现象,即上皮细胞失去其上皮细胞表型并获得纤维间充质细胞表型,获得了较强的运动和迁移能力。RAS-MAPK和PI3K-AKT在EMT中起到重要的作用。在MDCK细胞模型中,通过RAS-MAPK介导途径,表现为RON介导EMT,纺锤体呈现特定形态,上皮细胞钙黏蛋白表达减少,波形蛋白表达增加等[15]。核糖体蛋白S6激酶2(ribosomal protein S6 kinase-2,RSK-2)是MAPK通路的下游信号蛋白,也是主要连接RON和EMT的信号分子。研究表明,RSK-2是上皮细胞侵入性生长的重要分子[16]。侵入性生长进一步受RON介导的PI3K-AKT信号的调控,从而增加体外上皮细胞黏附、迁移、浸润和转移。近来研究还发现,RON在低氧环境下,能发生细胞核转位,在细胞核与低氧诱导因子1结合后,作为转录因子与c-jun基因启动子D区结合,造成c-jun的转录,并进而导致肿瘤细胞在缺氧环境下的生长与增殖[17]。
4 RON在肿瘤发生发展中的作用
RON在人体多种常见上皮性肿瘤的发生发展中所起的作用已被广泛地证实。明确RON在各种组织中的表达情况,具有重要的临床意义。
4.1胰腺癌
胰腺癌是一种恶性度极高的肿瘤。近年来研究发现,RON与胰腺癌存在相关性。使用免疫组化技术,在33%~96%胰腺癌临床标本中可检测到RON,而RON的表达与肿瘤病理进程成正相关:在正常胰腺导管或早期低级别胰腺上皮内瘤变(pan⁃creatic intraepithelial neoplasia,PanIN-1)呈极低程度表达,而在高级别胰腺上皮内瘤变(PanIN 2-3)以及原发性胰腺癌和转移性胰腺癌却有RON的过量表达[18]。随后在转基因小鼠的模型中也进一步证明了RON在胰腺癌发生发展中起了重要作用。使用胰腺特异性启动子Pdx-1将RON基因转入小鼠后,18个月可见胰腺肿瘤的形成。而在kras突变的小鼠,在转入RON后,仅需6周即可观察到胰腺肿瘤的形成与转移,提示在ras突变的胰腺癌,RON起到了重要的协调作用[19]。联合使用RON小分子抑制剂BMS-777607和mTOR抑制剂AZD8055可有效抑制对化疗药物耐药的胰腺癌细胞L3.6pl[20]。由于RON是一种细胞膜上的酪氨酸激酶受体,这使得RON成为研究者们颇感兴趣的胰腺癌靶向治疗的一个潜在靶点[21]。
4.2乳腺癌
RON在人体正常乳腺上皮细胞和良性乳腺损伤中表达较低,但在各种病理分型的原发乳腺癌中表现为异常高表达。体外乳腺癌细胞的生长实验表明,RON受体的激活导致了细胞增殖、转移和侵袭等现象[22],表明RON过度表达在人类乳腺癌侵袭-转移的发展过程中发挥了重要作用。目前研究证明,多种RON的异构体在乳腺癌细胞中表达,其中包括RON的致癌性异构体RONΔ160。使用RONΔ160特异性单抗Zt/h12可观察到RONΔ160在77%浸润性导管癌、42%小叶癌和64%淋巴结转移的乳腺癌标本中表达。使用RON抑制剂PHA665752处理移植乳腺癌细胞DU4475的裸鼠,13 d后可观察到肿瘤体积抑制了近60%,提示RONΔ160可作为乳腺癌靶向治疗的一个潜在靶点[11]。RON在乳腺癌中的异常表达促进了乳腺癌的发展,针对RON的靶向治疗的临床试验正在进行中[2]。
4.3大肠癌
RON在正常大肠组织中几乎不表达,但在多种(59.2%)大肠癌细胞系中高表达,并呈持续的激活。免疫组化染色技术发现,大部分大肠癌中RON高水平表达,与正常大肠黏膜相比增高4 ~6倍。并且RON的3种剪切变异体RONΔ165,RONΔ160和RONΔ155也在多个大肠癌样本中被检测到[23]。在种植结肠癌细胞株HT29的裸鼠模型中,使用RON特异性抗体Zt/f2能够抑制近50%的肿瘤生长,与化疗药物氟尿嘧啶联合使用后,肿瘤的抑制程度提高到80%[24],这进一步促进了结肠癌靶向治疗的临床前研究。使用抗体药物偶联技术将细胞毒药物美坦新(美登素,maitansine,DM1)与RON特异性抗体Zt/g4制备成Zt/g4-DM1。Zt/g4-DM1在小鼠异种移植肿瘤模型中高度有效,>95%肿瘤的生长被抑制,且Zt/g4-DM1抑制肿瘤不再生长的时间可持续20 d[25]。
4.4膀胱癌
RON在正常膀胱组织中呈低水平的表达,而在膀胱癌中,RON蛋白呈明显的异常过表达。RON的异常表达与肿瘤的组织学分期、大小、外形和肿瘤分期呈正相关,RON与同家族的MET在19.1%膀胱癌呈现共表达。RON与MET在膀胱癌的共表达与总体生存率及无转移生存率明显相关[26]。33.3%膀胱癌患者可发现RON与EGFR的共表达,这种共表达与肿瘤浸润、局部复发及疾病预后显著相关[27]。在1项Ⅰ期临床试验中,使用2个周期的RON靶向小分子抑制剂戈伐替尼(golvatinib),使1例膀胱肿瘤患者获得了部分缓解[28]。
4.5其他恶性肿瘤
除了上述肿瘤,近年来也报道了RON在其他多种恶性肿瘤的异常表达及其与肿瘤浸润进展和预后的相关性。如在胃癌细胞异常表达的RON160可促进肿瘤细胞在体内、体外的浸润进展[29]。在非小细胞肺癌小鼠模型中,使用RON/ MET小分子抑制剂LY2801653显著抑制了肿瘤生长和肿瘤血管生成,为RON/MET抑制剂LY2801653提供了临床前应用依据[30]。在64.3%头颈部鳞癌(head and neck squamous cell carci⁃noma,HNSCC)患者有RON的表达,且RON的表达与EGFR的异常磷酸化(pEGFR)相关。有RON/pEGFR的HNSCC患者无疾病生存期较无RON/pEGFR的HNSCC患者缩短[31]。16%肝门胆管癌患者有RON和MET的表达,RON和MET的共表达是肿瘤预后不良的独立预后因子[32]。在经典型霍奇金淋巴瘤和弥漫性大B细胞淋巴瘤,RON均是一个与预后相关的独立预后因子[33-34]。以上结果表明,RON是一种与多种恶性肿瘤相关的酪氨酸激酶受体。
5 结语
受体酪氨酸激酶RON是人类酪氨酸激酶大家族的一个特定成员,在胚胎发育和天然免疫中具有不可替代的作用,并且长期的研究已证实RON在肿瘤的发生发展中发挥了重要作用,如在胰腺癌、乳腺癌、大肠癌和膀胱癌等多种肿瘤RON均介导了致癌信号的传递和下游信号分子的激活。目前,基于RON肿瘤靶向治疗的临床试验正在进行,可以预期,在不远的将来,基于RON的靶向治疗将由实验室研究走向肿瘤治疗的临床应用。
[1]Chang K,Karnad A,Zhao S,Freeman JW.Roles of c-Met and RON kinases in tumor progression and their potential as therapeutic targets[J].Onco⁃target,2015,6(6):3507-3518.
[2]Yao HP,Zhou YQ,Zhang R,Wang MH.MSP-RON Signalling in cancer:pathogenesis and therapeutic potential[J].Nat Rev Cancer,2013,13(7):466-481.
[3]Wang X,Hankey PA.The ron receptor tyrosine kinase:a key regulator of inflammation and cancer progression[J].Crit Rev Immunol,2013,33(6):549-574.
[4]Wang MH,Padhye SS,Guin S,Ma Q,Zhou YQ. Potentialtherapeutics specific to c-MET/RON receptor tyrosine kinases for molecular targeting in cancer therapy[J].Acta Pharmacol Sin,2010,31(9):1181-1188.
[5]Ma Q,Zhang K,Guin S,Zhou YQ,Wang MH. Deletion or insertion in the first immunoglobulinplexin-transcription(IPT)domain differentially reg⁃ulates expression and tumorigenic activities of RON receptor tyrosine kinase[J].Mol Cancer,2010,9(9):307.
[6]Chao KL,Gorlatova NV,Eisenstein E,Herzberg O.Structural basis for the binding specificity of human Recepteur d'Origine Nantais(RON)recep⁃tor tyrosine kinase to macrophage-stimulating pro⁃tein[J].J Biol Chem,2014,289(43):29948-29960.
[7]Wang MH,Zhang R,Zhou YQ,Yao HP.Patho⁃genesis of RON receptor tyrosine kinase in cancer cells:activation mechanism,functional crosstalk,and signaling addiction[J].J Biomed Res,2013,27(5):345-356.
[8]Chao KL,Tsai IW,Chen C,Herzberg O.Crystal structure of the Sema-PSI extracellular domain of human RON receptor tyrosine kinase[J].PLoS One,2012,7(7):e41912.
[9]Xiao ZQ,Chen YQ,Wang MH.Requirement of both tyrosine residues 1330 and 1337 in the C-terminal tail of the RON receptor tyrosine kinase for epithelial cell scattering and migration[J].Biochem BiophysRes Commun,2000,267(2):669-675.
[10]Lu Y,Yao HP,Wang MH.Multiple variants of the RON receptor tyrosine kinase:biochemical properties,tumorigenic activities,and potential drug targets[J].Cancer Lett,2007,257(2):157-164.
[11]Yao HP,Zhuang CM,Zhou YQ,Zeng JY,Zhang RW,WangMH.OncogenicvariantRON160 expression in breast cancer and its potential as a therapeutic targetby smallmolecule tyrosine kinase inhibitor[J].Curr Cancer Drug Targets,2013,13(6):686-697.
[12]Penengo L,Rubin C,Yarden Y,Gaudino G.c-Cbl Is a critical modulator of the Ron tyrosine kinase receptor[J].Oncogene,2003,22(24):3669-3679.
[13]Catenacci DV,Cervantes G,Yala S,Nelson EA,EI-Hashani E,Kanteti R,et al.RON(MST1R)is a novel prognostic marker and therapeutic target for gastroesophageal adenocarcinoma[J].Cancer Biol Ther,2011,12(1):9-46.
[14] Wang J,Steinbacher S,Augustin M,Schreiner P,Epstein D,Mulvihill MJ,et al.The crystal struc⁃ture of a constitutively active mutant RON kinase suggests an intramolecular autophosphorylation hypothesis[J].Biochemistry,2010,49(37):7972-7974.
[15]Wang D,Shen Q,Chen YQ,Wang MH.Collabor⁃ative activities of macrophage-stimulating protein and transforming growth factor-beta1 in induction of epithelial to mesenchymal transition:roles of the RON receptor tyrosine kinase[J].Oncogene,2004,23(9):1668-1680.
[16]Ma Q,Guin S,Padhye SS,Zhou YQ,Zhang RW,Wang MH.Ribosomal protein S6 kinase(RSK)-2 as a central effector molecule in RON receptor tyro⁃sine kinase mediated epithelial to mesenchymal transition induced by macrophage-stimulating pro⁃tein[J].Mol Cancer,2011,10:66.
[17]Chang HY,Liu HS,Lai MD,Tsai YS,Tzai TS,Cheng HL,et al.Hypoxia promotes nuclear trans⁃location and transcriptional function in the oncogenic tyrosine kinase RON[J].Cancer Res,2014,74(16):4549-4562.
[18]Thomas RM,Toney K,Fenoglio-Preiser C,Revelo-Penafiel MP,Hingorani SR,Tuveson DA,et al. The RON receptor tyrosine kinase mediates onco⁃genic phenotypes in pancreatic cancer cells and is increasingly expressed during pancreatic cancer progression[J].Cancer Res,2007,67(13):6075-6082.
[19]Babicky ML,Mose E,Maruyama K,Harper M, Jaquish D,French R,et al.RON Overexpression accelerates tumorigenesis and induces metastasis in a KRAS mutant mouse model of pancreatic cancer[J].J Am Coll Surgeons,2011,213(3):S131.
[20]Zeng JY,Sharma S,Zhou YQ,Yao HP,Hu X,Zhang R,et al.Synergistic activities of Met/RON inhibitor BMS-777607 and mTOR inhibitor AZD8055 to polyploid cells derived from pancreatic cancer and cancer stem cells[J].Mol Cancer Ther,2014,13(1):37-48.
[21]Kang CM,Babicky ML,Lowy AM.The RON receptortyrosine kinase in pancreatic cancer pathogenesisand itspotentialimplicationsfor future targeted therapies[J].Pancreas,2014,43(2):183-189.
[22]Kretschmann KL,Eyob H,Buys SS,Welm AL. The macrophage stimulating protein/Ron pathway as a potential therapeutic target to impede multiple mechanisms involved in breast cancer progression[J].CurrDrugTargets,2010,11(9):1157-1168.
[23]Xu XM,Wang D,Shen Q,Chen YQ,Wang MH. RNA-Mediated gene silencing of the RON receptor tyrosine kinase alters oncogenic phenotypes of human colorectal carcinoma cells[J].Oncogene,2004,23(52):8464-8474.
[24]Yao HP,Zhou YQ,Ma Q,Guin S,Padhye SS,Zhang RW,et al.The monoclonal antibody Zt/f2 targeting RON receptor tyrosine kinase as poten⁃tial therapeutics against tumor growth-mediated by colon cancer cells[J].Mol Cancer,2011,10:82.
[25]Feng L,Yao HP,Wang W,Zhou YQ,Zhou J,Zhang R,et al.Efficacy of anti-RON antibody Zt/g4-drug maytansinoid conjugation(anti-RON ADC)as a novel therapeutics for targeted colorectal cancer therapy[J].Clin Cancer Res,2014,20(23):6045-6058.
[26]Cheng HL,Liu HS,Lin YJ,Chen HH,Hsu PY,Chang TY,et al.Co-expression of RON and MET is a prognostic indicator for patients with transitionalcell carcinoma of the bladder[J].Br J Cancer,2005,92(10):1906-1914.
[27]Hsu PY,Liu HS,Cheng HL,Tzai TS,Guo HR,Ho CL,et al.Collaboration of RON and epidermal growth factor receptor in human bladder carcino⁃genesis[J].J Urol,2006,176(5):2262-2267.
[28]Molife LR,Dean EJ,Blanco-Codesido M,Krebs MG,Brunetto AT,Greystoke AP,et al.phaseⅠ,doseescalation study ofthe multitargeted receptortyrosine kinase inhibitor,golvatinib,in patients with advanced solid tumors[J].Clin Cancer Res,2014,20(24):6284-6294.
[29]Zhou DH,Li C,Yang LN.Variant RONΔ160 of the RON receptor tyrosine kinase promotes the growth and invasionin vitroandin vivoin gastric cancer cell lines[J].Cancer Cell Int,2015,15(1):9.
[30]KawadaI,HasinaR, ArifQ, MuellerJ,SmithbergerE, Husain AN,etal.Dramatic antitumor effects of the dual Met/RON small-molecule inhibitor LY2801653 in non-small cell lung cancer[J].Cancer Res,2014,74(3):884-895.
[31]Keller J,Nimnual AS,Shroyer KR,Joy C,Ischenko I,Chandler CS,et al.Ron Tyrosine kinase receptor synergises with EGFR to confer adverse features in head and neck squamous cell carcinoma[J].Br J Cancer,2013,109(2):482-492.
[32]Watanabe H,Yokoyama Y,Kokuryo T,Ebata T,Igami T,Sugawara G,et al.Prognostic value of hepatocyte growth factor receptor expression in pa⁃tients with perihilar cholangiocarcinoma[J].Ann Surg Oncol,2015,22(7):2235-2242.
[33]Wha Koh Y,Park C,Hyun Yoon D,Suh C,Huh J.Met And MST1R as prognostic factors for classi⁃cal Hodgkin′s lymphoma[J].Mod Pathol,2013,26(9):1172-1182.
[34]Koh YW,Hwang HS,Jung SJ,Park C,Yoon DH,Suh C,et al.Receptor tyrosine kinases Met and RON as prognostic factors in diffuse large B-cell lymphoma patients receiving R-CHOP[J].Cancer Sci,2013,104(9):1245-1251.
Role of tyrosine kinase receptor RON in tumor growth and metastasis:research progress
MA Qi1,YU Bi-xia1,CHEN Jun-feng1,CHENG Yue2
(1.Translational Research Laboratory for Urological Disease,2.Uro-nephrological Disease Center,Ningbo First Hospital,Ningbo 315010,China)
Recepteur d′origine Nantais(RON),a tyrosine kinase receptor,is a growth factor receptor belonging to the proto-oncogenemetfamily and has been proved to display abnormal expres⁃sion in many types of tumors.The RON receptor is activated by binding to the ligand macrophage stim⁃ulating protein,overexpression of the receptor,variants of the proto-oncogene and by point mutations of the kinase region.The downstream transduction of RON by mitogen-activated protein kinases and phosphoinositide3-kinase signaling pathways can help regulate the proliferation,apoptosis,migration and invasion of tumor cells.A better understanding of the mechanisms and related signaling pathways of RON activation in tumor progress and development will provide more information for the RON-based target therapy.
tyrosine kinase receptor;RON;cancer;target therapy
CHENG Yue,E-mail:yue.cheng@eyou.com,Tel:(0574)87089049
R963
A
1000-3002-(2016)07-0784-06
10.3867/j.issn.1000-3002.2016.07.012
Foundation item:The project supported by National Natural Science Foundation of China(81272828);Zhejiang Pro⁃vincial Foundation for Medical and Health Sciences(2016KYB263);and Ningbo Natural Science Foundation(2015A610224)
2015-12-18 接受日期:2016-07-04)
(本文编辑:齐春会)
国家自然科学基金(81272828);浙江省医药卫生科技计划项目(2016KYB263);宁波市自然科学基金(2015A610224)
马 琪,博士,副主任医师,主要从事酪氨酸激酶受体作用机制及肿瘤靶向治疗研究,E-mail:qi.ma@eyou.com;程 跃,教授,主任医师,主要从事泌尿系结石与泌尿系肿瘤研究。
程 跃,E-mail:yue.cheng@eyou.com,Tel:(0574)87089049
