苦参碱和氧化苦参碱致小鼠肝毒性比较
2016-02-14郭秋平金若敏
郭秋平,金若敏
(1.广州医药研究总院有限公司药物非临床评价研究中心,广东广州 510240;2.上海中医药大学药物安全评价中心,上海 201203)
苦参碱和氧化苦参碱致小鼠肝毒性比较
郭秋平1,金若敏2
(1.广州医药研究总院有限公司药物非临床评价研究中心,广东广州 510240;2.上海中医药大学药物安全评价中心,上海 201203)
目的比较苦参碱和氧化苦参碱的肝毒性,探索其肝毒性机制。方法ICR小鼠单次ig给予苦参碱200 mg·kg-1或氧化苦参碱200 mg·kg-1,第15天计算小鼠死亡率;采用生化分析仪检测谷丙转氨酶(GPT)、谷草转氨酶(GOT)、碱性磷酸酶(ALP)和乳酸脱氢酶(LDH)含量;HE染色法检查肝组织病理变化;ELISA法检测肝组织匀浆液超氧化物歧化酶(SOD)和谷胱甘肽(GSH)含量;TUNEL染色法检测肝细胞凋亡率。结果苦参碱组小鼠死亡率为80%,氧化苦参碱组小鼠全部存活。与正常对照组相比,苦参碱组死亡小鼠血清酶GPT,GOT和ALP明显升高(P<0.05),氧化苦参碱组小鼠仅血清ALP升高(P<0.05);HE染色结果表明,苦参碱组8只死亡小鼠中4只小鼠肝细胞变性、灶性坏死(P<0.05),氧化苦参碱组10例中1只小鼠肝细胞轻度坏死;ELISA结果表明,苦参碱组死亡小鼠肝组织匀浆液SOD和GSH含量降低(P<0.05,P<0.01),氧化苦参碱组仅GSH含量降低(P<0.05);苦参碱组存活小鼠和氧化苦参碱组小鼠肝细胞凋亡率均升高(P<0.05)。结论苦参碱和氧化苦参碱对小鼠均具有肝毒性,苦参碱的肝毒性大于氧化苦参碱,肝毒性机制与氧化应激和诱导细胞凋亡有关。
苦参碱;氧化苦参碱;肝毒性
苦参的生物碱中含有氧化槐果碱、氧化苦参碱、槐花醇、槐花碱和苦参碱[1],山豆根的生物碱中含有金雀花碱、氧化槐果碱、氧化苦参碱、槐花醇、槐花碱和苦参碱[2]。苦参碱和氧化苦参碱是苦参和山豆根生物碱的主要活性成分,两者具有明确的抗病毒及保护心肌等作用[3-4],也是主要质量标准指标成分[5]。
苦参碱和氧化苦参碱在临床广泛应用于治疗乙型肝炎、抗肿瘤和抗病毒等,大量基础研究和报道显示,它们具有保肝作用。Wan等[6]对苦参碱和甘草酸进行了联合应用,发现苦参碱和甘草酸合用后,明显减小了对乙酰氨基酚引起的肝损伤,具有保护肝细胞的作用。但对于苦参碱和氧化苦参碱的肝毒性,却知之较少。近年来,已有文献报道,它们均具有肝毒性。但两者的毒性大小和毒性机制尚不明确。本研究采用整体小鼠实验,以大剂量并等剂量的苦参碱和氧化苦参碱给药,比较两者的肝毒性,探讨其肝毒性机制,为其临床应用提供实验依据。
1 材料与方法
1.1药物、试剂和主要仪器
苦参碱,纯度99.1%,氧化苦参碱,纯度99.3%(均上海融禾医药科技发展有限公司)。超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽(glutathione,GSH)试剂盒,脱氧核苷酸转移酶荧光素标记(TdT-mediated dUTP nick-end labeling,TUNEL)试剂盒(均南京建成生物科技有限公司)。日立7100生化分析仪(日本Hitachi公司),BX51荧光显微镜和Image图像分析系统(日本Olympus公司)。
1.2实验动物及分组
30只ICR小鼠,18 ~22 g,雌雄各半,购自湖南斯莱克景达实验动物有限公司。实验期间小鼠饲养于SPF级动物饲养室,12 h明/暗,标准饮食饮水。所有实验方案均符合广州医药研究总院IACUC的要求(方案编号:EX-EL2014007-02)。ICR小鼠随机分为3组:正常对照组、苦参碱200 mg·kg-1组和氧化苦参碱200 mg·kg-1组,每组10只,单次ig给药,正常对照组给予超纯水。
1.3急性毒性症状的观察和死亡率的计算
苦参碱和氧化苦参碱给药后4 h,参照《药物单次给药毒性研究技术指导原则》,每天观察小鼠的行为活动、饮食和饮水等,连续观察14 d,计算小鼠死亡率。
1.4血清生化指标检测
死亡小鼠濒死前采血,存活动物第15天采血。乙醚麻醉,眼眶静脉丛取血0.5 mL,1000×g离心10 min,制备血清,按试剂盒步骤检测谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、谷草转氨酶(glutamic-oxalacetic transaminase,GOT)、碱性磷酸酶(alkaline phosphatase,ALP)和乳酸脱氢酶(lactate dehydrogenase,LDH)活性。
1.5HE染色检测肝组织病理变化
死亡小鼠及时解剖,存活小鼠第15天解剖。取肝,于4%甲醛溶液固定,常规石蜡包埋,切片,HE染色,在光镜下观察肝组织病理变化;参照文献[7]将肝细胞病理分级为:①肝细胞形态正常,结构完整,未见肝细胞坏死,为“-”,计0级;②偶见小叶中央散在肝细胞坏死,为“+”,计1级;③见小叶中央肝细胞少数坏死,为“++”,计2级;④坏死细胞广泛存在于小叶中央,为“+++”,计3级;⑤坏死细胞弥散于小叶中央,为“++++”,计4级。
1.6ELISA法检测肝组织匀浆液中SOD和GSH含量
肝组织病理检测同时,用0.9%氯化钠溶液对部分肝加工成匀浆,制备10%肝组织匀浆液,按试剂盒操作步骤检测肝组织匀浆液中SOD(kU·g-1蛋白质)和GSH(mg·g-1蛋白质)的含量。
1.7TUNEL法检测肝细胞凋亡
取肝石蜡切片,脱蜡,PBS冲洗,胃蛋白酶消化,PBS冲洗,浸入样本封闭液,室温封闭10 min,PBS冲洗,加TdT酶反应液,加盖玻片37℃避光湿润反应60 min,PBS冲洗,加1 ~2滴辣根过氧化物酶标记的链霉亲和素工作液,加盖玻片37℃避光湿润反应30 min,PBS冲洗,滴加DAB工作液,室温孵育5 ~30 min,PBS冲洗,普通光学显微镜下观察,拍照。细胞核棕黄色为阳性,每个样本观察5个视野,采用图像分析软件进行阳性着色区域统计,以阳性着色区域面积表示各组凋亡率。
1.8统计学分析
实验结果数据以x±s表达,组间比较采用t检验,死亡率采用卡方检验,病理半定量分析采用Ridit检验,P<0.05为差异具有统计学意义。
2 结果
2.1苦参碱和氧化苦参碱致小鼠急性毒性症状及死亡率
给药后4 h,与正常对照组相比,苦参碱200 mg·kg-1组小鼠表现为活动减弱、闭目、蜷缩、运动失调、惊厥,间或出现强直性痉挛,甚至出现剧烈跳动,给药4 h内8只小鼠死亡,存活小鼠1 d后采食、饮水、自主活动和粪便恢复正常;氧化苦参碱200 mg·kg-1组小鼠症状与苦参碱200 mg·kg-1组相似,但症状较轻,未出现小鼠死亡,给药1 d后,所有小鼠采食、饮水、自主活动和粪便恢复正常。苦参碱200 mg·kg-1组小鼠死亡率为80%,氧化苦参碱200 mg·kg-1组小鼠全部存活。
2.2苦参碱和氧化苦参碱对小鼠血清生化指标的影响
由表1可见,与正常对照组相比,苦参碱组死亡小鼠血清GPT,GOT和ALP含量升高(P<0.05),存活小鼠血清生化指标无明显差异;氧化苦参碱组小鼠血清ALP含量升高(P<0.05)。与氧化苦参碱组相比,苦参碱组死亡小鼠血清GPT升高(P<0.05),其存活小鼠血清生化指标无明显差异。
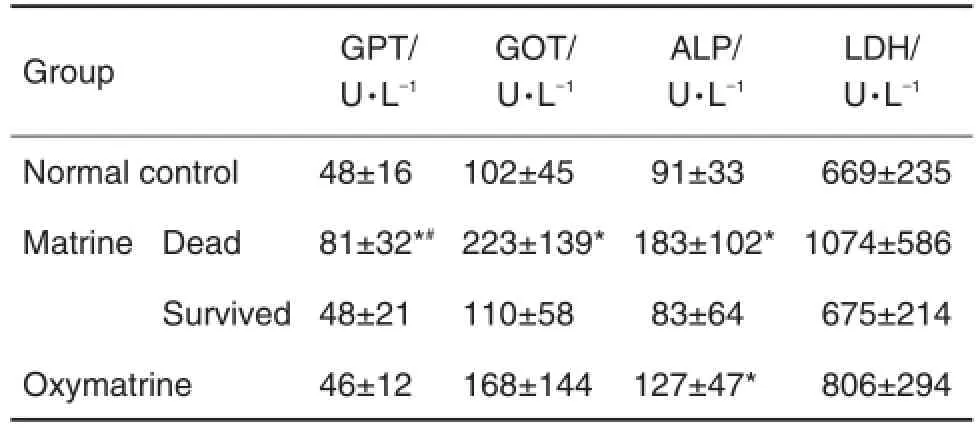
Tab.1 Effect of matrine and oxymatrine on hepato⁃toxic biomarkers in serum of mice
2.3苦参碱和氧化苦参碱对小鼠肝组织病理变化的影响
由图1可见,正常对照组小鼠肝窦清晰,肝细胞形态正常,结构完整。苦参碱组8只死亡小鼠中,有4只肝细胞发生变性、灶性坏死(P<0.05),2只存活小鼠肝无明显异常。氧化苦参碱组10只小鼠中,1只小鼠肝小叶偶见肝细胞坏死,其余小鼠未出现明显肝细胞形态的改变。表2可见,苦参碱组死亡小鼠肝病变程度比氧化苦参碱组严重(P<0.05)。

Fig.1 Effect of matrine and oxymatrine on pathological changes in liver tissues of mice(HE×100).See Tab.1for the mouse treatment.Arrows show degeneration and focal ne⁃crosis in liver cells.
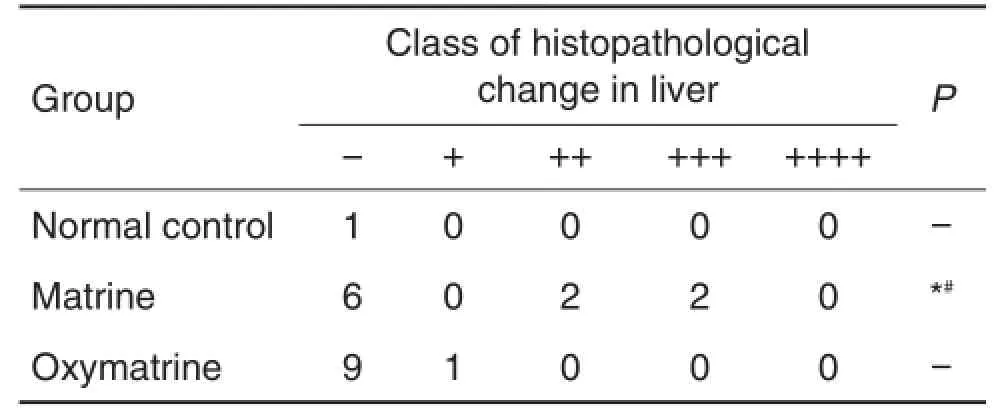
Tab.2 Effect of matrine and oxymatrine on class of histopathological change in liver of mice
2.4苦参碱和氧化苦参碱对小鼠肝组织匀浆液中SOD和GSH含量的影响
由表3可见,与正常对照组相比,苦参碱组死亡小鼠肝组织SOD和GSH含量降低(P<0.05,P< 0.01),氧化苦参碱组仅GSH含量降低(P<0.05)。与氧化苦参碱组相比,苦参碱组死亡小鼠肝组织SOD含量降低无显著性差异。
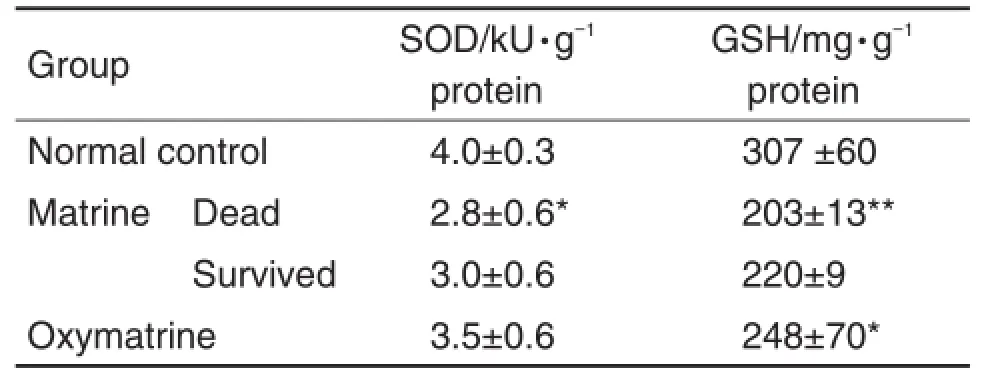
Tab.3 Effect of matrine and oxymatrine on SOD and GSH level in the liver of mice
2.5苦参碱和氧化苦参碱对小鼠肝细胞凋亡的影响
由图2可见,正常对照组肝细胞圆形或类圆形,细胞质形状规则,细胞仅少数见棕黄色。苦参碱组死亡小鼠有很多细胞核被深染为棕黄色的凋亡细胞,可见细胞缩小,间隙增大,苦参碱组存活小鼠和氧化苦参碱组可见少量细胞的细胞核被染为棕黄色。

Fig.2 Effect of matrine and oxymatrine on liver cell apoptosis in mice by TUNEL staining.See Tab.1 for the mouse treatment.Arrows show the apoptotic cells in liver tissue.
由表4可见,阳性着色区域面积越大,凋亡率越高。与正常对照组相比,苦参碱组死亡和存活小鼠肝细胞的凋亡率明显升高(P<0.01,P<0.05),氧化苦参碱组小鼠肝细胞凋亡率升高(P<0.05);与氧化苦参碱组相比,苦参碱组死亡小鼠肝细胞凋亡率明显升高(P<0.01)。
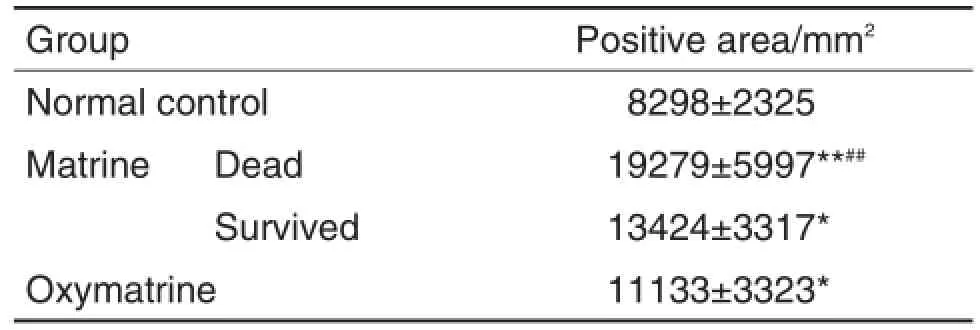
Tab.4 Effect of matrine and oxymatrine on liver cell apoptosis in mice
3 讨论
前期预实验发现,苦参碱毒性明显大于氧化苦参碱,结合前期文献报道,苦参碱具有肝毒性。因此,本研究选择了一个>50%死亡的苦参碱剂量(200 mg·kg-1),然后选择等剂量的氧化苦参碱,对比死亡率,观察它们对肝的毒性作用。宋兵等[8]对两者进行急性毒性研究,结果显示,苦参碱180 mg·kg-1单次ig给药,小鼠死亡率为30%,与氧化苦参碱260 mg·kg-1组相同。另有文献报道,苦参碱200 mg·kg-1ig给药,小鼠死亡率为100%[9]。本研究结果显示,与等剂量氧化苦参碱相比,苦参碱组小鼠死亡率和血清酶含量明显升高,肝细胞形态病变程度明显加重,提示大剂量苦参碱和氧化苦参碱对小鼠均具有肝毒性作用,等剂量时苦参碱对小鼠的肝毒性明显大于氧化苦参碱。张茜等[10]采用体外肝细胞,研究了两者对肝细胞的毒性,结果得出两者均具有一定的肝毒性,苦参碱的肝毒性明显大于氧化苦参碱。本文的研究结果与张茜等报道的体内外研究结果一致。
本研究结果显示,苦参碱使小鼠肝SOD和GSH含量明显降低,氧化苦参碱仅使小鼠肝GSH含量降低,苦参碱组小鼠肝GSH含量降低幅度大于氧化苦参碱组;两者虽都能使肝细胞凋亡率升高,但苦参碱组肝细胞凋亡率的升高幅度大于氧化苦参碱组;以上结果提示,两者的肝毒性机制均与氧化应激和细胞凋亡有关。只是毒性机制基本一致,毒性程度有所不同。
目前,大多数中药因为质量标准的问题难以进行药效及安全性物质基础的研究,近年来,中药整体质量控制标准体系构建及应用已取得突破性进展,提倡基于质量标准的中药药效/安全性研究。在《中国药典》已明确指出,本实验所研究的苦参碱和氧化苦参碱是中药山豆根和苦参的质量指标成分,但它们在这两种中药中的含量有所差异。山豆根的生物碱部位中,氧化苦参碱的峰面积明显大于苦参碱,峰面积比约为4∶1[11];苦参的生物碱部位中,氧化苦参碱的峰面积大于苦参碱,峰面积比约为7∶1[12];山豆根中两者含量之比大于苦参。本研究表明,苦参碱的毒性明显大于氧化苦参碱,在《中国药典》中注明山豆根有小毒,而苦参无毒,这种差异是否是苦参碱与氧化苦参碱含量的差异引起的,还有待于进一步深入研究。药效方面,已有报道对两者的药效进行了比较研究,在等剂量(40 mg·kg-1)时,苦参碱的镇痛作用强于氧化苦参碱,氧化苦参碱的抗炎作用强于苦参碱[13];等浓度下,苦参碱的抑菌作用强于氧化苦参碱[14],表明两者的药效各有所长。本研究主要介绍了两者在体内小鼠模型的肝毒性比较,本课题组将结合两者的含量配比,在质量标准的基础上,进一步研究中药山豆根和苦参的药效/肝毒性,为这2种中药在临床更加合理的使用提供科学依据。
[1]Wang JM,Cui Y.Research progress in chemical components,pharmacological effectiveness and toxicity of Radix et RhizomaSophorae Tonkinensis[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2011,17(4):229-231.
[2]Miao KL,Zhang JZ,Dong Y,Xi YF.Research progress in the chemical compounds and pharma⁃cology ofSophora flavescens[J].Nat Prod Res Dev(天然产物研究与开发),2001,13(2):69-72.
[3]Wang Z,Wu Y,Wang Y,Jin Y,Ma X,Zhang Y,et al.Matrine inhibits the invasive properties of human glioma cells by regulating epithelial to mesenchymal transition[J].Mol Med Rep,2015,11(5):3682-3686.
[4]Chang C,Liu SP,Fang CH,He RS,Wang Z,Zhu YQ,et al.Effects of matrine on the proliferation of HT29 human colon cancer cells and its antitumor mechanism[J].Oncol Lett,2013,6(3):699-704.
[5]Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People′s Republic of China,2015,Vol.1(中华人民共和国药典2015年版1部)[S].Beijing:China Medical Science Press,2015,114.
[6]Wan XY,Luo M,Li XD,He P.Hepatoprotective and anti-hepatocarcinogenic effects of glycyrrhizin and matrine[J].Chem-Biol Interact,2009,181(1):15-19.
[7]Al-Sayed E,Martiskainen O, Seif el-Din SH,Sabra AN,Hammam OA,El-Lakkany NM,et al. Hepatoprotective and antioxidant effect of Bauhinia hookeri extract against Carbon tetrachloride-induced hepatotoxicity in mice and characterization of its bioactive compounds by HPLC-PDA-ESI-MS/MS[J].Biomed Res Int,2014,2014:245171.
[8]Song B,Han CX,Zhang HL.Toxicity of threeSophora flavescensAit.alkaloids to mice[J].Acta Bot Boreali-Occident Sin(西北植物学报),2009,29(4):0818-0823.
[9]Wang XY,Liang L,Chang JL,Yang MH,Li ZG. Toxicity of matrine in Kunming mice[J].J First Mil Med Univ(南方医科大学学报),2010,30(9):2154-2155.
[10]Zhang Q,Li FJ,Jin RM,Song ZP.Study on the hepatotoxicity induced by matrine and oxymatrine[J].Chin Arch Tradit Chin Med(中华中医药学刊),2011,29(6):1222-1225.
[11]Liu JC,Lu SH,Xie W,Lu WJ.Establishment of the HPLC fingerprint ofSophora tonkinensisvar.polyphyllafrom Guangxiand comparison of concordance with HPLC fingerprint ofS.tonkinensis[J].Chin J Exp Tradit Med Formulae(中国实验方剂学杂志),2014,20(23):89-94.
[12]Zhao H,Song M,Zhao H,Hang TJ.HPLC fingerprint of alkaloid components ofSophora Flave⁃scensAit.[J].J China Pharm Univ(中国药科大学学报),2009,40(2):139-143.
[13]Qian LW,Dai WH,Zhou GQ,Wang LL,Wang HS. Study on analgesic and anti-inflammatory effects ofmain alkaloidsinSophoraflavescensandS.tonkinensis[J].Chin Tradit Pat Med(中成药),2012,34(8):1593-1596.
[14]Dai WH,Qian LW,Yang SY,Zhou GQ,Wang LL. Study on antimicrobial activity of alkaloids inSophora flavescensandS.tonkinensis[J].Chin J Exp Tradit Med Formulae(中国实验方剂学杂志),2012,18(3):177-180.
Comparison of liver toxicity of matrine and oxymatrine in mice
GUO Qiu-ping1,JIN Ruo-min2
(1.Drug Non-clinical Evaluation and Research Center,Guangzhou General Pharmaceutical Research Institute,Guangzhou 510240,China;2.Drug Safety Evaluation Center,Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China)
OBJECTIVE To compare the liver toxicity of matrine and oxymatrine,and to explore their toxic mechanism.METHODS Thirty ICR mice were randomly divided into normal control,matrine 200 mg·kg-1and oxymatrine 200 mg·kg-1groups,10 mice per group.After single ig administration of corresponding drugs or water,animal mortality was calculated at the 15thday.The content of glutamic-pyruvic transami⁃nase(GPT),glutamic-oxalacetic transamin(GOT),alkaline phosphatase(ALP)and lactate dehydroge⁃nase(LDH)in serum were detected.Histopathological changes of the liver were examined by HE stain.The content of superoxide dismutase(SOD)and glutathione(GSH)in liver homogenates were detected by ELISA.Hepatocyte apoptosis was detected by Tunel stain.RESULTS The mortality rate of mice in two groups was 80%and 0,respectively.GPT,GOT and ALP contents of dead mice in matrine group were significantly higher than that in normal control group(P<0.05).In oxymatrine group,only the content of ALP was increased(P<0.05).Four of the eight dead mice in matrine group exhibited liver cell necrosis(P<0.05),while only 1/10 mice in oxymatrine group had a mild liver cell necrosis(P>0.05). The content of SOD and GSH of dead mice in matrine group was lower than that in control group(P< 0.05,P<0.01).The content of GSH in oxymatrine group was also decreased(P<0.05).The apoptosis rate of liver cells in dead mice in matrine group was increased(P<0.05).CONCLUSION A large dose of matrine and oxymatrine can produce liver toxicity.At an equal dosage,the liver toxicity of matrine is significantly higher than that of oxymatrine.The toxic mechanism is related to oxidative stress and apoptosis.
matrine;oxymatrine;hepatotoxicity
JIN Ruo-min,E-mail:rmj801@126.com,Tel:(021)51322401
R285.1
A
1000-3002-(2016)07-0736-05
10.3867/j.issn.1000-3002.2016.07.005
Foundation item:The project supported by National Key Basic Research and Development Program(2009CB522807);Major Bioscience and Technology Project of Guangzhou City(201300000053);and Science and Technology Project of Haizhu District in Guangzhou City(2012-CG-01)
2016-03-22接受日期:2016-07-15)
(本文编辑:贺云霞)
国家重点基础研究发展计划(2009CB522807),广州市生物产业重大专项(201300000053);广州市海珠区科技计划项目(2012-CG-01)
郭秋平,女,博士,高级工程师,主要从事药理毒理学研究,E-mail:vipvivenguoguo@126.com,Tel:(020)66284078。
金若敏,E-mail:rmj801@126.com,Tel:(021)51322401
