桔梗皂苷D对肿瘤坏死因子相关凋亡诱导配体抗肺癌细胞活性的影响
2016-02-10章艳斐
章艳斐
桔梗皂苷D对肿瘤坏死因子相关凋亡诱导配体抗肺癌细胞活性的影响
章艳斐
目的探讨中药活性成分桔梗皂苷D对肿瘤坏死因子相关凋亡诱导配体(TRAIL)抗肺癌细胞活性的影响及其机制。方法将人肺癌细胞系A549分为对照组、桔梗皂苷D组、TRAIL组及桔梗皂苷D联合TRAIL组,MTT法检测A549细胞活力,Annexin V/PI染色检测A549细胞凋亡,免疫共沉淀法检测A549细胞RIP1-FADD-caspase-8复合物的形成,Western blot法检测A549细胞caspase-8的活化。结果对照组、桔梗皂苷D组、TRAIL组、桔梗皂苷D+TRAIL组对A549细胞活力的抑制率分别为0、(7.6±0.7)%、(13.4±1.0)%、(60.3±4.2)%,桔梗皂苷D组、TRAIL组、桔梗皂苷D+TRAIL组的细胞活力抑制率与对照组比较差异均有统计学意义(P<0.05)。对照组、桔梗皂苷D组、TRAIL组、桔梗皂苷D+TRAIL组对A549细胞凋亡的诱导率分别为(1.6±0.2)%、(4.5±0.3)%、(7.2±0.5)%、(40.2±2.8)%,TRAIL组、桔梗皂苷D+TRAIL组的细胞凋亡率较对照组有明显提高(P<0.05)。桔梗皂苷D+TRAIL组A549细胞内的RIP1-FADD-caspase-8复合物水平及caspase-8的活化程度显著提高。RIP1 siRNA及z-IETD-fmk能显著抑制桔梗皂苷D对TRAIL的协同作用。对照组、桔梗皂苷D+TRAIL组、桔梗皂苷D+TRAIL+RIP1 siRNA组、桔梗皂苷D+TRAIL+z-IETD-fmk组对A549细胞活力的抑制率分别为0、(61.2±5.0)%、(24.5±1.9)%、(17.5±1.7)%,与桔梗皂苷D+ TRAIL组比较,桔梗皂苷D+TRAIL+RIP1 siRNA组、桔梗皂苷D+TRAIL+z-IETD-fmk组的细胞活力抑制率明显降低(P<0.05)。对照组、桔梗皂苷D+TRAIL组、桔梗皂苷D+TRAIL+RIP1 siRNA组、桔梗皂苷D+TRAIL+z-IETD-fmk组对A549细胞的凋亡诱导率分别为(1.8±0.2)%、(39.5±2.6)%、(12.3±1.1)%、(9.4±0.8)%,与桔梗皂苷D+TRAIL组比较,桔梗皂苷D+TRAIL+RIP1 siRNA组、桔梗皂苷D+TRAIL+z-IETD-fmk组的细胞凋亡率明显降低(P<0.05)。结论桔梗皂苷D可能通过促进死亡受体复合物的形成,增强TRAIL对肺癌细胞的凋亡诱导效应。
人肺癌细胞系A549;桔梗皂苷D;TRAIL;caspase-8;凋亡
肺癌是危害人类健康的世界性难题,死亡率居所有恶性肿瘤的首位,我国肺癌的5年存活率不足15%[1]。肿瘤坏死因子相关的凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)是TNF家族的成员,能与死亡受体4(DR4)或死亡受体5 (DR5)结合,从而激活半胱天冬酶-8(caspase-8)并诱导肿瘤细胞发生凋亡[2]。研究发现,很多肿瘤细胞对TRAIL的抗肿瘤作用不敏感,并能抵抗TRAIL依赖的凋亡效应[3-4]。因此研究如何提高肿瘤细胞对TRAIL的敏感性是目前研究工作的重点。本文探讨桔梗皂苷D是否能提高肺癌细胞对TRAIL治疗的敏感性并研究其机制。
1 材料与方法
1.1 材 料 噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT),桔梗皂苷D(osthole),z-IETD-fmk,Annexin V/PI凋亡检测试剂盒购于美国Sigma-Aldrich。肿瘤坏死因子凋亡诱导配体(TRAIL)购于美国R&D Systems。细胞蛋白提取液、RIP1(受体相互作用蛋白激酶1)、FADD(Fas相关死亡域蛋白)、caspase-8、cIAP2(细胞凋亡抑制蛋白2)和β-肌动蛋白(β-actin)抗人抗体购于美国Cell Signa-ling。蛋白G免疫共沉淀琼脂糖珠购于美国Santa Cruz。RIP1 siRNA购于上海吉玛生物,序列为:正向:5’-GGGCGAUAUUUGCAAAUAAUU-3’,反向:5’-UUAUUUGCAAAUAUCGCCCUU-3’。Lipofectamine 2000购于美国Invitrogen。ECL(增强型化学发光底物)试剂盒购于美国Pierce。
1.2 细胞培养 人肺癌细胞系A549购于美国ATCC(美国模式菌种收集中心)。细胞系培养在含10%胎牛血清的DMEM培养基中,在37°C恒温培养箱中培养,通入5%CO2。
1.3 细胞活力检测 将A549细胞按5×103/孔接种在96孔板上,对照组为A549细胞不加药物培养48h,桔梗皂苷D组为在A549细胞培养体系中加入5μmol/L的桔梗皂苷 D培养 48h,TRAIL组为在A549细胞培养体系中加入5pg/L的TRAIL培养48h,桔梗皂苷D联合TRAIL组为在A549细胞培养体系中加入5μmol/L的桔梗皂苷 D和 5pg/L的TRAIL培养48h。培养完毕后加20μL的5g/L MTT再培养4h。弃上清,往孔中加入150μL二甲亚砜,570nm波长下用酶标仪检测OD值,细胞活力抑制率用以下公式计算:抑制率=(OD对照组-OD实验组)/ OD对照组×100%。
1.4 免疫共沉淀 将A549细胞按5×105/孔接种在6孔板上,对照组为A549细胞不加药物培养48h,桔梗皂苷D组在A549细胞培养体系中加入5μmol/L的桔梗皂苷D培养48h,TRAIL组为在A549细胞培养体系中加入5pg/L的TRAIL培养48h,桔梗皂苷D联合 TRAIL组为在A549细胞培养体系中加入5μmol/L的桔梗皂苷D和5pg/L的TRAIL培养48h。之后将细胞用免疫沉淀缓冲液裂解。缓冲液成分:50 mmol/L Tris–HCl(pH7.4),1%NP-40细胞裂解液,150mmol/L NaCl,1mmol/L EDTA,1%混合蛋白酶抑制剂(Sigma-Aldrich)。裂解后的细胞在12 000g下离心10min,收取上清液加入RIP1抗体孵育过夜,之后加入蛋白G琼脂糖珠孵育2h。免疫沉淀反应后,在1200g速度下离心5min,将琼脂糖珠离心至管底,之后将上清小心吸去,琼脂糖珠用免疫沉淀缓冲液洗涤2次后加入western blot上样缓冲液,沸水浴煮5min。
1.5 Western blot实验 将A549细胞按5×105/孔接种在6孔板上,对照组为A549细胞不加药物培养48h,桔梗皂苷D组为在A549细胞培养体系中加入5μmol/L的桔梗皂苷 D培养 48h,TRAIL组为在A549细胞培养体系中加入5pg/L的TRAIL培养48h,桔梗皂苷D联合TRAIL组为在A549细胞培养体系中加入 5μmol/L的桔梗皂苷D和5pg/L的TRAIL培养48h。之后将细胞用生理盐水洗涤两遍后提取总蛋白质。将蛋白提取液或免疫共沉淀处理样品用12.5%SDS-PAGE进行电泳分离。分离完毕后通过电转方法将蛋白质从分离胶上转到PVDF膜上,用RIP1、FADD、caspase-8、cIAP2、β-actin抗体孵育过夜,之后再用带辣根过氧化物酶的二抗孵育2h,蛋白条带用ECL试剂盒显色发光。目的蛋白的相对表达用目标蛋白灰度值与β-actin灰度值的比值表示,蛋白灰度值分析用Image J软件处理。对于免疫共沉淀结果,Input表示在加入RIP1抗体和琼脂糖珠之前,预先留取的相同含量的样品蛋白作为对照。IP:RIP1表示加入RIP1抗体和琼脂糖珠之后的免疫共沉淀蛋白。
表1 桔梗皂苷D促进TRAIL对肺癌细胞的抗肿瘤活性(±s)

表1 桔梗皂苷D促进TRAIL对肺癌细胞的抗肿瘤活性(±s)
注:与对照组比较,*P<0.05;与TRAIL组比较,△P<0.05
组别对照组桔梗皂苷D组TRAIL组桔梗皂苷D+TRAIL组孔数 桔梗皂苷D浓度(μmol/L)TRAL浓度(pg/L)3 3 3 3 0 5 0 5 0 0 5 5细胞活力抑制率(%)0 7.6±0.7* 13.4±1.0* 60.3±4.2*△凋亡诱导率(%)1.6±0.2 4.5±0.3 7.2±0.5* 40.2±2.8*△
2 结果
2.1 桔梗皂苷D促进TRAIL对肺癌细胞凋亡诱导效应 MTT细胞活力实验及细胞凋亡实验显示,桔梗皂苷D显著提高TRAIL对A549细胞的杀伤活性和凋亡诱导活性,见表1。
2.2 桔梗皂苷D促进TRAIL依赖的DISC的形成免疫共沉淀及Western blot实验显示,桔梗皂苷D能显著促进TRAIL依赖的RIP1-FADD-caspase-8这一死亡受体复合物(DISC)的形成(图1),进而显著激活细胞内的caspase-8(图2)。
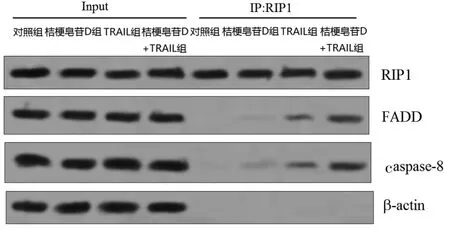
图1 桔梗皂苷D促进TRAIL依赖的RIP1-FADD-caspase-8复合物的形成

图2 桔梗皂苷D促进TRAIL依赖的caspase-8的活化
2.3 桔梗皂苷D通过DISC-caspase-8途径增强肺癌细胞对TRAIL的敏感性 转染RIP1 siRNA或用caspase-8特异性抑制剂z-IETD-fmk[5]预处理后,桔梗皂苷D对TRAIL的协同抗肿瘤作用受到抑制,见表2。
3 讨 论
研究发现,肿瘤坏死因子相关的凋亡诱导配体(TRAIL)能选择性诱导肿瘤细胞发生凋亡,却不影响
1.6 细胞凋亡实验 将A549细胞按5×105/孔接种在6孔板上,对照组为A549细胞不加药物培养48h,桔梗皂苷D组为在A549细胞培养体系中加入5μmol/L的桔梗皂苷 D培养 48h,TRAIL组为在A549细胞培养体系中加入 5pg/L的TRAIL培养48h,桔梗皂苷D联合TRAIL组为在A549细胞培养体系中加入 5μmol/L的桔梗皂苷D和5pg/L的TRAIL培养48h。之后将细胞用生理盐水洗涤2次,按照凋亡试剂盒说明书步骤将PI(碘化丙啶)和Annexin-V加入细胞中孵育20min,采用流式细胞术检测肿瘤细胞的凋亡,凋亡率用annexin-V阳性、PI阴性细胞数占总细胞数的百分比表示。正常组织细胞的功能,因此,TRAIL被认为是一种有很好前景的低毒抗肿瘤药物[6-7]。然而一些肿瘤细胞对TRAIL的抵抗性限制了TRAIL的临床应用,因此研究如何提高肿瘤细胞对TRAIL的敏感性是目前研究工作的重点。桔梗皂苷D是桔梗总皂苷的主要活性成分,具有抗炎、镇痛和免疫调节的作用,最近也有文献报道,桔梗皂苷D具有一定的抗肿瘤活性,如桔梗皂苷D能抑制肝癌细胞的增殖、转移和细胞周期[8-9]。然而,桔梗皂苷D对肺癌的辅助治疗作用却很少报道。本研究发现桔梗皂苷D能显著提高TRAIL对肺癌细胞的凋亡诱导能力。
表2 桔梗皂苷D通过DISC-caspase-8途径增强肺癌细胞对TRAIL的敏感性(±s)
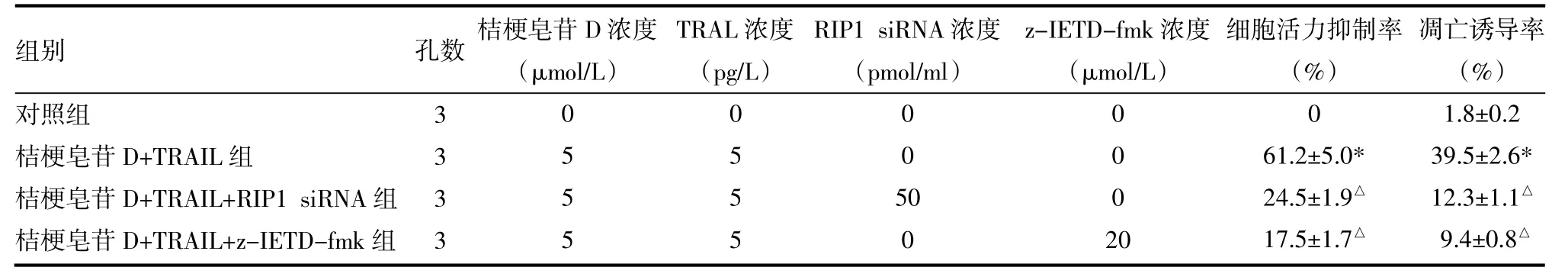
表2 桔梗皂苷D通过DISC-caspase-8途径增强肺癌细胞对TRAIL的敏感性(±s)
注:与对照组比较,*P<0.05;与桔梗皂苷D+TRAIL组比较,△P<0.05
组别对照组桔梗皂苷D+TRAIL组桔梗皂苷D+TRAIL+RIP1 siRNA组桔梗皂苷D+TRAIL+z-IETD-fmk组孔数桔梗皂苷D浓度(μmol/L)TRAL浓度(pg/L)RIP1 siRNA浓度(pmol/ml)z-IETD-fmk浓度(μmol/L)3 3 3 3 0 5 5 5 0 5 5 5 0 0 5 0 0 0 0 0 2 0细胞活力抑制率(%)0 61.2±5.0* 24.5±1.9△17.5±1.7△凋亡诱导率(%)1.8±0.2 39.5±2.6* 12.3±1.1△9.4±0.8△
当TRAIL与其细胞表面的DR4和DR5受体结合后,能募集RIP1,进而形成RIP1-FADD-caspase-8这一死亡受体复合物(death-inducing signaling complex,DISC),最后激活caspase-8依赖的凋亡途径[10]。因此,为了研究桔梗皂苷D提高A549细胞对TRAIL敏感性的机制,笔者采用免疫共沉淀技术研究DISC的形成。实验结果发现,桔梗皂苷D能显著增加FADD蛋白、前体caspase-8蛋白与RIP1蛋白的结合,并且桔梗皂苷D也能促进caspase-8的活化。而当用RIP1 siRNA沉默RIP1的表达,以减少RIP1-FADD-caspase-8复合物的水平,或用z-IETD-fmk阻断caspase-8的活化后,桔梗皂苷D对TRAIL的协同作用丧失,显示桔梗皂苷D通过促进死亡受体复合物的形成,增强TRAIL对肺癌细胞的凋亡诱导效应。
实验结果显示,桔梗皂苷D能显著提高肺癌细胞对TRAIL的敏感性。通过机制研究我们发现桔梗皂苷D能使肺癌细胞在TRAIL的治疗下易于形成死亡受体复合物,进而诱导肿瘤细胞进入凋亡程序。这些研究为如何提高TRAIL的抗肿瘤活性提供了新的思路和理论依据。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J]. CA Cancer J Clin,2013,63(1):11-30.
[2]Laussmann MA,Passante E,Rehm M,et al.Proteasome inhibition can impair caspase-8 activation upon submaximal stimulation of apoptotic tumor necrosis factor-related apoptosis inducing ligand(TRAIL)signaling[J].J Biol Chem,2012,287(18):14402-14411.
[3]Fadeev RS,Solovieva ME,Akatov VS,et al.Inhibition of NF-kB Activation Decreases Resistance in Acute Myeloid Leukemia Cells to TRAIL-induced Apoptosis in Multicellular Aggregates[J].Biofizika,2015,60(6):1146-1150.
[4]Finlay D,Vamos M,Vuori K,et al.Small-molecule IAP antagonists sensitize cancer cells to TRAIL-induced apoptosis:roles of XIAP and cIAPs[J].Mol Cancer Ther,2014,13 (1):5-15.
[5]Roberge S,Roussel J,Fauconnier J,et al.TNF-α-mediated caspase-8 activation induces ROS production and TRPM2 activation in adult ventricular myocytes[J].Cardiovasc Res,2014,103(1):90-99.
[6] Limami Y,Pinon A,Simon A,et al.TRAIL and targeting cancer cells:between promises and obstacles[J].Cell Mol Biol(Noisy-le-grand),2015,61(6):33-38.
[7]Ge Y,Yan D,An G,et al.Novel Molecular Regulators of Tumor Necrosis Factor-Related Apoptosis-Inducing Ligand (TRAIL)-Induced Apoptosis in NSCLC Cells[J].Clin Lab,2015,61(12):1855-1863.
[8]Li T,Xu WS,Lu JJ,et al.Platycodin D induces apoptosis,and inhibits adhesion,migration and invasion in HepG2 hepatocellular carcinoma cells[J].Asian Pac J Cancer Prev,2014,15(4):1745-1749.
[9]Qin H,Du X,Wang R,et al.Platycodin D,a triterpenoid saponin from Platycodon grandiflorum,induces G2/M arrest and apoptosis in human hepatoma HepG2 cells by modulating the PI3K/Akt pathway[J].Tumour Biol,2014,35(2):1267-1274.
[10]Sessler T,Healy S,Szegezdi E,et al.Structural determinants of DISC function:new insights into death receptormediated apoptosis signalling[J].Pharmacol Ther,2013,140(2):186-199.
(收稿:2015-12-23 修回:2016-03-03)
Platycodin-DPromotes TRAIL-induced Apoptosis in Lung Cancer
ZHANG Yanfei.Department of Pathology,Central Hospital of Jinhua City,Jinhua(321000),China
ObjectiveTo investigate the role of platycodin-Din TNF-related apoptosis-inducing ligand(TRAIL)-induced cell death in lung cancer.MethodsThe A549 cells were divided into control group,platycodin-D group, TRAIL group,and platycodin-D+TRAIL group,then the cell death,cell apoptosis,and the formation of RIP1-FADD-caspase-8 complex were detected by MTT assay,AnnexinⅤ/PI staining,and co-immunoprecipitation,respectively.The activation of caspase-8 in A549 cells was evaluated by western blot assay.ResultsThe cell viability inhibitory rate of A549 cells in control group,platycodin-D group,TRAIL group,and platycodin-D+TRAIL group was as follows:0,(7.6±0.7)%,(13.4±1.0)%,and(60.3±4.2)%;significant differences in the cell viability inhibitory ratewas found between control group and platycodin-D group,TRAIL group,and platycodin-D+TRAIL group(all P<0.05).The apoptotic ratio of A549 cells in control group,platycodin-D group,TRAIL group,and platycodin-D+TRAIL group was as follows:(1.6±0.2)%,(4.5±0.3)%,(7.2±0.5)%,and(40.2±2.8)%,with significant differences between control group and TRAIL group and platycodin-D+TRAIL group(all P<0.05).The formation of RIP1-FADD-caspase-8 complex and the activation of caspase-8 in TRAIL-treated A549 cells were signifi-cantly increased in platycodin-D+TRAIL group.Treatment of RIP1 siRNA and z-IETD-fmk significantly impaired the synergistic effect of platycodin-D on TRAIL-induced cell death.The cell viability inhibitory rate of A549 cells in control group,platycodin-D+TRAIL group,platycodin-D+TRAIL+RIP1 siRNA group,and platycodin-D+TRAIL+z-IETD-fmk group was as follows:0,(61.2±5.0)%,(24.5±1.9)%,(17.5±1.7)%;significant differences in the cell viability inhibitory ratewas noted between platycodin-D+TRAIL groupandplatycodin-D+TRAIL+RIP1 siRNA groupand platycodin-D+TRAIL+z-IETD-fmk group(all P<0.05).The apoptotic rate of A549 cells in control group,platycodin-D+TRAIL group,platycodin-D+TRAIL+RIP1 siRNA group,and platycodin-D+TRAIL+z-IETD-fmk group was as follows:(1.8±0.2)%,(39.5±2.6)%,(12.3±1.1)%,and(9.4±0.8)%,with significant differences betweenplatycodin-D+TRAIL groupand platycodin-D+TRAIL+RIP1 siRNA groupand platycodin-D+TRAIL+z-IETD-fmk group(all P<0.05).Conclusionplatycodin-D promotes TRAIL-induced apoptosis by the formation of RIP1-FADD-caspase-8 complex in lung cancer.
human lung cancer cell line A549;platycodin-D;TRAIL;caspase-8;apoptosis
浙江省金华市中心医院病理科(金华 321000)
