大黄酸对糖尿病大鼠肾脏系膜细胞炎症因子的调控
2016-02-10段淑芳胡江缪菁杜文喜
段淑芳胡 江缪 菁杜文喜
大黄酸对糖尿病大鼠肾脏系膜细胞炎症因子的调控
段淑芳1胡 江1缪 菁1杜文喜2
目的观察大黄酸(Rheic acid)对高糖(30mmol/L)诱导的大鼠肾脏系膜细胞(MsC)转化生长因子β1(TGF-β1)及单核细胞趋化因子(MCP-1)表达的影响,探讨其肾脏保护的可能机制。方法大黄酸作用于高糖诱导的MsC,运用MTS检测细胞存活率,ELISA法测定细胞上清TGF-β1、MCP-1含量,RT-PCR法检测MCP-1、TGF-β1 mRNA表达量。结果与模型组(高糖30mmol/L)比较,大黄酸(62.5、125、250μg/mL)干预组MsC细胞存活率明显上升(59%、75%、84%比53%,P<0.05)。高糖(30mmol/L)作用于MsC细胞后,TGF-β1、MCP-1表达被激活,与正常组比较,差异有统计学意义(P<0.05)。大黄酸(62.5、125、250μg/mL)干预后,TGF-β1及MCP-1活性均被抑制,与模型组比较,差异均有统计学意义(P<0.05)。结论大黄酸可以通过调控MCP-1和TGF-β1表达,从而减少高糖诱导的MsC炎症反应。
大鼠;肾脏系膜细胞;大黄酸;TGF-β1;MCP-1
糖尿病肾病(DN)是全球终末期肾病的主要原因,终末期肾病有54%来自糖尿病肾病[1]。糖尿病肾病的发生、发展与炎症因子和炎症反应密切相关[2]。前期研究[3]显示,大黄酸可以明显降低尿白蛋白排泄量,预防血肌酐水平的升高,但是具体机制不明确。本研究通过体外实验,观察大黄酸对高糖诱导的大鼠肾脏系膜细胞(mesangial cell,MsC)的转化生长因子β1(TGF-β1)及单核细胞趋化因子(MCP-1)1表达调控作用,阐述大黄酸延缓糖尿病肾病发展的可能机制,为糖尿病肾病防治和大黄酸的进一步开发奠定理论基础。
1 材料与方法
1.1 药材及制备 大黄酸(批号20121220,纯度≥98%)购自上海源叶生物科技有限公司,经本校中药鉴定室鉴定属正品。大黄酸用二甲基亚砜(DMSO)溶解后,加入无血清DMEM稀释,并经0.22μm过滤消毒备用。DMSO终浓度<0.01%,以0.01%DMSO作为溶剂对照组,实验显示溶剂对细胞无毒性作用。
1.2 主要试剂与仪器 DMEM培养基(GIBCO,USA)(每升含10%胎牛血清,100U/mL的青霉素,100μg/mL的链霉素,2mM的L-谷氨酰胺,100μM的非必需氨基酸,1mM的丙酮酸,PH7.4);胰酶(MERCK,USA);链脲佐菌素(上海源叶生物科技有限公司,批号20121028);MTS(Promega.USA);二甲基亚砜(DMSO)(上海生工生物工程有限公司,批号2067B011);ELISA试剂盒(ADL);Tag酶;RT-PCR试剂盒(TAKARA);TGF-β1引物、MCP-1引物、β-Actin(Invitrogen)。
1.3 方 法
1.3.1 大鼠肾脏系膜细胞(MsC)体外培养 细胞株MsC购自上海复蒙基因生物科技有限公司,低糖(5.5mmol/L)DMEM培养液常规传代保存。
1.3.2 实验分组 将生长良好的MSC调整细胞比例为2×106个/培养皿dish,接种于100mm dishes,待24h后细胞长满,弃上清更换为无血清培养基,随机分组为:正常组(MsC无任何诱导剂);模型组:MsC+高糖(30mmol/L)DMEM培养基;大黄酸低剂量组:MsC+30mmol/L高糖+大黄酸62.5μg/mL;大黄酸中剂量组:MsC+30mmol/L高糖+大黄酸125μg/mL;大黄酸高剂量组:MsC+30mmol/L高糖+大黄酸250μg/ mL。各组更换无血清培养基后先给予相应浓度各中药干预4h,再加入终浓度为30mmol/L的高糖DMEM培养基,继续作用18h后进行各项检测。
1.3.3 指标检测 (1)细胞活力测定:MTS法。上述各组细胞药物干预后继续培育18h,每孔再加入20μL MTS,继续培育4h,于酶标仪上测定其490nm处的光密度OD值,以间接反映细胞存活率。(2)ELISA法检测各组细胞上清液中细胞因子TGF-β1、MCP-1的含量:收集各组药物干预后的上清,6000rpm离心6min,离去悬浮物。各样本孔加入50μL样品的空白微孔,加入10μL的生物素标记液。同时在标准品孔和样品孔中分别加入100μL的酶标记溶液。最后36±2℃孵育反应60min,洗板5次后,每孔加入底物显色液A(3,3′,5,5′-四甲基联苯胺,TMB)、B(0.1mol/L柠檬酸-0.2mol/L碳酸氢二钠缓冲液,pH5.0~5.4)液各50μL(2mol/L H2SO4溶液),36± 2℃下避光孵育反应15min,每孔加入50μL终止液,终止反应。于波长450nm的酶标仪上读取各孔的OD值。(3)RT-PCR检测大黄酸对高糖诱导的MsC相关因子TGF-β1、MCP-1的基因表达:cDNA扩增采用固定模式:95°C 4min;30个循环 94℃(30s),56℃(30s)和72℃(30s),72℃ 7min;最后一步冷却。
1.3.4 统计学方法 应用SPSS13.0统计软件,计量资料以(±s) 表示,组间比较采用单因素方差分析。
2 结果
2.1 MTS测定细胞存活率 经高糖作用后,MsC存活率53%,而加用高、中、低浓度的大黄酸干预组,细胞存活率明显上升,分别为84%、75%、59%,大黄酸可减少高糖所致MsC细胞死亡,且存在剂量依赖关系,以大剂量大黄酸(250μg/mL)效果最佳,见表1。
表1 大黄酸对高糖诱导大鼠肾脏系膜细胞MsC存活率的影响(±s)
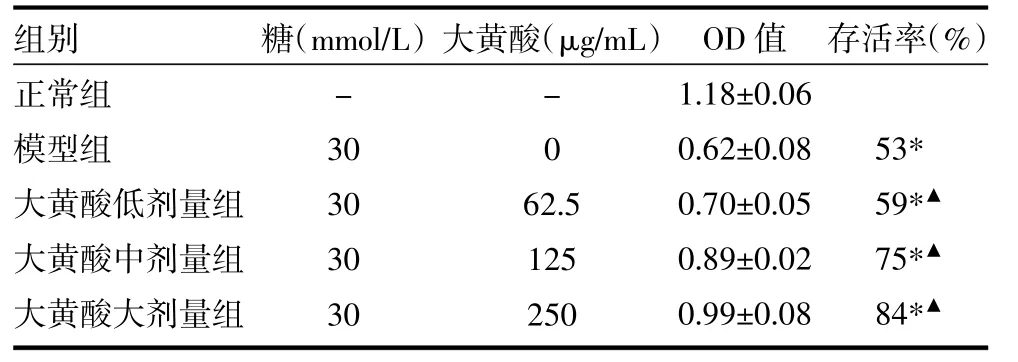
表1 大黄酸对高糖诱导大鼠肾脏系膜细胞MsC存活率的影响(±s)
注:与正常组比较,*P<0.05;与模型组比较,▲P<0.05;MsC:大鼠肾脏系膜细胞;细胞存活率=各组OD值/正常组OD值
?
2.2 大黄酸对高糖诱导MsC细胞的相关炎症因子TGF-β1和MCP-1表达的调控 与正常组比较,模型组经高糖(30mmol/L)作用于MsC后,细胞因子TGF-β1和MCP-1表达量增加,差异具有统计学意义(P<0.05)。不同浓度大黄酸(62.5、125、250μg/mL)干预后,TGF-β1和MCP-1活性均被抑制,与模型组比较,差异均有统计学意义(P<0.05),同时存在剂量依赖关系,可见大黄酸可以显著抑制被高糖激活的细胞因子TGF-β1和MCP-1表达量,以250μg/mL浓度效果最佳,见图1(封二)。
2.3 大黄酸调控高糖所致MsC细胞相关基因TGF-β1和MCP-1的表达 与正常组比较,模型组经高糖(30mmol/L)作用于MsC细胞后,TGF-β1和MCP-1表达均被激活,差异有统计学意义(P<0.05)。予大黄酸(62.5、125、250μg/mL)干预后,TGF-β1、MCP-1活性均被抑制,与模型组比较差异均有统计学意义(P<0.05),可见大黄酸可以显著抑制被高糖激活的TGF-β1和MCP-1的基因表达,见图2(封二)。
3 讨论
糖尿病肾病(DN)的发生、发展与炎症因子和炎症反应密切相关,炎症级联反应引起胰岛素抵抗和血流动力学改变,两者共同参与了体内信号转导通路的激活,导致肾小球系膜细胞表型和功能发生改变,糖尿病肾病的发生和持续性进展[2]。因此抑制炎症反应,阻断炎症相关信号通路,保护肾小球系膜细胞,对药物干预糖尿病肾病具有重要意义。
在糖尿病肾病的发展过程中,众多炎症因子相互作用产生一系列级联反应。其中转化生长因子-β1 (TGF-β1)是已知的DN中致硬化作用最强的细胞因子,可能通过蛋白激酶(MAPK)通路的级联反应导致系膜增生等反应[4-5],胰岛素增敏剂吡格列酮可以通过活化PPARγ通道,下调TGF-β1延缓肾损伤[6-7]。单核细胞趋化蛋白1(MCP-1)与尿蛋白排泄率、肾小球和肾间质损伤呈正相关,它的增高程度与DN发展一致[8],通过抑制MCP-1的表达来抑制RAS系统活性,可以延缓糖尿病肾病的发展[9]。
糖尿病肾病属中医“湿浊”范畴,大黄具有清热燥湿作用。大黄酸(Rhein)为大黄的重要成分之一,属单蒽核类1,8-二羟基蒽醌衍生物,前期研究证实大黄酸可以明显降低尿白蛋白排泄量,预防血肌酐水平的升高[3]。但是具体机制不明确,限制了大黄的进一步开发和临床循证使用。
本实验结果显示,高糖作用于大鼠肾脏系膜细胞(MsC)后,明显增加了细胞死亡率,降低了正常细胞的存活率,而大黄酸可以有效减少高糖所致细胞死亡率,并且存在剂量依赖关系。同时,高糖作用于大鼠肾脏系膜细胞(MsC)后,炎症因子TGF-β1、MCP-1的表达增多,而大黄酸可以有效减少TGF-β1、MCP-1的表达,同时存在剂量依赖关系,其中以250μg/mL作用最佳。细胞炎症因子TGF-β1、MCP-1 的mRNA表达同样说明,大黄酸可以有效减少被高糖激活的炎症因子TGF-β1、MCP-1 mRNA表达,同样存在剂量依赖关系,其中250μg/mL作用最佳。
本研究证实,大黄酸可以通过调控高糖诱导的MsC的细胞因子TGF-β1、MCP-1表达,有效抑制肾脏系膜细胞炎症反应,延缓糖尿病肾病发展。
[1]Basevi V,Di Mario S,Morciano C,et al.Comment on:American Diabetes Association.Standards of medical care in diabetes-2011[J].Diabetes Care,2011,34(8):1887.
[2]Fukui M,Tanaka M,Asano M,et al.Serum allograft inflammatory factor-1 is a novel marker for diabetic nephropathy [J].Diabetes Res Clin Pract,2012,97(1):146-150.
[3]胡江,缪菁,段淑芳,等.大黄酸对2型糖尿病模型大鼠的保护作用[J].中药研究,2014,24(23):2113-2115.
[4]Zuo L1,Du Y,Lu M,et al.Atorvastatin inhibits hyperglycemia-induced expression of osteopontin in the diabetic rat kidney via the p38 MAPK pathway[J].Mol Biol Rep,2014,41(4):2551-2558.
[5]Tossidou I1,Starker G,Kruger J,et al.PKC-alpha modulates TGF-beta signaling and impairs podocyte surviva[J].Cell Physiol Biochem,2009,24(5-6):627-634.
[6]Tian C,Jin X,Ye X,et al.Long term intake of 0.1%ethanol decreases serum adiponectin by suppressing PPARγ expression via p38 MAPK pathway[J].Food Chem Toxicol,2014,9(65):329-334.
[7]Nicholas SB,Liu J,Kim J,et al.Critical role for osteopontin in diabetic nephropathy[J].Kidney International,2010,4 (77):588-600.
[8]TumLin JA,Galphin CM,Rovin BH.Advanced diabetic nephropathy with nephrotic range proteinuria:a pilot study of the long-term efficacy of subcutaneous ACTH gel on proteinuria,progression of CKD,and urinary levels of VEGF and MCP-1[J].Diabetes Res,2013,9(12):489869.
[9]Chen J,Guo Y,Zeng W,et al.ER stress triggers MCP-1 expression through SET7/9-induced histone methylation in the kidneys of db/db mice[J].Am J Physiol Renal Physiol,2014,4(15):916-925.
(收稿:2015-12-08 修回:2016-03-21)
Effects of Rheic Acid on Inflammatory Cytokines in Rats with Diabetic Nephropathy
DUAN Shufang1,HUJiang1,MIAO Jing1,DU Wenxi21 Department of Endocrinology,the First Affiliated Hospital of Zhejiang Chinese Medical University,Hangzhou(310005),China;2 Department of Orthopedics,the Second Affiliated Hospital of Zhejiang Chinese Medical University,Hangzhou(310006),China
ObjectiveTo investigate the effect of Rheic acid on the expression of transforming growth factor-βl (TGF-β1)and monocyte chemoattractant protein-1(MCP-1)on mesangial cells of high glucose(30mmol/L)induced diabetic rats and the mechanism under its renal protection.MethodsMesangial cells from diabetic rats induced by high glucose was treated with Rheic acid,then the cell survival rate was detected by using MTS method,the level of TGF-β1 and MCP-1in cell supernatant was determined with ELISA,and the mRNA transcription of MCP-1 and TGF-β1 was assessed by RT-PCR.ResultsCompared with model group(high glucose group),the cell survival rate in Rheic acid groups(62.5,125,250μg/mL)increased(84%,75%,59%vs 53%,all P<0.05).The expression of TGF-β1 and MCP-1in high glucose-induced mesangial cells was increased compared with healthy mesangial cells(P<0.05),but the increase was significantly inhibited after the treatment of Rheic acid(62.5,125, 250μg/mL,all P<0.05).ConclusionRheic acid can alleviatehigh glucose-inducedinflammatoryresponse of mesangial cells by regulating the expression ofTGF-β1 and MCP-1.
rats;mesangial cells;Rheic acid;TGF-β1;MCP-1
浙江省中医药科技计划项目(No.2012ZB059);国家自然科学基金项目(No.81202709)
1浙江中医药大学附属第二医院内分泌科(杭州 310005);2浙江中医药大学附属第一医院骨科(杭州 310006)
杜文喜,Tel:15858187089;E-mail:duanshufang2009@163.com
