白藜芦醇对抗氧化型低密度脂蛋白诱导的内皮细胞损伤及其机制
2016-02-10过华蕾邵畅龚仪棠陈
过华蕾邵 畅龚仪棠陈 豪
白藜芦醇对抗氧化型低密度脂蛋白诱导的内皮细胞损伤及其机制
过华蕾1邵 畅2龚仪棠1陈 豪1
目的探讨白藜芦醇对氧化型低密度脂蛋白(ox-LDL)诱导的内皮细胞损伤的保护作用及其机制。方法体外培养人脐静脉内皮细胞,并随机分为对照组、ox-LDL组、不同浓度(10μmol/ L、50μmol/L)白藜芦醇保护组,通过检测细胞活力、超氧化物歧化酶(SOD)水平、丙二醛(MDA)含量评价内皮细胞损伤程度。RT-PCR及Western blot法检测单核细胞趋化蛋白1(MCP-1)和细胞间黏附分子1(ICAM-1)RNA和蛋白表达。结果与对照组比较,ox-LDL组细胞活力、SOD水平降低[(0.33±0.01)比(0.45±0.010),(12.8±0.31)U/mL比(15.5±0.150U/mL,P<0.05],MDA含量增加[(2.10± 0.51)nmol/mgprot比(1.05±0.06)nmol/mgprot,P<0.05],MCP-1、ICAM-1 RNA表达明显升高(1.56± 0.06比0.67±0.09,3.62±0.32比1.35±0.21,P<0.05);与ox-LDL组相比,白藜芦醇(10、50μmol/L)保护组细胞活力升高(0.38±0.02、0.39±0.02比0.33±0.01,P<0.05)、SOD水平升高[(14.4±0.61)U/mL、(14.8±0.57)U/mL比(12.8±0.31)U/mL,P<0.05],MDA含量减少[(1.41±0.15)nmol/mgprot、(1.37±0.05)nmol/mgprot比(2.10±0.51)nmol/mgprot,P<0.05],MCP-1、ICAM-1 RNA和蛋白表达明显降低(1.03± 0.05、0.92±0.08比1.56±0.06,1.88±0.25、1.67±0.16比3.62±0.32,P<0.05)。结论白藜芦醇对ox-LDL诱导的血管内皮细胞损伤有保护作用。
动脉粥样硬化;内皮细胞损伤;白藜芦醇;ox-LDL;氧化应激
心血管疾病是世界范围内发病率和致死率均居首位的疾病,严重危害到人类健康。血管内皮损伤及功能障碍是心血管病尤其是动脉粥样硬化发生发展的始动环节。氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)是公认的动脉粥样硬化的独立危险因子,参与动脉粥样硬化发生发展的各个环节[1]。白藜芦醇是一种存在于葡萄、虎杖、藜芦等植物中的活性物质,具有多种生物学功能,包括抗肿瘤、延缓衰老、促脑卒中后脑功能恢复等[2-3]。对于心血管系统,也具有多重保护功能,如调节脂质代谢,抑制血小板凝集,平衡凝血纤溶系统等[4]。但白藜芦醇对ox-LDL诱导的内皮损伤的效应尚未见报道。本研究以ox-LDL为诱导因子,作用于人脐静脉内皮细胞,检测细胞活力、氧化应激水平、单核细胞趋化蛋白 1(monocyte chemoattractant protein 1,MCP-1)及细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1)的表达,从细胞水平探讨白藜芦醇对ox-LDL诱导的内皮细胞损伤有无保护作用及其机制。
1 材料与方法
1.1 材 料 ox-LDL购自奕源生物科技有限公司、M199培养基、青链霉素、0.05%胰酶、0.25%胰酶、胎牛血清、胰蛋白酶均购自美国Hyclone公司;内皮细胞生长因子(ECGS)购自美国BD公司;白藜芦醇、噻唑蓝(MTT)购自美国Sigma公司;超氧化物歧化酶(Superoxide dismutase,SOD)测定试剂盒、细胞丙二醛(Malondialdehyde,MDA)测定试剂盒购自南京建成生物工程研究所。单克隆小鼠β-actin抗体、MCP-1、ICAM-1抗体购自CST公司。抗鼠及抗兔的连接辣根过氧化物酶的IgG(H+L)购自美国Vector公司,超敏发光液(enhanced chemiluminescence,ECL)为普利莱基因技术有限公司产品。逆转录试剂盒、Realtime PCR试剂盒购自日本TaKaRa公司,Trizol购自美国Invitrogen公司。
1.2 细胞培养 在无菌条件下取新生儿脐带(长度>20cm),将剪成钝端的注射针头插入脐静脉内,用PBS冲洗掉管腔内残留的血凝块,再用0.25%胰酶注入静脉腔,充分消化静脉内皮8min后将松开止血钳,使消化液流入预先放有1mL血清的15mL离心管中,1000r/min离心7min后可见离心管底部有白色的细胞团块,弃去上清后用完全培养液悬浮细胞,轻轻吹打混匀,置于37℃、5%CO2的培养箱中。培养24h换液,至细胞融合90%以上时用0.05%胰酶消化传代,第2~5代用于实验。
1.3 实验分组 取第2~5代人脐静脉内皮细胞(HUVECs)铺96孔板,每组6个复孔。实验分为正常对照组、100mg/L ox-LDL处理24h诱导的内皮细胞损伤模型组、ox-LDL加不同剂量白藜芦醇(10、50μmol/L)处理24h的保护组。
1.4 MTT法测定细胞活力 待细胞贴壁后按实验分组加入相应药物处理24h。每孔避光加入5g/L的MTT 20μL后置于37℃、5%的CO2培养箱中孵育4h。弃去上清液,每孔加入150μL DMSO,振荡器振荡10min,使结晶充分溶解。采用酶标仪测定各孔OD(560nm)值。
1.5 细胞外液SOD水平、细胞中MDA含量测定待细胞贴壁后按实验分组加入相应药物处理24h。将培养液移入1.5mL EP管中,3000r/min离心10min,取上清。按照SOD检测试剂盒(WST-1法)操作说明检测细胞外液SOD活力。将贴壁生长的HUVECs用细胞刮刮下,按照细胞丙二醛(MDA)测定试剂盒操作说明检测细胞中MDA含量。
1.6 实时荧光定量PCR 按Trizol总RNA提取试剂说明,提取内皮细胞总RNA,并测定其浓度和纯度。取500ng总RNA用于cDNA合成,采用TaKaRa逆转录试剂盒,按照说明操作。逆转录引物序列如下:MCP-1(forward):5’-CTGCCCTCCTGTGCCTGCTAC-3’,MCP-1(reverse):5’-ATTCTTGGGTTGTGGAGTGAGTGC-3’;ICAM-1(forward):5’-AACTCT CCAGAACACCTCG-3’,ICAM-1(reverse):5’-AGCA CCAGGTAGACCTTAGC-3’;β-actin(forward):5’-AACCGCGAGAAGATGACCCAGATCATGTTT-3’,βactin(reverse):5’-AGCAGCCGTGGCCATCTCTTGCT CGAAGTC-3’。合成的cDNA用于实时定量PCR反应,采用TaKaRa荧光定量PCR试剂盒,按照说明书进行操作。步骤一预变性:95℃ 30s;步骤二两步法扩增:95℃ 5s,60℃ 20s,40个循环;步骤三溶解曲线:95℃ 0s,65℃ 15s,95℃ 0s。MCP-1和ICAM-1的表达量,通过与β-actin CT值的均数的比值来表示。
1.7 Western blotting检测 将每组蛋白按照总量80μg计算出上样体积,加入蛋白上样缓冲液,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后,转移至PVDF膜。脱脂奶粉封闭1h,然后4℃一抗摇床孵育过夜。TBST洗3次,每次10min,然后与二抗孵育1h。TBST洗3遍后显影。
1.8 统计学方法 各项实验都至少重复3次。应用SPSS16.0统计软件处理统计资料。计量资料以均数±标准差(±s)表示,采用单因素方差分析(one-way ANOVA)和LSD-test检验进行均数的两两比较。P<0.05为差异有统计学意义。
2 结 果
2.1 各组细胞活力、SOD水平、MDA含量比较 与对照组相比,ox-LDL组HUVECs细胞活力明显降低,SOD水平明显下降,MDA含量明显增多(P<0.05);加入白藜芦醇(10、50μmol/L)的保护组,细胞活力明显升高,SOD水平明显升高,MDA含量明显减少,与ox-LDL组比较差异有统计学意义(P<0.05)。见表1。
表1 各组细胞活力、SOD水平、MDA含量比较(±s)
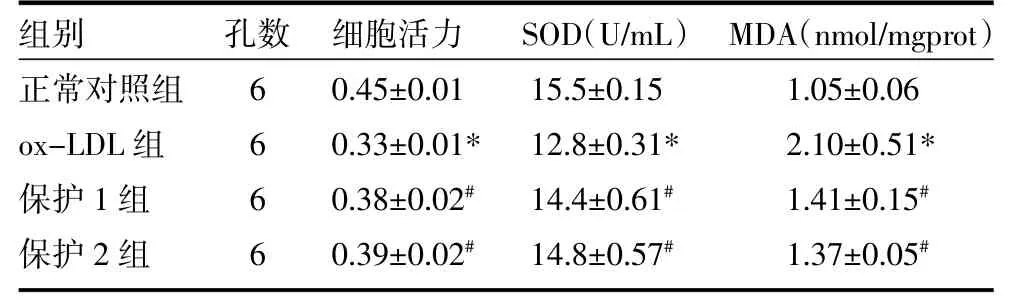
表1 各组细胞活力、SOD水平、MDA含量比较(±s)
注:与正常对照组比较,*P<0.05;与ox-LDL组比较,#P<0.05;保护1组:ox-LDL+10μmol/L RESV;保护2组:ox-LDL+50μmol/L RESV
组别正常对照组ox-LDL组保护1组保护2组孔数6 6 6 6细胞活力0.45±0.01 0.33±0.01* 0.38±0.02#0.39±0.02#SOD(U/mL)15.5±0.15 12.8±0.31* 14.4±0.61#14.8±0.57#MDA(nmol/mgprot)1.05±0.06 2.10±0.51* 1.41±0.15#1.37±0.05#
2.2 各组MCP-1和ICAM-1 RNA水平比较 与对照组相比,ox-LDL组MCP-1、ICAM-1 RNA表达水平明显升高(P<0.05),加入白藜芦醇(10、50μmol/L)的保护组,MCP-1、ICAM-1 RNA表达水平明显降低,与ox-LDL组比较,差异有统计学意义(P<0.05)。见表2。
表2 各组MCP-1和ICAM-1 RNA水平比较(±s)
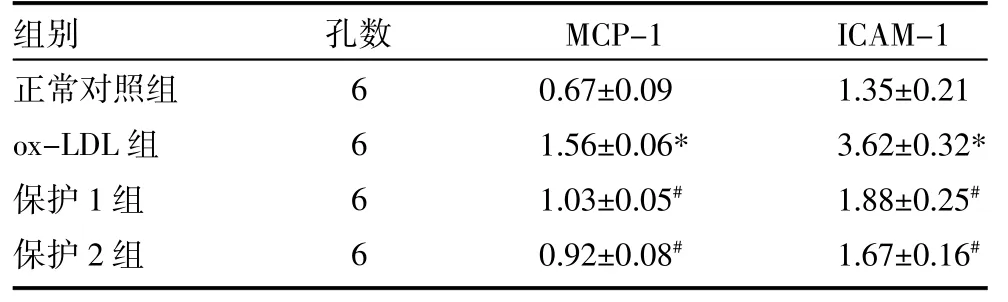
表2 各组MCP-1和ICAM-1 RNA水平比较(±s)
注:与正常对照组比较,*P<0.05;与ox-LDL组比较,#P<0.05;保护1组:ox-LDL+10μmol/L RESV;保护2组:ox-LDL+50μmol/L RESV
?
2.3 各组MCP-1和ICAM-1蛋白表达比较 与对照组比较,ox-LDL组MCP-1、ICAM-1蛋白表达明显升高,而加入白藜芦醇(10、50μmol/L)的保护组,MCP-1、ICAM-1蛋白表达水平明显降低,见图1。
3 讨 论
冠状动脉粥样硬化性心脏病及心肌梗死的发病与脂质代谢异常密切相关,特别是氧化型低密度脂蛋白(ox-LDL)是公认的动脉粥样硬化的独立危险因子,参与动脉粥样硬化发展的各个环节[5]。血管内皮在调节血管舒缩、凝血及纤溶,对抗氧自由基损伤等方面起到重要的作用。血管内皮损伤是心血管疾病的始动环节,而血管内皮对ox-LDL诱导的氧化损伤非常敏感。
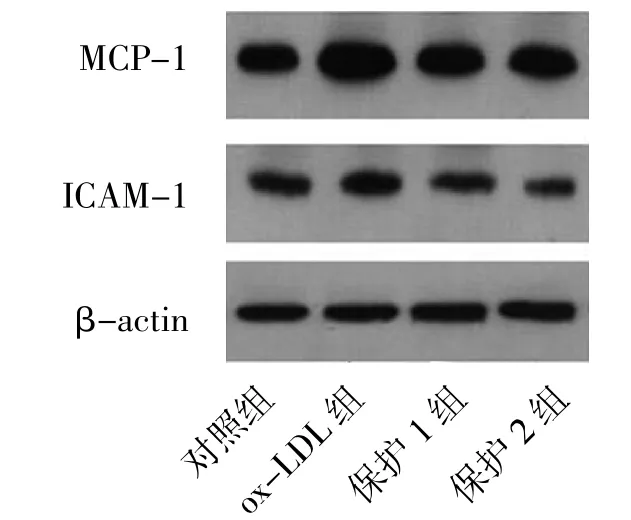
图1 各组MCP-1和ICAM-1蛋白表达的比较
超氧化物歧化酶(SOD)能清除细胞中过多的氧自由基,其活力高低可间接反映细胞清除氧自由基的能力;丙二醛(MDA)是自由基损伤不饱和脂肪酸生成的中间产物,其含量能间接证明细胞内自由基的水平[6]。细胞内自由基产生增多,而清除自由基的相关酶活性下降,是细胞损伤坏死的重要机制。本实验结果表明ox-LDL作用可使细胞抗氧化能力降低,细胞内自由基含量升高。白藜芦醇可以对抗ox-LDL处理产生的效应,提高细胞外SOD水平,降低细胞内MDA含量。
MCP-1和ICAM-1在动脉粥样硬化的早期病灶中已有表达,主要是促单核细胞向内皮黏附、迁移。巨噬细胞吞噬ox-LDL形成泡沫细胞,导致MCP-1、ICAM-1表达升高[7]。ox-LDL促血小板聚集、单核细胞黏附,促内皮细胞凋亡。本研究发现,与对照组相比,ox-LDL可以明显降低细胞活力,使MCP-1、ICAM-1 RNA与蛋白表达显著提高,而白藜芦醇可以增加细胞活力,同时使MCP-1、ICAM-1 RNA与蛋白表达降低。
白藜芦醇主要通过减少血小板聚集,促血管舒张,减少脂质过氧化反应,调节血胆固醇和甘油三酯水平来防治心血管疾病[8-9]。本研究结果显示,白藜芦醇的保护效应可能是因为其良好的抗氧化作用改善了细胞的氧化应激状态,提高细胞的抗氧化能力所致。同时它还降低内皮细胞MCP-1、ICAM-1的表达。
综上所述,白藜芦醇可以适度调控内皮细胞氧化应激水平,抑制ox-LDL诱导的内皮细胞趋化和黏附反应,在早期环节改善内皮细胞功能、活力,抑制ox-LDL对内皮的损伤,阻断中、晚期斑块的病理过程。
[1]Mitra S,Goyal T,Mehta JL.Oxidized LDL,LOX-1 and atherosclerosis[J].Cardiovasc Drugs Ther,2011,25(5):419-429.
[2]Wang H,Yang YJ,Qian HY,et al.Resveratrol in cardiovascular disease:what is known from current research[J].Heart Fail Rev,2012,17(3):437-448.
[3]宋康杰.白藜芦醇阻断转化生长因子-β/Smad通路抑制人结肠癌细胞系SW480侵袭转移实验研究[J].浙江中西医结合杂志,2016,26(1):27-30.
[4]Schmitt CA,Heiss EH,Dirsch VM.Effect of resveratrol on endothelial cell function:Molecular mechanisms[J].Biofactors,2010,36(5):342-349.
[5]徐瑞霞,李建军.氧化型低密度脂蛋白胆固醇与动脉粥样硬化[J].中国循环杂志,2012,27(3):223.
[6]王秋林,王浩毅,王淑人.氧化应激状态的评价[J].中国病理生理杂志,2005,21(10):2069-2074.
[7]Formoso G,Di Tomo P,Andreozzi F,et al.The TRIB3 R84 variant is associated with increased carotid intima media thickness in vivo and with enhanced MAPK signaling in human endothelial cells[J].Cardiovasc Res,2011,89(1):184-192.
[8]Baur JA,DA Sinclair.Therapeutic potential of resveratrol:the in vivo evidence[J].Nat Rev Drug Discov,2006,5(6):493-506.
[9]Li H,Forstermann U.Resveratrol:a multifunctional compound improving endothelial function.Editorial to:"Resveratrol supplementation gender independently improves endothelial reactivity and suppresses superoxide production in healthy rats"by S.Soylemez et al[J].Cardiovasc Drugs Ther,2009,23(6):425-429.
(收稿:2016-01-26 修回:2016-03-14)
Protective Effect of Resveratrol on Endothelial Injury Induced by OxidizedLow Density Lipoprotein and the Involved Mechanism
GUO Hualei1,SHAO Chang2,GONG Yitang1,CHEN Hao11 Department of Pathology, Hangzhou Maternity Hospital,Hangzhou(310008),China;2 Department of Pathology,Hangzhou First People's Hospital,Hangzhou(310006),China
ObjectiveTo investigate the effect of resveratrol on endothelial injury induced by oxidized low density lipoprotein(ox-LDL)and its mechanism.MethodsIn vitro cultured human umbilical vein endothelial cells were randomly divided into control group,ox-LDL group,protective groups added different concentrations(10μmol/L and 50μmol/L)of resveratrol.Cell viability,superoxide dismutase(SOD)level and malondialdehyde(MDA)content were detected to evaluate the damage of endothelial cells.Expression of monocyte chemoattractant protein l(MCP-1)and intercellular adhesion molecule 1(ICAM-1)in RNA and protein level were detected by RT-PCR and Western blot,respectively.ResultsCompared to control group,cell viability(0.33±0.01 vs 0.45±0.01)and SOD level(12.8±0.31U/mL vs 15.5±0.150U/mL)decreased while MDA content increased(2.10±0.51nmol/mgprot vs 1.05± 0.06nmol/mgprot),expression of MCP-1(1.56±0.06 vs 0.67±0.09)and ICAM-1(3.62±0.32 vs 1.35±0.21)in RNA levelincreased significantly(all P<0.05)in ox-LDL group.Compared to ox-LDL group,protective groups had increased cell viability(0.38±0.02,0.39±0.02 vs 0.33±0.01)and SOD level(14.4±0.61U/mL,14.8±0.57U/mL vs 12.8± 0.31U/mL)and decreased MDA content(1.41±0.15nmol/mgprot,1.37±0.05nmol/mgprot vs 2.10±0.51nmol/mgprot), decreased expression of MCP-1(1.03±0.05,0.92±0.08 vs 1.56±0.06)and ICAM-1(1.88±0.25,1.67±0.16 vs 3.62± 0.32)in RNA and protein level(all P<0.05).ConclusionResveratrol can protect vascular endothelial cells against ox-LDL-induced injury.
resveratrol;ox-LDL;oxidative stress;atherosclerosis
1杭州市妇产科医院病理科(杭州 310008);2杭州市第一人民医院病理科(杭州 310006)
过华蕾,E-mail:jane_123@163.com
