辣木叶抗氧化活性研究及活性成分含量测定
2016-02-09高秋玉邓小宽刘丽琼
高秋玉,邓小宽,刘丽琼,何 淼,高 平
(四川大学生命科学学院药用天然产物实验室,四川成都 610015)
辣木叶抗氧化活性研究及活性成分含量测定
高秋玉,邓小宽,刘丽琼,何 淼,高 平*
(四川大学生命科学学院药用天然产物实验室,四川成都 610015)
目的:确定辣木叶抗氧化有效部位,建立HPLC测定辣木叶中新绿原酸和异槲皮苷含量的方法。方法:采用体外方法评价辣木叶提取物四个部位石油醚萃取物、乙酸乙酯萃取物、总奎宁酸和总黄酮的抗氧化活性;采用HPLC,选择Sepax Sapphire C18(250 mm×4.6 mm,5 μm)色谱柱,流动相为乙腈-0.05%磷酸溶液梯度洗脱,流速为1 mL/min,检测波长330 nm,柱温30 ℃。结果:以异槲皮苷为代表的黄酮类成分和新绿原酸等奎宁酸类成分清除能力最强,二者浓度大于800 μg/mL时,对DPPH清除率达80%以上,且对DPPH和羟自由基清除率均高于石油醚和乙酸乙酯萃取物;新绿原酸和异槲皮苷在检测范围内线性关系良好,平均加样回收率分别为98.84%、98.70%,RSD均小于3.0%。结论:辣木叶抗氧化有效部位为总奎宁酸和总黄酮;该方法简便可靠,可作为辣木叶中新绿原酸和异槲皮苷的定量分析方法。
辣木叶,抗氧化活性,有效部位,HPLC,含量测定
辣木(MoringaoleiferaLam)又名鼓槌树、马萝卜、不死树等,属十字花目辣木亚目辣木科辣木属植物,为多年生热带落叶乔木[1]。研究表明辣木叶富含矿物质、氨基酸和维生素等营养物质成分[2-3]。另外,辣木叶具有的消炎抑菌[4-5]、降血糖[6]、抗氧化[7]、治疗溃疡[8]和疟疾[9]等医疗保健功能也引起了广泛关注。
目前,国内外关于辣木叶抗氧化活性研究局限于粗提物上[10-11],抗氧化成分不明确,基本没有质量控制方面的报道[12]。为进一步确定辣木叶抗氧化有效部位和制定其质量标准,本研究利用萃取和柱层析方法对辣木叶提取物进行分离纯化,得到石油醚萃取物、乙酸乙酯萃取物、总奎宁酸和总黄酮四个部位,采用体外方法[13-14]评价该四个部位的抗氧化活性,筛选得到有效部位,并建立HPLC测定活性成分新绿原酸、异槲皮苷含量的方法,为辣木叶的质量评价和合理开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
七水硫酸亚铁、水杨酸、维生素C(VC)、30%过氧化氢、乙醇、磷酸、石油醚、乙酸乙酯 均为分析纯;乙腈 色谱纯,成都市科龙试剂厂;1,1-二苯基-2-三硝基苯肼(DPPH) 成都艾科达化学试剂有限公司;实验用5批辣木叶样品(S1.云南丽江,S2.云南昆明,S3.云南西双版纳,S4.广西河池,S5.广东韶关),经四川大学生命科学学院药用天然产物实验室鉴定为辣木科植物辣木MoringaoleiferaLam的干燥叶;新绿原酸、异槲皮苷对照品 成都植标化纯生物技术有限公司,纯度大于98%。
LC3000型高效液相色谱仪 北京创新通恒科技有限公司,UV3000紫外检测器,P3000高压输液泵;BS124S电子天平 北京赛多利斯仪器系统有限公司;KH5200E型超声波清洗器 昆山禾创超声仪器有限公司;R201D真空旋转蒸发仪 巩义英峪高科仪器厂;SHZ循环水式真空泵 巩义予华有限责任公司;UV8100型可见分光光度计 北京莱伯泰科仪器有限公司;MCI层析材料 成都科谱生物有限公司,50~70 μm。
1.2 实验方法
1.2.1 辣木叶提取物的制备 辣木叶药材粉碎过40目筛,取500 g,加入50%乙醇连续浸提3次。合并3次浸提液浓缩至无醇味得到辣木叶提取物浸膏。得到的浸膏加水稀释后依次用石油醚、乙酸乙酯萃取,分别得到石油醚萃取物(Petroleum ether Extraction of Leaves,记为PEL)、乙酸乙酯萃取物(Ethyl acetate Extraction of Leaves,记为EEL)。取适量萃取后的辣木叶水相经MCI柱层析,先用水洗脱除去糖、蛋白等,再依次用3个柱体积30%甲醇、3个柱体积50%甲醇洗脱[15-16],结合HPLC检测分段收集得到高纯度的总奎宁酸和总黄酮类成分,分别记为LM1和LM2,将其减压浓缩蒸干备用。
1.2.2 辣木叶提取物对DPPH自由基清除能力的测定 将待测样品和维生素C用50%乙醇配成浓度为6.25、12.5、25、50、100、200、400、800、1000 μg/mL的样品溶液,在5 mL离心管中加入2 mL0.1 mmol/L(50%乙醇配制)DPPH标准溶液和2 mL待测样品溶液,混合均匀,室温下避光静置30 min后,以50%乙醇为空白对照,在517 nm波长下测定吸光值[17-18]。DPPH自由基清除率的计算公式如下:
清除率(%)=[1-(Aj-Ai)/A0]×100
式中:Aj,2 mL DPPH标准溶液和2 mL样品溶液的吸光值;Ai,2 mL 50%乙醇和2 mL 样品溶液的吸光值;A0,2 mL DPPH标准溶液和2 mL 50%乙醇的吸光值。
1.2.3 辣木叶提取物对羟自由基清除能力的测定 利用Fenton反应测定辣木叶提取物清除羟自由基的能力[19-20]。取1 mL 2.5 mmol/L FeSO4于5 mL离心管中,加入1 mL 5% H2O2,混匀后立即加入待测样品溶液1 mL,混匀静置5 min待反应;加入1 mL 2.5 mmol/L水杨酸,于37 ℃恒温水浴锅中反应1 h后,于510 nm波长处测定吸光值,记为Am。将样品溶液用等量50%乙醇代替,在相同条件下测定的吸光值,记为A0;用等量蒸馏水代替H2O2,在相同条件下测得的吸光值记为An。羟自由基清除率的计算公式如下:
清除率(%)=[1-(Am-An)/A0]×100
1.2.4 HPLC同时测定新绿原酸和异槲皮苷含量
1.2.4.1 色谱条件 色谱柱:Sepax Sapphire C18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.05%磷酸水溶液(B),梯度洗脱(0~15 min,10% A;15~50 min,30% A);流速:1.0 mL/min;检测波长:330 nm;进样量:5 μL;柱温30 ℃。
1.2.4.2 对照品溶液的制备 分别精密称取新绿原酸、异槲皮苷对照品9.0 mg、5.2 mg,置于25 mL容量瓶中,加入50%乙醇超声溶解并定容至刻度,配制成质量浓度为新绿原酸0.360 mg/mL、异槲皮苷0.208 mg/mL的混合对照品溶液。
1.2.4.3 供试品溶液的制备 辣木叶药材粉碎过40目筛,取约1.0 g,精密称定,置于20 mL容量瓶中,加入50%乙醇15 mL,超声处理30 min,放冷,加50%乙醇稀释至刻度,摇匀,用0.45 μm有机系微孔滤膜过滤,取续滤液,待用。
1.2.4.4 线性关系考察 精密吸取对照品溶液适量,用50%乙醇分别配制成含新绿原酸0.018、0.036、0.09、0.18、0.27、0.36 mg/mL和异槲皮苷0.0104、0.0208、0.052、0.104、0.156、0.208 mg/mL的对照品溶液,按1.2.4.1项条件下进行测定。
1.2.4.5 精密度实验 取配制好的浓度分别为新绿原酸0.09 mg/mL、异槲皮苷0.052 mg/mL的混合对照品溶液,按1.2.4.1项条件,连续进样6次,记录峰面积值。
1.2.4.6 稳定性实验 在室温下,考察辣木叶中这两种成分的稳定性。选取新绿原酸0.18 mg/mL和异槲皮苷0.104 mg/mL的混合对照品溶液,按1.2.4.1项条件,分别于0、4、8、12、24 h进行测定,记录峰面积。
1.2.4.7 重复性实验 取同一批辣木叶原料,按1.2.4.3项下方法平行制备6份供试品溶液,进行HPLC分析。
1.2.4.8 加样回收率实验 取同一批已知含量的辣木叶样品约1.0 g,精密称定,分别精密加入一定量新绿原酸和异槲皮苷对照品溶液,按1.2.4.3项下方法制备供试品溶液,按1.2.4.1项条件测定,计算加样回收率。
1.2.4.9 样品含量测定 制备5批样品溶液,平行3份,测定其新绿原酸和异槲皮苷的含量。
2 结果与分析
2.1 辣木叶提取物对DPPH自由基清除能力的测定
根据测定结果,计算各个样品对DPPH自由基的清除率,结果见图1。

图1 DPPH自由基清除率折线图Fig.1 Line charts of DPPH free radical clearance rate
由结果可知,不同样品对DPPH自由基的清除能力依次为VC>LM1>LM2>EEL>PEL。低浓度时,LM1、LM2对DPPH的清除率明显高于EEL和PEL,随着样品浓度增加,清除率呈现增长趋势,最后趋于稳定,逐渐接近VC。
2.2 辣木叶提取物对羟自由基清除能力的测定
根据测定结果,计算各个样品对羟自由基的清除率,结果见图2。
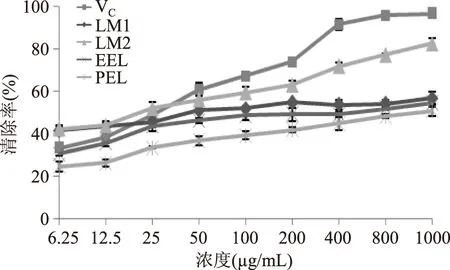
图2 羟自由基清除率折线图Fig.2 Line charts of hydroxyl radical clearance rate
由结果可知,不同样品对羟自由基的清除能力依次为VC>LM2>LM1>EEL>PEL。低浓度时,LM1和LM2对羟自由基的清除率高于VC,随着浓度升高,LM2清除率接近VC。结合“2.1”实验结果,LM1、LM2均表现出对DPPH和羟自由基较强的清除能力,且二者的清除能力仅稍弱于VC,说明这两个部位具有较强的抗氧化活性,具有极大的研究意义。
2.3 HPLC同时测定新绿原酸和异槲皮苷含量
2.3.1 色谱条件的选择 分别对乙腈-0.05%磷酸水、甲醇-0.05%磷酸水等多种洗脱系统进行考查,发现采用前者梯度洗脱时,各峰的分离度较好,保留时间适中,基线较平稳。选择330 nm作为检测波长,这是基于所测化合物在该波长处吸收相对最大,且杂质干扰较少。色谱图见图3。结果证明,在该色谱条件下,样品中目标物出峰时间和对照品的出峰时间一致,且与其他杂峰分离良好。

图3 混合对照品(A)和供试品(B)HPLC图Fig.3 HPLC chromatograms of the reference substances(A)and sample(B)注:1:新绿原酸;2:异槲皮苷。
2.3.2 线性关系考察 以对照品溶液浓度(X)为横坐标,峰面积(Y)为纵坐标绘制标准曲线,得新绿原酸、异槲皮苷的回归方程分别为:Y1=1025.3582×104X1-39809,r1=0.9995;Y2=660.8132×104X2-13976,r2=0.9995。结果表明,新绿原酸、异槲皮苷分别在0.018~0.36、0.0104~0.208 mg/mL与峰面积积分值线性关系良好。
2.3.3 精密度实验 测得新绿原酸、异槲皮苷峰面积的RSD分别为1.29%、1.30%,表明仪器精密度良好。
2.3.4 稳定性实验 计算新绿原酸、异槲皮苷的RSD分别为0.23%和1.69%,表明对照品溶液在24 h内稳定性良好。
2.3.5 重复性实验 考察新绿原酸、异槲皮苷峰面积RSD分别为1.4%和1.5%,表明该方法的重复性良好。
2.3.6 加样回收率实验 新绿原酸、异槲皮苷的平均加样回收率分别为98.84%、98.70%,RSD分别为2.52%、2.82%,表明上述实验方法的准确度较高。
2.3.7 样品含量测定 测定结果见表1。
表1 不同产地辣木叶中新绿原酸和异槲皮苷含量(n=3)
Table 1 Content determination results of neochlorogenic acid and isoquercitrin inMoringaoleiferaLamleaves from different regions(n=3)

样品编号新绿原酸(mg/g)异槲皮苷(mg/g)S10048±00010027±0003S20035±00020030±0002S30035±00010031±0001S40038±00040033±0002S50040±00030049±0003
3 结论
实验过程中,辣木叶提取物用石油醚、乙酸乙酯萃取后得到的水相经分离纯化,鉴定得到其中主要化学成分为新绿原酸、隐绿原酸等奎宁酸类和异槲皮苷、紫云英苷等黄酮类化合物,据此结果在MCI柱层析过程分段收集得到总奎宁酸LM1和总黄酮LM2。采用体外方法对得到的辣木叶提取物四个部位进行活性评价,结果LM1、LM2对DPPH和羟自由基的清除率大大高于EEL、PEL,表现出较强的抗氧化活性,仅稍弱于VC,从而得出辣木叶抗氧化有效部位为总奎宁酸和总黄酮,但还需对其中的抗氧化活性单体成分继续追踪研究。
基于抗氧化实验结果,选取辣木叶中奎宁酸成分新绿原酸和黄酮成分异槲皮苷作为质量控制指标成分。本实验建立了HPLC同时测定不同产地辣木叶中新绿原酸和异槲皮苷含量的方法,该法简便、准确,为制定辣木叶质量标准提供参考。
[1]张俐,张成,佘丽娜.辣木产业发展综述[J].云南林业,2014(5):64-65.
[2]贺艳培,王倩,孔令珏.辣木的研究进展[J].天津科技,2013(2):87-90.
[3]矫健,陈伟忠,穆珏,等.国内外辣木产业发展现状及思考[J].世界农业,2015(5):126-128.
[4]Carrie W,Diana MC,Patricio RS,et al.Stable,water extractable isothiocyanates fromMoringaoleiferaleaves attenuate inflammationinvitro[J].Phytochemistry,2014,103(10):114-122.
[5]Daljit SA,Jemimah GO.Invitroantimicrobial evaluation and phytoconstituents ofMoringaoleiferapod husks[J]. Industrial Crops and Products,2014,52(52):125-135.
[6]吉莉莉,汪开毓,罗晓波,等.辣木叶总黄酮响应面法微波萃取工艺优化及其体外降糖效果观察[J].天然产物研究与开发,2015(6):979-985.
[7]Boonyadist V,Pongtip S,Supachoke M,et al. Maximizing total phenolics,total flavonoids contents and antioxidant activity ofMoringaoleiferaleaf extract by the appropriate extraction method[J].Industrial Crops and Products,2013,44(1):566-571.
[8]Manoj KC,Surendra HB,Sanjay KG.Assessment of the Antiulcer Potential ofMoringaoleiferaRoot-Bark Extract in Rats
[J].Journal of Acupuncture and Meridian Studies,2013,6(4):214-220.
[9]Prabhu K,Murugan K,Nareshkumar A. Larvicidal and repellent potential ofMoringaoleiferaagainst malarial vector,Anopheles stephensi Liston(Insecta:Diptera:Culicidae)[J]. Asian Pacific Journal of Tropical Biomedicine,2011,1(2):124-129.
[10]Brahma N. Singh,B.R. Singh,R.L. Singh,et al.Oxidative DNA damage protective activity,antioxidant and anti-quorum sensing potentials ofMoringaoleifera[J].Food and Chemical Toxicology,2009,47(6):1109-1116.
[11]B. Moyo,S. Oyedemi,P.J. Masika,et al.Polyphenolic content and antioxidant properties ofMoringaoleiferaleaf extracts and enzymatic activity of liver from goats supplemented withMoringaoleiferaleaves/sunflower seed cake[J].Meat Science,2012,91(4):441-447.
[12]孙丹,管俊玲,许玫,等.辣木的有效成分、保健功能和开发利用研究进展[J].热带农业科学,2016,36(3):28-33.
[13]徐贵华,张凤梅,张磊.果蔬食品体外抗氧化方法研究进展[J].食品研究与开发,2010,31(11):215-219.
[14]张文彬,龚海英,张丽,等.天然产物抗氧化活性体内外评价方法[J].武警后勤学院学报,2013,22(11):1035-1038.
[15]李红领,李春阳,曾晓雄,等.桂花酶解物中酚类物质及其抗氧化活性研究[J].食品工业科技,2015,36(24):85-90.
[16]黄莎,王建勇,陈庆富,等.金荞麦叶茶有效成分的抗氧化作用研究[J].粮食与油脂,2016(2):30-32.
[17]韦献雅,殷丽琴,钟成,等. DPPH法评价抗氧化活性研究进展[J].食品科学,2014,35(9):317-321.
[18]梁蓉蓉,贾振斌,罗辉,等.DPPH在抗氧化活性评价中的应用[J].广东化工,2014,41(20):57-58.
[19]李艳,巩士磊,车影,等.Fenton反应考察抗坏血酸清除羟自由基能力及动力学[J].应用化学,2015,32(8):948-954.
[20]冯慧萍,李亦聪.羟自由基与水杨酸反应机理的初探[J]. 光谱实验室,2009,26(4):931-938.
Research of antioxidative activity and determination of active ingredients in Moringa oleifera Lam leaves
GAO Qiu-yu,DENG Xiao-kuan,LIU Li-qiong,HE Miao,GAO Ping*
(Laboratory of Medicinal Natural Products,College of Life Sciences,Sichuan University,Chengdu 610015,China)
Objective:To determine antioxidant effective parts and develop a HPLC method for simultaneous determination of neochlorogenic acid and isoquercitrin inMoringaoleiferaLamleaves. Methods:The antioxidant potency of four extracts ofMoringaoleiferaLamleaves,which are petroleum ether extraction,ethyl acetate extraction,total quinic acids and flavonoids,was evaluatedinvitrosystems. HPLC analysis was successfully conducted by using a Sepax Sapphire C18(250 mm×4.6 mm,5 μm)column,eluted with a gradient of acetonitrile -0.05% phosphoric acid with a flow rate of 1 mL/min,and detected at 330 nm. The column temperature was set at 30 ℃. Results:Quinic acids like neochlorogenic acid and flavonoids represented by isoquercitrin showed strongest scavenging capability. It showed that their scavenging activity of DPPH free radical reached 80%,when the concentration was greater than 800 μg/mL. And both of them showed higher scavenging rate for DPPH and hydroxyl radicals than petroleum ether and ethyl acetate extraction. Neochlorogenic acid and isoquercitrin showed good linearity within the test ranges. The recoveries were 98.84%,98.70%,respectively and RSD was less than 3%.Conclusions:The antioxidant effective parts inMoringaoleiferaLamleaves were total quinic acids and flavonoids. The method is simple and accurate,and could be used to identify and evaluate the quantitative determination of neochlorogenic acid and isoquercitrin inMoringaoleiferaLamleaves.
MoringaoleiferaLamleaves;antioxidant activity;effective parts;HPLC;quantitative determination
2016-07-08
高秋玉(1991-),女,在读硕士研究生,研究方向:天然药物化学,E-mail:848893521@qq.com。
*通讯作者:高平(1963-),女,博士,教授,研究方向:天然药物化学,E-mail:gaop@scu.edu.cn。
TS202.1
A
1002-0306(2016)23-0324-04
10.13386/j.issn1002-0306.2016.23.052
