体外传代对版纳微型猪骨髓间充质干细胞绿色荧光蛋白表达的影响
2016-02-07余璞龙海霍金龙王强李自安王金祥刘菊芬潘兴华庞荣清
余璞龙海霍金龙王强李自安王金祥刘菊芬潘兴华庞荣清
·论著·
体外传代对版纳微型猪骨髓间充质干细胞绿色荧光蛋白表达的影响
余璞1,3龙海2霍金龙4王强1李自安1王金祥1刘菊芬1潘兴华1庞荣清1
目的 通过分离扩增版纳微型猪骨髓间充质干细胞(BMSCs)观察传代对慢病毒转染的绿色荧光蛋白(GFP)表达的影响。方法 采集4月龄版纳微型猪的骨髓,在DMEM/F12培养液中分离间充质干细胞(MSCs),并根据其形态学、抗原标志表达和分化潜能给予鉴定。MSCs与GFP慢病毒载体共培养,荧光显微镜观察GFP的表达,流式细胞仪检测传代后MSCs GFP表达率的变化。标记后传代至1、2、3、4代细胞间比较用非参数检验。结果 采用直接培养骨髓,可以分离到高表达CD13、CD29、CD90、CD105 的MSCs,并可诱导分化为脂肪、骨和软骨细胞。MSCs与携带GFP的慢病毒载体共培养3天即可观察到GFP的表达,最佳转染复数(MOI)值为50,最佳共培养时间为6 d。传代后 MSCs GFP表达率呈下降趋势[1代转染率(42.3±2.25)%、2代转染率(41.6±2.65)%、3代转染率(41.4±3.75)%和 4 代转染率(38.2± 4.75)%],但传至 4 代GFP表达率的变化差异无统计学意义(P > 0.05)。结论 采用含有10%胎牛血清的DMEM/F12培养液可以从版纳微型猪骨髓中分离到MSCs,GFP慢病毒转染是标记MSCs的有效方法,连续传代4代不会显著影响GFP的表达。
猪; 骨髓; 间质干细胞; 细胞培养技术; 生物学标记
版纳微型猪近交系(banna minipig inbred line,BMI)是云南农业大学曾养志教授领导的科研小组精心培育的大型哺乳类医学实验动物,具有遗传背景清楚、个体相似度高的特点,是十分珍稀的医学科学实验研究模型[1-3],近交系来源的细胞也是体外实验研究的珍稀材料。间充质干细胞(mesenchymal stem cells,MSCs)是常用的种子细胞,追踪MSCs在体内的生存演变规律一直是再生医学研究的一个重要内容[4]。绿色荧光蛋白(green fuorescent protein,GFP)基因转染是标记干细胞的有效方法。研究建立近交系版纳微型猪骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)分离培养及GFP标记的技术方法,观察标记细胞传代对GFP表达的影响,目前尚无研究报道,研究结果将为版纳微型猪开展再生医学研究奠定重要的基础。
材料和方法
一、实验试剂与动物
携带GFP基因的慢病毒载体液(上海吉满生物科技有限公司);DMEM/F12培养基(美国Hyclone公司);胎牛血清和0.25%胰蛋白酶(均为以色列BI公司);流式抗体CD13-FITC、CD29-FITC、CD34-FITC、CD45-FITC、CD90-FITC和CD105-FITC(美国Beckman公司);肝素钠(华北制药集团责任有限公司);成脂、成骨及成软骨的分化诱导试剂盒(美国Gibco公司)。倒置荧光相差显微镜、荧光显微镜(Nikon公司)、流式细胞仪(美国BD公司)。3头4月龄雄性BMI,由云南农业大学提供。
二、BMSCs的制备与扩增
取4月龄版纳微型猪,用3%戊巴比妥钠10 ml静脉麻醉后备皮。局部消毒后,在髂后上脊处用骨穿针穿刺,用含有1 ml肝素钠生理盐水(1 200 U/ml)的注射器抽取骨髓0.5 ~ 1 ml,把等量含10%胎牛血清的DMEM与骨髓混均匀,以884×g离心5 min,在超净工作台内将漂浮的脂肪团块弃去,用含10%胎牛血清的DMEM 20 ml重悬。将混合液吹打均匀后分别接种在4个75 cm2培养瓶中,每瓶为9 ml,再向每个培养瓶补6 ml含10%胎牛血清的DMEM,置于37℃、5%CO2、饱和湿度的培养箱内进行培养。第3天行半量换液,以后每隔3 ~ 4 d更换培养基,当细胞长至80%~ 90%融合时,按1∶ 4的比例进行传代。∶
三、免疫表型检测
参照课题组建立的检测分析方法[5-6],将第3代BMSCs用0.25%胰蛋白酶液消化,制成1× 106个/ml的细胞悬液,分别加入流式抗体CD29、CD34、CD45、CD90和CD105,避光孵育30 min,离心后用流式细胞仪检测细胞标志物的表达。
四、分化潜能检测
1.成脂分化:取第3代细胞按照1×104个/cm2接种到12孔板中静置培养,当细胞达到100%融合时,弃去10%胎牛血清的DEME/F12培养液,加入成脂分化诱导液进行培养,每隔3天换液。待培养至14 d后,4%多聚甲醛固定后加入红油O染色。
2.成骨分化:取第3代细胞按照5×103个/cm2接种到12孔板中培养,待细胞至60%融合状态时,弃去培养液后,加入成骨诱导液持续培养,每隔3天换液。待培养21 d后,4%多聚甲醛固定后加入茜素红染色。
3.成软骨分化:收集第3代细胞,调整密度为1×107个/ml,取5 μl接种至12孔板中,放置于5% CO2、37℃的培养箱中静置培养2 h,缓慢加入预温的成软骨分化培养液培养,每隔3天换液。培养14 d后,4%多聚甲醛固定、石蜡包埋软骨细胞小球、病理切片,脱蜡后加入阿新蓝染色,生物显微镜下观察拍照。
五、BMSCs的GFP转染标记及检测分析
取第3代BMSCs,用0.25%胰蛋白酶来消化细胞,以884×g,离心5 min,弃去上清液,加入含10%胎牛血清的完全培养基重悬,制成单细胞悬液。将细胞稀释至5×104个/ml后,接种于24孔板中,每孔200 μl,培养至细胞达到30%~ 50%融合后,分别以0、25、50、100、200、400的转染复数(multiplicity of infection,MOI)加入携带GFP的慢病毒载体液0,25,50,100,200,400 μl,48 h后弃去培养液,用磷酸缓冲盐溶液冲洗后,加入不含慢病毒的含10%胎牛血清完全培养基继续培养,3 d后在荧光显微镜下观察且比较不同MOI的细胞绿色荧光的亮度,亮度最强的则为合适GFP病毒转染细胞的合适MOI。
此后每3天换液1次并观察荧光表达情况,待细胞融合80%以上进行传代,将传代后的细胞消化后制成1×106个/ml单细胞悬液,用流式细胞仪检测传代细胞GFP的阳性率。
六、统计学分析方法
结 果
一、BMSCs的培养和扩增
采用全骨髓培养法,培养4 ~ 5 d后细胞分裂增殖明显,出现形态均一的细胞增殖集落,培养至8 ~12 d,80%以上细胞融合(图1a),加入胰蛋白酶消化后1∶4传代,传代细胞呈漩涡状贴壁生长,典型的成纤维细胞样形态(图1b),分布均匀。
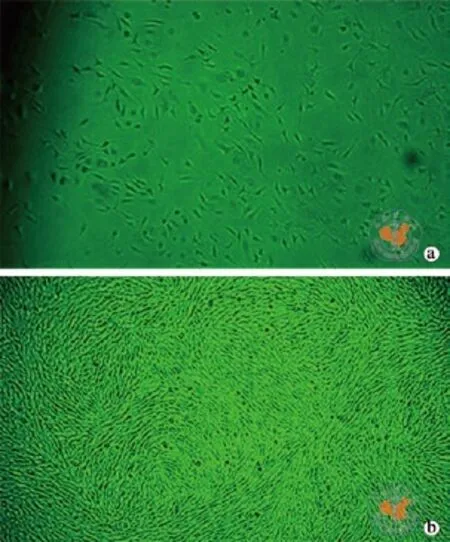
图1 光镜下观察版纳微型猪BMSCs形态 (×40)
注:a图为采用全骨髓培养法,贴壁的BMSCs呈长梭形态;b图为加入胰蛋白酶消化后1∶4传代,猪BMSCs呈漩涡式生长
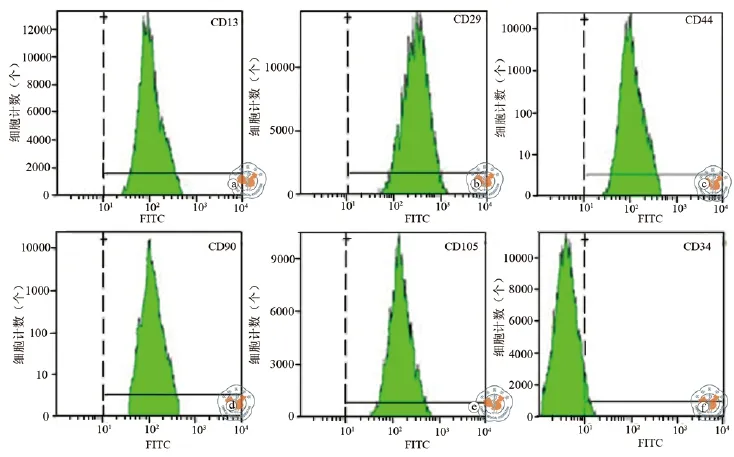
图2 版纳微型猪BMSCs免疫表型的流式检测
二、BMSCs的免疫表型检测
经流式细胞仪分析,结果显示培养出的细胞高表达CD13、CD29、CD44、CD90、CD105(图2a~e),低表达或者不表达CD34(图2f)。
三、BMSCs的分化潜能
成脂分化:细胞成脂分化诱导14 d后,经油红O染色,可见胞浆内有红色脂滴(图3a);成骨分化:细胞成骨分化诱导21 d后,钙质结节可被茜素红染成红色(图3b)。成软骨分化:诱导14 ~ 28 d后,石蜡包埋切片,可见软骨胶原基质被阿甲新蓝染成蓝色(图3c)。
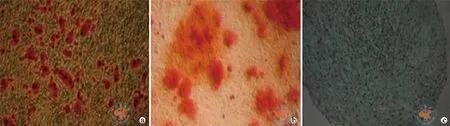
图3 光学显微镜下观察骨髓间充质干细胞的诱导分化结果(×40)
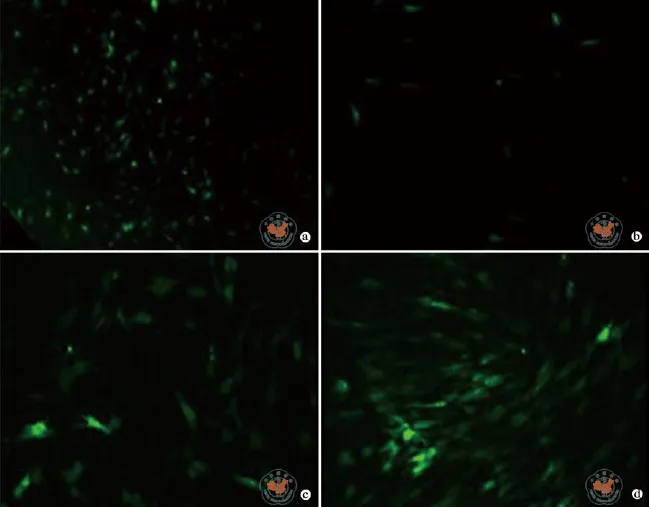
图4 荧光显微镜下观察慢病毒转染后的骨髓间充质干细胞
四、GFP标记猪BMSCs
分别按0、25、50、100、200、400的MOI加入慢病毒与猪BMSCs共培养,3 d后可在荧光显微镜下观察到MOI为50的转染组GFP表达明显较多,即绿色荧光亮度较强,MOI为0的对照组没有观察到绿色荧光,剩余其他组均较少表达(图4a、2b~d);将细胞消化后采用流式细胞技术检测荧光强度,发现6 d后MOI为50的转染组GFP表达达到高峰且此后维持在较高水平,MOI为100和200组的荧光亮度较弱(图5)。
五、转染GFP后BMSCs的传代
转染GFP的BMSCs进行传代,1、2、3、4代后分别经流式细胞仪分析后,转染率分别为(42.3± 2.25)%、(41.6±2.65)%、(41.4±3.75)%和(38.2± 4.75)%。将转染率进行比较,结果发现转染率呈下降趋势,但无明显差异(P > 0.05)(图6)。
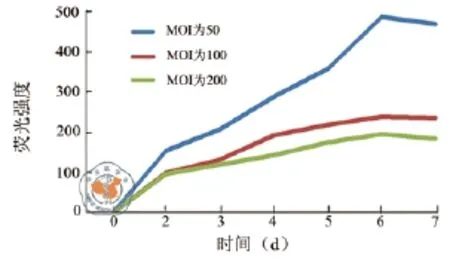
图5 流式细胞仪分析GFP转染后的荧光强度
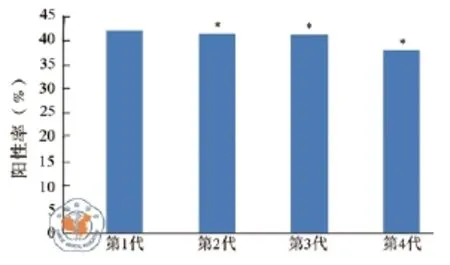
图6 GFP转染的BMSCs传代后的转染率变化分析
讨 论
在含有10%胎牛血清的DMEM/F12的培养液中直接培养4月龄版纳微型猪少许骨髓8 d,可以在光学显微镜下观察到呈旋涡状贴壁生长的成纤维细胞样细胞,高表达CD13、CD29、CD44、CD90、CD105,并能在体外诱导分化成骨、成脂、成软骨,根据MSCs的鉴定标准,可以判断这些细胞就是版纳微型猪BMSCs。前期研究发现:年轻供体来源的干细胞活性更好,更适于用作再生医学研究的种子细胞[7]。因此,本研究采集4月龄版纳微型猪骨髓,便于分离获取的MSCs用于后续研究。
建立稳定可靠的示踪方法是追踪干细胞生存演变的有效手段,是开展干细胞临床应用基础研究的关键环节。本研究显示:携带GFP的慢病毒液与版纳微型猪BMSCs共培养3 d,即可在荧光显微镜下观察到大量绿色荧光的存在,表明慢病毒转染的GFP表达效率较高。MOI为50时,MSCs的GFP表达率最高,说明共培养时GFP的加入量不是越多越好,加入太多,比如MOI为200时,可能是因为慢病毒影响了MSCs的增殖生长。共培养6 d后GFP表达率下降,可能是BMSCs融合度过高增长速度减慢。传代是否对标记信号的表达有影响,是评价干细胞标记技术的一个重要指标。本研究显示:GFP标记的版纳微型猪BMSCs传至6代其GFP表达率变化无显著差异,但显示有下降趋势,说明GFP的表达比较稳定,传代对其影响较小。本实验结果提示:GFP慢病毒转染标记的版纳微型猪MSCs,有可能用于体内研究实验,并可维持GFP表达数月之久。一种良好的干细胞标记技术,要求标记效率高,无毒性,标记时间长,便于检测观察。超顺磁标记法、荧光染料标记法、PCR检测法、基因标记法都是近年来建立的干细胞标记方法等[8-10]。GFP转基因标记方法操作简便快捷,标记细胞移植到体内后,既可利用荧光显微镜直接观察阳性细胞的存在而进行定性研究,也可运用流式细胞仪检测阳性细胞的比例而进行定量分析,可见,该方法具有显著的优势[11]。本研究显示:细胞传代后GFP表达率呈现下降趋势,提示GFP转染标记干细胞可能不适于长期体内示踪研究。将雄性个体来源细胞移植给雌性个体,检测Y染色体的存在是最可靠的长期体内示踪技术方法。因此,本研究选择雄性版纳微型猪作为骨髓供体,目的就在于方便获取的BMSCs用于后续长期示踪实验研究。
本研究从4月龄的BMI骨髓中分离到了MSCs,具有良好的增殖和分化能力,并建立了GFP转基因标记方法,为下一步以BMI为实验动物开展干细胞体内迁移和分化实验研究奠定了重要基础,实验数据有助于BMI的开发应用。
1 Qu KX, Wu GS, Gou X, et al. Genetic differentiations between randomly and selectively bred pig populations in Yunnan, China[J]. Dongwuxue Yanjiu, 2011, 32(3)∶255-261.
2 Wei H, Qing Y, Pan W, et al. Comparison of the effciency of Banna miniature inbred pig somatic cell nuclear transfer among different donor cells[J]. PLoS One, 2013, 8(2)∶e57728.
3 成文敏, 潘伟容, 尹俊芳, 等. 版纳微型猪近交系基因编码区序列扩增及生物信息学分析[J]. 畜牧兽医学报, 2015, 46(10)∶1706-1712.
4 Azevedo CM, Solano de Freitas Souza B, Andrade de Oloveira S, etal. Bone marrow-derived cells migrate to the liver and contribute to the generation of different cell types in chronic Schistosoma mansoni infection[J]. Exp Parasitol, 2015, 159∶29-36.
5 庞荣清, 何洁, 李福兵, 等. 一种简单的人脐带间充质干细胞分离培养方法[J/CD]. 中华细胞与干细胞杂志∶电子版, 2011, 1(2)∶30-33.
6 庞荣清, 何洁, 李瑞生, 等. 食蟹猴脐带间充质干细胞的分离与鉴定[J]. 中国比较医学杂志, 2015, 25(4)∶66-69.
7 潘兴华, 庞荣清, 张步振, 等. 不同年龄人骨髓间充质干细胞体外生长特性分析[J]. 生物医学工程与临床, 2006, 10(5)∶275-279.
8 Keighren MA, Flockhart J, Hodson BA, et al. Lessons from mouse chimaera experiments with a reiterated transgene marker∶revised marker criteria and a review of chimaera markers[J]. Transgenic Res, 2015, 24(4)∶665-691.
9 Martínez-López J, Crooke A, Grande S, et al. Real-time PCR quantification of haematopoietic chimerism after transplantation∶a comparison between TaqMan and hybridization probes technologies[J]. Int J Lab Hematol, 2010, 32(1 Pt 1)∶e17-e25.
10 Kim M, Choi B, Joo SY, et al. Generation of humanized liver mouse model by transplant of patient-derived fresh human hepatocytes[J]. Transplant Proc, 2014, 46(4)∶1186-1190.
11 Matsuda S, Shoumura M, Osuga N, et al. Migration and differentiation of GFP-transplanted bone marrow-derived cells into experimentally induced periodontal polyp in mice[J]. Int J Med Sci, 2016, 13(7)∶500-506.
Isolation and proliferation of bone marrow mesenchymal stem cells of Banna inbred minipig in vitro
Yu Pu1,3, Long Hai2, Huo Jinlong4, Wang Qiang1, Li Zi'an1, Wang Jinxiang1, Lui Jufeng1, Pan Xinghua1, Pang Rongqing1.1the Cell Biological Therapy Center of Kunming General Hospital of Chendu Military Commend, the Integrated Engineering laboratory of Cell Biological Medicine of State and Regions, The Transfer Medicine Key Laboratory of Cell Therapy Technology of Yunan Province, The Stem Cell Engineering laboratory of Yunan Province, Kunming 650032,China;2Special Branch Consultation of Kunming General Hospital of Chendu Military Commend, Kunming 650032,China;3Kunming Medical University Kunming General Hospital of Chendu Military Commend, Kunming 650500,China;4Yunnan Agricultural University College of Animal Science and Technology, Kunming 650201, China
Pang Rongqing, Email: pangrq2000@aliyun.com
Objective This study was aimed to isolate and culture bone marrow mesenchymal stem cells(MSC) from inbred Banna minipig in vitro. Metheods Bone marrow was aspirated from posterior superior iliac spine of three male Banna minipigs under sterile conditions. Then, primary bone marrow mesenchymal stem cells were isolated and cultured. Adherent cells were purified and labeled at the fourth generation with fluorescent dyes GFP in vitro as a source of donor cells. Results Bone marrow mesenchymal stem cells were cultured successfully in vitro using bone marrow adherent separation metheods. Flow cytometry rescults showed that CD13, CD29, CD90, CD105 were all highly expressed in the cells. However, CD34 were not expressed. After passage, theGFP expression decreased slightly(42.3%±2.25%, 41.6%±2.65%, 41.4%±3.75% and 38.2%± 4.75%for the 1-4 passages respectively, P > 0.05). Conclusion Miniature pig bone marrow MSCs may proliferate in DMEM/F12 medium with 10% fetal bovine serum, and labeling of MSCs via GFP lentiviral transfection is effective and stable.
Swine; Bone marrowone; Mesenchymal stem cells; Cell culture techniques; Biological markers
2016-08-16)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2016.06.007
云南省应用基础研究重点项目(2015FA039)
650032 昆明,成都军区昆明总医院细胞生物治疗中心、干细胞与免疫细胞生物医药技术国家地方联合工程实验室、云南省干细胞工程实验室1,特诊科2;650500 昆明医科大学成都军区昆明总医院临床学院3;650201昆明,云南农业大学动物科技学院4
庞荣清,Email:pangrq2000@aliyun.com
余璞,龙海,霍金龙,等.体外传代对版纳微型猪骨髓间充质干细胞GFP表达的影响[J/CD].中华细胞与干细胞杂志∶电子版, 2016, 6(6)∶ 363-368.
