水飞蓟宾对人肝癌HepG2细胞迁移的作用研究
2016-02-07陈惠云王少珍廖联明
陈惠云 王少珍 廖联明
·论著·
水飞蓟宾对人肝癌HepG2细胞迁移的作用研究
陈惠云 王少珍 廖联明
目的 观察水飞蓟宾对人肝癌(HCC)HepG2细胞迁移的作用。方法 采用MTT法观察水飞蓟宾对HepG2细胞的增殖抑制作用,采用细胞划痕实验和Transwell小室法观察水飞蓟宾对HepG2细胞迁移的作用,通过RT-PCR方法检测迁移相关基因Twist、Snail和Slug的表达水平;采用单因素方差分析方法比较不同浓度水飞蓟宾对细胞活力、细胞迁移距离的和迁移细胞个数的影响,并比较各组间Twist、Snail和Slug的转率。结果 MTT检测结果显示不同浓度(0,30,60,120,240,480 µg/ml)水飞蓟宾可以不同程度地抑制HepG2细胞增殖,同时呈现剂量依赖和时间依赖(P < 0.05);与对照组相比,HepG2细胞在划痕24 h后,水飞蓟宾组(60,120,240 µg/ml)的迁移距离分别为(1.50±0.24)cm(P = 0.046)、(1.20±0.33)cm(P = 0.037)和(1.05±0.24)cm(P = 0.029);Transwell实验中水飞蓟宾组(60,120和240 µg/ml)细胞迁移个数分别为(100.00±4.25)个、(30.00±5.34)个和(6.00±2.28)个(P均 < 0.05);PCR结果显示,水飞蓟宾不同程度的降低HepG2细胞Snail、Slug和Twist基因的转率。结论 水飞蓟宾可抑制人HCC HepG2细胞的迁移。
水飞蓟素; 肝肿瘤; 细胞运动
肝癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤之一,其发病率居全球所有恶性肿瘤的第6位,病死率排在第3位,5年生存率不到5%[1]。转移和术后复发是HCC致死的主要原因[2]。虽然科学界已经发现了许多肿瘤细胞启动的机制[3-6],但HCC的发病机制至今并不十分清楚。
水飞蓟宾(silybin)是菊科水飞蓟(silybum marianum L.Gaertn)种子中提取的黄酮类化合物,具有保肝、降血脂、抗氧化、防止糖尿病、保护心肌、抗血小板聚集和抗肿瘤等生理作用[7]。研究表明水飞蓟宾还具有抗肿瘤活性,对于多种肿瘤均具有良好的抑制作用[8-11]。另外,水飞蓟宾还可以抑制表皮生长因子受体(epidermal growth factor receptor,EGFR)突变的非小细胞肺癌细胞发生上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)和转移[12]。因此,课题组推测水飞蓟宾对HCC转移可能有抑制作用。本研究以人HCC细胞株(HepG2)为模型,观察水飞蓟宾对HepG2人HCC细胞迁移的作用,为开发水飞蓟宾用于抑制肿瘤转移提供依据。
材料与方法
一、材料
1.肿瘤细胞株:人HCC HepG2细胞株为福建中医药大学医学实验中心保存。
2.主要试剂及仪器:水飞蓟宾[天津天士力制药集团股份有限公司(H37023385)],二甲亚砜(dimethyl sulfoxide, DMSO,美国Sigma公司产品),四甲基偶氮唑盐(methylthiazolyldiphenyltetrazolium bromide,MTT);High-DMEM(美国Gibco公司);胎牛血清(美国Gibco公司)、磷酸缓冲液(PBS)、4%台盼蓝、引物(上海捷瑞生物工程有限公司)、Trizol(美国Nitrogen公司)、逆转录试剂盒(日本TaKaRa公司)、2xTaq Mix、焦碳酸二乙醋 (diethy pyrocarbonate,DEPC)(美国Sigma公司)、Gold View核酸染料、TBE Buffer、DNA marker。使用仪器包括ELX800酶标仪(美国Biotek公司)、PCR分析仪(德国Eppendorf公司)、电泳仪(美国Bio-rad公司)和全自动凝胶成像系统(美国Bio-rad公司)
二、方法
1.细胞培养:HepG2重悬于含有10%胎牛血清的high-DMDE培养液中并添加100 μg/ml青霉素和100 U/ml硫酸链霉素。放于37 ℃、5% CO2、95%湿度的培养箱培养。当细胞达90%~100%汇合时,用0.125%胰蛋白酶+ 0.01%EDTA常规消化,细胞按1∶3比例进行传代。所有实验均使用处于对数生长期的细胞。
2. MTT法:取对数生长期的HepG2细胞,0.25%胰蛋白酶消化,重悬计数后,均以5×103个/孔接种于96孔板中,每孔100 µl。于37 ℃细胞培养箱中培养过夜,待细胞融合度达50%~ 60%时,弃上清液,分别加入不同浓度水飞蓟宾(0,30,60,120, 240,480 µg/ml)干预24,48,72 h,小心吸弃上清液,每孔加0.5 mg/ml MTT 100 µl,于37℃培养箱继续孵育4 h,小心吸弃MTT溶液(注意不要吸走孔底部的蓝紫色结晶),每孔加入DMSO 100 µl,置37℃培养箱中继续孵育10 min,振荡器上充分振荡至蓝紫色结晶完全溶解,经全自动酶标仪于490 nm处检测各孔的吸光度(A)值。每组设6个复孔,实验重复3次。按公式计算细胞活力:细胞活力(%)=实验组(A)值/对照组(A)值×100%。
3.细胞划痕实验:取对数生长期的HepG2细胞,0.25%胰蛋白酶消化,重悬计数,调整细胞密度为1×105个/ml,接种于6孔板,待细胞融合度达95%以上时,用10 µl的无菌移液器吸头在板孔底部沿直尺作直线形划痕,吸去培养液,PBS洗2遍,小心洗去被划下的细胞,各孔加入新的含或不含水飞蓟宾的培养液继续培养(0,60,120,240 µg/ml),此时记为0 h,分别在划痕后0,12,24 h于倒置显微镜下观察、拍照。实验重复3次。
4. Transwell迁移实验:同前所述,细胞经传代,接种及不同浓度水飞蓟宾干预(0,60,120,240 µg/ml)48 h后,0.25%胰蛋白酶消化,用无血清培养液洗2遍,Countstar自动细胞计数仪计数,调整细胞密度为5×105个/ml,取100 µl加入上层小室,下层小室加750 µl含10% FBS的DMEM培养液,于37 ℃细胞培养箱中培养14 h。将Transwell小室从24孔板中取出,用移液枪吸出小室上层培养液,用棉签头擦去上室未迁移的细胞,将小室置于4% 多聚甲醛溶液中固定15 min,用PBS轻轻荡洗,0.1%的结晶紫染色20 min,PBS洗3次,洗去多余的结晶紫染液,晾干,于显微镜下观察,随机选取6个视野进行拍照(×200),统计迁移的细胞数。
5. PCR反应:胰酶消化对数生长期的HepG2细胞,调整细胞密度为1×105个/ml,接种于6孔板,置于细胞培养箱培养,当细胞融合度为50%~60%时,不同浓度水飞蓟宾(0,60,120,240 µg/ml)干预48 h,用Trizol提取总RNA,取1 μg进行逆转录。根据试剂盒说明书,逆转录选20 µl体系,各组样品均取1 µg Total RNA。置于Bio-rad PCR仪上进行逆转录反应。逆转录反应条件:42℃,30 min;85℃,5 min。所得cDNA产物于-20℃保存备用。作为内参的3-磷酸甘油醛脱氢酶(GAPDH)的引物为5-TTAGCACCCCTGGCCAAGG-3和5-CTTACTCCTTGGAGGCCATG-3,Snail基因的引物为5-CTCCACGAGGTGTGACTAACTA-3和5-CCGACAAGTGACAGCCATTAC-3,Slug基因的引物为5-CTTCAAGGACACATTAGAACTCACA-3和5-CTACACAGCAGCCAGATTCC-3,Twist基因的引物为5-GGAGTCCGCAGTCTTACGAG-3和5-TCTGGAGGACCTGGTAGAGG-3。PCR总体系25 µl,按94 ℃ 2 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s扩增30个循环,72℃ 2 min。PCR产物进行常规电泳分析,观察药物处理后Snail、Slug和Twist基因表达的变化。
三、统计学分析方法
采用SPSS 20.0统计软件进行统计分析。水飞蓟宾干预后细胞活力、细胞迁移距离、细胞迁移个数以及Snail、Slug和Twist基因的相对表达量均以± s表示,多组比较采用单因素方差分析,以P <0.05为差异具有统计学意义。
结 果
一、水飞蓟宾对HepG2细胞增殖的影响
HepG2细胞在含有不同浓度水飞蓟宾(0,30,60,120,240,480 µg/ml)的培养液中培养24,48,72 h后,MTT检测细胞活力,如表1所示,HepG2细胞活力随水飞蓟宾浓度增加而降低,同时呈现剂量依赖和时间依赖(P < 0.05)。由于30 µg/ml的水飞蓟宾对HepG2细胞的生长抑制作用不明显,所以其余细胞实验均选择60,120,240 µg/ml的水飞蓟宾干预,另外药物干预48 h的效果较24 h明显,所以其他实验选择干预48 h后进行检测。
表1 不同浓度水飞蓟宾对HepG2细胞活力的影响(%,± s,n = 6)

表1 不同浓度水飞蓟宾对HepG2细胞活力的影响(%,± s,n = 6)
药物浓度(µg/ml)24 h48 h72 h 0 100.00±4.10100.00±4.22100.00±4.21 30115.13±5.03105.31±5.00100.05±0.62 60100.88±4.02 90.33±3.89 80.50±3.42 120 95.85±3.04 85.29±3.01 66.75±2.87 240 85.70±3.01 61.12±2.87 37.25±1.31 480 75.73±2.63 52.68±1.88 25.38±1.00 F值10.12650.345 77.789 P值 0.053 0.024< 0.001
二、细胞划痕实验结果
如图1和表2所示,对照组的HepG2细胞在划痕24 h后,划痕距离明显变窄,不同浓度水飞蓟宾(0,60,120,240 µg/ml)干预的HepG2细胞的划痕愈合能力明显弱于对照组,即细胞的迁移能力明显减弱,且细胞迁移能力随药物浓度的增大而降低。可见水飞蓟宾可以抑制HepG2细胞的迁移。
三、Transwell实验结果
Transwell通过检测一段时间穿过小孔膜的细胞数来反映细胞迁移能力,穿过小孔膜的细胞数越多,迀移能力越强。结果如图2和表3所示。在迁移实验中,对照组有较多的HepG2细胞穿过微孔膜,水飞蓟宾干预后穿过微孔膜的细胞数量明显减少(P均< 0.05),且药物剂量越大,穿过孔膜的细胞数越少。表明水飞蓟宾可以显著降低HepG2的迁移能力。
表2 不同干预时间下水飞蓟宾对HepG2细胞迁移距离的影响(cm,± s,n = 3)

表2 不同干预时间下水飞蓟宾对HepG2细胞迁移距离的影响(cm,± s,n = 3)
药物浓度(µg/ml)12 h24 h 0 0.80±0.241.50±0.24 60 0.70±0.251.20±0.33 1200.60±0.341.05±0.24 240 0.40±0.280.75±0.26 F值3.464 37.648 P值0.052 0.029
表3 水飞蓟宾对HepG2细胞迁移个数的影响(± s)

表3 水飞蓟宾对HepG2细胞迁移个数的影响(± s)
药物浓度(µg/ml)n细胞迁移个数(个)0 3 150 60 3100.00±4.25 1203 30.00±5.34 240 3 6.00±2.28 F值182.450 P值 < 0.001
四、水飞蓟宾对HepG2细胞Snail、Slug和Twist基因的影响
如表4,HepG2细胞经不同浓度水飞蓟宾(0,60,120,240 µg/ml)干预48 h后Snail、Slug和Twist基因表达量均降低。由此可知,水飞蓟宾可使HepG2细胞的Snail、Slug和Twist基因表达下调(P均< 0.05)。
讨 论
肿瘤转移是一个复杂的过程,而细胞的迁移是肿瘤转移的主要表现[13]。因此,开发新的抑制细胞迁移的药物对治疗肿瘤转移至关重要。开发新药的来源之一是天然药物[14]。水飞蓟宾是一种天然药物,能抑制肿瘤细胞的增殖和诱导肿瘤细胞凋亡,对于多种肿瘤均具有良好的抑制作用[8-11]。
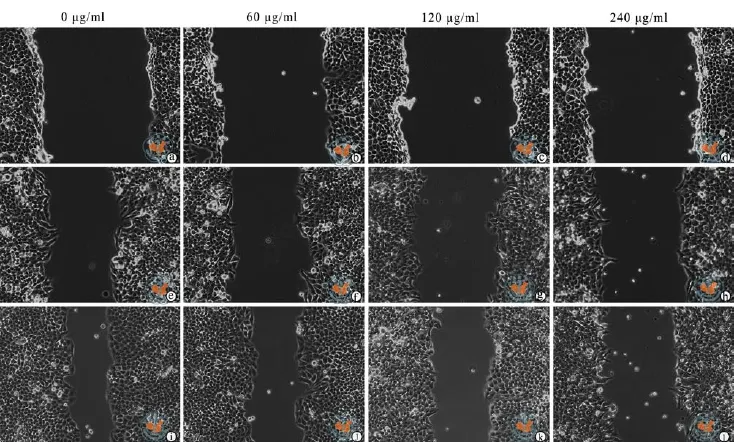
图 1 倒置显微镜下观察水飞蓟宾对HepG2细胞划痕实验结果 (×100)

图 2 倒置显微镜下观察水飞蓟宾对HepG2细胞迁移能力的影响 (结晶紫染色×200)
表4 HepG2细胞对Snail、Slug和Twist基因表达量的影响(n = 3,± s)

表4 HepG2细胞对Snail、Slug和Twist基因表达量的影响(n = 3,± s)
药物浓度(µg/ml)SnailSlugTwist 0 2.244±0.0841.704±0.1101.431±0.210 60 1.677±0.0531.353±0.0751.132±0.620 1201.494±0.0321.160±0.0680.913±0.068 2401.577±0.0441.173±0.0560.857±0.054 F值4.3444.496 43.689 P值0.0270.028< 0.001
本实验首先通过MTT实验观察水飞蓟宾对HepG2细胞增殖的作用。实验结果表明,水飞蓟宾可以抑制HepG2细胞的增殖,并且随着药物浓度和时间的增加逐渐增强。在此基础上,通过细胞划痕实验和Transwell迁移实验研究水飞蓟宾对HepG2细胞迁移的抑制作用。细胞划痕实验结果表明,给药24 h后水飞蓟宾组HepG2细胞的愈合能力比未用药组高,并具有浓度依赖性,因此可以推测水飞蓟宾具有抑制HepG2细胞迁移的趋势,但这种方法只是定性的分析。为了进一步确定水飞蓟宾对HepG2细胞迁移的影响,采用Transwell进行定量研究,Transwell方法是通过检测一段时间内穿过小孔膜的细胞数来观察细胞迁移能力的实验。实验表明,不同浓度的水飞蓟宾对HepG2细胞的迁移有明显的抑制作用,并呈现剂量依赖效应。
本研究通过RT-PCR实验观察水飞蓟宾对转移相关因子Snail、Slug和Twist的作用。实验结果表明,水飞蓟宾干预48 h后HepG2细胞的Snail、Slug和Twist基因表达明显下调,并且有剂量依赖效应。由于Snail、Slug和Twist等基因参与细胞的EMT,因此水飞蓟宾是否会抑制EMT值得进一步研究。EMT对肿瘤的转移非常关键[15-19]。Slug和Twist参与调控乳腺癌的EMT[18]。Snail参与调控多种肿瘤的侵袭和转移[20-23]。本实验发现水飞蓟宾对Snail、Slug和Twist等基因的影响,对开发抑制HCC转移的靶点抑制剂显得尤为重要[24-26]。因此,在接下来的研究中将继续深入研究水飞蓟宾与HCC细胞EMT的关系。
综上所述,水飞蓟宾具有抑制人HCC HepG2细胞迁移的能力,为水飞蓟宾临床抗肿瘤的应用提供了新的理论基础和前景。同时,水飞蓟宾可以抑制转移相关因子Snail、Slug和Twist的表达又为开发HCC转移抑制剂提供新的思路和基础。水飞蓟宾可以抑制EGFR突变的非小细胞肺癌细胞的EMT转变[12]。但是,本实验只是初步研究水飞蓟宾对EMT相关因子Snail、Slug和Twist基因表达的影响,未对细胞EMT的标志物E钙黏蛋白与波形蛋白的表达进行检测,因此水飞蓟宾是否是通过逆转HCC细胞EMT或通过其他通路来调节HCC细胞迁移的机制还不清楚,需要进一步研究。
1 Gluer AM, Cocco N, Laurence JM, et al. Systematic review of actual 10-year survival following resection for hepatocellular carcinoma[J]. HPB (Oxford), 2012, 14(5)∶285-290.
2 Lau WY, Lai EC. Hepatocellular carcinoma∶ current management and recent advances[J]. Hepatobiliary Pancreat Dis Int, 2008, 7(3)∶237-257.
3 Hanahan D, Weinberg RA. Hallmarks of cancer∶ the next Generation[J]. Cell, 2011, 144(5)∶646-674.
4 Hanahan D, Weinberg RA. The hallmarks of cancer[J]. Cell, 2000, 100(1)∶57-70.
5 Liu F, Liu Y, Shen J, et al. MicroRNA-224 inhibits proliferation and migration of breast cancer cells by down-regulating fizzled 5 expression[J]. Oncotarget, 2016. [Epub ahead of print].
6 Wu YR, Qi HJ, Deng DF, et al. MicroRNA-21 promotes cell proliferation, migration, and resistance to apoptosis through PTEN/ PI3K/AKT signaling pathway in esophageal cancer[J]. Tumour Biol, 2016, 37(9)∶12061-12070.
7 刘香臣. 水飞蓟素的药理作用与临床评价[J]. 中国医药指南, 2012 (14)∶66-67.
8 Deep G, Agarwal R. Antimetastatic efficacy of silibinin∶ molecular mechanisms and therapeutic potential against cancer[J]. Cancer Metastasis Rev, 2010, 29(3)∶447-463.
9 Son Y, Lee HJ, Rho JK, et al. The ameliorative effect of silibinin against radiation-induced lung injury∶ protection of normal tissue without decreasing therapeutic effcacy in lung cancer[J]. BMC Pulm Med, 2015, 15∶68.
10 Flaig TW, Glodé M, Gustafson D, et al. A study of high-dose oral silybin-phytosome followed by prostatectomy in patients with localized prostate cancer[J]. Prostate, 2010, 70(8)∶848-855.
11 Wang Y, Liang WC, Pan WL, et al. Silibinin, a novel chemokine receptor type 4 antagonist, inhibits chemokine ligand 12-induced migration in breast cancer cells[J]. Phytomedicine, 2014, 21(11)∶1310-1317.
12 Cufí S, Bonavia R, Vazquez-Martin A, et al. Silibinin meglumine, a water-soluble form of milk thistle silymarin, is an orally active anticancer agent that impedes the epithelial-to-mesenchymal transition (EMT) in EGFR-mutant non-small-cell lung carcinoma cells[J]. FoodChem Toxicol, 2013, 60∶360-368.
13 Cheng CY, Lie PP, Wong EW, et al. Focal adhesion kinase and actin regulatory/binding proteins that modulate F-actin organization at the tissue barrier∶ Lesson from the testis[J]. Tissue Barriers, 2013, 1(2)∶e24252.
14 Liu X, Wang J, Sun B, et al. Cell growth inhibition, G2M cell cycle arrest, and apoptosis induced by the novel compound Alternol in human gastric carcinoma cell line MGC803[J]. Invest New Drugs, 2007, 25(6)∶505-517.
15 Li X, Pei D, Zheng H. Transitions between epithelial and mesenchymal states during cell fate conversions[J]. Protein Cell, 2014, 5(8)∶580-591.
16 Thiery JP, Sleeman JP. Complex networks orchestrate epithelialmesenchymal transitions[J]. Nat Rev Mol Cell Biol, 2006, 7(2)∶131-142. 17 Yilmaz M, Christofori GE, The C. And cancer cell invasion[J]. Cancer Metastasis Rev, 2009, 28(1/2)∶15-33.
18 Weyemi U, Redon CE, Sethi TK, et al. Twist1 and slug mediate H2AX-regulated Epithelial-Mesenchymal transition in breast cells[J]. Cell Cycle, 2016, 15(18)∶2398-2402.
19 Zhou XM, Zhang H, Han X. Role of epithelial to mesenchymal transition proteins in gynecological cancers∶ pathological and therapeutic perspectives[J]. Tumor Biology, 2014, 35(10)∶9523-9530.
20 Wang Y, Shi J, Chai K, et al. The role of snail in EMT and tumorigenesis[J]. Curr Cancer Drug Targets, 2013, 13(9)∶963-972.
21 Zheng M, Jiang YP, Chen W, et al. Snail and slug collaborate on EMT and tumor metastasis through miR-101-mediated EZH2 axis in oral tongue squamous cell carcinoma[J]. Oncotarget, 2015, 6(9)∶6797-6810.
22 Ota I, Masui T, Kurihara M, et al. Snail-induced EMT promotes cancer stem cell-like properties in head and neck cancer cells[J]. Oncol Rep, 2016, 35(1)∶261-266.
23 Jeon SY, Go RE, Heo JR, et al. Effects of cigarette smoke extracts on the progression and metastasis of human ovarian cancer cells via regulating epithelial-mesenchymal transition[J]. Reprod Toxicol, 2016, 65∶1-10.
24 Wang C, Jiang K, Kang X, et al. Tumor-derived secretory clusterin induces epithelial-mesenchymal transition and facilitates hepatocellular carcinoma metastasis[J]. Int J Biochem Cell Biol, 2012, 44(12)∶2308-2320.
25 Stebbing J, Filipović A, Giamas G. Claudin-1 as a promoter of EMT in hepatocellular carcinoma[J]. Oncogene, 2013, 32(41)∶4871-4872.
26 Wang J, Chen L, Li Y, et al. Overexpression of cathepsin Z contributes to tumor metastasis by inducing epithelial-mesenchymal transition in hepatocellular carcinoma[J]. PLoS One, 2011, 6(9)∶e24967.
Silybin inhibits migration of human hepatocellular carcinoma cells and its mechanism
Chen Huiyun, Wang Shaozhen, Liao Lianming. Fujian University of Traditional Chinese Medicine, Fuzhou 350108, China
Liao Lianming, Email:llm@fjtcm.edu.cn
Objective To observe the effect of silybinin on the migration of HepG2 cells. Methods MTT assay was used to determine the effect of silybinin on cell proliferation and viability of HepG2 cells. Cell scratch and Transwell assay were used to evaluate the effect of silybinin on migration of HepG2 cells. mRNA transcription level of Twist, Snail and Slug genes was qualified by real-time quantitative PCR. The viability of HepG2 cells, migration distance, the numbers of migrated cells and gene expression levels of Twist, Snail and Slug were compared among four groups by Oneway ANOVA. P < 0.05 was considered statistically significant. Results MTT assay showed that silybinin(0, 30, 60, 120, 240, 480 μg/ml)treatment could significantly decrease viability of HepG2 cells in dose- and time- dependent manners(P < 0.05). The migration distances of silybinin group(60, 120 and 240 μg/ml ) were (1.50±0.24) cm(P = 0.046)、(1.20±0.33) cm(P = 0.037)and (1.05±0.24)cm(P = 0.029)respectively. Then, we examined the numbers of migrated cells were 100.00±4.25、30.00±5.34 and 6.00±2.28(P < 0.05)respectively. Gene expression levels of Twist, Snail and Slug were inhibited in HepG2 cells(P < 0.05). Conclusion Silybinin could inhibit the migration of HepG2 cells.
Silymarin; Liver neoplasms; Cell movement
2016-04-10)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2016.06.004
350122 福州,福建中医药大学药学院
廖联明,Email:llm@fjtcm.edu.cn
陈惠云,王少珍,廖联明. 水飞蓟宾对人肝癌HepG2细胞迁移的作用研究[J/CD].中华细胞与干细胞杂志∶电子版, 2016, 6(6)∶345-350.
