以Ni-B为催化剂合成5-氨基苯并咪唑酮
2016-02-04马洪庆孟舒献冯亚青
马洪庆,孟舒献*,冯亚青,方 硕
(1.天津大学化工学院,天津300072;2.化工协同创新中心,天津300072;3.天津力生制药股份有限公司,天津 300111)
5-氨基苯并咪唑酮是合成苯并咪唑酮结构偶氮型颜料的主要中间体,用于制备高档有机颜料系,如 C.I.颜料黄 154、C.I.颜料黄 180、C.I.颜料橙36等[1]。苯并咪唑酮类颜料在结构上具有较好的分子平面性与分子对称性,并且可以形成分子内、分子间氢键,改变了分子的聚集状态[2],使得该颜料具有优异的耐光、耐气候牢度、耐溶剂性、耐热稳定性与耐迁移性能[3]。通常5-氨基苯并咪唑酮是由5-硝基苯并咪唑酮还原制备,还原方法有铁粉还原和催化加氢还原。铁粉还原法[4-5]所用铁粉价格低廉,设备投资少,工艺成熟,是目前工业上采用的主要方法,但产生大量氧化铁泥,后处理比较复杂,对环境造成严重污染。催化加氢还原法[6]的反应完全,副反应少,产品的质量和收率都很高,对环境的污染少。Okujina等[7]报道使用 Pd/C作为催化剂还原5-硝基苯并咪唑酮,收率达到95%,但是该催化剂价格昂贵,与产物难于分离,循环再利用困难,难以实现工业化。
Ni-B非晶态合金中部分电子由B转移到金属Ni上,使Ni呈富电子状态,B呈缺电子状态,能有效提高催化剂的活性,故本研究采用液相催化加氢还原法,以非晶态Ni-B为催化剂催化加氢还原5-硝基苯并咪唑酮,制备5-氨基苯并咪唑酮,收率达92%以上,质量分数达到99.7%以上。本工艺流程简单,操作简便,可望用于大规模工业化生产。
1 实验部分
1.1 试剂与仪器
KBH4(质量分数大于96.0%),天津市光复精细化工研究所;Ni(CH3COO)2·4H2O(质量分数大于98.0%),天津市光复精细化工研究所;乙醇(质量分数99.6%)天津市科锐思精细化工有限公司;5-硝基苯并咪唑酮(自制,质量分数大于99.3%);NaOH(质量分数96.0%)天津市风船化学试剂科技有限公司。
高压釜,山东威海新元化工机械有限公司;熔点仪:SGWX-4显微熔点仪;高效液相色谱:Agilent 1100液相色谱仪;场发射扫描电子显微镜 S-4800,日本日立公司;X-射线衍射仪(D/MAX-2500),日本理学公司。
1.2 Ni-B催化剂的制备
在三口瓶中加入 0.2 mol/L的 Ni(CH3COO)2溶液100mL,置于冰盐浴中,将100mL 0.2 mol/L的KBH4溶液(pH值为12)逐滴滴加到 Ni(CH3COO)2溶液中,此过程中会产生大量气泡,并伴随黑色沉淀析出,约1 h滴加完毕,继续反应约1 h至无气体产生,停止反应,倾泻法将黑色沉淀用蒸馏水反复洗涤至 pH值为7,最后用无水乙醇洗3遍,得到Ni-B非晶态合金催化剂,无水乙醇液封保存。
1.3 非晶态Ni-B催化剂的表征
1.3.1 催化剂的表面形貌(SEM)
机器型号:S-4800,在5 kV电压,放大20 000倍,SE(M)条件下进行扫描,观察催化剂的表面形貌。
1.3.2 X-射线衍射(XRD)
机器型号:X'Pert Pro,钴靶,在 40 kV电压,40 mA电流,20°~70°范围内,以 8(°)/min 的速度测定衍射角,确定所制备的催化剂为Ni-B非晶态合金催化剂。
1.3.3 比表面积(BET)和孔结构测定
对催化剂的比表面积以及孔隙进行测量,根据BET公式计算比表面积,其计算方程为:
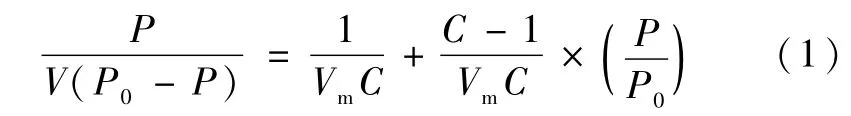
其中:P为吸附质(N2)的压力;P0为吸附质(N2)的饱和蒸汽压;V为压力 P时的吸附量(STP,cm3/g);Vm为单分子层饱和吸附量(STP,cm3/g);C为常数。
1.4 5-氨基苯并咪唑酮的制备
在高压釜中,将5-硝基苯并咪唑酮溶解到无水乙醇中,然后加入制得的Ni-B催化剂,氮气置换3次,通入氢气至设定压力,经检查不漏气,开始搅拌,加热,反应期间不断补充氢气以维持设定的压力,当压力在1 h左右维持不变时,停止搅拌,冷却,卸压,抽滤,得到产物 a,产物 a经过滤得到的滤饼在80℃热水中溶解,过滤除去催化剂,滤液重结晶,得到5-氨基苯并咪唑酮结晶体产物;产物a经过滤得到的滤液经减压蒸馏浓缩,得到的固体在80℃的热水中重结晶,得到5-氨基苯并咪唑酮结晶体产物,将2次结晶体产物干燥,得到5-氨基苯并咪唑酮,计算收率,高效液相色谱分析纯度,其中高效液相色谱的分析条件为:C-18色谱柱、100%的甲醇为流动相,流速为1mL/min,检测波长为249 nm。该操作中重结晶的目的有2个:1)提纯5-氨基苯并咪唑酮,因为5-氨基苯并咪唑酮溶于热水,而5-硝基苯并咪唑酮不溶于热水,所以通过热水重结晶可将未反应的5-硝基苯并咪唑酮分离出来。2)将催化剂与5-氨基苯并咪唑酮分离,因为5-氨基苯并咪唑酮和Ni-B催化剂均为固体无法分离,只能通过重结晶分离。

2 结果与讨论
2.1 催化剂的表征
图1为催化剂的扫描电镜图,图2为X-射线衍射谱图,图3为氮气吸附等温线,图4为孔分布曲线。

图1 Ni-B催化剂的扫描电镜Fig.1 SEM of catalyst Ni-B
从图1中看出,催化剂呈小球状均匀分布,主要是因为Ni-B非晶态合金中存在分布均匀的活性中心,能使反应原料有效的接触催化剂的活性位点,提高催化活性。
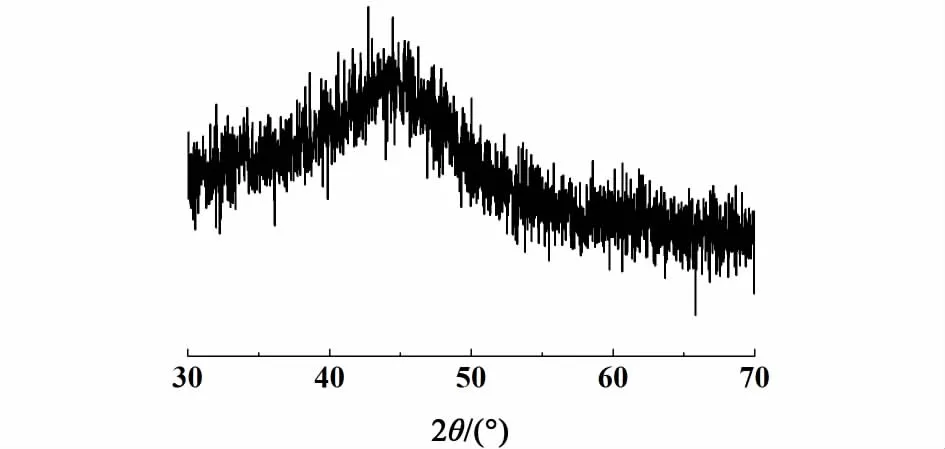
图2 催化剂的X-射线衍射谱图Fig.2 XRD of catalyst Ni-B
图2可以看出样品在2θ=45°出现1个弥散衍射峰,这是金属Ni与类金属B形成非晶态合金的特征峰[8-10],表明样品具有非晶态结构。
从图3看出,低P/P0区曲线凸向上,与Ⅱ型等温线类似。当P/P0在0.3~0.5时,吸附质发生毛细管凝聚,等温线迅速上升。当所有均发生凝聚后,吸附只在远小于内表面积的外表面上发生,曲线趋于平坦[11]。同时通过氮气吸附可以计算 Ni-B催化剂的比表面积和孔体积,比表面积为51 m2/g和总孔容为0.0524cm3/g,微孔容为0.015cm3/g,介孔容为0.0374cm3/g,说明Ni-B催化剂在金属类催化剂中具有较大的比表面积和孔容积,因此,能够允许较多的反应分子与催化剂活性中心接触,使催化剂活性较高。

图3 Ni-B催化剂的氮气吸附等温线Fig.3 N2adsorption isotherm of the catalyst Ni-B
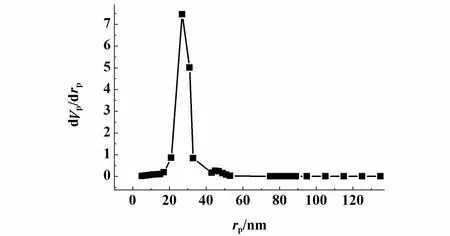
图4 Ni-B催化剂的孔分布曲线Fig.4 Pore size distribution of the catalyst Ni-B
从图4可以看出,孔径分布在25 nm处出现极值,说明催化剂内部主要由中孔构成。由于催化剂的中孔特征,传质阻力较小,反应物可以方便地进入或逸出,使反应顺利进行。
2.2 反应温度的影响
反应条件为:5-硝基苯并咪唑酮17.9 g,Ni-B催化剂1.0 g,反应溶剂乙醇100mL,压力为2.0 MPa,改变反应温度,结果见表1。

表1 反应温度对反应的影响Table 1 Effect of reaction pressure
表1中的反应时间是反应到一定程度,反应压力在1 h左右保持不变记录下的反应时长,从表1看出,当反应温度由150℃升高到180℃时,产率由45.2%升高到92.4%,反应时间从16 h缩短至8 h,可见较高的温度使催化剂活性升高,有利于反应的进行。但当温度升高到200℃时,产率开始降低,主要原因是催化剂的活性降低,导致产率下降,故对于Ni-B催化剂催化还原5-硝基苯并咪唑酮制备5-氨基苯并咪唑酮这一反应,催化剂的最适温度为180℃,温度以不超过190℃为宜。
2.3 催化剂用量对反应的影响
反应条件:5-硝基苯并咪唑酮17.9 g,反应溶剂100mL,反应压力2.0 MPa,反应温度180℃,改变催化剂的用量,结果见表2。
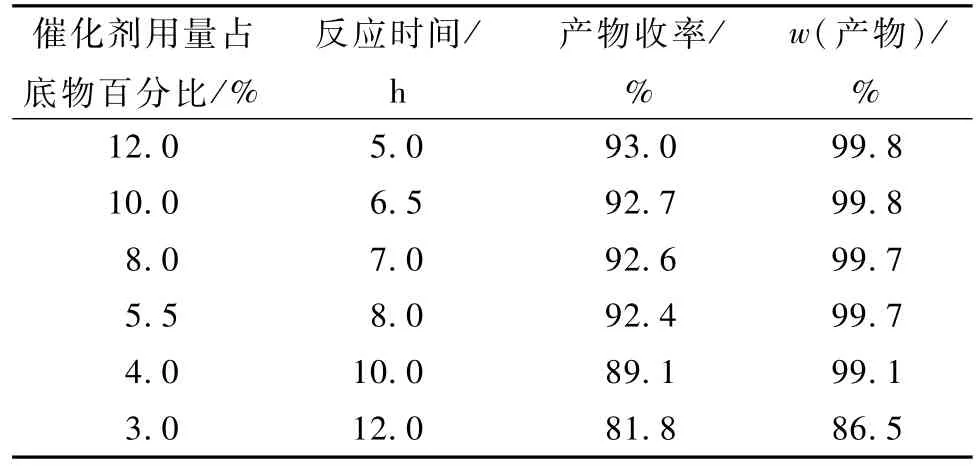
表2 催化剂用量对反应的影响Table 2 Effect of the amount of Ni-B
由表2看出,随着催化剂用量的增加,产物的收率提高,质量分数增大,当催化剂用量由1.00 g,增加到2.15 g时,产率由92.4%提高到93.0%,产率有所提高但并不明显,明显的是加快了反应速率,缩短了反应时间,由8 h缩短到5 h。而在催化加氢反应中,催化剂的反应效率取决于催化剂的活性中心数目,催化剂的用量增大,其活性中心数目增多,故随着催化剂用量的增大,反应时间在缩短,反应产率在提高。由此可见,催化剂用量越大越好,可是催化剂成本高,回收麻烦,从经济性考虑,选择催化剂的用量占5-硝基苯并咪唑酮用量的5.5%为宜,此时收率为92.4%,质量分数为99.7%。
2.4 催化剂的回收利用
Ni-B催化剂参加还原反应后,不做任何处理,直接用于下一次催化加氢还原反应,反应条件:5-硝基苯并咪唑酮17.9 g,反应溶剂100mL,反应压力2.0 MPa,反应温度180℃,其催化活性见表3。
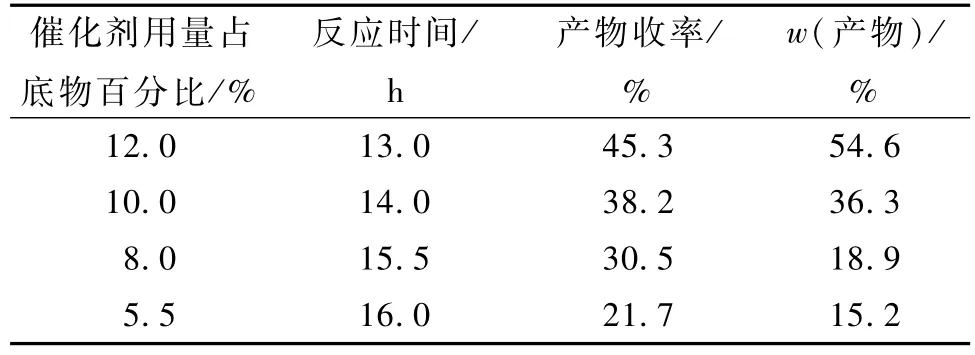
表3 催化剂直接回收利用对反应的影响Table 3 Effect of recycle of Ni-B without treated
从表3看出,反应时间延长,产物的收率不到50.0%,质量分数最高也只有54.6%,可见不经过处理的Ni-B催化剂活性很低。从电子效应分析,在Ni-B非晶态合金中,Ni原子和B原子存在明显的相互作用,部分电子由B原子转移到Ni原子,所以合金中Ni呈富电子状态,而B呈缺电子状态。由于硝基(NO2)中N原子的部分电子转移给O原子,因此富电子的活性Ni原子可通过吸附缺电子的N原子而增强对硝基的吸附,而缺电子的B原子又与硝基中的O原子作用,进一步加强对5-硝基苯并咪唑酮的吸附[12]。在催化加氢反应中,Ni-B催化剂的表面活性中心被破坏,无法形成N-Ni-H,从而使 Ni-B活性降低[13]。同时,由于催化剂的活性降低,导致反应产率下降,产物重结晶后,纯度下降,究其原因正在进一步研究。
通过重结晶将产物与Ni-B催化剂分离,回收后的Ni-B催化剂用水洗干净,然后加入到100mL水中,在冰盐浴中逐滴滴加 0.2 mol/L KBH4溶液50mL,搅拌1.5 h,至不再产生气体为止,倾泻法用蒸馏水洗至pH值为7,无水乙醇洗3次,无水乙醇液封保存。反应条件为:5-硝基苯并咪唑酮17.9 g,反应溶剂100mL,反应压力2.0 MPa,反应温度180℃,催化活性见表4。
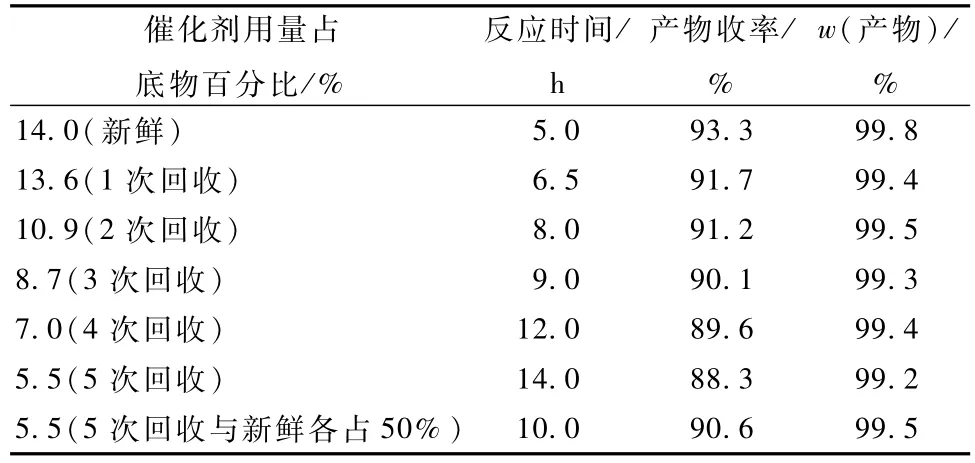
表4 催化剂回收处理对反应的影响Table 4 Effect of reuse of Ni-B
从表4可以看出,使用过的Ni-B催化剂经过硼氢化钾溶液在冰盐浴环境中处理后,回收的催化剂活性明显增强。当催化剂回收5次时,产物收率为88.3%,在催化剂回收第5次时补加2.75%的新鲜催化剂时,收率为90.6%,质量分数为99.5%,产物和收率都有所提高。因此,催化剂在回收过程中会有不可避免的损失,在使用时,每次催化剂的用量要增大1.2倍。
3 结论
用非晶态Ni-B催化剂还原5-硝基苯并咪唑酮合成5-氨基苯并咪唑酮,催化剂用量为5.5% ~6.6%,(相对于5-硝基苯并咪唑酮的质量),反应温度180℃,反应压力2.0 MPa,反应时间8 h,溶剂无水乙醇100mL,产物产率为92.4%,质量分数在99%以上,催化剂可回收使用 5次,可望工业化生产。
[1]穆振义.苯并咪唑酮高档有机颜料及其专用中间体[J].化工中间体,2002(10):10-14 Mu Zhenyi.High-Grade organic pigments and special intermediates of benzimidazolone-2 [J].Chemical Intermediates,2002(10):10-14(in Chinese)
[2]廖建明.有机颜料概况及性能应用[J].涂料工业,2004,34(9):20-23 Liao Jianming.Overview of organic pigment and application performance[J].Painting Industry,2004,34(9):20-23(in Chinese)
[3]谭川江.5-氨基苯并咪唑酮的合成及工艺改进[D].天津:天津大学,2007 Tan Chuanjiang.Synthesis and improvement on process of 5-amino benzimidazolone-2[D].Tianjin:Tianjin U-niversity,2007(in Chinese)
[4]张容成,高健.芳香族硝基化合物还原制芳胺生产工艺评析[J].化工矿物与加工,2000(8),29-31 Zhang Rongcheng,Gao Jian.Review on the manufacturing technology of aromatic amine through the reduction reaction [J].Industrial Minerals and Processing,2000,(8):29-31(in Chinese)
[5]Agrawal A,Tratnyek P G.Reduction of nitro aromatic compounds by zero-valent iron metal[J].Environ Sci Technol,1996,30:153-160
[6]王桂林,王纪康,严 魏.催化加氢技术在精细化工中应用 [J].化工生产与技术,1997,(3):27-29 Wang Guilin,Wang Jikang,Yan Wei.Application of catalytic hydrogenation technology in fine chemical industry[J].Chemical Production and Technology,1997,(3):27-29(in Chinese)
[7]Kujina O,Irom H,Narinatsr A,et al.Heterocyclylamino-2(3H)-benzimidazolones or their salts as cardiotonics:JP,0259572 [90591572][P].1990-02-01
[8]严新焕,孙庆军,徐颖华,等.Ni-Co-B非晶态合金催化剂用于氯代硝基苯液相加氢制氯代苯胺[J].催化学报,2006,27(2):123-199 Yan Xinhuan,Sun Qingjun,Xu Yinghua,et al.Liquid-Phase hydrogenation of chloronitrobenzene to chloroaniline over Ni-Co-B amorphous alloy catalyst[J].Journal of Catalysis,2006,27(2):123-199(in Chinese)
[9]武美霞,李伟,张明慧,等.壳聚糖修饰的Ni-B非晶态合金的制备及表征[J].物理化学学报,2011,27(4):953-958 Wu Meixia,LiWei,Zhang Minghui,et al.Preparation and characterization of Ni-B amorphous alloy modified using chitosan[J].Acta Physico-Chimica Sinica,2011,27(4):953-958(in Chinese)
[10]武美霞,李伟,张明慧,等.以壳聚糖为介质的 Ni-B非晶态合金/膨胀石墨的制备及其催化加氢性能[J].催化学报,2007,28(4):351-356 Wu Meixia,LiWei,Zhang Minghui,et al.Preparation of chitosan-mediated expanded graphite-supported amorphous Ni-B alloy catalysts and their catalytic hydrogenation performance[J].Journal of Catalysis,2007,28(4):351-356(in Chinese)
[11]Zhou C,Beltramini JN,Fan Y,et al.Chemoselective catalytic conversion of lycerol as a biorenewable source to valuable commodity chemicals[J].Chem Soc Rev,2008,37(3):527-549
[12]王明辉,李和兴.Ni-B/SiO2非晶态催化剂应用于硝基苯液相加氢制苯胺[J].催化学报,2001,22(3):287-290 Wang Minghui,Li Hexing.Liquid-Phase hydrogenation of nitrobenzene to aniline over Ni-B/SiO2amorphous catalyst[J].Journal of Catalysis,2001,22(3):287-290
[13]Birkenstok U,Holm R,Reinfandt B,et al.Surface analysis of Raney catalyst[J].Cata L,1985,93:55-67
