非晶态合金与氢相互作用的研究进展∗
2017-09-09林怀俊朱云峰刘雅娜李李泉朱敏
林怀俊朱云峰刘雅娜 李李泉 朱敏
1)(暨南大学,先进耐磨蚀及功能材料研究院,广州 510632)
2)(南京工业大学材料科学与工程学院,南京 210009)
3)(华南理工大学材料科学与工程学院,广州 510640)
非晶态合金与氢相互作用的研究进展∗
林怀俊1)†朱云峰2)‡刘雅娜2)李李泉2)朱敏3)‡
1)(暨南大学,先进耐磨蚀及功能材料研究院,广州 510632)
2)(南京工业大学材料科学与工程学院,南京 210009)
3)(华南理工大学材料科学与工程学院,广州 510640)
(2017年5月2日收到;2017年6月8日收到修改稿)
非晶态合金在力学性能、耐磨耐蚀性、磁性等方面比传统晶态合金具有显著优势,是一类有优良应用前景的新型结构与功能材料.非晶态合金与氢相互作用可以产生很多有趣的物理化学现象和应用.本文从物理基础和材料应用两个方面评述非晶态合金和氢相互作用的研究进展,在物理基础研究方面,从氢在非晶态合金中的存在状态出发,讨论氢在非晶态合金中的溶解、分布、占位和扩散等相关物理问题,进而分析氢对非晶态合金的热稳定性、磁性、内耗、氢脆等的影响.在材料应用研究方面,对非晶态储氢合金、非晶态合金氢功能膜、吸氢改善非晶态合金的塑性和玻璃形成能力、氢致非晶化、利用非晶态合金制备纳米储氢材料等方面的研究进展进行评述.最后总结并展望有关非晶态合金与氢相互作用的研究和应用.
非晶态合金,氢,储氢,氢致相变
1 引 言
1960年,加州理工学院的Duwez教授等[1]在研究晶体结构和化合价完全不同的两个元素能否形成固溶体时,偶然发现了Au-Si非晶态合金,从那时起,这种非平衡亚稳态材料就受到越来越多科学家和工程师的关注.经过半个多世纪的发展,非晶态合金在国防、航天航空、变压器、催化剂、微纳米器件、首饰、高档电子产品等高科技与时尚领域备受青睐[2−5].相比自然界普遍存在的晶态合金,非晶态合金在强度、耐蚀性、软磁等方面有着显著的优势[4,6],比如:Co基非晶态合金的强度可高达6.0 GPa;铁基非晶态合金变压器铁芯的铁损比传统的硅钢、坡莫合金降低60%—70%;非晶态合金可如玻璃一样吹制成表面光泽的合金球,加工成各种精密器件.
自从非晶态合金发明以来,其与氢的相互作用引领了一系列重要的基础研究和材料应用的发展,非晶态合金中的氢(Hydrogen in amorphous alloys)受到越来越多物理、化学和材料等领域科技人员的关注[7−10].氢和材料中缺陷(空位、位错和界面等)的相互作用对工程材料的应用有着重要意义,非晶态合金的结构在一定程度上可以当作晶体中的缺陷结构,因此研究氢在非晶态合金中的物理化学行为可以帮助我们理解氢与缺陷的相互作用[7].将氢作为探针,利用中子散射、核磁共振等手段,可以研究非晶态合金的微观结构和本质[11].非晶态合金吸氢过程中产生的应力应变小,不易发生粉化[12],故吸放氢循环稳定性高,同时非晶态合金中还存在很多松散原子团簇和自由体积,可能提供潜在的氢占位,是一类有应用前景的储氢材料[13,14].非晶态合金膜的氢渗透性强、生产成本低、化学成分可调控性高,是能够代替Pd基合金氢渗透膜的新一代氢提纯材料[15−18].利用非晶态合金的氢致变色和氢致变阻特性,可以制备新型的智能玻璃和氢传感器[19−22].吸氢处理还可以提高非晶态合金的力学性能和玻璃形成能力等[23−25].图1总结了迄今为止有关非晶态合金和氢相互作用的主要研究和应用.
本文从物理基础和材料应用两个方面总结有关非晶态合金和氢相互作用的研究进展.在物理基础方面,从非晶态合金中氢的溶解度、分布、占位和扩散等出发,分析吸氢对非晶态合金的热稳定性、磁性、内耗、氢脆等特性的影响;在材料应用研究方面,主要从非晶态储氢合金、非晶态合金氢功能膜、氢致非晶化、氢合金化提高非晶态合金的塑性和玻璃形成能力等方面进行综述.
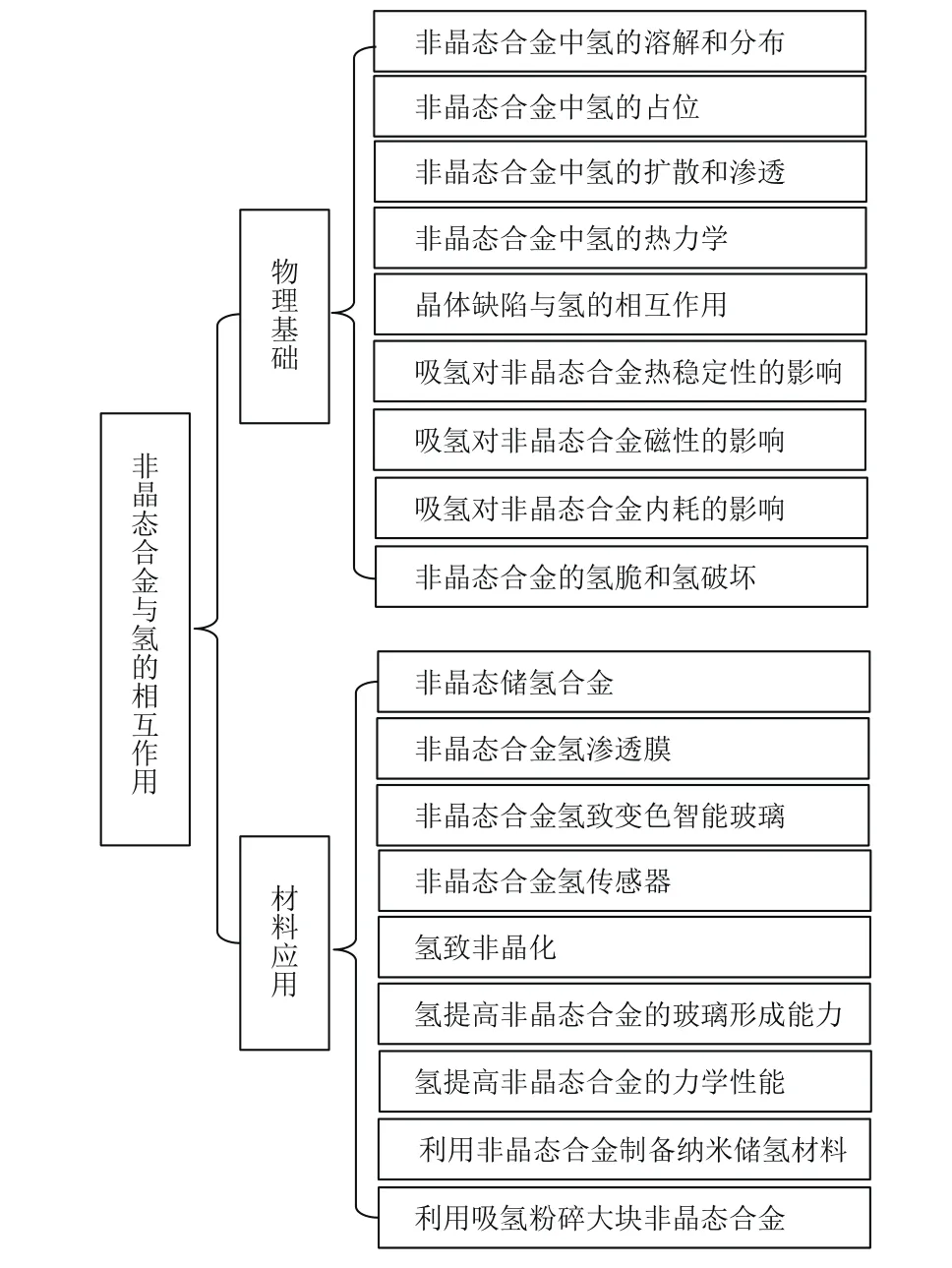
图1 非晶态合金与氢相互作用的物理基础和材料应用研究Fig.1.Physical fundamentals and materials applications on the interactions between hydrogen and amorphous alloys.
2 非晶态合金与氢相互作用的物理基础
2.1 非晶态合金的吸氢方式
非晶态合金的吸氢方式主要有气态吸氢和电化学吸氢两种,此外还有熔体吸氢、氢气氛下反应球磨等方法.气态吸氢(gaseous hydrogenation)是将材料置于氢气氛中,通过调节氢气压、温度和时间等参数进行吸氢,利用氢气压力的变化计算吸放氢量,此方法也称为体积法或者Sievert法,是实验室测试储氢性能的常用手段,为了防止非晶态合金发生晶化,温度要尽量低于非晶态合金的晶化温度.电化学吸氢(electrochemical hydrogenation)通常在室温进行,将材料置于碱液(如KOH)中,利用充放电对非晶态合金进行吸放氢,是块体非晶态合金吸氢的常用方法.熔体吸氢(melt hydrogenation)是在金属熔炼的过程中引入氢气气氛(通常为Ar和H2混合气),此过程中氢可以被溶解到熔融金属中,最后采用铜模吸铸、喷铸或甩带等方法制备非晶态合金的过程中,部分溶入的氢固溶在非晶态合金中[26].反应球磨吸氢(reactive ball milling hydrogenation),球磨法是制备非晶态合金粉末的常用手段[27],通过在氢气氛下进行球磨制备非晶态合金粉末,可使部分氢固溶入非晶态合金中.反应球磨法的设备和工艺简单,适合大规模制备.
2.2 氢在非晶态合金中的占位与迁移
2.2.1 非晶态合金中氢的溶解度和分布
非晶态合金中氢的溶解度和分布是一个重要的科学研究课题,特别对于非晶态储氢材料的开发有重要的指导价值.此外,对于研究氢与材料中缺陷的相互作用、利用氢作为探针来研究非晶态合金的原子结构、氢渗透膜材料的开发等也有重要意义.Kirchheim[7]对非晶态Pd77.5Cu6Si16.5和Ni49.9Pd31.8P18.3合金进行电化学吸氢,研究氢在非晶态合金中的溶解度和分布,发现非晶态合金中占据某特定能级的氢占位的密度呈高斯分布,如图2所示.氢占位的数目n(G)满足如下关系:
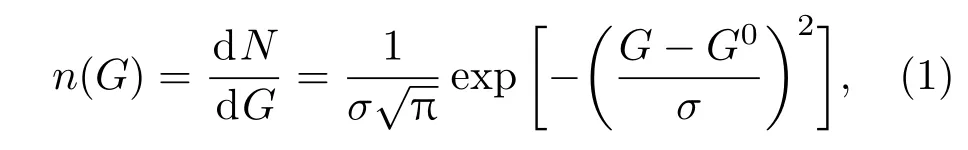
其中dN是处于能量为G、区间为dG内的可能氢占位的数目;Go是与标准状态相关的能量平均值;σ是高斯函数的宽度.由于每个能量对应数量有限的氢占位,氢在非晶态合金中满足费米-狄拉克分布:
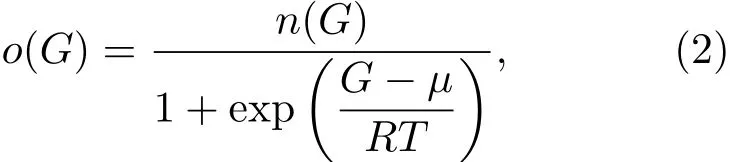
其中µ是氢的费米能(化学势).与计算金属中电子浓度的方法相似,非晶态合金中的氢浓度c可以通过以下关系得到:
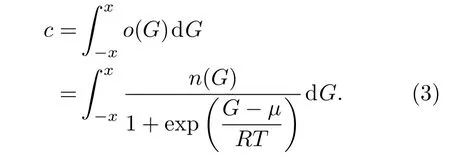

图2 (a)非晶态合金中氢的潜在轨迹,从参考状态的溶解需要自由焓G;(b)自由焓分布n(G),平衡位点e的氢占位o(G)服从费米-迪拉克统计[7]Fig.2.(a)Potential trace for hydrogen in an amorphous metal,where dissolution froMa reference state requires the free enthalpy G;(b)the distribution n(G)of the free enthalpy,the occupation o(G)of the equilibriuMsites e is governed by Fermi-Dirac statistics[7].
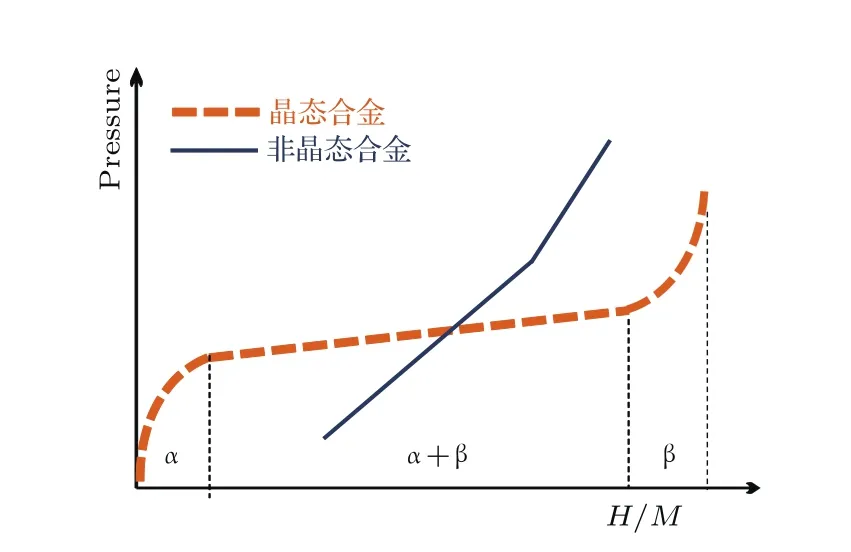
图3 典型晶态和非晶态合金的吸氢PCI曲线Fig.3. Typical hydrogenation PCI curves of crystalline and amorphous alloys.
氢进入非晶态合金后会优先占据低能级的占位,随着吸氢量的增加,氢逐渐占据非晶态合金中较高能量的占位,非晶态合金对氢的诱捕能力逐渐降低.PCI(pressure composition isotherm)性能是材料储氢性能的重要特性,通过PCI曲线可获得材料的氢溶解度(或储氢量)、吸放氢平台压力、焓变和熵变等参数.图3对比了典型晶态和非晶态合金的PCI曲线,对于晶态单相合金,在吸氢过程首先形成固溶体α相,随后形成氢化物β相,存在(α+β)两相共存区,根据吉布斯相率可知,两相共存区在PCI曲线上表现为平台.相对而言,非晶态合金通常在整个吸氢过程中只生成非晶态固溶体α相而不形成晶态氢化物β相,随着吸氢过程推移,氢在非晶态合金中的溶解度逐渐增加,PCI曲线类似斜直线.
2.2.2 非晶态合金中氢的占位
非晶态合金中氢的占位对其物理性质有着重要的影响.氢占位的数量、尺寸、类型和稳定性等对于氢在非晶态合金中的存在状态至关重要,与非晶态合金的储氢性能、氢渗透特性、氢脆等特性也关系密切.Harris等[28]分析了Ni-Zr,Pd-Ti和NiTi等非晶态合金体系在实验上测试得到的吸氢量,认为二元过渡金属基非晶态合金A1−xBx是同构的,氢占据了非晶态合金中的准四面体空位A4−nBn(n=4,3,2,...), 吸氢量满足以下关系:1.9(4n)Xn(1−x)4−n,其中(4n)=4!/n!(4−n)!,最大的吸氢量与温度、化学成分无关,非晶态合金的吸氢和晶态合金具有同一性,主要取决于非晶态合金中氢占位的类型、尺寸和数量.Fires等[29]利用穆斯堡尔谱(Mössbauer spectroscopy)和X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)研究了Zr76Fe24非晶态合金中氢的占位,发现氢在Zr76Fe24非晶态合金中的优先占位类似于氢在晶态ZrH2中的占位,对比吸氢五周后的样品与刚吸氢的样品的穆斯堡尔谱,发现它们几乎完全一致,说明氢在Zr76Fe24非晶态合金中的宏观扩散很慢,占位很稳定.
中子散射是研究材料中氢占位的重要手段,这是因为氢(1H)的中子相干散射长度为−0.3742×10−14m,并有十分明显的非相干散射,而氘(D或2H)的中子相干长度则为0.6674× 10−14m,非相干散射很弱.因此,可以对材料进行完全或部分氘化,利用中子散射精确地确定D原子的位置.Itoh等[30]利用中子散射比较研究了晶态和非晶态的TbFe2Dx的短程原子结构,研究表明晶态TbFe2合金和非晶态TbFe2Dx(x=3.0,2.0)氢化物的金属原子结构具有显著的差别.图4为通过中子散射得到的晶态TbFe2D3.8、非晶态TbFe2Dx的径向分布函数(radial distribution function,RDF(r)),以及非晶态TbFe2D3的原子结构图[31].如图所示,晶态的TbFe2D3.8的前三个峰分别属于Fe-D,Tb-D和D-D原子对,但是对于非晶态的TbFe2Dx,除了Tb-D和D-D原子对,还存在金属-金属相互关系.表1为通过RDF(r)计算得到的晶态TbFe2D3.8和非晶态TbFe2Dx的最近邻原子配位数和原子间距,结合以上分析可知,D原子占据了晶态TbFe2D3.8中的 (2Fe+2Tb)四面体间隙,而在非晶态TbFe2Dx中,D原子占据(4Tb),(3Tb+1Fe)和(2Fe+2Tb)三种四面体间隙,这表明某些非晶态合金的氢占位类型和数量比晶态合金更多.
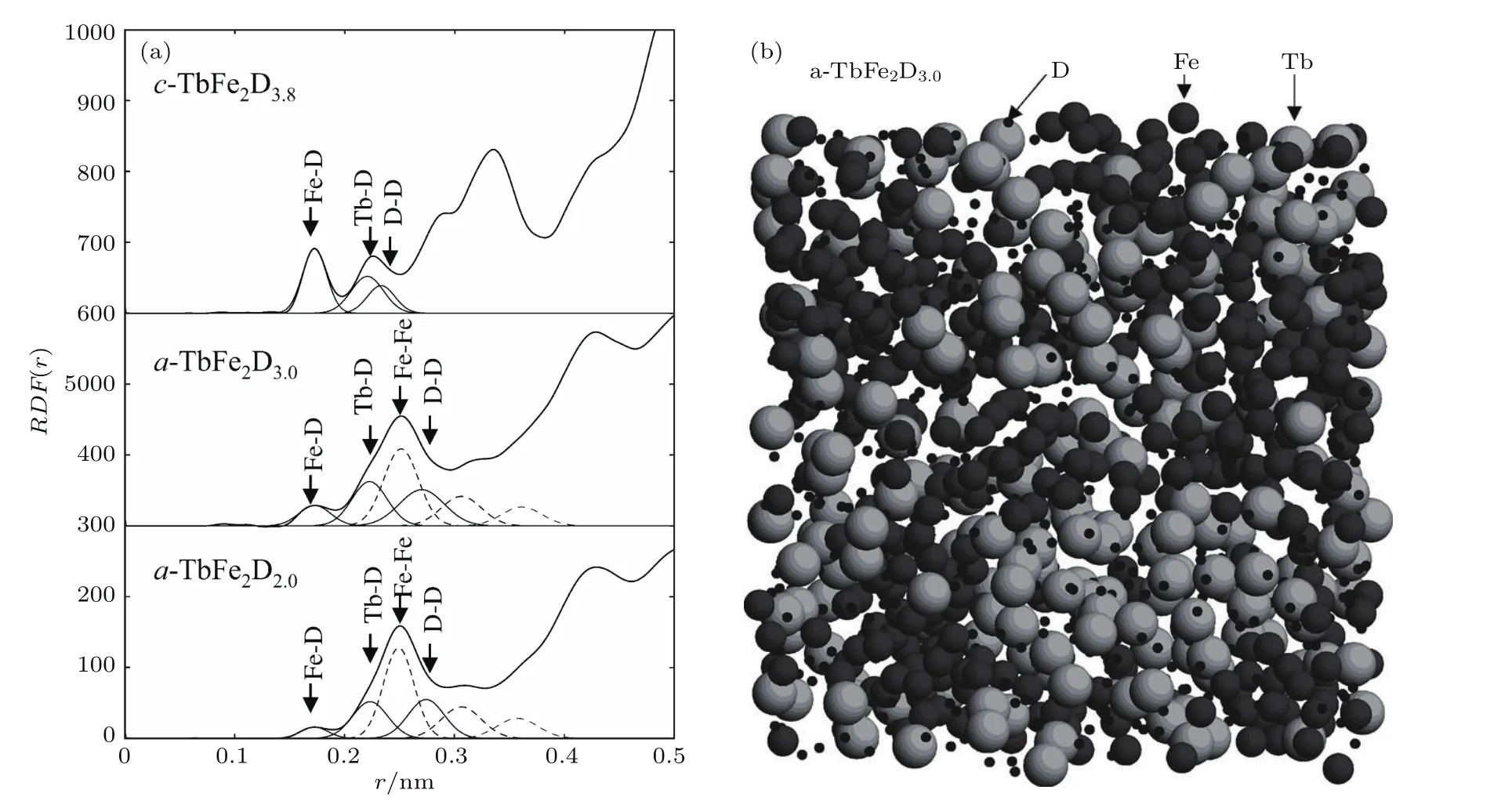
图4 (a)通过中子散射得到的晶态TbFe2D3.8、非晶态TbFe2Dx(x=3.0,2.0)的径向分布函数RDF(r);(b)非晶态TbFe2D3的原子结构图[31]Fig.4.(a)Radial distribution functions,RDF(r)derived froMneutron di ff raction for c-TbFe2D3.8and a-TbFe2Dx(x=3.0,2.0);(b)section froMa con fi guration for a-TbFe2D3.0[31].
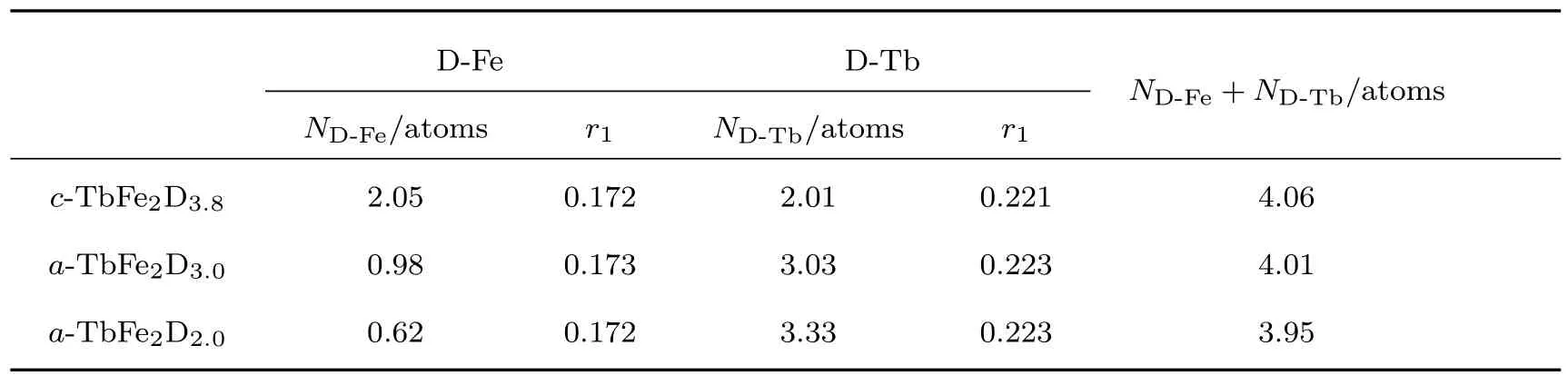
表1 晶态TbFe2D3.8、非晶态TbFe2Dx(x=3.0,2.0)的最近邻原子配位数Ni-j和原子间距r1[31]Table 1.Nearest neighbor coordination number Ni-j,and interatomic distances r1,in c-TbFe2D3.8and a-TbFe2Dx(x=0.3,0.2)[31].
2.2.3 非晶态合金中氢的扩散
材料中氢的扩散对材料的储氢动力学性能、氢提纯膜的效率、氢致变色智能的玻璃敏感系数等有着至关重要的影响.氢在晶态材料中的扩散系数D一般满足Arrhenius关系[32]:
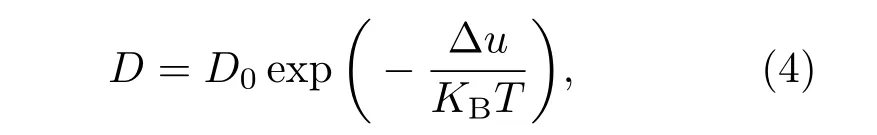
其中Δu为扩散激活能.而对于非晶态合金,通过Arrhenius公式拟合的氢扩散系数总会出现偏差,Eliaz等[33]认为出现偏差的原因在于温度对非晶态合金中的短程有序原子(short-range order,SRO)的影响,通过修正温度对最近邻原子和次近邻原子配位数的影响,计算得到的扩散激活能与实验观测的结果吻合.
晶态合金中的氢扩散系数D主要受温度影响,在小温度范围内,氢扩散系数的变化很小,并且与氢浓度无关[36],但是氢在非晶态合金中的扩散系数却与氢溶解度有十分密切的关系,图5(a)为非晶态和晶态Pd83Si17合金的扩散系数随着氢溶解度增加的变化[8,34],在氢溶解度很低(H/M<0.1)的情况下,随着氢溶解度增加,晶态Pd83Si17合金的氢扩散系数几乎不发生变化,但非晶态合金中氢的扩散系数却随着氢浓度的增加而呈指数递增.此外,非晶态合金的氢扩散系数还受温度影响,如图5(b)所示,氢扩散系数随温度增加而升高,在低温下,非晶态合金的氢扩散系数随着氢浓度增大而升高的速率比在高温下更快.
Kirchheim[35]研究了氢在Pd77.5Si16.5Cu6非晶态合金中的扩散,假定氢在非晶态合金中的占位密度满足高斯分布(方程(1)),在氢浓度c≪1的情况下,氢扩散系数DH随着氢浓度c的变化满足如下关系式:
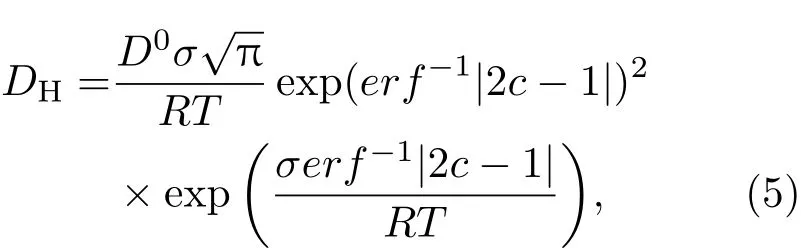
其中D0是氢在只含有G0能级占位的材料中的扩散系数,σ是高斯函数的宽度.通过计算得到的Pd77.5Si16.5Cu6非晶态合金中氢的扩散系数随着氢浓度的变化与实验观测相符合(图5(c)).由此可见,氢优先占据非晶态合金中低能级的占位,随着氢浓度继续增加,非晶态合金对氢的诱捕能力逐渐降低,氢扩散系数逐渐提高.
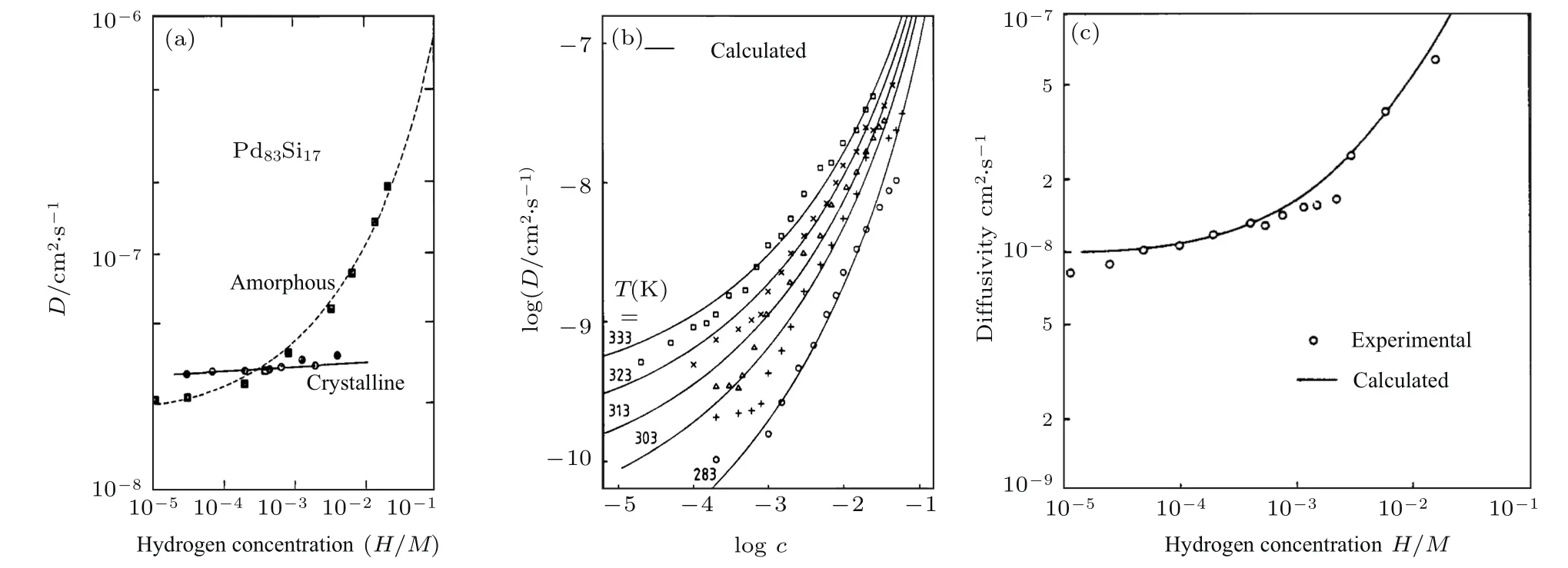
图5 氢扩散系数随着氢浓度的变化 (a)晶态和非晶态Pd83Si17合金在292 K的对比;(b)非晶态Pd80Si20合金在不同温度下的对比;(c)在295 K实验测得和计算得到的Pd77.5Si16.5Cu6非晶态合金[8,34,35]Fig.5.H-di ff usion coefficient as a function of H-concentration in:(a)Amorphous and crystalline Pd83Si17alloys at 292 K;(b)amorphous Pd80Si20alloy at various temperatures;(c)experimental and calculated data for amorphous Pd77.5Si16.5Cu6alloy at 295 K[8,34,35].
2.3 氢对非晶态合金物理性质的影响
2.3.1 氢对非晶态合金热稳定性的影响
氢与不同元素的亲和力、混合焓、结合能等差别很大,因此吸氢对不同非晶态合金(体系)热稳定性影响的差别也很大.根据文献报道,对于有些体系,吸氢可以降低非晶态合金(体系)的热稳定性,比如Cu50Ti40Al10[37],Zr76Fe24[29],Zr-Cu-Ni-Al[38]和TiCu等[39],这主要是由于Zr和Ti等元素和氢的亲和力强,吸氢会在非晶态合金基体上诱发相分离和晶化,以致生成ZrH2,TiH2等氢化物,形成纳米晶+非晶复合结构,导致非晶态合金的热稳定性降低.对于另外一些体系,吸氢也可提高非晶态合金(体系)的热稳定性,比如Mg67Ni28Pd5[40],Mg62Ni33Ca5[41],Zr-Ti-Cu-Ni-Be[42]和Mg-Ce-Ni[14]等. 对于Mg67Ni28Pd5非晶态合金,其晶化过程的第一阶段由Mg2Ni组成,吸氢之后,Pd和氢的亲和力最强,故氢优先和Pd原子结合,在晶化过程中,首先晶化生成Mg2Ni,随后氢从Pd中脱离与Mg2Ni结合形成Mg2NiH4,因而晶化完成温度提高了65 K.Mg62Ni33Ca5和Mg-Ce-Ni非晶体系也是类似的机理.而对Mg76Ni19Y5[43],Fe70B14Si7和Fe60Co25B15[44]等非晶态合金而言,吸氢对其热稳定性的影响不大.对此现象的微观机理仍不是很清楚,差示扫描(DSC)实验显示,吸氢会显著降低晶化热,可能是由于吸氢改变了非晶态合金的晶化路径.
除了体系不同造成的影响不同,随着吸氢温度和氢浓度的变化,氢对非晶态合金热稳定性的影响也不同.Li等[45]报道了吸氢对Zr60Al10Ni30非晶态合金热稳定性的影响,发现吸氢温度对非晶态合金的热稳定性有着重要的影响,吸氢后Zr60Al10Ni30非晶态合金的晶化温度Tx从约750 K降低至700 K以下,晶化温度随着吸氢温度的升高而有所提高.在较低的氢浓度条件下,吸氢会提高Zr60Al10Ni30非晶态合金的热稳定性,但是随着氢浓度提高,氢会促进非晶态合金发生晶化,特别是ZrH2氢化物的生成会显著地降低Zr60Al10Ni30非晶态合金的热稳定性.
2.3.2 氢对非晶态合金内耗的影响
吸氢会导致非晶态合金产生内耗峰(或称为非晶态氢峰),利用氢在非晶态合金中运动所反映出来的宏观内耗性质的变化规律,可以间接理解非晶态合金的微观原子结构[46,47].Hasegawa等[48,49]研究了添加Si,Ge和Pd对不同吸氢程度的非晶态Ti34Zr11Cu47Ni8合金内耗峰的影响,结果表明,对于纯非晶态合金,在吸氢量低于20 at.%的条件下,随着吸氢量的增加非晶态合金的内耗Q−1逐渐增加,非晶态(Ti34Zr11Cu47Ni8)98Si2合金和(Ti34Zr11Cu47Ni8)99Ge2合金的内耗峰远高于非晶态Ti34Zr11Cu47Ni8合金,吸氢14.4 at.%的非晶态(Ti34Zr11Cu47Ni8)98Si2合金的内耗高达4× 10−2,Si的引入会导致非晶态合金中应变各向异性的改变.值得一提的是,与吸氢后的非晶态Ti34Zr11Cu47Ni8合金相比,添加Pd与添加Si的结果截然不同,如图6(a)所示,随着吸氢量增加,添加Si的合金内耗逐渐增加,而添加Pd的合金则先增加后降低.由此可见,添加Si和Pd会降低导致非晶态合金内耗的氢占位能垒,特别是当Pd含量在低于几at.%的情况下,添加Pd会在非晶态合金中诱导出能量低于原来占位的新占位分布,而Pd含量继续增加则会引导另一种新的占位,后一种新占位并不影响原始非晶态Ti34Zr11Cu47Ni8合金中的氢占位分布.
2.3.3 氢对非晶态合金磁性的影响
吸氢可以改变非晶态合金的磁学性能,Coey等[50−52]研究了吸氢对Fe基Fe-Y非晶态合金磁性的影响,对Fe-Y非晶态合金利用电化学吸氢的方式使氢与金属的摩尔比达到3左右.磁性测试结果表明吸氢前的Fe-Y非晶态合金为散铁磁性,其自旋冻结温度低于100 K,而吸氢之后合金变成软铁磁性,居里温度达到400—500 K,吸氢处理使Fe-Y非晶态合金的铁磁矩由1.96µB增大至2.24µB.而富Fe的FexZr100−x非晶态合金为弱巡游电子铁磁性,吸氢后趋于转变为软铁磁性.吸氢处理对于Fe40Ni39Mo4B18非晶态合金的磁矩没有明显影响,但磁各向异性有所改变,软磁特性降低.

图6 非晶态Ti34Zr11Cu47Ni8合金及添加Si和Pd后的(a)内耗和(b)氢占位密度与其占位能量的关系曲线,maxEH为氢占位最高能量[48]Fig.6. (a)Internal friction peak as a function of hydrogen content and(b)hydrogen site distribution curve as a function of the hydrogen site energy normalized by the lowest site energy of Ti34Zr11Cu47Ni8-Pd hydrogenated glassy alloys[48].
氢致非晶化(Hydrogen-induced amorphourization,HIA)也会显著改变合金的磁性.Aoki等[53]研究了氢致非晶化对Laves相GdFe2合金磁性的影响,对于晶态GdFe2合金,在423 K下可吸氢生成晶态GdFe2H4.4,在423—523 K吸氢不发生歧化反应而是生成非晶态GdFe2H3.6.另外,也可以通过甩带法制备非晶态GdFe2再吸氢生成非晶态GdFe2H3.6.晶态GdFe2合金的居里温度为818 K,而晶态GdFe2H4.4的居里温度则剧烈地降低至107 K,氢致非晶化制备的非晶态GdFe2H3.6的居里温度为443 K,通过氢致非晶化和非晶态合金吸氢两种途径获得的非晶态氢化物均在300 K附近达到最大磁化强度.
2.4 非晶态合金的氢脆
氢脆是金属材料失效的一个重要原因,主要是由于氢分子在金属材料中发生聚集造成应力集中,最终导致材料的脆化甚至开裂[54],氢脆也是非晶态合金失效和破坏的重要原因[55].Jayalakshmi和Fleury[56]利用甩带法制备Zr基、Ni基和Ti基非晶态合金条带,通过电化学吸氢的方式进行不同程度的吸氢处理.由于Zr和Ti元素与氢有较强的亲和力,非晶态合金的吸氢动力学性能及最大吸氢量随着Zr和Ti元素含量的增加而有所提升.对不同吸氢程度的非晶态合金在室温下进行弯曲和拉伸测试,考察材料的断裂应变随着吸氢量增加的变化趋势,得到氢浓度与晶格体积膨胀的关系,如图7所示,有助于预测氢致非晶态合金的韧性-脆性转变.最先进入非晶态合金的氢优先占据能量较低的稳定位置,这些占位主要由与氢亲和力较高的元素组成(如Zr,Ti).随着吸氢量进一步增加,当材料中的氢浓度Hconc超过临界氢浓度Hcrit时,继续进入材料的氢开始占据较为不稳定的位置,这些占位的组成元素与氢的亲和力较弱,故此部分的氢处于不稳定的状态,导致材料很容易发生氢脆.另外,当晶格体积膨胀率Δd/d≥1.2时,金属原子间的吸引力显著弱化,此时也容易发生严重的氢脆.

图7 氢浓度与晶格体积膨胀率的关系[56]Fig.7.Proposed map of hydrogen concentration versus dilatation as an aid to predict the ductile-to-brittle transition in amorphous alloys[56].
3 非晶态合金与氢相互作用相关的材料和应用
3.1 非晶态储氢合金
3.1.1 非晶态储氢合金的研究背景
氢能被认为是有可能替代传统化石燃料的清洁能源,实现氢能源应用的发展目标,解决储氢材料和技术是我们面临的一大挑战[57].储氢合金由于具有高安全性、高储氢密度、良好可逆性等优势而被认为是解决氢能存储的一个重要途径[58].对储氢合金的研究主要起源于20世纪70年代的能源危机,典型的代表有荷兰菲利普实验室发明的AB5型LaNi5合金[59].早期的储氢合金,如LaNi5[59],TiFe等[60],可以在室温附近吸放氢,吸放氢动力学性能较快,但储氢容量通常小于2.5 wt.%,且在吸放氢过程经常发生粉化,因此研究人员开始关注非晶态合金的储氢性能.这主要是基于以下几方面的考虑:1)非晶态合金在吸放氢过程产生的应力应变较小,因此吸放氢循环稳定性较晶态合金有优势[12];2)非晶态合金中存在很多类似晶体材料的“缺陷”,因而可能提供更多的氢占位而具有更高的储氢量;3)非晶态原子存在多种玻璃态的转变,这种转变能够为氢占位提供更多潜在的可能性;4)有些合金体系的玻璃形成范围很宽,有利于材料化学成分的设计,因此储氢性能有较大的可调控性.表2列举了一些典型的非晶态合金及其晶态合金的储氢量对比,由表可见,非晶态合金的储氢量可能高于也可能低于其晶态合金.关于非晶态储氢合金的研究可大致分为两个阶段:一是1970年代至1990年代,这个时期主要以Zr基、Ti基等过渡金属基非晶态合金为研究对象;二是1990年代至今,主要的研究对象为Mg基非晶态储氢合金.
表2 一些典型的非晶态合金及其晶态合金的储氢量对比Table 2.Hydrogen storage properties of several amorphous and crystalline alloys.
3.1.2 过渡金属基非晶态储氢合金(1970年代—1990年代)
20世纪80年代,甩带法(melt spinning)的发明极大地促进了非晶态合金的发展,随后Zr基、Ti基、Pd基等过渡金属基非晶态合金逐渐得到开发,并被证明具有一定的储氢能力.Mealand等[61]比较研究了晶态和非晶态的TiCu合金和ZrCu合金的储氢性能,结果表明非晶态的TiCu合金吸氢得到非晶态的氢化物TiCuH1.35,相比较晶态合金吸氢后形成的TiCuH,吸氢量提高了35%.类似的现象在Pd-Si非晶态合金体系也存在,这证明了非晶态合金在储氢性能较晶态合金的潜在优势.但同时也有很多研究指出非晶态合金的储氢容量并不一定高于其晶态合金,如Hf-Ni,Zr-Ni等非晶态合金体系的储氢量就低于其晶态合金[63].
Ciureanu等[64]研究了非晶态Ni64Zr36合金的电化学储氢特性,结果表明氢原子占据非晶态合金中的四面体间隙位置Zr4和NiZr3,在长时间充放电循环后,循环伏安图中出现了几个新的阳极极值,是由于占据低能四面体间隙位置的氢原子被氧化的结果.随着合金中的氢浓度从2.65 at.%增加至6.36 at.%,合金中的氢扩散系数从约2.2× 10−14m2/s逐渐增大至4.3×10−14m2/s,结果与Kirchheim[8]提出的氢占位分布模型一致.Li等[45]研究了具有宽过冷液相区(约50°C)的非晶态Zr60Al10Ni30合金的储氢性能,结果表明非晶态Zr60Al10Ni30合金的吸氢量可以达到H/M=0.94—1.13.随着吸氢量的增加,非晶态合金中的低能占位逐渐被占满,继续吸附的氢原子只能占据能量更高的间隙,导致金属原子趋于形成更稳定的短程有序的ZrH2,在宏观上表现为非晶态合金的热稳定性发生很大变化.
为了得到较高储氢量(H/M>0.5),过渡金属基非晶态储氢合金必须富含易吸氢的元素,如Zr,Ti,Pd等.尽管如此,过渡金属基非晶态储氢合金的重量储氢密度通常低于2 wt.%,无法满足高容量储氢材料的要求.另一方面,Zr,Ti等与氢结合力强的元素的含量过高会导致脱氢的困难,这对吸放氢的循环性能也是一个很大的挑战,因此将过渡金属基非晶态合金作为储氢材料的研究热度逐渐降温.值得关注的是,过渡金属基非晶态合金的晶化温度高(400—700°C),Ta基非晶态合金的晶化温度甚至接近1000°C,适合在高温条件下工作,所以在氢渗透合金膜领域有广阔的应用前景.
3.1.3 Mg基非晶态储氢合金(1990年代至今)
金属Mg的资源丰富,且其储氢密度高达7.6 wt.%,因此被认为是一类具有巨大应用前景的储氢材料[65].但是其储氢动力学较缓慢,且放氢热力学性能过于稳定而无法在较低温度下脱氢.因此,研究人员开始探讨Mg基非晶态合金作为储氢材料的可能.20世纪90年代日本东北大学的Inoue研究组利用甩带法制备了Mg-RE-Ni(RE为稀土元素)非晶态合金[66],极大地促进了镁基非晶态储氢合金的研究[67−70].Spassov等[67,68]通过甩带法制备Mg-RE-Ni(RE为Y,La或Mm等稀土元素)非晶态合金,并研究其电化学吸氢特性,发现Mg75Ni20Mm5非晶态合金吸氢量可达到约4 wt.%,10 min内可快速吸氢达到3 wt.%.Lei等[71]研究了Mg50Ni50−x−yMxNy(M,N 为Co,Al或Si)非晶态合金的电化学储氢特性,结果表明Mg基非晶态合金很容易活化,电化学容量高,非晶态Mg50Ni10合金的储氢量达500 mA.h/g,约是晶态合金的10倍.但是Mg在碱性溶液中易被氧化,循环性能较差,其容量的循环衰退达到每循环(10—60)mA.h/g.Liu等[72]通过高能球磨制备MgxNi100−x(10<x<90)晶态和非晶态合金,结果表明当30<x<60时,球磨120 h可以得到非晶态合金,只有非晶态合金能够在室温下可逆吸放氢,当45<x<50时,室温下的储氢容量约350 mA.h/g.Huang等[73]报道了一种利用Ag负载石墨烯包覆提高Mg-La-Ni非晶态合金电化学储氢性能的方法.通过复合0.2 wt.%的Ag负载石墨烯,非晶态Mg65Ni27La8合金的放电容量可高达814.8 mA.h/g,50次循环后的容量保持率为75%.可见表面修饰可以改善Mg基非晶态合金的抗氧化性和抗腐蚀性,从而提高其电化学储氢循环稳定性.值得一提的是Mg基非晶态合金吸氢后通常会发生晶化或部分晶化,调控晶化过程可以控制晶粒尺寸,提高吸放氢动力学性能,但实际储氢的媒介是MgH2或Mg2NiH4等氢化物.
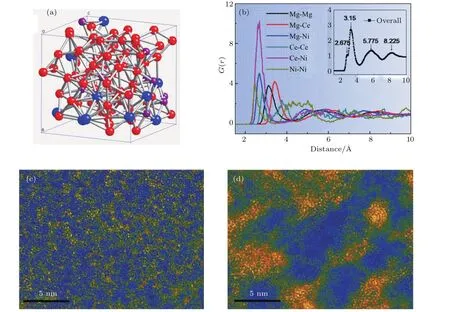
图8 (a),(b)Mg80Ce10Ni10非晶态合金的原子结构图和双体分布函数PDF,插图是RDF;(c),(d)Mg80Ce10Ni10非晶态合金在吸氢前后的STEM图[14]Fig.8.(a)Atomic structure and(b)PDF of the Mg80Ce10Ni10amorphous alloy,the inset shows the RDF of the Mg80Ce10Ni10amorphous alloy;HAADF-STEMimages of Mg80Ce10Ni10amorphous alloy(c)before and(d)after hydrogenation[14].
Lin等[74]比较研究了晶态、纳米晶和非晶态Mg-Ce-Ni合金的气态储氢性能,尽管它们在室温下的吸氢量仅为0.2 wt.%0.4 wt.%,非晶态结构对于储氢性能仍然具有明显的优势.随着非晶态合金中Mg含量的增加,吸氢量也呈现上升趋势,Mg90Ce5Ni5非晶态合金的吸氢量是其晶态合金的两倍.与室温相比,Mg-Ce-Ni非晶态合金在120°C可以吸氢达到5 wt.%,并高于同成分的晶态合金[14],XRD(X-ray di ff raction)和XPS结果表明随着吸氢量的增加,非晶态合金逐渐转变为非晶态氢化物,结合第一性原理计算模拟和HAADF-STEM(high angle annular dark fi eld scanning transmission electron microscopy)揭示了非晶态合金氢化形成的非晶态氢化物的原子结构变化.如图8(a)和图8(b)所示,由于Ce-Ni原子的混合焓远低于Ce-Mg原子和Mg-Ni原子的混合焓而发生强烈聚集,Mg-Ce-Ni非晶态合金形成富Ce-Ni原子团簇和富Mg原子团簇两种非晶态结构.吸氢后富Ce-Ni原子团簇增大,平均尺寸由3 nm增至17.5 nm(图8(c)和图8(d)).另外,非晶态氢化物的脱氢温度还随着合金化元素与氢的混合焓降低而降低.由于吸氢可能会导致非晶态合金发生相分离[75,76],这对于吸放氢的循环可逆性造成不利的影响,如何抑制吸氢过程中非晶态合金的相分离是一个重要的研究课题.另外,值得一提的是某些超细纳米晶合金(<1—5 nm)与非晶态合金的原子结构很难区分[77],甚至在机械球磨过程中晶态和非晶态还可以发生交替转变[78],因此如何判定纳米晶与非晶态存在一定的争议.
3.2 非晶态合金氢功能膜
3.2.1 非晶态合金氢渗透膜
氢渗透膜是一种重要的氢气提纯材料,由于氢在金属Pd中的扩散很快,传统的氢渗透金属膜主要是Pd基合金[36],后来研究人员又开发了晶态的V基、Ni-Nb基等合金渗透膜[79],以及非晶态合金氢渗透膜.非晶态合金膜具有诸多优点而被认为是可以取代Pd基合金的新一代氢提纯材料[18,79,80]:1)非晶态合金氢渗透膜一般用Zr,Ni,Nb,Cu,Al等相对廉价的金属制备,制备工艺成熟,成本远低于Pd基合金;2)非晶态合金膜的氢渗透性能较好,已经接近Pd合金膜,可以满足工业生产的需求;3)非晶结构可以在某种程度上抑制晶态氢化物的形成,因此有较好的抗氢脆性;4)由于主要由过渡金属组成,非晶态合金的晶化温度较高,可以在较高的温度条件下工作(>400°C[81]).
影响合金膜氢渗透性能的关键因素主要包括氢渗透系数、氢扩散系数、氢溶解度和抗氢脆性等,其中氢渗透率是最重要的一个参数,表3列举了一些优异的非晶态合金膜的气态氢渗透率.由表3可知,某些非晶态合金的氢渗透率可以与Pd合金媲美,Ni-Nb基非晶态合金的氢渗透率与Pd合金基本上在同一数量级,非晶态Ni60Nb30Ta10合金的氢渗透率甚至接近Pd60Cu40合金的两倍[82].另外,通过表面改性还可以进一步提高非晶态合金的氢渗透特性[83].
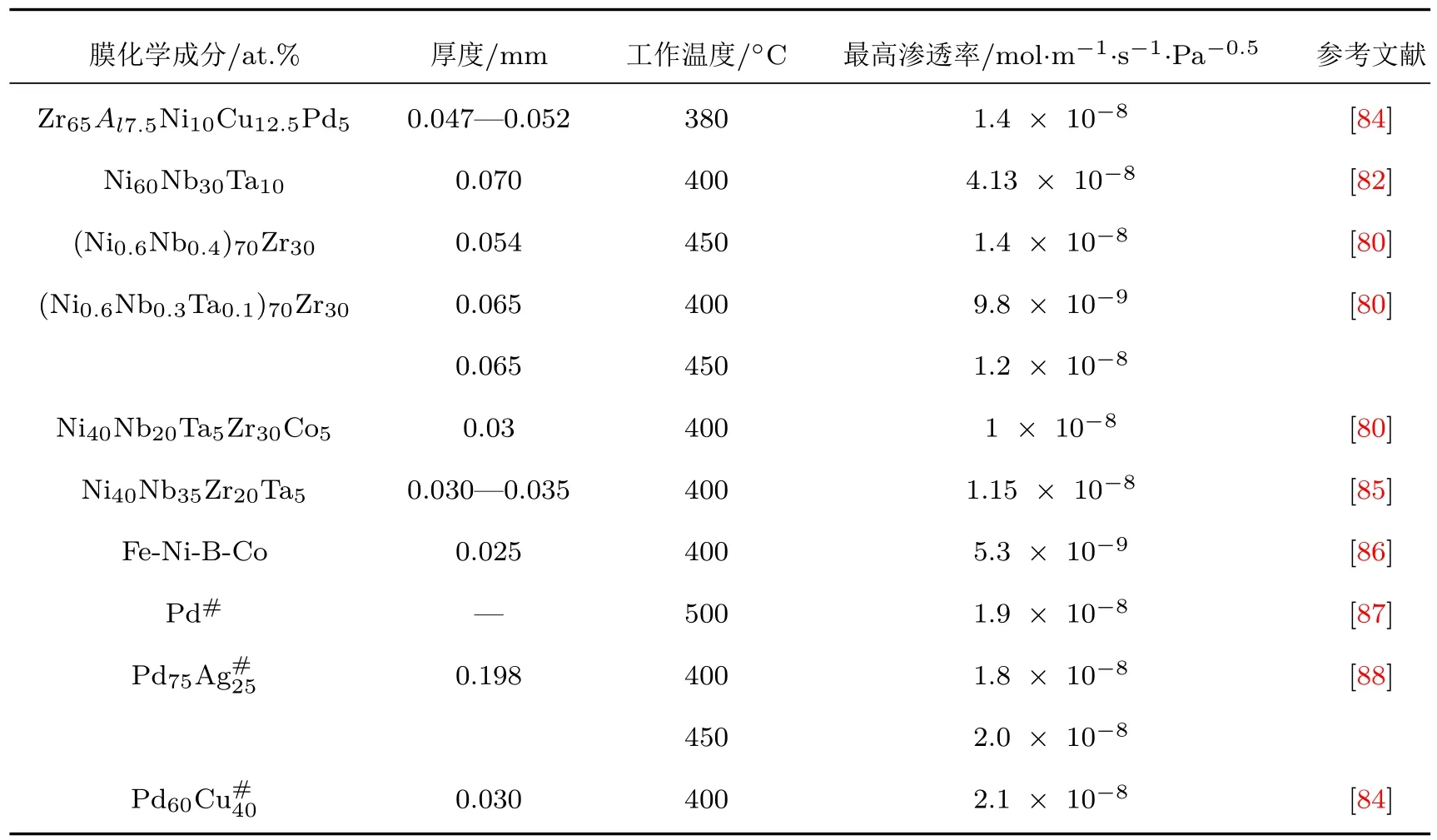
表3 一些优良的非晶态合金氢渗透膜的气态氢渗透特性Table 3.Gaseous hydrogen permeability of several excellent amorphous alloy membranes.
3.2.2 氢致变色非晶态合金膜
金属吸氢成为氢化物的过程是一种从导体转变为半导体的物理过程,利用此特性可制备氢致变色智能玻璃[19].Zhao等[22]利用共溅射法制备非晶态MgNi0.03,MgNi0.09,MgNi0.21和MgNi0.29合金薄膜.随着Ni的比例由0.03上升至0.29,薄膜在可见光范围内的最大透射率由31%降低为17.2%,同时透射曲线的吸收边逐渐向红光方向移动,禁带宽度变窄.MgNi0.09的响应时间最短,加氢和脱氢分别只需26 s和22 min,与非晶态Mg薄膜的110 s和85 min相比,分别缩短了76.4%和74.1%.薄膜氢致光电转变过程的控速步骤由晶态时的氢原子扩散过程变为非晶态时的氢化物反应过程,非晶态Mg-Ni合金薄膜的响应时间约为晶态Mg-Ni合金薄膜的十分之一,表明非晶态薄膜的加氢动力学性能远优于晶态薄膜.利用Mg2Ni/Mg2NiH4转变的氢致变色效应可以制备光敏传感器原件,Victoria等[21]通过磁控溅射的方法制备一系列Mg-Ni-Zr合金薄膜,调控非晶态Ni-Zr中间合金的含量制备不同化学成分和结构的Mg-Ni-Zr合金,改变其与Mg2NiH4的相互作用,进而改善其氢致变色性能.图9的PTIs曲线(pressure-optical transmission isotherms)表明通过非晶化可以大幅度提高Mg-Ni-Zr非晶态合金薄膜的光学敏感性,这主要是由于氢在非晶态合金中的扩散系数远高于晶态合金,同时非晶态合金在吸放氢过程不存在两相共存而具有更高的敏感系数.
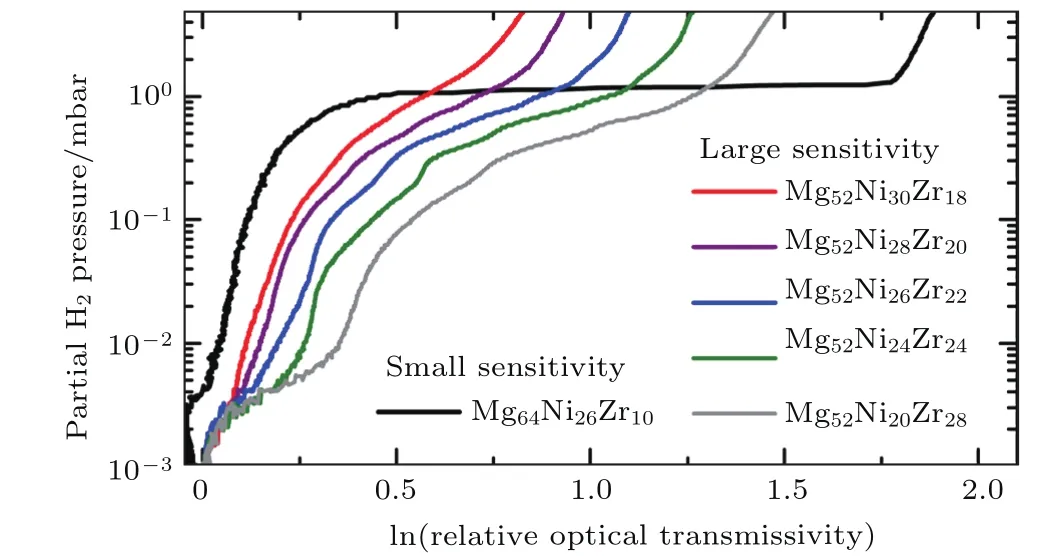
图9 非晶态Mg-Ni-Zr合金体系的PTIs曲线[21]Fig.9.PTIs of selected amorphous and crystalline Mg-Ni-Zr compositions[21].
3.2.3 非晶态合金氢传感器
利用吸、放氢过程中非晶态合金的电敏、光敏感特性变化,非晶态合金还可以作为氢传感器材料.非晶态合金作为氢传感器的重要优势在于对氢的敏感性强,氢扩散快,且在吸放氢过程中不容易生产晶态氢化物.Nakano等[89]报道了吸氢对Mg90Pd10非晶态合金电阻的影响,发现随着吸氢量的增加电阻增加,反之亦然.另外,作者还将Mg90Pd10非晶态合金置于溶解氢的水环境中,研究其在液体环境中的氢敏感性,发现置于氢溶解度分别为0.555和1.170 ppm的水中300 s后,合金的电阻分别提高至原来的1.152和1.476倍.这表明Mg90Pd10非晶态合金可以作为氢传感器材料,并且适合在水溶液环境中工作.
3.3 氢对非晶态合金性能的积极影响
3.3.1 氢提升非晶态合金的塑性
氢除了会使非晶态合金发生氢脆和破坏,氢也可以对非晶态合金产生积极的影响.材料的吸氢可看成是一种合金化的过程,氢作为合金化元素,当氢含量处于一定合适的范围内可以提高非晶态合金的塑性[24,90].Dong等[24]在氢气氛(Ar+H2混合气)下熔炼和吸铸Zr57Al10Cu15.4Ni12.6Nb5(Vit106)和Zr55Cu30Ni5Al10(Zr55)合金,结果表明经过熔体吸氢处理之后的非晶态合金比起在纯Ar气氛吸铸制备的合金在室温具有更高的塑性.如图10所示,通过改变Ar+H2混合气中H2的比例从5%逐渐增加到30%,两种非晶态合金的压缩塑性得到不同程度的增强.在纯Ar气氛吸铸得到的非晶态合金的塑性应变仅约1%,吸氢之后塑性应变显著地增加至约10%.通过对断裂截面的分析可知,在纯Ar气氛吸铸得到的非晶态合金在断口附近只有少量的主剪切带,剪切带的间距约300µm,而经过氢微合金化之后断口附近产生了大量的主剪切带和次剪切带,剪切带的间距也降低至约50µm.通过DSC结果分析可知,通过吸氢处理制备的非晶态合金的自由体积有所增加,可见适度的氢合金化是提高非晶态合金塑性的一条有效的途径.
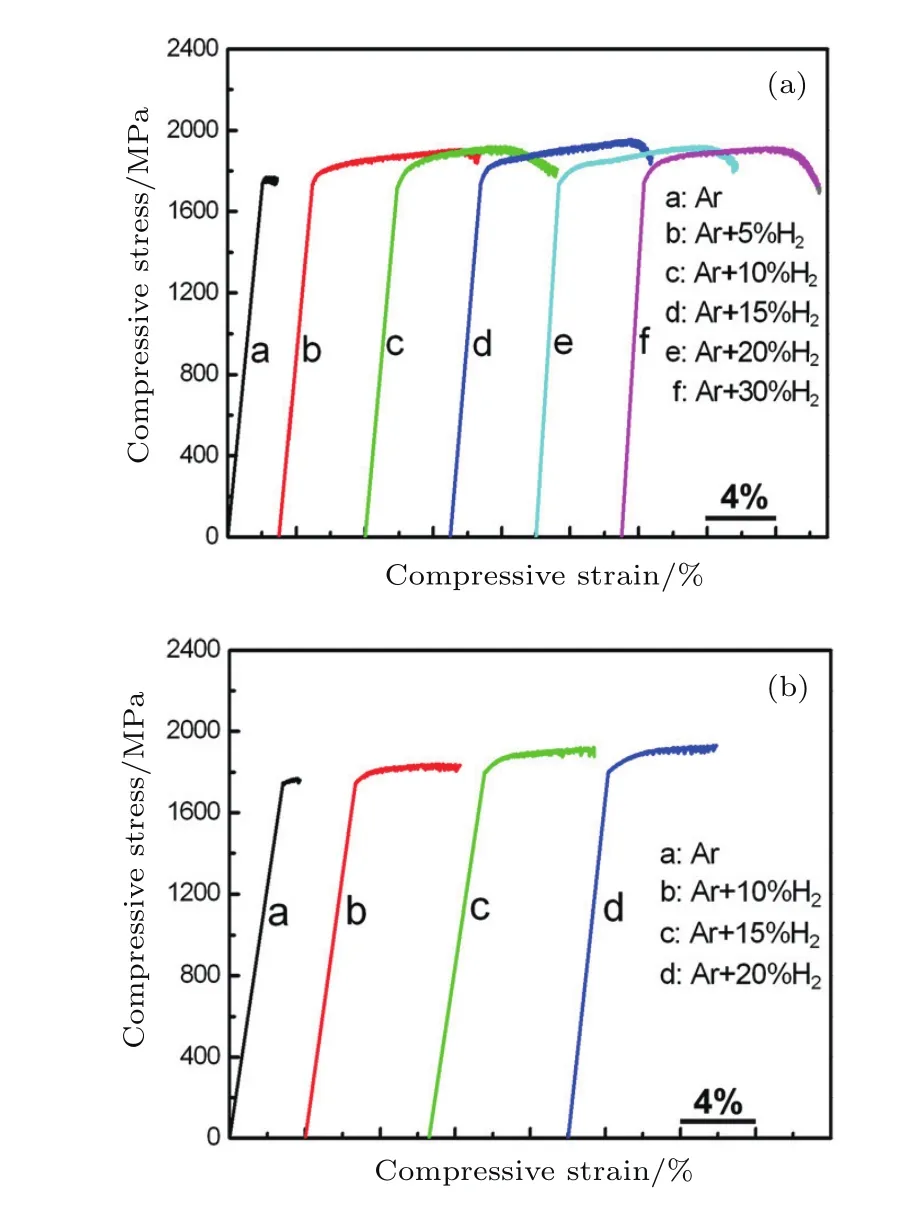
图10 不同气氛条件吸铸制备的(a)Vit106和(b)Zr55非晶态合金的压缩应力-应变曲线[24]Fig.10.Stress-strain curves of Vit106alloy(a)prepared under Ar+x%H2(x=0–30)atmospheres,and Zr55alloy(b)prepared under Ar+x%H2(x=0–30)atmospheres[24].
3.3.2 氢提高非晶态合金的玻璃形成能力
吸氢还可以提高非晶态合金的玻璃形成能力(glass forming ability,GFA),在实验上表现为临界玻璃形成尺寸的增加,通过吸氢处理可以制备更大尺寸的块体非晶态合金.Su等[26]发现通过适量的吸氢可以提高Zr基非晶态合金的玻璃形成能力,如表4所列,在Ar气氛吸铸的Zr55Cu30Ni5Al10非晶态合金的临界尺寸为4 mm,随着Ar气氛中H2含量的由5%增加20%,Zr55Cu30Ni5Al10非晶态合金的临界尺寸dc逐渐增大至8 mm随后回落至5 mm.另外,玻璃化转变温度Tg也随着吸氢而有所提高.Granata等[91]研究了氢微合金化对Zr基非晶态合金玻璃形成能力的影响,比较研究了Zr64Cu24Al12(Zr64)和Zr66Cu22Al12(Zr66)两个非晶态合金在Ar气氛和95%Ar+5%H2混合气氛的玻璃形成能力,随着在Ar气氛种添加5%的H2,Zr64和Zr66非晶态合金的临界形成半径dc由5.1 mm和2.8 mm分别增大至6.8 mm和4.9 mm.Zr和Pd等金属原子与氢有强的亲和力,引入氢可以提高非晶态合金中无序原子的紧凑度,降低松散原子团簇的密度,因此吸氢可以提高非晶态合金的玻璃形成能力.
Mahjoub等[92]利用第一性原理计算分析氢微合金化提高Zr64Cu22Al12非晶态合金玻璃形成能力的微观机理,计算模拟了吸氢前后非晶态合金的原子结构、电子结构、化学键和原子扩散等,发现在熔点附近添加氢会降低合金中二十面体的数量,进而导致玻璃形成能力的降低,但是氢的引入同时也显著地降低了组成元素的移动扩散能力,总体而言,动力学的放缓是主要的因素,因此综合的结果使得合金玻璃形成能力提升.另外氢还能增强离子性并促进局部结构中的异质性,降低非晶态合金中无序原子的填充密度,最终导致非晶态合金的压缩塑性的提升.吸氢处理是提升非晶态合金玻璃形成能力的一条新型有效的途径,氢微合金化是设计金属玻璃成分的一条有效途径[25].
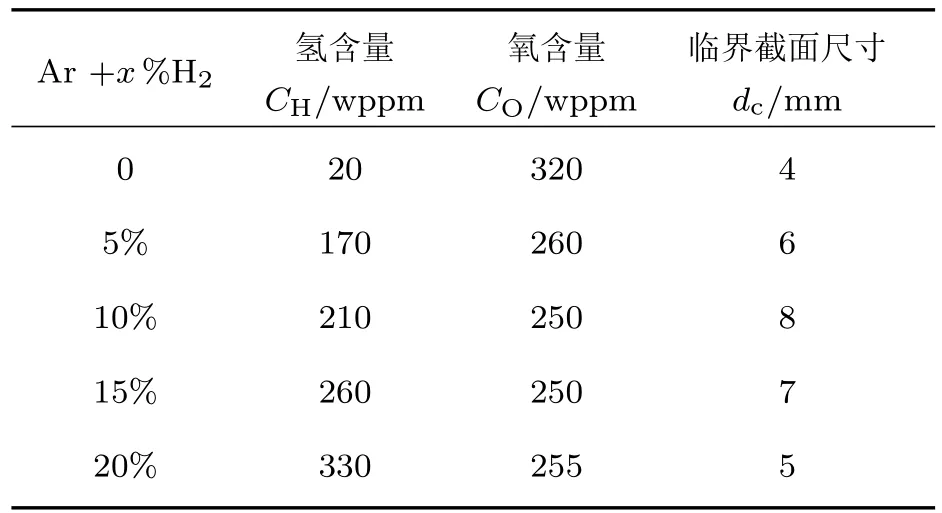
表4 不同氢气氛下熔炼的Zr55Cu30Ni5Al10合金的氢含量CH,氧含量CO和临界截面尺寸dc[26]Table 4. Hydrogen content CH,oxygen content COand critical section sizes dcof Zr55Cu30Ni5Al10amorphous alloys prepared under Ar+x%H2atmospheres[26].
3.4 其 他
3.4.1 氢致非晶化
20世纪80年代初,非晶态合金的制备工艺主要有两种:快速冷却金属液体及沉积金属气体,这两种工艺对于制备大块、大量非晶态合金存在很大的局限性,加州理工学院的Johnson等[93]首先发现通过对晶态合金进行吸氢处理可以得到非晶态氢化物,也称为“氢致非晶化”.研究表明晶态的Zr3Rh合金在吸氢之后可以形成非晶态的氢化物Zr3RhH5.5.晶态Zr3Rh合金也可以通过快淬处理转变为非晶态合金,随后进行吸氢处理也可以得到非晶态的Zr3RhH5.5,两种途径制备的非晶态Zr3RhH5.5的约化径向分布函数、密度和超导转变温度等都几乎完全一致.随后,Aoki等[94−97]对氢致非晶化做了大量研究,他们发现具有C15型Laves相的RM2(R为稀土元素,M为Fe,Co等过渡金属元素)在400—500 K吸氢可以得到非晶态的RM2Hx.氢致非晶化不只受到晶体结构的影响,还受到原子半径比的影响,只有当Goldschmidt原子半径比值rA/rB≥1.37时才能产生氢致非晶化[96].Zhang等[98]研究了添加Mg对Sm2−xMgxNi4合金氢致非晶化的影响,发现当Mg的添加量x为0,0.25,0.5时可以发生氢致非晶化,Sm1.25Mg0.75Ni4合金可以可逆吸放氢而不发生氢致非晶化,Sm2−xMgxNi4合金体系发生氢致非晶化的临界原子半径比rA/rB略大于1.37.
3.4.2 利用非晶态合金作为前驱体制备纳米复合储氢材料
利用非晶态合金作为前驱体,进行吸氢、氧化等后处理是一条有效的制备纳米复合储氢材料的途径.研究表明利用非晶态合金作为前驱体容易得到颗粒细小、分布均匀的纳米材料,能够缩短氢扩散路径,原位生成活性催化相、提高催化特性,从而大幅度提高储氢材料的吸放氢动力学性能[99−101].Lin等[101]发现通过控制吸氢工艺的参数,如温度、压力和时间等,可以调控Mg基纳米复合材料的储氢性能,随着活化温度的降低、活化压力的增加,得到的氢化物的晶粒尺寸显著细化,在10 MPa氢气压和220°C下,经过3 h的吸氢可以得到晶粒尺寸低于10 nm的氢化物复合物,并且在随后的吸放氢循环中,通过活化得到最细的复合物一直保持最小的晶粒尺寸,这主要是由于弥散均匀细小的纳米复合组织可以阻碍Mg基氢化物基体相在吸放氢过程中的晶粒长大.将非晶态Mg-Ce-Ni合金作为前驱体,利用吸氢和氧化处理还可以在MgH2基体上原位制备具有共生结构的CeH2.73/CeO2纳米催化相[102].如图11所示,首先对非晶态Mg-Ce-Ni合金进行吸氢处理得到MgH2-Mg2NiH4-CeH2.73氢化物复合物,随后在空气中进行可控的氧化物得到MgH2-Mg2NiH4-CeH2.73/CeO2纳米复合材料,显著地降低MgH2的脱氢温度.通过透射电子显微镜(TEM),HRTEM和FFT(fast Fourier transform)分析可知CeH2.73和CeO2是具有立方-立方关系的纳米共生相,结合原位脱氢HRTEM和第一性原理计算可知,CeH2.73和CeO2共生界面处的自发脱氢效应是实现高效催化的重要原因.

图11 (a)—(c)对应Mg80Ce10Ni10非晶态合金、MgH2-Mg2NiH4-CeH2.73和MgH2-Mg2NiH4-CeH2.73/CeO2纳米复合物的XRD和BSEM图;(d)—(f)CeH2.73/CeO2纳米共生相的TEM和HRTEM图;(g),(h)分别为CeH2.73和CeO2的FFT谱[102]Fig.11.(a)–(c)XRD patterns and BSEMimages of amorphous Mg80Ce10Ni10alloy,MgH2-Mg2NiH4-CeH2.73and MgH2-Mg2NiH4-CeH2.73/CeO2nanocomposites,respectively;(d)–(f)TEMand HTEMimages showing the symbiotic CeH2.73/CeO2nanoparticle;(g),(h)are the corresponding FFT patterns of CeH2.73and CeO2[102].
3.4.3 吸氢粉碎大块非晶态合金
Maeland和Libowitz[103]报道了利用吸氢破坏块体非晶态合金来制备非晶态合金粉末.首先利用甩带法制备非晶态合金,包括Fe84B16,Ni45Co20Cr10Fe5Mo4B16,Fe40Ni40P14B16,Fe83P16.5Si0.5,Fe40Ni38Mo4B18,Co60Fe7.5Ni7.5Mo2Si8 B15和CuTi等非晶态合金,接着在室温和12—15 MPa气氛条件下对非晶态合金进行吸氢处理1—6 h,吸氢处理之后合金发生膨胀甚至破碎,最后对非晶态氢化物粉末进行真空处理.除了氢在CuTi非晶态合金中非常稳定而不容易脱附,其他的合金在真空处理之后均可得到不含氢具有不规则形状的非晶态合金粉末,粉末的表面光滑干净,颗粒尺寸大体上小于200µm.可见通过吸氢来破坏块体非晶态合金,随后进行真空处理来制备非晶态合金粉末是一条独特的途径.
4 结论与展望
本文综述了非晶态合金和氢相互作用的研究进展,讨论了非晶态合金中氢的溶解度、分布、占位和扩散等相关物理化学问题,分析了氢对非晶态合金的热稳定性、磁性、内耗、氢脆等的影响,对非晶态合金和氢相互作用相关的材料应用研究进展进行简述.总结已有的进展,我们认为关非晶态合金和氢相互作用的研究在以下几方面应该继续探索和加强研究.
1)吸氢可以改变非晶态合金的热稳定性、内耗、磁性等特性,这些物理现象背后的微观机制很复杂,未来还需要大量的研究来加深理解.
2)非晶态合金的微观原子结构仍是未解之谜,借助内耗测试、中子散射、核磁共振等手段研究氢在非晶态合金中的状态,可以间接理解非晶态合金的无序原子结构,氢具有很强的敏感性,借助氢来研究非晶态合金的微观结构在不久的将来可能会取得较大的突破.
3)随着非晶态合金体系越来越多的发明,非晶态合金在储氢材料、氢渗透膜、氢传感器、氢致变色智能玻璃等领域必然有着越来越广泛的应用.
4)除了提高非晶态合金的塑性和玻璃形成能力,氢合金化对非晶态合金力学性能和功能性等方面还有很多潜在的积极影响,设计巧妙的吸氢方式以及调控非晶态合金中氢的状态可能是未来发展的方向.
5)利用非晶态合金作为前驱体可控地制备纳米颗粒,如氢化物、氧化物等,这种多相复合策略在储氢、储能、催化、化工等领域有着广阔的应用前景,应当进一步积极拓展.
[1]Klement W,Willens R H,Duwez P L 1960 Nature 187 869
[2]Inoue A,Takeuchi A 2011 Acta Mater.59 2243
[3]Wang W H 2011 Physics 40 701(in Chinese)[汪卫华2011物理40 701]
[4]Wang W H,Dong C,Shek C H 2004 Mater.Sci.Engineer.R:Reports 44 45
[5]Li Z,Bai H Y,Zhao D Q,Pan MX,Wang W L,Wang W H 2005 Acta Phys.Sin.54 652(in Chinese)[李正,白海洋,赵德乾,潘明祥,王万录,汪卫华 2005物理学报 54 652]
[6]Wang W H 2013 Prog.Phys.33 177(in Chinese)[汪卫华2013物理学进展33 177]
[7]KirchheiMR,Sommer F,Schluckebier G 1982 Acta Metall.30 1059
[8]KirchheiMR 1988 Prog.Mater.Sci.32 261
[9]Dong F Y,Luo L S,Su Y Q,Guo J J,Fu H Z 2013 Rare Metal Mater.Engineer.42 1536(in Chinese)[董福宇,骆良顺,苏彦庆,郭景杰,傅恒志2013稀有金属材料与工程42 1536]
[10]Eliaz N,Eliezer D 1999 Adv.Perform.Mater.6 5
[11]Rush J J,Rowe J M,Maeland A J 1980 J.Phys.F:Metal Phys.10 L283
[12]Spit F H M,Drijver J W,Radelaar S 1980 Scripta Metall.14 1071
[13]Turnbull D,Cohen MH 1961 J.Chem.Phys.34 120
[14]Lin H J,He M,Pan S P,Gu L,Li H W,Wang H,Ouyang L Z,Liu J W,Ge T P,Wang D P,Wang W H,Akiba E,Zhu M2016 Acta Mater.120 68
[15]Yamaura S,Sakurai M,Hasegawa M,Wakoh K,Shimpo Y,Nishida M,Kimura H,Matsubara E,Inoue A 2005 Acta Mater.53 3703
[16]Dolan MD,Dave N C,Ilyushechkin A Y,Morpeth L D,McLennan K G 2006 J.Membrane Sci.285 30
[17]Hara S,Sakaki K,Itoh N,Kimura H M,Asami K,Inoue A 2000 J.Membrane Sci.164 289
[18]Ding H Y,Yao K F 2014 Rare Metal Mater.Engineer.43 1787(in Chinese)[丁红瑜,姚可夫2014稀有金属材料与工程43 1787]
[19]Richardson T J,Slack J L,Armitage R D,Kostecki R,Farangis B,Rubin MD 2001 Appl.Phys.Lett.78 3047
[20]Chaudhari P,Cuomo J J,Gambino R J 1973 Appl.Phys.Lett.22 337
[21]Victoria M,Westerwaal R J,DaMB,van Mechelen J L M2016 ACS Sensors 1 222
[22]Zhao Q,Li Y,Song Y,Cui X,Sun D,Fang F 2013 Appl.Phys.Lett.102 161901
[23]Dong F,Lu S,Zhang Y,Luo L,Su Y,Wang B,Huang H,Xiang Q,Yuan X,Zuo X 2017 J.Alloy Compud.695 3183
[24]Dong F,Su Y,Luo L,Wang L,Wang S,Guo J,Fu H 2012 Int.J.Hydrogen Energy 37 14697
[25]Granata D,Fischer E,Löffler J F 2015 Acta Mater.99 415
[26]Su Y,Dong F,Luo L,Guo J,Han B,Li Z,Wang B,Fu H 2012 J.Non-Cryst.Solids 358 2606
[27]Huot J,Ravnsbæk D B,Zhang J,Cuevas F,Latroche M,Jensen T R 2013 Prog.Mater.Sci.58 30
[28]Harris J H,Curtin W A,Tenhover MA 1987 Phys.Rev.B 36 5784
[29]Fries S M,Wagner H G,Campbell S J,Gonser U,Blaes N,Steiner P 1985 J.Phys.F:Metal Phys.15 1179
[30]Itoh K,Kanda K,Aoki K,Fukunaga T 2003 J.Alloy Compud.348 167
[31]Fukunaga T,Itoh K,Orimo S,Aoki K 2004 Mater.Sci.Engineer.B 108 105
[32]Völkl J,Alefeld G 1978 Hydrogen in Metals I:Basic Properties(Berlin&New York:Springer-verlag)p321
[33]Eliaz N,Fuks D,Eliezer D 1999 Acta Mater.47 2981
[34]Lee Y S,Stevenson D A 1985 J.Non-Cryst.Solids 72 249
[35]KirchheiMR 1982 Acta Metall.30 1069
[36]Knapton A 1977 PlatinuMMetals Rev.21 44
[37]Spassov T,Stergioudis G,Ivanov G,Polychroniadis E 1998 Zeitschrift für Metallkunde 89 23
[38]Huett V,Zander D,Jastrow L,Majzoub E,Kelton K,Köster U 2004 J.Alloy Compud.379 16
[39]Bowman R Jr,Furlan R,Cantrell J,Maeland A 1984 J.Appl.Phys.56 3362
[40]Yamaura S,Isogai K,Kimura H,Inoue A 2002 J.Mater.Res.17 60
[41]Isogai K,Shoji T,Kimura H,Inoue A 2000 Mater.Trans.JIM41 1486
[42]Peng D,Yan M,Sun J,Shen J,Chen Y,McCartney D 2005 J.Alloy Compud.400 197
[43]Rangelova V,Spassov T,Neykov N 2004 J.Thermal Analy Calorim.75 373
[44]Lazarova M,Spassov T,Budurov S 1994 Int.J.Rapid Solidi fi cat.8 133
[45]Li X G,Otahara T,Takahashi S,Shoji T,Kimura H M,Inoue A 2000 J.Alloy Compud.297 303
[46]Stolz U,Weller M,KirchheiMR 1986 Scripta Metall.20 1361
[47]Künzi H U,Agyeman K,Güntherodt H J 1979 Solid State Commun.32 711
[48]Hasegawa MTakeuchi M,Inoue A 2005 Acta Mater.53 5297
[49]Hasegawa M,Takeuchi M,Kato H,Inoue A 2004 Acta Mater.52 1799
[50]Coey J MD,Ryan D,Gignoux D,Liénard A,Rebouillat J P 1982 J.Appl.Phys.53 7804
[51]Coey J,Ryan D,Boliang Y 1984 J.Appl.Phys.55 1800
[52]Ryan D H,Coey J MD,Batalla E,Altounian Z,Ström-Olsen J O 1987 Phys.Rev.B 35 8630
[53]Aoki K,Nagano M,Yanagitani A,Masumoto T 1987 J.Appl.Phys.62 3314
[54]Nagumo M2016 Characteristic Features of Deformation and Fracture in Hydrogen Embrittlement,in:Fundamentals of Hydrogen Embrittlement pp137–165
[55]Nagumo M,Takahashi T 1976 Mater.Sci.Engineer.23 257
[56]Jayalakshmi S,Fleury E 2010 J.ASTMInternational 7 1
[57]He T,Pachfule P,Wu H,Xu Q,Chen P 2016 Nat.Rev.Mater.1 16059
[58]Sandrock G 1999 J.Alloy Compud.293–295 877
[59]Buschow K H,van Mal H H 1972 J.Less-Common Metals 29 203
[60]Reilly J J,Johnson J R,Reidinger F,Lynch J F,Tanaka J,Wiswall R H 1980 J.Less-Common Metals 73 175
[61]Maeland A J,Tanner L E,Libowitz G 1980 J.Less-Common Metals 74 279
[62]Aoki K,Masumoto T,Kamachi M1985 J.Less Common Metals 113 33
[63]Bowman R C Jr 1988 Mater.Sci.Forum.31 197
[64]Ciureanu M,Ryan D H,Ström-Olsen J O,Trudeau ML 1993 J.Electrochem.Soc.140 579
[65]Wang H,Lin H J,Cai W T,Ouyang L Z,Zhu M2016 J.Alloy Compud.658 280
[66]Inoue A,Masumoto T 1993 Mater.Sci.Engineer.A 173 1
[67]Spassov T,Lyubenova L,Köster U,BaróMD 2004 Mater.Sci.Engineer.A 375–377 794
[68]Spassov T,Köster U 1999 J.Alloy Compud.287 243
[69]Tanaka K,Kanda Y,Furuhashi M,Saito K,Kuroda K,Saka H 1999 J.Alloy Compud.293–295 521
[70]Wu D C,Huang L J,Liang G Y 2008 Acta Phys.Sin.57 1813(in Chinese)[吴东昌,黄林军,梁工英 2008物理学报57 1813]
[71]Lei Y,Wu Y,Yang Q,Wu J,Wang Q 1994 Zeitschrift für Physikalische Chemie 183 379
[72]Liu W,Wu H,Lei Y,Wang Q,Wu J 1997 J.Alloy Compud.252 234
[73]Huang L,Wang Y,Tang J,Zhao Y,Liu G,Wang Y,Liu J,Jiao J,Wang W,Jin B,Bel fi ore L A,Kipper MJ 2017 J.Alloy Compud.694 1140
[74]Lin H J,Wang W H,Zhu M2012 J.Non-Cryst.Solids 358 1387
[75]Griessen R 1983 Phys.Rev.B 27 7575
[76]Fadonougbo J O,Suh J Y,Han S,ShiMC H,KiMG H,KiMMH,Fleury E,Cho Y W 2016 J.Alloy Compud.660 456
[77]Shao H,Asano K,Enoki H,Akiba E 2009 Scripta Mater.60 818
[78]El-Eskandarany MS,Aoki K,Sumiyama K,Suzuki K 1997 Scripta Mater.36 1001
[79]Jiang P,Yu Y D 2013 Rare Metal Mater.Engineer.42 868(in Chinese)[江鹏,于彦东2013稀有金属材料与工程42 868]
[80]Paglieri S N,Pal N K,Dolan MD,KiMS M,Chien W M,Lamb J,Chandra D,Hubbard K M,Moore D P 2011 J.Membrane Sci.378 42
[81]Dolan M,Dave N,Morpeth L,Donelson R,Liang D,KellaMM,Song S 2009 J.Membrane Sci.326 549
[82]KiMK B,KiMK D,Lee D Y,KiMY C,Fleury E,KiMD H 2007 Mater.Sci.Engineer.A 449–451 934
[83]Yamaura S,Inoue A 2010 J.Membrane Sci.349 138
[84]Yamaura S,Nakata S,Kimura H,Inoue A 2007 J.Membrane Sci.291 126
[85]Jayalakshmi S,Choi Y G,KiMY C,KiMY B,Fleury E 2010 Intermetallics 18 1988
[86]Brinkman K,Fox E,Korinko P,Missimer D,Adams T,Su D 2011 J.Membrane Sci.378 301
[87]Ockwig N W,Neno ffT M2007 Chem.Rev.107 4078
[88]Serra E,Kemali M,Perujo A,Ross D K 1998 Metall.Mater.Trans.A 29 1023
[89]Nakano S,Yamaura S,Uchinashi S,Kimura H,Inoue A 2005 Sensors and Actuators B:Chemical 104 75
[90]Zhao Y,Choi I C,Seok MY,KiMMH,KiMD H,Ramamurty U,Suh J Y,Jang J 2014 Acta Mater.78 213
[91]Granata D,Fischer E,Löffler J F 2015 Scripta Mater.103 53
[92]Mahjoub R,Laws K J,Hamilton N E,Granata D,Ferry M2016 Computat.Mater.Sci.125 197
[93]Yeh X L,Samwer K,Johnson W L 1983 Appl.Phys.Lett.42 242
[94]Aoki K,Yamamoto T,Masumoto T 1987 Scripta Metall.21 27
[95]Aoki K,Yanagitani A,Li X G,Masumoto T 1988 Mater.Sci.Engineer.97 35
[96]Aoki K,Li X G,Masumoto T 1992 Acta Metall.Mater.40 1717
[97]Aoki K,Masumoto T 1995 J.Alloy Compud.231 20
[98]Zhang Q A,Yang D Q 2017 J.Alloy Compud.711 312
[99]Wu Y,Solberg J K,Yartys V A 2007 J.Alloy Compud.446–447 178
[100]Lin H J,Ouyang L Z,Wang H,Zhao D Q,Wang W H,Sun D L,Zhu M2012 International J.Hydrogen Energy 37 14329
[101]Lin H J,Zhang C,Wang H,Ouyang L,Zhu Y,Li L,Wang W,Zhu M2016 J.Alloy Compud.685 272
[102]Lin H J,Tang J J,Yu Q,Wang H,Ouyang L Z,Zhao Y J,Liu J W,Wang W H,Zhu M2014 Nano Energy 9 80[103]Maeland A J,Libowitz G G 1982 Mater.Lett.1 3
PACS:61.43.Dq,81.05.KfDOI:10.7498/aps.66.176105
*Project supported by National Natural Science Foundation of China(Grant Nos.51601090,51571112,51471087,51621001).
†Corresponding author.E-mail:hjlin@jnu.edu.cn
‡Corresponding author.E-mail:yfzhu@njtech.edu.cn;memzhu@scut.edu.cn
Research progress of interactions between amorphous alloys and hydrogen∗
Lin Huai-Jun1)†Zhu Yun-Feng2)‡Liu Ya-Na2)Li Li-Quan2)Zhu Min3)‡
1)(Institute of Advanced Wear&Corrosion Resistant and Functional Materials,Jinan University,Guangzhou 510632,China)
2)(College of Materials Science and Engineering,Nanjing Tech University,Nanjing 210009,China)
3)(School of Materials Science and Engineering,South China University of Technology,Guangzhou 510640,China)
2 May 2017;revised manuscript
8 June 2017)
Amorphous alloys are a group of novel mechanical and functional materials that possess remarkably improved properties,such as mechanical property,wear property,anti-corrosion property,magnetic property and catalytic property,compared with those of their crystalline counterparts.The interactions between amorphous alloys and hydrogen can lead to various interesting physical and chemical phenomena,and also important applications.Typically,some amorphous alloys can store more hydrogen with faster kinetics than their crystalline counterparts due to the disordered atomic structures,which make theMpromising candidates for hydrogen storage.Hydrogen induced optical transformation in amorphous alloy fi lMwith thickness on a nanoscale makes theMsuitable for developing optical switchable windows.Hydrogen could be used as a sensitive probe to study the atomic structures of amorphous alloys.Amorphous alloys,whose structures are similar to defects in crystalline alloys(vacancies,dislocations,boundaries,ect.),are a group of suitable objects to study the interactions between hydrogen and defects.Amorphous alloys are also promising membranes materials for industrial hydrogen gas puri fi cation.Micro-alloying by hydrogenation could enhance the plasticity and glass-forming ability of amorphous alloy.
In this review,recent research progress of interactions between amorphous alloys and hydrogen are summarized froMtwo main aspects:fundamental research and practical applications.In the aspect of fundamental research,we fi rstly review the recent study on hydrogen in the amorphous alloy,including the hydrogen concentration and distribution,hydrogen occupancy type and geometric size,hydrogen di ff usion and thermodynamics and other relevant physical and chemical issues.Secondly,the studies on the e ff ects of hydrogenation on thermal stability,magnetic property and internal friction of amorphous alloys,together with some discussion on the corresponding mechanisms are summarized.Thirdly,hydrogen embrittlement of amorphous alloy and the corresponding prevention techniques,together with the studies of the interactions between hydrogen and defects in crystalline materials such as vacancies,dislocations and boundaries in material,are also involved.In the aspect of practical applications,we fi rstly review recent advances in amorphoushydrogen storage alloys,focusing on transition metal based amorphous alloys and Mg based alloys.Secondly,amorphous alloy fi lms for hydrogen puri fi cation,hydrogen sensors and optical switchable windows are reviewed.Thirdly,some positive in fl uences introduced by hydrogenation on amorphous alloys are discussed,typically on enhancing plasticity and glass-forming ability.Besides the above,hydrogen induced amorphization on crystalline alloy,the use of amorphous alloy for preparing nanocrystalline hydrogen storage materials,and using hydrogenation to crack bulk amorphous alloys to produce amorphous alloys powders are also discussed.In the last section of this review,we try to give our own viewpoint of the future perspectives of relevant researches and applications of interactions between hydrogen and amorphous alloys.
amorphous alloys,hydrogen,hydrogen storage,hydrogen-induced phase transformation
10.7498/aps.66.176105
∗国家自然科学基金(批准号:51601090,51571112,51471087,51621001)资助的课题.
†通信作者.E-mail:hjlin@jnu.edu.cn
‡通信作者.E-mail:yfzhu@njtech.edu.cn;memzhu@scut.edu.cn
©2017中国物理学会Chinese Physical Society
http://wulixb.iphy.ac.cn
