ZNF268基因在实体瘤中的差异拼接模式
2016-02-01朱晨刚郭明雄邵焕杰
朱晨刚, 郭明雄, 邵焕杰
(1 贵州师范学院 化学与生命科学学院, 贵州 贵阳 550018;
2 武汉大学 生命科学学院, 湖北 武汉 430072;
3 陕西师范大学 生命科学学院, 陕西 西安 710119)
ZNF268基因在实体瘤中的差异拼接模式
朱晨刚1,2, 郭明雄2, 邵焕杰3*
(1 贵州师范学院 化学与生命科学学院, 贵州 贵阳 550018;
2 武汉大学 生命科学学院, 湖北 武汉 430072;
3 陕西师范大学 生命科学学院, 陕西 西安 710119)
摘要:为研究ZNF268基因在癌症发生过程中的作用,以17例正常人外周血为对照,收集并分析了5例实体瘤标本。通过提取总RNA反转录合成cDNA,使用PCR、巢式PCR和测序的方法调查ZNF268在样本中的表达模式。结果显示,ZNF268基因在实体瘤中的差异拼接模式明显不同于正常人外周血。剪切本ZNF268a在正常人外周血中表达概率为100%,而在实体瘤样本中为0。该结果提示剪切本ZNF268a消失与细胞癌变密切相关,是潜在的癌症诊断分子标记。
关键词:ZNF268基因; 异常差异剪切; 实体瘤; 分子标记
肺癌、胃癌、乳腺癌、肝癌等实体瘤是我国主要的癌症发病形式,发病率和死亡率均高于世界平均水平[1-2]。引发肿瘤的因素有很多,包括放射性物质、环境污染、病毒感染、先天遗传和个人生活习惯等。这些因素作用于染色体DNA,导致基因功能紊乱,促成细胞永生化无序生长并发生转移。因为转录因子在功能上的特殊性,在细胞癌变过程中有非常重要的作用。在高等脊椎动物细胞中,很大一部分转录因子由锌指蛋白组成[3-6]。近几十年的研究也证明,锌指蛋白与恶性肿瘤发生有很高的关联性,如:WT1、GATA1基因等[7-10]。
人类锌指蛋白基因ZNF268来源于3~5周龄胚胎cDNA文库,编码典型的KRAB/C2H2型锌指蛋白[11-12]。前期研究表明ZNF268在胚胎肝脏细胞内高表达,与造血功能密切相关[12-13]。Krackhardt等利用改进的SEREX方法鉴定出14个慢性淋巴细胞白血病特异性抗原,其中之一就是ZNF268的一种剪接本KW4[14]。近期研究结果显示,通过GATA1下调ZNF268表达,能够促进K562细胞增殖,ZNF268异常表达则影响卵巢肿瘤的生长和迁移,ZNF268通过强化NF-ΚB信号参与宫颈癌发生[15-17]。对启动子功能研究显示,ZNF268基因受到CREB因子调控,该因子是一种原癌基因并参与急性髓性白血病发生[18-19]。这些实验证据表明ZNF268基因在癌症发生过程中有重要作用。
差异拼接显著增加了人类基因组所编码的蛋白质。一个基因在发挥功能时,所应对的拼接模式是恒定的,异常的拼接模式常与疾病关联,成为病变发生和诊断的分子标记[20-22]。考虑到ZNF268基因在癌症发生中的作用,调查该基因在实体瘤中的拼接模式是研究其功能的重要方面。本文以17例正常人外周血样本为对照,使用RT-PCR、巢式PCR和测序的方法分析ZNF268基因在5例实体瘤样本中的差异拼接模式。结果显示转录本ZNF268a在正常人外周血中表达率为100%,而在实体瘤组织中为0。该结果提示ZNF268a消失与癌症发生密切相关,是潜在的癌症诊断分子标记。
1材料和方法
1.1实体瘤和正常人外周血样本
经患者同意,在华中科技大学同济医学院附属同济医院收集到5例实体瘤样本,分别是胃癌2例、结肠癌1例、肝癌1例、乳腺癌1例。经同意,在武汉大学校医院收集到17例正常人外周血样本,以作为对照。
1.2RNA提取、反转录和PCR
按照试剂盒说明书,分别使用Trizol和Trizol LS(Invitrogen, USA)提取实体瘤和外周血样本总RNA。使用DNase处理RNA,以排除基因组污染。然后用TAKARA反转录试剂盒获取cDNA链。简述如下:取总RNA 1 μg,依次加入引物Oligo dT 1 μL,MMLV酶0.5 μL,RNAsin0.5 μL,10×缓冲液1 μL,dNTP 1 μL,用DEPC处理水补足至10 μL。混匀。按以下条件进行反转录:42 ℃,45 min;99 ℃,5 min;5 ℃,5 min。
取1 μL 反转录产物作为PCR模板,依次加入10×缓冲液2.5 μL,MgCL2(25 mmol/L) 1.5 μL,正向引物(10 μmol/L)和反向引物(10 μmol/L)各1 μL,DNA聚合酶1 μL,dNTPs(2.5 mmol/L) 1 μL,灭菌去离子水补足至25 μL。检测ZNF268基因的条件:预变性96 ℃ 3 min(96 ℃变性15 s,56 ℃退火30 s,72 ℃延伸90 s),循环35个,最后72 ℃延伸7 min。检测β-actin基因的条件:预变性96 ℃ 3 min(96 ℃变性15 s,56 ℃退火30 s,72 ℃延伸45 s),循环30个,最后72℃延伸7 min。PCR产物使用1.5%琼脂糖凝胶电泳分离,采用EDAS 290系统(Kodak,USA)成像。PCR引物序列见表1。

表1 引物列表
1.3巢式PCR
第一轮扩增25个循环,反应条件同步骤1.2。产物稀释100倍取1 μL作为第二轮扩增模板。检测ZNF268的条件:预变性96 ℃ 3 min(96 ℃变性15 s,56 ℃退火30 s,72 ℃延伸90 s),循环30个,最后72 ℃延伸7 min。PCR产物使用1.5%琼脂糖凝胶电泳分离,采用EDAS 290系统(Kodak,USA)成像。
1.4PCR产物回收、克隆和测序鉴定
随机挑选PCR条带进行克隆和测序鉴定。按照说明书,使用DNA凝胶回收试剂盒(北京博大泰克,中国),回收PCR片段。连接反应如下:纯化PCR产物0.5 pmol/L;pGEM-T easy载体1 μL;2×连接缓冲液5 μL;T4 DNA连接酶1 μL,灭菌去离子水补足至10 μL。4 ℃连接过夜。转化DH5α感受态细胞,获取重组载体并测序。
2结果
2.1剪切本ZNF268a、ZNF268b在正常人外周血中的表达
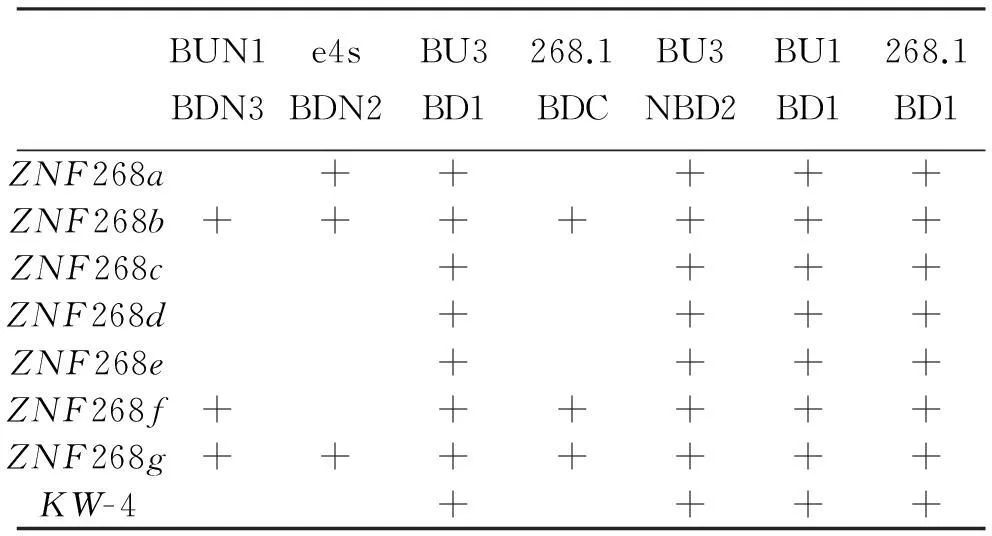
ZNF268基因有8种剪切形式(图1),其中ZNF268a、ZNF268b丰度最高,是重点研究的两条mRNA[23-24]。作为检测实体瘤中ZNF268基因差异拼接模式的对照,本文收集了17例外周血样本。提取总RNA,反转录成cDNA,使用引物对BUN1和BDN3检测样品。该引物对可以检测出ZNF268b、ZNF268f、ZNF268g(表2)。结果显示17例正常人外周血中,表达ZNF268b的概率是100%(图2a)。引物对e4s和BDN2可以检测ZNF268a、ZNF268b、ZNF268g(表2),其中ZNF268b和ZNF268g的PCR产物大小一致。结果显示在样本中ZNF268a表达概率为100%(图2b)。
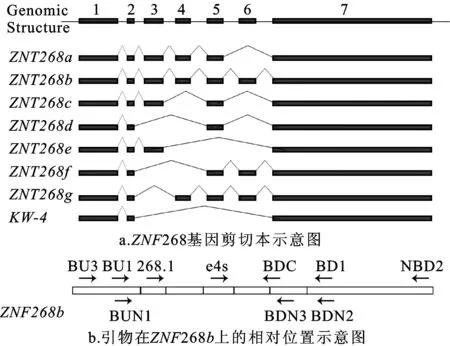
图1 ZNF268基因剪切本(a)及引物位置(b)
BUN1BDN3e4sBDN2BU3BD1268.1BDCBU3NBD2BU1BD1268.1BD1ZNF268a+++++ZNF268b+++++++ZNF268c++++ZNF268d++++ZNF268e++++ZNF268f++++++ZNF268g+++++++KW-4++++

图2PCR检测正常人外周血ZNF268基因表达
Fig.2Examination ofZNF268 gene expression
in healthy peripheral blood by PCR
a.使用引物对BUN1和BDN3;b.使用引物对e4s和BDN2。
2.2剪切本ZNF268b在实体瘤中表达概率为100%,而ZNF268a表达概率为0
为检测ZNF268基因在实体瘤中的差异拼接模式,收集了5例样本,提取总RNA,反转录成cDNA。根据前期报道,ZNF268基因差异拼接发生在3、4、5、6号外显子(图1a)。引物BU3、BD1分别位于第一号、第七号外显子(图1b)。按照预期,这对引物能够检测到所有的剪切本(表2)。PCR和测序结果显示,这对引物只检测到ZNF268b(图3a)。为进一步验证结果,文章使用了另外一对引物进行实验。268.1位于第二号外显子,BDC位于第六号和第七号外显子的交界处(图1b)。按照预期,这对引物可以检测ZNF268b、ZNF268f、ZNF268g(表2)。PCR和测序结果再次显示在实体瘤组织中只检测到ZNF268b(图3b)。实验过程中使用β-actin作为内参(图3c)。该结果表明ZNF268b在实体瘤中表达概率为100%,ZNF268a表达概率为0。

图3 PCR检测实体瘤组织ZNF268基因表达。
a.使用引物对BU3和BD1; b.使用引物对268.1和BDC; c.β-actin对照。
2.3巢式PCR再次证明剪切本ZNF268a在实体瘤样本中表达概率为0
ZNF268基因在实体瘤中都表达了ZNF268b,而ZNF268a表达概率为0。这个结果非常意外,猜测可能是ZNF268a丰度过低,以至于单论PCR无法检测阳性结果。为排除这种可能性,使用特异性更强灵敏度更高的巢式PCR法,进一步确认转录本ZNF268a是否存在。首先使用BU3和NBD2进行第一轮PCR扩增,然后用巢式引物对BU1和BD1(图4a)或者268.1和BD1(图4b)进行巢式PCR。这三对引物都可以检测到所有剪切本(表2),BU3、NBD2位于其他引物的外侧(图1b)。根据预测,如果实体瘤样本中存在ZNF268a,那么巢式PCR至少应该扩增出两条条带,分别是ZNF268a和ZNF268b。电泳结果显示只有一条扩增条带,再次证明ZNF268a在实体瘤中表达概率为0。
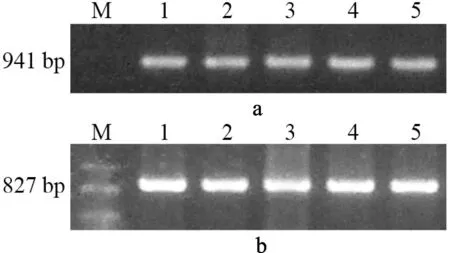
图4 巢式PCR检测实体瘤组织ZNF268基因表达
3讨论
差异拼接是高等真核生物基因转录后调控的关键模式,据报道人类大部分基因都存在差异拼接现象,单基因形成的mRNA从几条到几千条不等,基因功能发挥与特定的拼接模式成对应关系[25-26]。癌症是细胞异常的无序和永生化生长,是基因功能紊乱的结果。癌细胞中经常发现某些基因出现异常的差异拼接模式,导致该基因在细胞中的mRNA种类和比例发生变化,进而基因功能发生变化,如WT1、FHIT[27-28]。本文以17例正常人外周血为对照,研究了5例实体瘤标本的ZNF268差异拼接模式。结果显示剪切本ZNF268a在外周血中表达概率为100%,而在实体瘤中则为0。
细胞癌变初始阶段可能由单个或少数基因功能改变开始,但是细胞彻底转变成癌细胞,是分子系统网络结构和调控的整体改变。癌症蛋白分子标记对病症诊断有重要的指示、治疗靶向作用[29-30]。由于癌症发生和发展过程的复杂性和参与分子的多样性,癌症分子标记的研究十分困难。目前为止,经FDA批准应用于临床诊断的癌症分子标记只有9个蛋白质。ZNF268a在实体瘤中表达概率为0,而在正常人外周血中则为100%,这种有和无的存在关系提示ZNF268a消失在细胞癌变过程中扮演着重要角色,有可能成为一种癌症诊断分子标记。这对癌症诊断、治疗及预后都有十分重要的指示作用。
ZNF268基因有8种剪切形式,在正常细胞中剪切本ZNF268a、ZNF268b出现的概率为100%,本研究表明,实体瘤组织只表达剪切本ZNF268b,而ZNF268a完全消失。这说明ZNF268基因在癌症组织中的差异拼接模式发生了很大的变化,可能是癌细胞分子系统网络结构和调控整体改变的结果。细胞在癌化过程中,与拼接有关的因子及内环境发生变化,最终导致ZNF268基因的拼接模式发生改变。ZNF268有两种主要的蛋白质形式ZNF268a和ZNF268b2,分别由剪切本ZNF268a、ZNF268b翻译产生[23]。ZNF268a比ZNF268b2多了KRAB区,它们有相似的细胞定位[24,31],共同存在以维护ZNF268基因的功能。在实体瘤组织中,平衡关系被打破,通过在细胞内表达ZNF268a,重新建立两种剪切本之间的平衡,可能是一种有效的治疗策略。进一步研究下调ZNF268a表达所引起的下游生物学事件和对细胞产生的影响将会有助于对ZNF268基因功能的深入认识。
4结论
以17例正常人外周血为对照,收集并分析了5例实体瘤样本的ZNF268基因差异拼接模式。通过PCR、巢式PCR和测序的方法,发现剪切本ZNF268a在正常人外周血的表达概率为100%,而在实体瘤中为0。本研究提示ZNF268a消失与细胞癌变密切相关,是潜在的癌症诊断分子标记。
致谢:感谢美国国立卫生研究院(National Institutes of Health,NIH)Yun-Bo Shi教授提出的建议性意见。感谢贵州师范学院自然科学研究基金项目(12BSO25)的资助。
参考文献:
[1] 王永川, 魏丽娟, 刘俊田,等. 发达与发展中国家癌症发病率与死亡率的比较与分析[J]. 中国肿瘤临床, 2012(10): 679-682.
[2] 陈万青, 郑荣寿, 张思维,等.2003—2007年中国癌症发病分析[J]. 中国肿瘤, 2012(3): 161-170.
[3] SAKAGUCHI S, HOMBAUER M, BILIC I, et al. The zinc-finger protein MAZR is part of the transcription factor network that controls the CD4 versus CD8 lineage fate of double-positive thymocytes[J]. Nature Immunology, 2010, 11(5): 442-448.
[4] LIAN L S, YANG Y G, LIU W, et al. Zinc finger protein-activating transcription factor up-regulates vascular endothelial growth factor-a expression in vitro[J]. Chinese Medical Sciences Journal, 2012, 27(3): 171-175.
[5] CALDERON M R, VERWAY M, BENSLAMA R O, et al. Ligand-dependent corepressor contributes to transcriptional repression by C2H2zinc finger transcription factor ZBRK1 through association with KRAB-associated protein-1[J]. Nucleic Acids Research, 2014, 42(11): 7012-7027.
[6] LAWRENCE S D, NOVAK N G, JONES R W, et al. Herbivory responsive C2H2zinc finger transcription factor protein StZFP2 from potato[J]. Plant Physiology and Biochemistry, 2014, 80: 226-233.
[7] HANDRA-LUCA A.WT1 expression in adult granular cell tumor of the vocal cord and tongue[J]. Head and Neck Pathology, First online:2015-07-11,1-3.
[8] ZHANG R, YANG J Y, SUN H Q, et al. Comparison of minimal residual disease (MRD) monitoring byWT1 quantification between childhood acute myeloid leukemia and acute lymphoblastic leukemia[J]. European Review for Medical and Pharmacological Sciences, 2015, 19(14): 2679-2688.
[9] BIBIKOVA E, YOUN M Y, DANILOVA N, et al. TNF-mediated inflammation repressesGATA1 and activates p38 MAP kinase in RPS19-deficient hematopoietic progenitors[J]. Blood, 2014, 124(25): 3791-3798.
[10] LI Y, KE Q, SHAO Y, et al.GATA1 induces epithelial-mesenchymal transition in breast cancer cells through PAK5 oncogenic signaling[J]. Oncotarget, 2015, 6(6): 4345-4356.
[11] GOU D M, SUN Y, GAO L, et al. Cloning and characterization of a novel Kruppel-like zinc finger gene,ZNF268, expressed in early human embryo[J]. Biochimica et Biophysica Acta, 2001, 1518(3): 306-310.
[12] SUN Y, GOU D M, LIU H, et al. The KRAB domain of zinc finger geneZNF268: a potential transcriptional repressor[J]. IUBMB Life, 2003, 55(3): 127-131.
[13] SUN Y, SHAO H, LI Z, et al.ZNF268, a novel kruppel-like zinc finger protein, is implicated in early human liver development[J]. International Journal of Molecular Medicine, 2004, 14(6): 971-975.
[14] KRACKHARDT A M, WITZENS M, HARIG S, et al. Identification of tumor-associated antigens in chronic lymphocytic leukemia by SEREX[J]. Blood, 2002, 100(6): 2123-2131.
[15] WANG W, GUO M, HU L, et al. The zinc finger proteinZNF268 is overexpressed in human cervical cancer and contributes to tumorigenesis via enhancing NF-kappaB signaling[J]. Journal of Biological Chemistry, 2012, 287(51): 42856-42866.
[16] ZENG Y, WANG W, MA J, et al. Knockdown ofZNF268, which is transcriptionally downregulated by GATA-1, promotes proliferation of K562 cells[J]. PloS One, 2012, 7(1): e29518.
[17] HU L, WANG W, CAI J, et al. Aberrant expression ofZNF268 alters the growth and migration of ovarian cancer cells[J]. Oncology Letters, 2013, 6(1): 49-54.
[18] GUO M X, WANG D, SHAO H J, et al. Transcription of human zinc fingerZNF268 gene requires an intragenic promoter element[J]. Journal of Biological Chemistry, 2006, 281(34): 24623-24636.
[19] WANG D, GUO M X, HU H M, et al. Human T-cell leukemia virus type 1 oncoprotein tax repressesZNF268 expression through the cAMP-responsive element-binding protein/activating transcription factor pathway[J]. Journal of Biological Chemistry, 2008, 283(24): 16299-16308.
[20] GABUT M, SAMAVARCHI-TEHRANI P, WANG X, et al. An alternative splicing switch regulates embryonic stem cell pluripotency and reprogramming[J]. Cell, 2011, 147(1): 132-146.
[21] AARONSON Y, MESHORER E. Stem cells: regulation by alternative splicing[J]. Nature, 2013, 498(7453): 176-177.
[22] GUEROUSSOV S, GONATOPOULOS-POURNATZIS T, IRIMIA M, et al. RNA splicing. an alternative splicing event amplifies evolutionary differences between vertebrates[J]. Science, 2015, 349(6250): 868-873.
[23] SHAO H, ZHU C, ZHAO Z, et al. KRAB-containing zinc finger geneZNF268 encodes multiple alternatively spliced isoforms that contain transcription regulatory domains[J]. International Journal of Molecular Medicine, 2006, 18(3): 457-463.
[24] WANG W, CAI J, WU Y, et al. Novel activity of KRAB domain that functions to reinforce nuclear localization of KRAB-containing zinc finger proteins by interacting with KAP1[J]. Cellular and Molecular Life Sciences, 2013, 70(20): 3947-3958.
[25] TIKHONOV M, GEORGIEV P, MAKSIMENKO O. Competition within introns: splicing wins over polyadenylation via a general mechanism[J]. Acta Naturae, 2013, 5(4): 52-61.
[26] BLACK D L. Protein diversity from alternative splicing: a challenge for bioinformatics and post-genome biology[J]. Cell, 2000, 103(3): 367-370.
[27] BAUDRY D, HAMELIN M, CABANIS M O, et al.WT1 splicing alterations in Wilms′ tumors[J]. Clinical Cancer Research, 2000, 6(10): 3957-3965.
[28] ZUCCHINI C, CONCU M, MARTINI F, et al.FHIToncosuppressor gene expression profile in human anal cancers[J]. International Journal of Biological Markers, 2007, 22(1): 39-42.
[29] CIMA I, SCHIESS R, WILD P, et al. Cancer genetics-guided discovery of serum biomarker signatures for diagnosis and prognosis of prostate cancer[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(8): 3342-3347.
[30] HIGGINS G, ROPER K M, WATSON I J, et al. Variant Ciz1 is a circulating biomarker for early-stage lung cancer[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(45): E3128-3135.
[31] WANG W, CAI J, LIN Y, et al. Zinc fingers function cooperatively with KRAB domain for nuclear localization of KRAB-containing zinc finger proteins[J]. PloS One, 2014, 9(3): e92155.
〔责任编辑王勇〕
第一作者: 刘莹娟,女,讲师,博士,主要研究方向为动物行为与化学通讯。E-mail:liuyingjuan620@126.com
Study of alternative splicing ofZNF268 gene in human solid tumors
ZHU Chengang1,2, GUO Mingxiong2, SHAO Huanjie3*
(1 School of Chemistry and Life Sciences, Guizhou Normal College, Guiyang 550018,Guizhou,China;
2 College of Life Sciences, Wuhan University, Wuhan 430072, Hubei, China;
3 School of Life Sciences, Shaanxi Normal University, Xi′an 710119, Shaanxi, China)
Abstract:In order to study the function of ZNF268 gene in tumorigenesis, five solid tumor specimens were collected and analyzed, which were compared to 17 peripheral blood specimens of healthy donors, by reverse transcription-polymerase chain reaction (RT-PCR), nested PCR and sequencing. Results demonstrated that the patterns of alternative splicing of ZNF268 gene in human solid tumors were dramatically different from healthy blood. The probability of appearance of ZNF268a was 100% in healthy peripheral blood, which was 0 in solid tumors. These results suggested that the disappearance of ZNF268a may contribute to cancerization and is a potential prognostic factor.
Keywords:ZNF268 gene; aberrant alternative splicing; solid tumor; biomarker
通信作者:* 张健旭,男,研究员,博士生导师。E-mail: zhangjx@ioz.ac.cn
基金项目:国家自然科学基金(31272322); 河南省高等学校重点科研项目(15A180053); 农业虫害鼠害综合治理研究国家重点实验室开放课题(ChineseIPM1403);南阳师范学院校级项目(Zx2014063)
收稿日期:2015-03-23
doi:10.15983/j.cnki.jsnu.2016.01.314
文章编号:1672-4291(2016)01-0071-07
中图分类号:Q344+.14
文献标志码:A
