小白菊内酯对球囊损伤后新生内膜增殖的影响
2016-01-31高丽华邓昌明
毛 霞, 高丽华, 邓昌明
(重庆医科大学附属第二医院心血管内科,重庆 400010)
小白菊内酯对球囊损伤后新生内膜增殖的影响
毛霞,高丽华,邓昌明△
(重庆医科大学附属第二医院心血管内科,重庆 400010)
[摘要]目的: 研究小白菊内酯(PN)对球囊损伤(balloon injury,BI)后新生内膜的影响及机制。方法: 将30只雄性新西兰兔2.0~2.3 kg在高脂适应性喂养1周后随机分为6组:假手术+生理盐水(sham+NS)组; 假手术+二甲基亚砜(sham+DMSO)组;球囊损伤+生理盐水(BI+NS)组;球囊损伤+DMSO(BI+DMSO)组;球囊损伤+PN低剂量(BI+PN low)组;球囊损伤+PN高剂量(BI+PN high)组。PN溶解于DMSO,术后立即按分组腹腔注射同体积药物治疗,每日1次。继续高脂喂养4周后取血清及髂总动脉,分析比较血管内-中膜厚度、半胱氨酰天冬氨酸蛋白酶(caspase)-1、白细胞介素(IL)-1β和IL-8的表达量以及血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)和高密度脂蛋白(HDL)的含量。 结果: BI+DMSO组较sham+DMSO组内膜厚度、caspase-1、IL-1β和 IL-8的表达量增加(P<0.05);与BI+DMSO组比较,上述指标在PN高、低剂量组有不同程度降低,但仅PN高剂量组与其差异有统计学意义(P<0.05);各组血脂指标差异不明显。结论: PN能抑制球囊损伤后的内膜增殖,其机制可能与抗炎作用有关。
[关键词]小白菊内酯; 内膜增殖; Caspase-1
动脉粥样硬化(atherosclerosis,AS)作为心脑血管疾病的重要的病因[1],严重影响人类的健康。AS是一种内皮损伤后血管增殖性疾病,以血管平滑肌细胞(vascular smooth muscle cells,VSMCs)表型改变、迁移以及过度增殖为特征,因此抑制VSMCs的异常增殖成为防治AS的措施之一[2]。炎症贯穿于AS发生发展的全过程[3],内膜损伤后多种炎症细胞侵润并分泌大量促炎因子,导致VSMCs增殖并向内膜迁移,血管内膜增厚,管腔狭窄,研究表明抑制炎症可达到改善内膜增殖的目的[4]。小白菊内酯(parthenolide,PN)是提取于墨西哥印度草药的一种倍半萜烯内酯,广泛用于抗肿瘤研究,近年来PN因其抗炎作用而受到关注。本实验通过高脂喂养联合球囊损伤(balloon injury,BI)建立模型,观察PN对兔髂动脉损伤后内膜增殖的影响并探讨其机制,为临床防治AS提供新思路。
材料和方法
1材料和仪器
30只雄性新西兰白兔,体重2.0~2.3 kg,由重庆医科大学试验动物中心提供,许可证号为SCXK(渝)2012-0001。
2主要材料和仪器
PN(天津士兰生物科技公司);二甲基亚砜(dimethyl sulfoxide,DMSO)购于Sigma;免疫组化试剂盒(北京中杉金桥生物科技公司);Western blot配胶试剂盒、ECL发光液及总蛋白提取试剂盒(上海碧云天生物科技公司);胆固醇及蛋白浓度测定试剂盒(北京鼎国昌盛生物科技公司);Caspase-1 p20抗体、IL-1β抗体(北京博奥森生物科技公司);β-actin抗体(北京康为世纪生物科技公司);IL-8 ELISA试剂盒(北京欣博盛生物科技公司);3.0 Fogarty球囊导管(Edwards Life Science);AUI1000自动生化分析仪(Olympus)。
3主要方法
3.1模型构建在既往建模基础上进行改良[5-6],将30只家兔用高脂(1%胆固醇+6%猪油+93%基础饲料)适应性喂养1周后随机分为6组,每组5只:假手术+生理盐水(sham+NS)组; 假手术+二甲基亚砜(sham+DMSO)组;球囊损伤+生理盐水(BI+NS)组;BI+DMSO组;BI+PN低剂量(BI+PN low)组,PN剂量为1 mg/kg;BI+PN高剂量(BI+PN high)组,PN剂量为2 mg/kg。用3%戊巴比妥钠30 mg/kg耳缘静脉注射进行麻醉,右侧腹股沟区备皮,钝性分离血管鞘,暴露股动脉,送入球囊导管至髂总动脉,以0.69 ATM的压力充盈球囊并回拉导管损伤内膜,重复3次,每次间歇约1 min,抽空球囊后退出血管,结扎股动脉,逐层缝合皮肤。对照组只分离结扎股动脉,不行球囊损伤。术后给予兔子耳缘静脉注射普通肝素100 U/kg抗凝,肌肉注射青霉素8×105U/d,连续3 d预防感染。术后立即按照分组腹腔注射给药(PN溶解于4% DMSO),每天1次,共4周。
3.2标本采集继续高脂喂养4周后,取出标本。家兔麻醉后固定,钝性分离血管鞘,股静脉采血,然后空气栓塞处死,取出建模后髂血管(约4 cm),生理盐水冲洗,分成2段,1段立即放入-80 ℃冰箱储存,另1段用4%多聚甲醛固定。采集血液静置1.5 h后3 000 r/min离心15 min,取出血清置-80 ℃储存备用。
3.3HE及免疫组织化学(immunohistochemistry,IHC)法染色固定后的髂血管行石蜡包埋切片(4 μm),HE染色用于观察髂血管的组织学特点并测量血管内-中膜厚度。根据试剂盒说明书对caspase-1(1∶100)和IL-1β(1∶100)进行IHC染色,细胞质中出现棕黄色颗粒为阳性细胞。用Image Pro Plus 6.0软件测量血管内-中膜厚度以及各组caspase-1、IL-1β的表达(取5个400倍视野阳性细胞数的平均值作为上述指标的相对表达量)。
3.4Western blot检测caspase-1和IL-1β的水平提取各组髂血管标本中总蛋白后,上样80 μg蛋白量用于电泳和膜转移,PVDF膜用5%脱脂奶粉封闭1 h,Ⅰ抗caspase-1 p20 (1∶200)、IL-1β (1∶200) 和β-actin(1∶200) 孵育4 ℃过夜。次日山羊抗兔多抗(1∶500)37 ℃孵育1 h,ECL发光液暗室曝光。以β-actin作为内参照,Quantity One 软件采集分析结果,以目的蛋白灰度值与β-actin灰度值的比值作为其相对表达量。
3.5ELISA检测IL-8的含量取血清约200 μL,根据兔IL-8试剂盒说明书进行检测。
3.6血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白(low-density lipoprotein,LDL)和高密度脂蛋白(high-density lipoprotein,HDL)测定取血清500 μL置于Olympus AUI1000自动生化分析仪检测各组血脂水平。
4统计学处理
采用SPSS 17.0软件进行数据统计分析,数据以均数±标准差(mean±SD)表示。多组之间的比较采用单因素方差分析,各组均数之间两两比较采用SNK-q检验,若方差不齐则采用Dunnett’s T3检验。以P<0.05为差异有统计学意义。
结果
1家兔存活情况及PN对新生内膜增殖影响
建模后30只新西兰兔均存活并最终纳入实验。在前期的准备工作中,为了排除溶剂DMSO的影响,分别设置了相关溶剂对照组,结果显示本实验中所采用的4% DMSO对内-中膜厚度无明显影响。HE结果显示sham+NS及sham+DMSO组无内膜增殖,内膜光滑连续,中膜平滑肌细胞排列整齐;而BI+NS及BI+DMSO组内膜增殖明显,中膜平滑肌细胞排列紊乱;PN低、高剂量组内膜增殖有不同程度改善,但仅PN高剂量组与BI+DMSO组差异有统计学意义(P<0.05),见图1、2。

Figure 1.The HE staining for the effect of PN on neointimal hyperplasia (×400).
图1PN对内-中膜增殖的作用
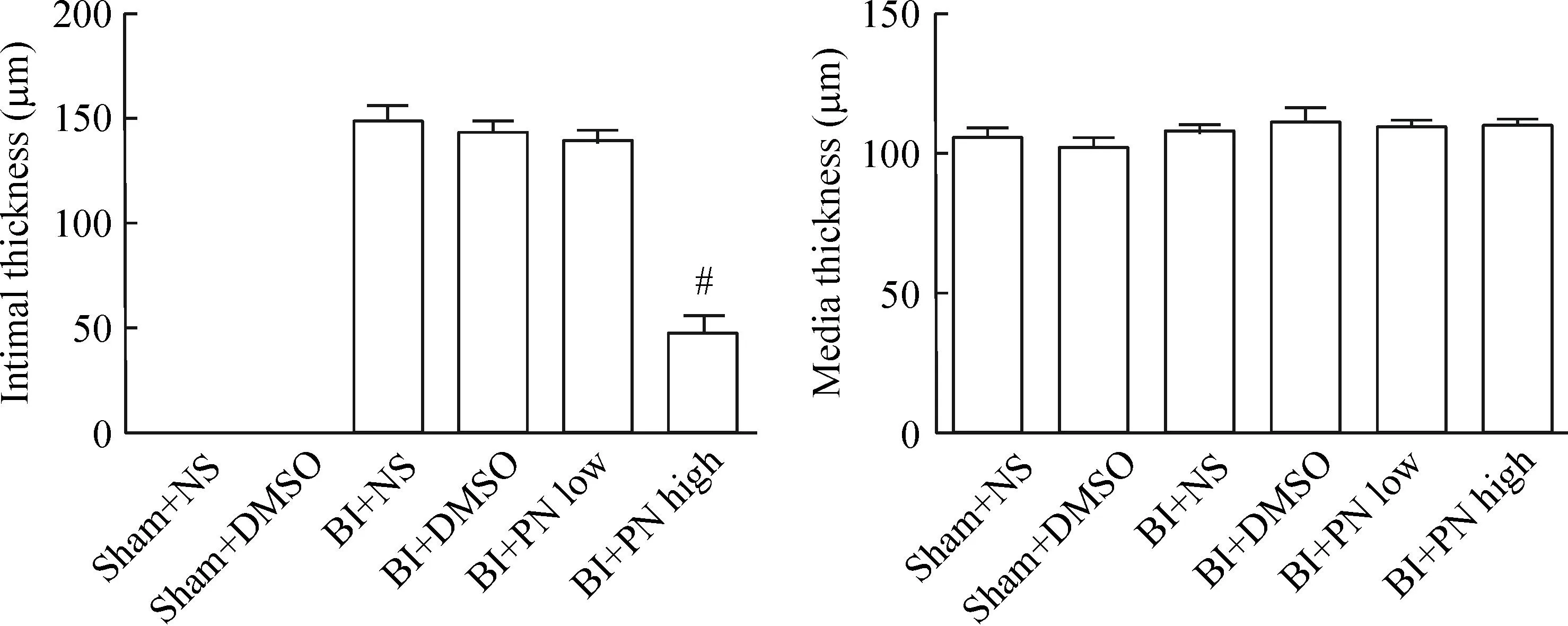
Figure 2.The intima-medium thickness in different groups. Mean±SD.n=5.#P<0.05vsBI+DMSO.
图2各组内-中膜厚度比较
2IHC结果
Sham+DMSO组中的caspase-1和IL-1β水平较低,BI+DMSO组与其比较, caspase-1和IL-1β的水平明显增高(P<0.05);caspase-1和IL-1β的水平在PN高剂量组中显著下降(P<0.05),见图3、4。

Figure 3.The expression of caspase-1 and IL-β in different groups(IHC,×400).
图3免疫组织化学分析caspase-1 及IL-β的表达
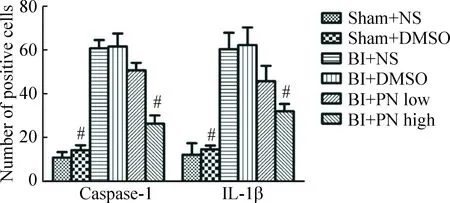
Figure 4.The number of positive cells in different groups. Mean±SD.n=5.#P<0.05vsBI+DMSO.
图4各组caspase-1 及IL-β的阳性细胞数比较
3Western blot结果
与sham+DMSO组比较,BI+DMSO组中的caspase-1/pro-caspase-1和IL-1β/pro-IL-1β的比值明显升高(P<0.05);PN高剂量组中caspase-1/pro-caspase-1和IL-1β/pro-IL-1β的比值较BI+DMSO组显著减少(P<0.05),见图5。
4血清IL-8含量
血清IL-8于球囊损伤后含量为(40.51±4.42)ng/L,较sham+DMSO组[(25.18±3.27)ng/L]明显增加;而给予高剂量PN后,血清IL-8含量降至(29.45±1.33) ng/L(P<0.05),低剂量PN组减少不明显。

Figure 5.The level of caspase-1/pro-caspase-1, IL-1β/pro-IL-1β in different groups. Mean±SD.n=3.#P<0.05vsBI+DMSO.
图5各组caspase-1和IL-1β的蛋白表达
5血脂TC、TG、LDL和HDL含量
各组血脂指标含量组间差异无统计学意义(P>0.05),见表1。
讨论
炎症在AS的发生发展中起着重要作用。VSMCs是动脉血管壁的主要成分之一,其增殖和迁移被认为是AS等血管增殖性疾病的重要原因。在炎症作用下,VSMCs可向内膜下迁移,并在此过程中分裂增殖形成新生内膜[7]。Duewell等[8]研究表明通过NOD样受体家族蛋白(NOD-like receptor protein,NLRP)-3炎性小体途径可促进AS病变形成,caspase-1是NLRP3炎性小体的重要组成部分[9],同时NLRP3炎性小体是caspase-1活化的分子平台,活化后的caspase-1能促进pro-IL-1β转化为具有活性的IL-1β[10]。IL-1β是一种重要的炎症细胞因子,研究表明它通过多个环节参与AS发生发展:(1)通过上调黏附因子、趋化蛋白合成以及破坏凝血-抗凝平衡,导致血管内凝血,减缓血流,促进炎性细胞黏附于血管壁[11];(2)诱导血小板衍化生长因子和血浆溶酶原激活物抑制剂-1的合成和释放,进而刺激VSMCs的有丝分裂增殖,内皮细胞再生和细胞外基质的沉着,促进新生内膜形成;(3)上调氧化低密度脂蛋白(ox-LDL)及其受体的表达,ox-LDL可介导内皮细胞损伤和凋亡,并促进VSMCs的增生;(4)通过激活NF-κB信号通路,诱导IL-6、IL-8、TNF-α等炎症因子产生,扩大炎症反应级联。其中IL-8是一种强有力的促血管生成因子,能促进内皮细胞和VSMCs的增殖和迁移;(5)诱导VSMC和巨噬细胞吞噬大量的LDL并转化成为泡沫细胞[12];(6)促进金属基质蛋白的表达,使AS斑块不稳定甚至破裂。本实验对NLRP3炎性小体通路的研究主要集中于caspase-1,因为它是生成具生物活性IL-1β的关键酶,此外,阻断caspase-1的激活是抑制炎性小体形成的新型抗炎策略[13]。本实验通过高脂喂养联合球囊损伤建立模型,结果显示血管内膜增殖明显,caspase-1、IL-1β和IL-8表达显著增加,推测内膜损伤后促进pro-caspase-1的募集及转化为活性caspase-1增加,并上调下游促炎因子,加重炎症反应,从而促进内膜增殖。
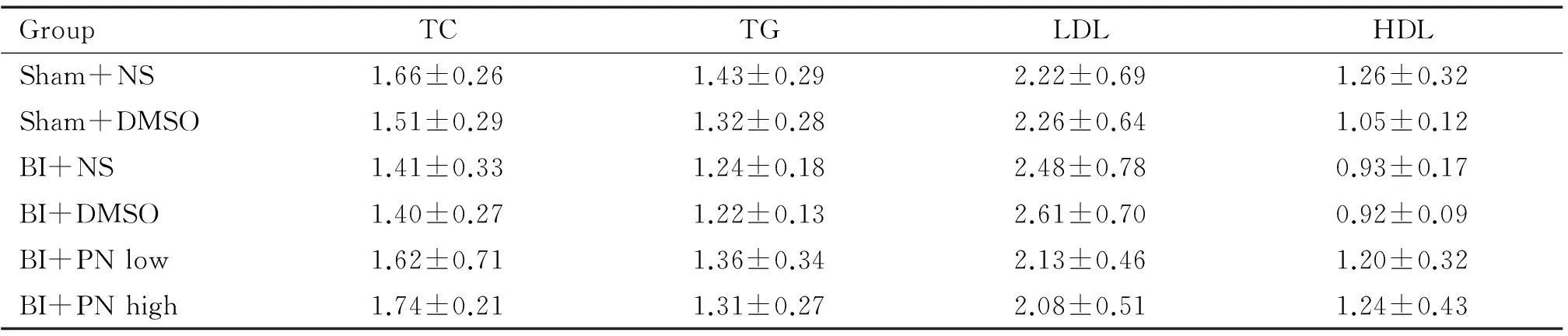
表1 各组血脂水平比较
PN分子式为C15H20O3,属于艾叶菊属的提取物,具有抗肿瘤、抗血小板聚集等特性。近年研究表明PN通过烷基化caspase-1的半胱氨酸残基来抑制其表达,从而发挥抗炎作用[14]。本实验结果显示,给予PN 2 mg·kg-1·d-1治疗后,内膜增殖受到抑制,同时血管局部活性caspase-1表达显著下降,下游IL-1β和IL-8含量减少,与既往研究结果一致[15],表明PN可以通过下调caspase-1起到减轻炎症反应,进而抑制内膜增殖。
脂质代谢异常也能通过刺激炎症反应加速AS的发生和发展[16],本实验通过检测血清中TC、TG、LDL和HDL水平以研究PN与脂质代谢的关系,结果显示各组血脂无明显差异,说明PN对内膜的影响与降脂作用无关。
综上所述,PN可以通过抑制caspase-1及下游炎症介质的表达从而减少炎症反应,减少球囊损伤后的内膜增殖。然而对于NLRP3炎性小体通路作用的研究尚处于起步阶段,更明确的机制尚未阐明,因此关于PN抑制新生内膜增殖的机制也有待更进一步的研究。
[参考文献]
[1]LaRosa JC, Grundy SM, Waters DD, et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease[J]. N Engl J Med, 2005, 352(14):1425-1435.
[2]吕心瑞,徐晓,陈明亮,等. Am80通过促进KLF4与维甲酸受体α相互作用抑制血管内膜增生[J]. 中国病理生理杂志, 2015, 31(4):630-634.
[3]Ross R. Atherosclerosis is an inflammatory disease[J]. Am Heart J, 1999, 138(5):419-420.
[4]Li YJ, Chen Y, You Y, et al. Effects of shenlian extracts on atherosclerosis by inhibition of the inflammatory response[J]. J Tradit Chin Med, 2011, 31(4):344-348.
[5]郭蓓蓓,黄晶,朱悫,等. 探讨白介素18结合蛋白对球囊损伤后内膜增殖的影响及其机制[J]. 重庆医科大学学报, 2011, 36(11):1427-1431.
[6]熊龙根, 黎德恩, 董颀,等. 环孢菌素A对大鼠腹主动脉球囊损伤后内膜增生的抑制作用[J]. 中国病理生理杂志, 2011, 27(9):1687-1691.
[7]Yoshida T, Yamashita M, Horimai C, et al.Smooth muscle-selective inhibition of nuclear factor-κB attenuates smooth muscle phenotypic switching and neointima formation following vascular injury[J]. J Am Heart Assoc, 2013, 2(3): e000230.
[8]Duewell P, Kono H, Rayner KJ,et al. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals[J]. Nature, 2010, 464(7293):1350-1361.
[9]毛开睿,孙兵. NLRP3炎症小体研究进展[J]. 现代免疫学, 2011, 31(1):1-4.
[10]Shaw PJ, McDermott MF, Kanneganti TD. Inflammasomes and autoimmunity[J]. Trends Mol Med, 2011, 17(2):57-64.
[11]Dinarello CA. A clinical perspective of IL-1 as the gatekeeper of inflammation[J]. Eur J Immunol, 2011, 41(5):1203-1217.
[12]Ruan XZ, Moorhead JF, Tao JL, et al. Mechanisms of dysregulation of low-density lipoprotein receptor expression in vascular smooth muscle cells by inflammatory cytokines arterioscler [J]. Arterioscler Thromb Vasc Biol, 2006, 26(5):1150-1155.
[13]Abulafia DP, de Rivero Vaccari JP, Lozano JD, et al. Inhibition of the inflammasome complex reduces the inflammatory response after thromboembolic stroke in mice[J]. J Cereb Blood Flow Metab, 2009, 29(3):534-544.
[14]Dong L, Qiao H, Zhang X, et al. Parthenolide is neuroprotective in rat experimental stroke model: downregulating NF-κB, phospho-p38MAPK, and caspase-1 and ameliorating BBB permeability[J]. Mediators Inflamm, 2013, 2013:370804.
[15]Pomerantz BJ, Rezeikov LL, Harken AH, et al. Inhibition of caspase-1 reduces human myocardial ischemic dysfunction via inhibition of IL-18 and IL-1β[J]. Proc Natl Acad Sci, 2001, 98(5):2871-2876.
[16]潘玉婷,郭春雨,马晓娟,等. 氧化低密度脂蛋白损伤血管内皮细胞的机制及雌激素保护作用[J]. 中华老年心脑血管病杂志, 2014, 26(2):209-212.
(责任编辑: 陈妙玲, 余小慧)

*[基金项目]国家自然科学基金资助项目(No. 81171178); 山西省自然科学基金资助项目(No. 2012011036-3); 山西省归国人员科研基金资助项目(No. 2013011054-2)
Effect of parthenolide on neointimal hyperplasia after balloon injuryMAO Xia, GAO Li-hua, DENG Chang-ming
(DepartmentofCardiology,TheSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China.E-mail:dy070308@126.com)
[ABSTRACT]AIM: To detect the effect and underlying mechanism of parthenolide (PN) on neointimal hyperplasia. METHODS: After 1 week of high-fat feeding, 30 male New Zealand white rabbits (2.0~2.3 kg) were randomly divided into 6 groups: sham+NS, rabbits received 0.9% normal saline after sham operation; sham+DMSO, rabbits received DMSO after sham operation; balloon injury(BI)+NS, rabbits received NS after balloon injury; BI+DMSO, rabbits received DMSO after balloon injury; BI+PN low, rabbits received PN at 1 mg/kg after balloon injury; BI+PN high, rabbits received PN at 2 mg/kg after balloon injury. The drugs were intraperitoneal injected once a day after the operation until sacrifice. After fed with high-fat diet for 4 weeks, the intima-media thickness, the expression of caspase-1, IL-1β, the levels of IL-8, TC, TG, LDL and HDL in the serum were measured. RESULTS: Compared with sham+DMSO group, the thickness of intima, the amount of caspase-1, IL-1β and IL-8 in BI+DMSO group were significantly increased (P<0.05). The levels of caspase-1, IL-1β and IL-8 were significantly decreased in BI+PN high group compared with BI+DMSO group (P<0.05). CONCLUSION: Neointimal hyperplasia is suppressed by PN after balloon injury, the potential mechanism may be associated with its anti-inflammatory role.
[KEY WORDS]Parthenolide; Intimal hyperplasia; Caspase-1
通讯作者△Tel: 0351-4135067; E-mail: xqli2013@126.com
[收稿日期]2015- 05- 28[修回日期] 2015- 09- 29
[文章编号]1000- 4718(2015)12- 2221- 07
doi:10.3969/j.issn.1000- 4718.2015.12.017
[中图分类号]R541.4; R363.2
[文献标志码]A
