信号转导与转录激活因子3表达水平与垂体腺瘤各亚型的相关性
2016-01-29焦永辉刘小海代从新王任直
焦永辉,刘小海,代从新,蔡 锋,王任直
1中国医学科学院 北京协和医学院 北京协和医院神经外科,北京 100730
2浙江大学 医学院附属第二医院神经外科,杭州 310009
信号转导与转录激活因子3表达水平与垂体腺瘤各亚型的相关性
焦永辉1,刘小海1,代从新1,蔡锋2,王任直1
1中国医学科学院北京协和医学院北京协和医院神经外科,北京 100730
2浙江大学医学院附属第二医院神经外科,杭州310009
摘要:目的探讨信号转导与转录激活因子3(STAT3)表达水平和垂体腺瘤各亚型之间的相关性。方法应用实时定量PCR、Western blot以及免疫组织化学染色检测STAT3在垂体腺瘤各亚型的表达。结果STAT3在垂体腺瘤各亚型均有表达,与其他类型肿瘤,包括催乳素、促卵泡激素/促黄体生成激素以及促肾上腺皮质激素腺瘤相比,STAT3在生长激素腺瘤表达最高,促卵泡激素/促黄体生成激素腺瘤表达最低。结论STAT3在垂体腺瘤各亚型的差异表达表明STAT3调控的细胞特异性本质,这种特异性的调控机制值得进一步研究。
关键词:信号转导与转录激活因子3;促肾上腺皮质激素;生长激素;泌乳素;卵泡刺激素/黄体生成素;垂体腺瘤
Effects of Rapamycin and Rapamycin-loaded Poly(lactic-co-glycolic)Acid Nanoparticles on Apoptosis and Expression of bcl- 2 and p27kip1Proteins of Human Umbilical Arterial Vascular Smooth Muscle Cell Correlation between Expression of Signal Transducer and Activator of Transcription 3 and Pituitary Adenoma Subtypes
ActaAcadMedSin,2015,37(6):693-697
信号转导和转录激活因子(signal transducer and activator of transcription,STAT)3是STAT家族的一员,参与对细胞因子和生长因子的细胞反应[1]。位于细胞质的磷酸化的STAT3变为二聚体并移位至细胞核内,其后调节靶基因调控细胞增殖、存活和分化[2]。有研究显示许多癌症STAT3过表达和/或持续性活化[3]。STAT3的持续性活化受抑制后,可以使细胞生长抑制,甚至细胞死亡,因此STAT3可以作为癌症治疗的靶标[4]。目前STAT3抑制剂的Ⅰ、Ⅱ肿瘤试验也在进行中[5]。在垂体,STAT3不仅调控gp130控制的促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)细胞的增殖和生长,而且也是白血病抑制因子介导的ACTH分泌的重要调节器[6- 7]。有研究已经证实STAT3在正常垂体组织低表达,而在生长激素(growth hormone,GH)腺瘤表达增高,但是STAT3在垂体腺瘤各亚型表达是否有差异,尚不是很明确[8]。因此,本研究主要探讨STAT3表达水平和垂体腺瘤各亚型之间的相关性。
材料和方法
标本垂体腺瘤标本来自2010年5月至2013年6月北京协和医院神经外科接受手术治疗的74例垂体腺瘤患者,所有手术标本均经临床及病理诊断证实。肿瘤标本包括20例GH腺瘤、20例泌乳素(prolactin,PRL)腺瘤、14例ACTH腺瘤、11例卵泡刺激素/黄体生成素(follicle-stimulating hormone/luteinizing hormone,FSH/LH)腺瘤、9例嫌色细胞(null cell,NC)瘤。男性25例、女性49例,年龄17~57岁,平均(40.2±13.8)岁。按照垂体腺瘤Knosp标准分组,Ⅱ级以上27例、Ⅱ级以下47例。
免疫组织化学采用链霉菌抗生物素蛋白-过氧化物酶连结法检测STAT3表达。鼠抗人STAT3单克隆抗体购自美国CST公司(1∶500,#9139),链霉菌抗生物素蛋白-过氧化物酶试剂盒及3,3,-二氨基联苯胺显色剂均购自北京中杉生物技术有限公司,其他试剂由北京协和医院病理科提供。组织标本经石蜡包埋作5 μm连续切片,行HE染色用于重新确认病理结果,免疫组织化学按试剂盒操作说明进行。采用人乳腺癌阳性片为对照片,阴性对照以PBS替代一抗。
Western blot采用Western blot检测STAT3表达。取液氮冰冻肿瘤组织100 mg,提取总蛋白,按美国细胞信号科技公司的说明书操作,进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳、转膜、滴加一抗、二抗进行免疫反应,化学发光、显影、定影,最后胶片拍照。采用Quantityone 4.6.2软件测定各条带积分灰度值。采用GAPDH为内参计算蛋白的相对表达量。以STAT3与GAPDH蛋白产物条带灰度值之比作为STAT3蛋白的相对表达量。
实时定量PCR实时定量PCR检测STAT3 mRNA的表达。取液氮冰冻肿瘤组织100 mg,提取总mRNA,采用Nanodrop2000紫外分光光度计测量RNA纯度及浓度,取8 μl总RNA按照PrimeScriptTMRT reagent Kit with gDNA Eraser进行反转录操作,取2 μl cDNA产物进行PCR扩增,用SYBR®Premix Ex TaqTMⅡ (Tli RNaseH Plus)ROX plus进行扩增,实验操作按产品说明书进行。混匀,置于ABI7500荧光定量PCR仪中,95 ℃ 15 s,60 ℃ 40 s,72 ℃ 60 s,45个循环,输出STAT3的荧光信号到达所设定的阈值时经历的循环数(cycle threshold,Ct)值。以β-actin为内参计算基因相对表达量。STAT3 mRNA相对表达量采用指标为:2-△△Ct。STAT3引物序列上游为:5’-CAGTCCGTGGAACCATACACAAAGC- 3’,下游为5’-CAATACTTTCCGAATGCCTCCTCCTT-3’;β-actin上游为5’-ACTTAG TTGCGTTACACCCTT-3’,下游为5’-GTCACCTTCACCGTTCCA- 3’。
免疫组织化学结果判定高倍率(×200)视野下评估STAT3的免疫染色结果。每个标本分别由两名病理科医师单独诊断评分。免疫组织化学半定量方法如下:对STAT3染色强度和阳性率分别进行评估。染色强度评分如下:0分,阴性;1分,弱阳性;2分,中等阳性;3分,强阳性。免疫阳性细胞的百分比定义为细胞在每个视野下显示阳性的百分比。视野内坏死、纤维化及人为污染区被排除在外。平均免疫阳性强度和百分比为观察10个高倍视野平均所得。对于每个样品,组织学评分计算按阳性细胞百分比乘以染色强度(1×阳性细胞百分比+2×阳性百分比+3×阳性细胞百分比)。组织学评分最高为3,最低为0。
统计学处理采用SPSS 19.0统计软件,所有数据用均数±标准差表示,统计方法采用t检验、ANOVA 或 Wilcoxon检验等进行统计学处理。P<0.05为差异具有统计学意义。
结果
免疫组织化学结果
STAT3细胞定位:STAT3在所有垂体腺瘤亚型中均有表达。无论何种亚型,STAT3染色部位在细胞核和细胞浆,细胞浆中核旁区域较为明显(图1)。
STAT3免疫阳性细胞百分比:所有标本STAT3阳性细胞的百分比为0%~100%,平均(60±30)%,其中平均阳性百分比最高的是GH腺瘤,为(84±13)%,其次是PRL腺瘤,为(64±29)%,最低的是FSH/LH腺瘤,为(21±29)%。
STAT3免疫阳性细胞染色强度:在所有腺瘤亚型,STAT3免疫染色强度为1.16±0.58(0~3),其中染色强度最高的是GH腺瘤(1.60±0.75),染色强度最低的是FSH/LH腺瘤(0.73±0.47)。
STAT3的组织学评分:在所有肿瘤亚型,平均组织学评分为(1.27±0.69)分(0~3分),其中以GH腺瘤、PRL腺瘤组织学评分最高,分别为(1.70±0.80)分和(1.40±0.68)分,组织学评分最低的是FSH/LH腺瘤,为(0.73±0.47)分。
Western blot结果各类型垂体腺瘤(PRL、ACTH、GH、FSH/LH、NC)均显示STAT3为相对分子质量86 000大小的条带,各腺瘤表达水平不一致,在GH腺瘤最高表达,与其他腺瘤比较,差异具有统计学意义(P<0.05),STAT3在FSH/LH腺瘤低表达(图2、表1)。
实时定量PCR结果在各类型垂体腺瘤(PRL、ACTH、GH、FSH/LH、NC)均显示STAT3表达,各腺瘤表达水平不一致,在ACTH腺瘤表达最高,NC、GH及PRL腺瘤次之,在FSH/LH腺瘤表达最低,GH与ACTH、FSH/LH比较差异具有统计学意义(P<0.05)(表1)。

STAT3:信号转导与转录激活因子3;PRL:泌乳素;ACTH:促肾上腺皮质激素;GH:生长激素;FSH/LH:卵泡刺激素/黄体生成素;NC:嫌色细胞
STAT3:signal transducer and activator of transcription 3;PRL:prolactin;ACTH:adrenocorticotropic hormone;GH:growth hormone;FSH/LH:follicle-stimulating hormone/luteinizing hormone;NC:null cell
A.PRL;B. ACTH;C. GH;D. FSH/LH;E. NC
图 1STAT3在垂体腺瘤各亚型免疫组织化学染色结果(×200)
Fig 1STAT3 immunohistochemistry in various pituitary adenoma subtypes(×200)

Mr:相对分子质量
Mr:relative molecular mass
图 2Western blot检测STAT3蛋白的表达
Fig 2Western blot assay shows the expression of STAT3 protein
讨论
垂体腺瘤占颅内肿瘤的10%~25%,居颅内肿瘤第2位[9],其起源于高度分化的分泌一种或多种激素的垂体前叶细胞,因分泌激素类型不同,垂体腺瘤可以分为GH、PRL、ACTH、FSH/LH以及嫌色细胞瘤等,不同类型肿瘤临床表现亦不同,例如肢端肥大症、甲亢、闭经/溢乳、库欣综合征或仅表现为压迫周围结构等症状。除PRL腺瘤外,大部分垂体腺瘤首选手术治疗,但部分肿瘤对药物、手术等常规治疗不敏感,术后复发率极高,总体预后很差,严重影响患者生存质量[10]。所以,本病亟待开发新的治疗方法,近年关于STAT3作为潜在的有效的抗癌靶标的研究越来越多。有研究已经证实STAT3在正常垂体组织低表达,而在GH腺瘤表达增高,但是STAT3在垂体腺瘤各亚型表达是否有差异,尚不是很明确[8]。
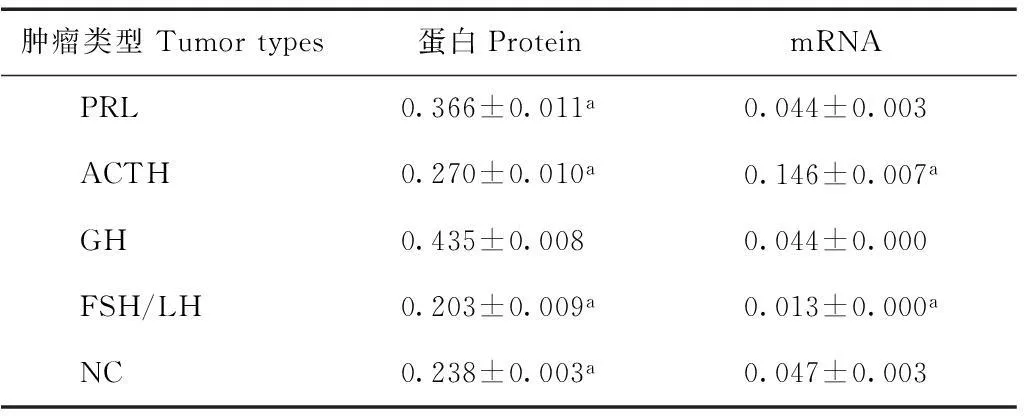
表 1 垂体腺瘤各亚型STAT3蛋白和mRNA的
与GH比较,aP<0.05
aP<0.05 compared with GH
本研究采用免疫组织化学、Western blot以及实时定量PCR等方法探讨STAT3表达与垂体腺瘤各亚型之间的关系,并且得出一个新的结论:STAT3在不同垂体腺瘤类型表达存在差异,结果表明STAT3蛋白在GH腺瘤最高,其次是PRL腺瘤,表达水平最低的是FSH/LH腺瘤。本研究结果与之前研究结果相似:与其他类型腺瘤相比,STAT3在GH腺瘤表达水平最高[8,11]。Trovato等[11]在30例垂体腺瘤(7例GH腺瘤、6例PRL腺瘤,4例ACTH腺瘤、1例FSH/LH腺瘤、12例嫌色细胞瘤)分析肝细胞生长因子/细胞间皮上皮转化因子下游分子STAT3表达水平,结果表明STAT3在GH腺瘤表达水平最高,但是该研究方法为单一免疫组织化学,而且样本数量偏少,因此本研究采用定性与定量相结合的方法探讨STAT3在垂体腺瘤各亚型的表达差异,并且增加了肿瘤组织样本量。
STAT3参与调控细胞分化和激素分泌过程。在小鼠垂体前叶细胞纤维母细胞生长因子受体4(fibroblast growth factor 4,FGFR4)的两个多态性变异R388、G388,分别与GH和PRL分泌相关,当FGFR4的跨膜结构域的G388位点变为R388后,垂体细胞不再分泌PRL,而是分泌GH,并且这个转变过程与STAT3磷酸化相关[12]。表明STAT3可能在促乳生长激素细胞向生长激素细胞分化过程发挥重要作用。此外,生长激素释放激素(growth hormone-releasing hormone,GHRH)与其受体结合后可以活化STAT3,在转染了磷酸化的生长激素释放激素受体的HeLa 人宫颈癌细胞系在予以GHRH后,STAT3表达水平增加,细胞增殖率加快,反之予以GHRH拮抗剂JMR- 132后,STAT3水平逐步回归正常,细胞增殖率减慢[13],进一步表明STAT3和生长激素细胞之间存在的密切联系。在垂体,STAT3不仅调控gp130控制的ACTH细胞的增殖和生长,而且也是白血病抑制因子介导的ACTH细胞分泌的重要调节器[6- 7]。FGFR4的跨膜结构域的变异FGFR-R388调控ACTH细胞生长以及对糖皮质激素负反馈的敏感性,进而影响Cushing病的表型改变,而这个过程也是通过STAT3磷酸化介导的[14]。因此,STAT3在ACTH腺瘤形成过程是一种重要的调节元件。在正常垂体,STAT3不仅和GH、PRL细胞分化有关,而且与ACTH细胞生长、分化以及功能密切相关,STAT3可能部分或完全参与垂体前叶细胞分化过程,而STAT3在GH、PRL、ACTH等细胞表达水平的差异,可能是所介导的细胞事件所产生的副产品。因此,值得进一步探讨STAT3在垂体前叶细胞的分化作用。
STAT持续活化促进肿瘤生长和进展,并且STAT3一直被认定为潜在的抗癌靶标[4]。STAT3在GH腺瘤的显著高表达可能表明STAT3在GH腺瘤发展和/或进展中发挥作用,而STAT3可能是一种潜在的治疗肢端肥大症的靶目标,但STAT3在GH腺瘤中发挥怎样的调控作用并且如何更有效利用STAT3这个靶标,需要进一步探讨。
实时定量PCR结果虽然显示STAT3在GH腺瘤与FSH/LH腺瘤之间存在表达差异,但是mRNA表达水平在ACTH腺瘤最高,PRL腺瘤与GH腺瘤差异无统计学意义,表明STAT3蛋白可能在ACTH腺瘤及PRL腺瘤半衰期短和/或STAT基因的翻译效率较低,这需要进一步深入研究。综上,在不同的垂体腺瘤亚型,STAT3表达水平不同,GH腺瘤表达水平最高,FSH/LH腺瘤表达水平最低。STAT3在垂体腺瘤各亚型的差异表达表明STAT3调控的细胞特异性本质,而这种差异性的调控机制值得进一步研究。
参考文献
[1]Darnell JE Jr,Kerr IM,Stark GR. Jak-STAT pathways and transcriptional activation in response to IFNs and other extracellular signaling proteins[J]. Science,1994,264(5164):1415- 1421.
[2]Aggarwal BB,Kunnumakkara AB,Harikumar KB,et al. Signal transducer and activator of transcription- 3,inflammation,and cancer:how intimate is the relationship? [J]. Ann NY Acad Sci,2009,1171:59- 76.
[3]Bromberg J. Stat proteins and oncogenesis[J]. J Clin Invest,2002,109(9):1139- 1142.
[4]Yue P,Turkson J. Targeting STAT3 in cancer:how successful are we? [J]. Expert Opin Inv Drug,2009,18(1):45- 56.
[5]Wang X,Crowe PJ,Goldstein D,et al. STAT3 inhibition,a novel approach to enhancing targeted therapy in human cancers (review)[J]. Int J Oncol,2012,41(4):1181- 1191.
[6]Arzt E. gp130 cytokine signaling in the pituitary gland:a paradigm for cytokine-neuro-endocrine pathways[J]. J Clin Invest,2001,108(12):1729- 1733.
[7]Mynard V,Guignat L,Devin-Leclerc J,et al. Different mechanisms for leukemia inhibitory factor-dependent activation of two proopiomelanocortin promoter regions[J].Endocrinology,2002,143(10):3916- 3924.
[8]Zhou CQ,Jiao YH,Wang RZ,et al.STAT3 upregulation in pituitary somatotroph adenomas induces growth hormone hypersecretion[J]. J Clin Invest,2015,125(4):1692- 1702.
[9]Ezzat S,Asa SL,Couldwell WT,et al. The prevalence of pituitary adenomas:a systematic review[J]. Cancer,2004,101:613- 619.
[10]代从新,马四海,蔡锋,等.替莫唑胺治疗难治性垂体腺瘤的研究进展[J].中华神经外科杂志,2013,29(4):423- 425.
[11]Trovato M,Torre ML,Ragonese M,et al. HGF/c-met system targeting PI3K/AKT and STAT3/phosphorylated-STAT3 pathways in pituitary adenomas:an immunohistochemical characterization in view of targeted therapies[J]. Endocrine,2013,44(3):735- 743.
[12]Asa SL,Tateno T,Zheng L,et al. The FGFR4-G388R poly- morphism promotes mitochondrial STAT3 serine phosphorylation to facilitate pituitary growth hormone cell tumorigenesis[J]. PLoS Genet,2011,7(12):e1002400.
[13]Siejka A,Schally AV,Barabutis N. Activation of Janus kinase/signal transducer and activator of transcription 3 pathway by growth hormone-releasing hormone[J].Cell Mol Life Sci,2010,67(6):959- 964.
[14]Nakano-Tateno T,Tateno T,Hlaing MM,et al.FGFR4 polymorphic variants modulate phenotypic features of Cushing disease[J]. Mol Endocrinol,2014,28(4):525- 533.
·论著·
JIAO Yong-hui1,LIU Xiao-hai1,DAI Cong-xin1,CAI Feng2,WANG Ren-zhi1
1Department of Neurosurgery,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
2Department of Neurosurgery,the Second Affiliated Hospital of Zhejiang University
School of Medicine,Hangzhou 310009,China
Corresponding author:WANG Ren-zhiTel:010- 69152530,E-mail:wangrz@126.com
ABSTRACT:ObjectiveTo investigate the correlation between signal transducer and activator of transcription 3 (STAT3) expression and pituitary adenoma subtypes. MethodThe STAT3 expression profiles in different pituitary adenomas from 74 patients were determined using quantificational real-time polymerase chain reaction,Western blot,and immunohistochemistry. ResultsExpression of STAT3 was observed in all pituitary adenoma subtypes. The STAT3 expression level was highest in growth hormone adenoma when compared with other tumors including prolactin,follicle-stimulating hormone/luteinizing hormone-secreting adenoma,and adrenocorticotrophic hormone-secreting adenoma. The follicle-stimulating hormone/luteinizing hormone adenomas exhibited the lowest STAT3 expression levels. ConclusionSTAT3 is differentially expressed in pituitary adenoma subtypes,suggesting the cell-specific features of STAT3 regulation,although further investigations are still warranted to clarify the underlying mechanisms.
Key words:signal transducer and activator of transcription 3;adrenocorticotropic hormone;growth hormone;prolactin;follicle-stimulating hormone/luteinizing hormone;pituitary adenoma
收稿日期:(2015- 02- 04)
DOI:10.3881/j.issn.1000- 503X.2015.06.009
中图分类号:R651
文献标志码:A
文章编号:1000- 503X(2015)06- 0693- 05
通信作者:王任直电话:010- 69152530,电子邮件:wangrz@126.com
